Analizar los tiempos de espera transcurridos desde que los sarcomas de partes blandas (SPB) se hacen sintomáticos hasta su tratamiento específico en nuestra Unidad de Tumores Músculo-Esqueléticos (UTME) para proponer estrategias de mejora en los circuitos de derivación.
Material y métodosEstudio observacional, longitudinal y ambispectivo de una cohorte de 61 pacientes con SPB vírgenes obtenidos e identificados de forma continua del registro de pacientes de la UTME. Se analizó la relación entre diferentes tiempos transcurridos desde que la enfermedad se hizo sintomática hasta la primera consulta en la UTME, y diversas variables ligadas a la persona, tumor y circuito asistencial. Se usó un nivel de significación α=0,05.
ResultadosEl tamaño medio de los sarcomas fue de 11,3cm. Treinta y seis pacientes (59%) siguieron el circuito habitual del Sistema Nacional de Salud en nuestro país. El tiempo medio transcurrido desde que la enfermedad se hizo sintomática hasta la primera consulta médica fue superior a 9,5 meses; y el que transcurrió desde esta hasta la primera en nuestra UTME fue de casi 8,5 meses. Algunas variables independientes mostraron relación estadísticamente significativa con las variables dependientes analizadas.
DiscusiónEl estudio muestra que la asistencia a los pacientes con SPB de las extremidades en nuestro medio está muy lejos de los tiempos que transcurren en los países de nuestro entorno.
ConclusionesParece fundamental la necesidad de concienciar a la población sobre la enfermedad y recordarla entre los profesionales sanitarios, al igual que la existencia de un circuito de derivación que es necesario utilizar.
To analyse the waiting periods elapsed since soft tissue sarcomas become symptomatic until their specific treatment in our unit, and to determine new strategies for the improvement of referral circuits.
Material and methodsThis is an ambispective observational study of a cohort of 61 patients, with previously untreated soft tissue sarcomas, obtained from our Musculoskeletal Tumors Database. Several variables related to the patient, tumour, and health care circuit were analysed, as well as the different periods between the initial symptoms of the disease and the first consultation in our unit. The significance level was α=0.05.
ResultsThe mean size of the sarcomas was 11.3cm. Thirty-six patients (59%) followed the usual circuit of the National Health System in Spain. The time elapsed since the disease became symptomatic until the first medical consultation was greater than 9.5 months, and nearly another 8.5 months to the consultation in our specific unit. Statistically significant relationships were found between the independent and dependent variables.
DiscussionThe study shows that the care of patients with soft tissue sarcomas in our environment is far away from the times of care in our neighbouring countries.
ConclusionsIt is essential to make the population and health professionals aware of this disease, as well as to remember that there is a referral circuit that must be used.
Los sarcomas de partes blandas (SPB) son un grupo heterogéneo de tumores malignos derivados de tejidos mesenquimales originarios del mesodermo embrionario1,2. Suponen el 1% de todos los cánceres del adulto, y no es infrecuente que se diagnostiquen tardíamente o que se traten de forma inadecuada en centros no especializados, lo que puede tener consecuencias irreparables para el paciente y el facultativo. Aquél puede ver comprometido un procedimiento de salvamento del miembro que hubiera sido posible adelantando el diagnóstico y el tratamiento y/o, lo que es más grave, reducida su supervivencia. El médico, por su parte, además de cargar con el sentimiento de haber podido hacer más por el paciente puede verse inmerso en desagradables demandas medicolegales.
El objetivo de este trabajo es analizar los tiempos de espera transcurridos entre el comienzo de la enfermedad sintomática y el de su tratamiento específico en nuestra Unidad de Tumores Músculo-Esqueléticos (UTME). Sin entrar en las consecuencias de las demoras, que damos por demostradas, pretendemos identificar cuellos de botella en el circuito de derivación de los pacientes, y proponer estrategias de mejora al respecto.
Material y métodosEn la UTME de nuestro hospital se ha prestado asistencia médica, desde el 1 de julio de 2006 hasta el 31 de diciembre de 2012, a un total de 112 pacientes con tumores malignos de partes blandas. Se ha realizado un estudio observacional, longitudinal y ambispectivo de una cohorte de 61 pacientes con SPB vírgenes, incluyendo algunos a los que se había realizado una biopsia previa en sus centros de origen. Todos los casos fueron manejados según las normas de diagnóstico, tratamiento y seguimiento que recogen las guías de práctica clínica de la enfermedad3–7.
Los pacientes se obtuvieron e identificaron de forma continua del registro de pacientes de la UTME. De acuerdo con las normas éticas de los procedimientos de investigación, la información se obtuvo de la revisión de las historias clínicas, completándose por entrevista telefónica realizada al paciente o a un familiar próximo (cuando el paciente había fallecido) por uno de los autores del trabajo (PCR). El tiempo medio de seguimiento de los pacientes contado desde la primera consulta en nuestra UTME hasta la fecha del estudio o su fallecimiento fue de 2 años (11 días-6 años y 2 meses). Las fechas consideradas para el cálculo de los distintos tiempos transcurridos en la asistencia sanitaria de los pacientes fueron las especificadas en los documentos oficiales correspondientes, y las referidas por el paciente con relación al comienzo de la sintomatología y primeras consultas médicas. Cuando no la precisaba y la situaba de forma aproximada en un mes determinado se consideró el día 15 de ese mes. Cuando refería 2 meses consecutivos como momento aproximado del episodio investigado se consideró el día 1 del segundo mes. Todos los datos fueron recogidos y anotados por uno de los autores del trabajo (PCR) en un formulario de recogida de datos diseñado para el estudio.
Se analizaron los diferentes tiempos transcurridos desde que la enfermedad se hizo sintomática en el paciente, hasta que fue atendido en nuestra UTME y comenzó su tratamiento (tablas 1 y 2 y fig. 1), relacionándolos con las siguientes variables independientes: a) ligadas con las características de la persona (edad mayor o no de 65 años, sexo, nivel de estudios, domicilio en una ciudad con hospital general o no y área sanitaria de procedencia); b) relacionadas con la enfermedad tumoral (primer síntoma/signo, localización del tumor en el miembro superior o en el inferior, localización del tumor superficial o profundo a la fascia, tamaño del tumor mayor o no a 8cm, entendido como el diámetro mayor del tumor en cualquier plano del espacio medido en centímetros en la resonancia magnética (RM) o tomografía computarizada (TC), y grado de malignidad baja o intermedia/alta), y c) relativas al circuito de asistencia sanitaria de los pacientes (tipo de primer médico consultado, tipo de primer especialista consultado y seguimiento del circuito habitual de asistencia sanitaria en el sistema sanitario público español: médico de Atención Primaria [AP]-traumatólogo general-cirujano ortopédico oncológico).
Descripción de las variables de tiempos transcurridos durante la asistencia sanitaria de los pacientes del estudio
| T0 | Tiempo transcurrido desde la constatación del primer síntoma/signo de la enfermedad por el paciente, y la primera consulta médica |
| T1 | Tiempo transcurrido desde la primera consulta médica por la enfermedad, y la primera consulta con un médico especialista |
| T 1.1 | Tiempo transcurrido desde la primera consulta médica por la enfermedad, y la primera consulta en nuestra UTME |
| T2 | Tiempo transcurrido desde la primera consulta con un médico especialista por la enfermedad, y la primera consulta en nuestra UTME |
| T 2.1 | Tiempo transcurrido desde la primera consulta con un médico especialista por la enfermedad, y el comienzo de los trámites de la derivación del paciente a nuestra UTME |
| T 2.2 | Tiempo transcurrido desde el comienzo de los trámites de la derivación del paciente hasta la primera consulta en nuestra UTME |
| T3 | Tiempo transcurrido desde la primera consulta en nuestra UTME, y el comienzo del tratamiento específico de la enfermedad |
Distribución de los pacientes de la serie según las variables y los tiempos de corte considerados
| Tiempos de corte | T0 (%) | T1 (%) | T1.1 (%) | T2 (%) | T2.1a (%) | T2.2a (%) | T3b (%) |
| >30 días | 31 (51) | 31 (51) | 57 (93) | 46 (75) | 40 (66) | 3 (5) | 22 (36) |
| <30 días | 30 (49) | 30 (49) | 4 (7) | 15 (25) | 17 (28) | 54 (88) | 35 (57) |
| >60 días | 44 (72) | 36 (59) | 21 (34) | ||||
| <60 días | 17 (28) | 25 (41) | 36 (59) | ||||
| >90 días | 39 (64) | ||||||
| <90 días | 22 (36) |
Las variables de tiempo fueron recodificadas en otras categóricas dicotómicas con los siguientes tiempos de corte: periodos iguales o inferiores (≤) y mayores (>) a 30 días para las variables T0 y T1; periodos ≤ y > de 30 y 60 días para las variables T2; y periodos ≤ y > de 30, 60 y 90 días para las variables T.1.1.
La información se recogió en una base de datos creada con el programa Microsoft® Access 2000. Una vez revisada y depurada, se procedió a la exportación de todos los datos al programa estadístico SPSS® v.18, con el que se realizó el análisis estadístico. Este consistió en un análisis descriptivo de las variables, calculando la distribución de frecuencias para las cualitativas y la media, mediana, desviación estándar, intérvalo de confianza al 95%, rango, amplitud intercuartil, y valores máximo y mínimo para las cuantitativas. Para analizar la relación entre los tiempos de espera recodificados a valores dicotómicos y las variables de estudio se ha utilizado el estadístico exacto de Fisher. En todos los casos se ha utilizado el nivel de significación α=0,05.
ResultadosResultados de las características de los pacientes de la serieEntre los 61 pacientes de la serie hubo 31 varones (51%) y 30 mujeres (49%), con una edad media del conjunto de 62 años (mediana: 64; DE: 17,4; intervalo de confianza del 95%: 57,7-66,6; rango: 72; y valores mínimo de 18 y máximo de 90 años). Doce pacientes (20%) tenían estudios de bachiller o superiores, en tanto que el resto no tenía o eran básicos (80%). Veinticuatro pacientes (39%) vivían en ciudades con un hospital general; con 27 (44%) en el área sanitaria de León, y el resto (56%) en otras de la CC.AA. de Castilla y León. Un paciente fue remitido desde Plasencia.
Resultados de las características de la enfermedadHubo 20 liposarcomas (33%) y 16 sarcomas pleomórficos (26%), con el resto de los casos repartidos entre diferentes tipos histopatológicos (fig. 2). Cuarenta y nueve (80%) fueron de grado intermedio o alto y 12 (20%) de bajo grado de malignidad. Cuarenta y cinco del total (74%) se localizaron en los miembros inferiores y la cintura pelviana, con 27 de ellos en el muslo. La localización del total de los casos se representa en la fig. 3. El tamaño medio de los sarcomas fue de 11,3cm (rango: 3,4-31), con 12cm (rango: 3,4-31) en los profundos y 7,9cm (rango: 4-20) en los superficiales. La primera sintomatología de la enfermedad fue un bulto en 50 pacientes (82%), en 3 de ellos con dolor asociado a la tumoración. Once (18%) no refirieron ninguna tumoración como primer signo de la enfermedad. Veintisiete pacientes (44%) habían fallecido al final del estudio.
Gráfica de los tipos histopatológicos de la serie. LS: liposarcoma; SPL: sarcoma pleomórfico; MFS: mixofibrosarcoma; SS: sarcoma sinovial; Otros: 3 leiomiosarcomas, 3 tumores malignos de vainas nerviosas, 2 dermatofibrosarcomas, un angiosarcoma, un sarcoma de células claras, un sarcoma epitelioide, un tumor maligno de células gigantes, un sarcoma de Ewing y un osteosarcoma extraesquelético.
El primer médico consultado fue un médico de AP en 48 ocasiones (79%), quien remitió a 36 de esos pacientes (75%) al traumatólogo de zona correspondiente, y a los 12 restantes a otros especialistas (4 veces a un cirujano general y 3 a un dermatólogo). Todos estos remitieron, posteriormente, al paciente a un traumatólogo o, en 2 ocasiones, directamente a nuestra UTME. En 13 ocasiones (21%) el primer médico consultado fue diferente al médico de AP (un médico de urgencias en 7 ocasiones). Tres pacientes fueron atendidos por la misma enfermedad por 3 especialistas diferentes. En 36 ocasiones (59%), el paciente pasó por el médico de AP de su Centro de Salud, y por un traumatólogo general de zona antes de llegar a nuestra UTME. Los valores de los tiempos de espera transcurridos desde que la enfermedad se hizo sintomática hasta su tratamiento se resumen en la tabla 3. En las figuras 4 y 5 se presentan 2 casos de la serie a modo de ejemplo.
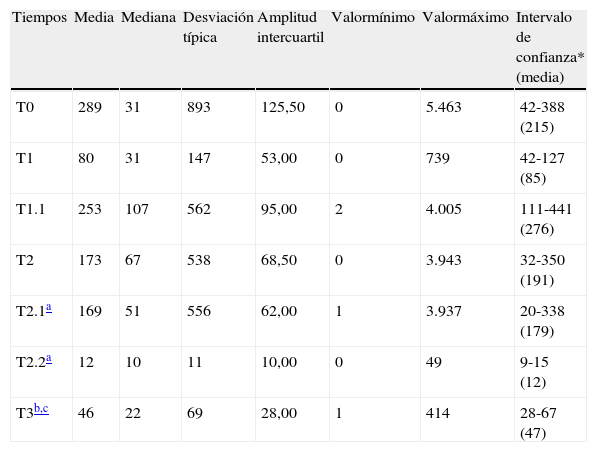
Descripción de los valores de los tiempos transcurridos, en días, en la asistencia médica de los pacientes de la serie
| Tiempos | Media | Mediana | Desviación típica | Amplitud intercuartil | Valormínimo | Valormáximo | Intervalo de confianza* (media) |
| T0 | 289 | 31 | 893 | 125,50 | 0 | 5.463 | 42-388 (215) |
| T1 | 80 | 31 | 147 | 53,00 | 0 | 739 | 42-127 (85) |
| T1.1 | 253 | 107 | 562 | 95,00 | 2 | 4.005 | 111-441 (276) |
| T2 | 173 | 67 | 538 | 68,50 | 0 | 3.943 | 32-350 (191) |
| T2.1a | 169 | 51 | 556 | 62,00 | 1 | 3.937 | 20-338 (179) |
| T2.2a | 12 | 10 | 11 | 10,00 | 0 | 49 | 9-15 (12) |
| T3b,c | 46 | 22 | 69 | 28,00 | 1 | 414 | 28-67 (47) |
DE: desviación estándar.
Cálculos sobre 57 casos por no figurar los datos del comienzo de los trámites para la derivación a nuestra UTME.
Liposarcoma profundo en un paciente de la serie, varón de 40 años de edad y estudios superiores, que consultó con su médico de AP 15 años (T0) después de haber comenzado a percibir un bulto en su muslo izquierdo de crecimiento muy lento (a). Fue remitido por aquél a un cirujano general, que lo atendió al cabo de 33 días (T1) y remitido y atendido en nuestra consulta el mismo día (T2: 0 días). El diámetro máximo del tumor medido en RM fue de 14cm (b). El tratamiento quirúrgico del tumor, después de la oportuna biopsia y planificación quirúrgica, se realizó 28 días después (T3). Dos años después de la resección y radioterapia postoperatoria (c).
Leiomiosarcoma superficial en una paciente de la serie, mujer de 49 años de edad y estudios básicos, que consultó con su médico de AP 630 días (T0) después de haber comenzado a percibir un bulto de crecimiento progresivo en su muslo izquierdo (a). Fue remitida por aquél a su traumatólogo de zona, que la atendió al cabo de 21 días (T1), realizándole una biopsia incisional. La paciente fue remitida y atendida en nuestra consulta 73 días después de la primera consulta especializada (T2), cumplimentándose los trámites para la derivación 3 días antes (T2.2). El diámetro mayor del sarcoma fue de 8,8cm (b). Su tratamiento quirúrgico se realizó 15 días después de la consulta en nuestra UTME (T3). Aspecto del muslo después de la resección amplia y reconstrucción con injerto de piel libre y radioterapia postoperatoria (c).
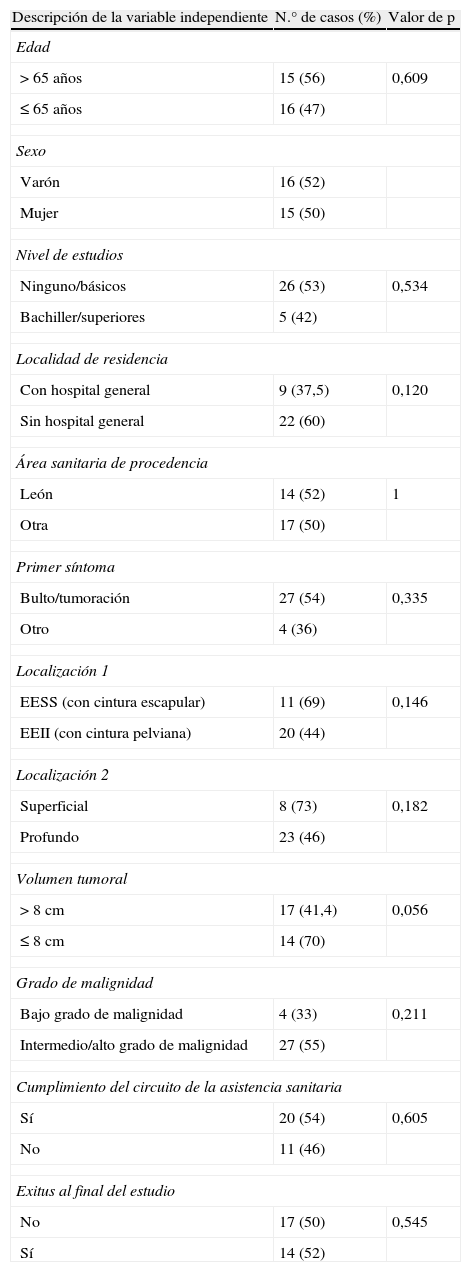
Muy pocas variables mostraron relación estadísticamente significativa con los tiempos de asistencia médica analizados. Si consideramos la frecuencia de pacientes con un tiempo T0 mayor de 30 días, se observaron diferencias cercanas a la significación estadística en el tamaño del tumor: el 70% de los pacientes con tumores de 8cm o menos tenían T0 mayor de 30 días, frente al 41,4% de los que tenían tumores de más de 8cm (p=0,056). El 60% de los pacientes residentes en localidades sin hospital también tenían T0 mayor de 30 días, frente al 37,5% de los que vivían en localidades con hospital (p=0,120). Con relación a la localización, el 69% de los pacientes con tumores en el miembro superior presentaron un tiempo T0 mayor de 30 días, superior al 44% observado en los pacientes con tumores localizados en el miembro inferior (p=0,146). También se observó que el 73% de los pacientes con tumores de asiento superficial tenían un tiempo T0 más prolongado, frente al 46% observado en el caso de pacientes con tumores profundos (p=0,182) (tabla 4).
Resumen de las tablas de contingencia de la relación de T0>30 días con las variables independientes estudiadas
| Descripción de la variable independiente | N.° de casos (%) | Valor de p |
| Edad | ||
| >65 años | 15 (56) | 0,609 |
| ≤65 años | 16 (47) | |
| Sexo | ||
| Varón | 16 (52) | |
| Mujer | 15 (50) | |
| Nivel de estudios | ||
| Ninguno/básicos | 26 (53) | 0,534 |
| Bachiller/superiores | 5 (42) | |
| Localidad de residencia | ||
| Con hospital general | 9 (37,5) | 0,120 |
| Sin hospital general | 22 (60) | |
| Área sanitaria de procedencia | ||
| León | 14 (52) | 1 |
| Otra | 17 (50) | |
| Primer síntoma | ||
| Bulto/tumoración | 27 (54) | 0,335 |
| Otro | 4 (36) | |
| Localización 1 | ||
| EESS (con cintura escapular) | 11 (69) | 0,146 |
| EEII (con cintura pelviana) | 20 (44) | |
| Localización 2 | ||
| Superficial | 8 (73) | 0,182 |
| Profundo | 23 (46) | |
| Volumen tumoral | ||
| >8cm | 17 (41,4) | 0,056 |
| ≤8cm | 14 (70) | |
| Grado de malignidad | ||
| Bajo grado de malignidad | 4 (33) | 0,211 |
| Intermedio/alto grado de malignidad | 27 (55) | |
| Cumplimiento del circuito de la asistencia sanitaria | ||
| Sí | 20 (54) | 0,605 |
| No | 11 (46) | |
| Exitus al final del estudio | ||
| No | 17 (50) | 0,545 |
| Sí | 14 (52) | |
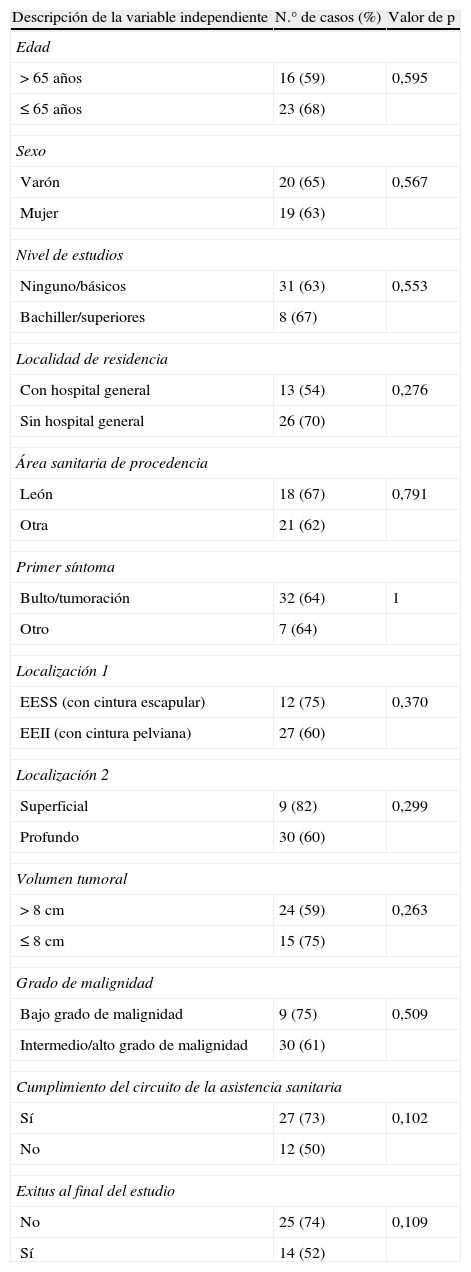
Las variables que más se relacionaron con T1.1 mayor de 30, 60 y 90 días fueron el cumplimiento del circuito de asistencia a los pacientes y su supervivencia al final del estudio. El 73% de los pacientes que cumplían el circuito esperaban más de 90 días, mientras que el 50% de los que no, esperaban menos, con diferencias no significativas (p=0,102). El 74% de los pacientes supervivientes al final del estudio había esperado más de 90 días, frente al 52% de pacientes entre los fallecidos (p=0,109) (tabla 5).
Resumen de las tablas de contingencia de T1.1>90 días con las variables independientes estudiadas
| Descripción de la variable independiente | N.° de casos (%) | Valor de p |
| Edad | ||
| >65 años | 16 (59) | 0,595 |
| ≤65 años | 23 (68) | |
| Sexo | ||
| Varón | 20 (65) | 0,567 |
| Mujer | 19 (63) | |
| Nivel de estudios | ||
| Ninguno/básicos | 31 (63) | 0,553 |
| Bachiller/superiores | 8 (67) | |
| Localidad de residencia | ||
| Con hospital general | 13 (54) | 0,276 |
| Sin hospital general | 26 (70) | |
| Área sanitaria de procedencia | ||
| León | 18 (67) | 0,791 |
| Otra | 21 (62) | |
| Primer síntoma | ||
| Bulto/tumoración | 32 (64) | 1 |
| Otro | 7 (64) | |
| Localización 1 | ||
| EESS (con cintura escapular) | 12 (75) | 0,370 |
| EEII (con cintura pelviana) | 27 (60) | |
| Localización 2 | ||
| Superficial | 9 (82) | 0,299 |
| Profundo | 30 (60) | |
| Volumen tumoral | ||
| >8cm | 24 (59) | 0,263 |
| ≤8cm | 15 (75) | |
| Grado de malignidad | ||
| Bajo grado de malignidad | 9 (75) | 0,509 |
| Intermedio/alto grado de malignidad | 30 (61) | |
| Cumplimiento del circuito de la asistencia sanitaria | ||
| Sí | 27 (73) | 0,102 |
| No | 12 (50) | |
| Exitus al final del estudio | ||
| No | 25 (74) | 0,109 |
| Sí | 14 (52) | |
La variable que más se relacionó con T1 mayor de 30 días fue la supervivencia en el momento del estudio: el 62% de los supervivientes tenía un T1 mayor de 30 días, frente al 37% entre los fallecidos al final del estudio (p=0,073). No hubo ninguna variable relacionada con T2 mayor de 30 días con valor de p<0,2. La variable que más se relacionó con una espera mayor de 60 días fue el cumplimiento del circuito de asistencia habitual: el 70% de los pacientes que lo cumplieron tuvo un T2 mayor de 60 días, frente al 42% entre los que no lo cumplieron (p=0,035). Las variables que más se relacionaron con un T2.1 mayor de 30 días fueron las áreas sanitarias de procedencia de los pacientes y su supervivencia al final del estudio. El 87,5% de los pacientes de la provincia de León tuvieron un T2.1 mayor de 30 días, frente al 58% entre los que procedían de otras áreas sanitarias de la CC.AA. de Castilla y León (p=0,020). Por otra parte, el 81% de los pacientes supervivientes al final del estudio tuvieron un T2.1 mayor de 30 días, frente al 58% entre los fallecidos (p=0,083). Ninguna variable se aproximó a la significación estadística al analizar el T2.1 mayor de 60 días, el T2.2 mayor de 30 días o el T3 mayor de 30 días.
DiscusiónLos SPB son tumores malignos derivados de tejidos mesenquimales extraesqueléticos, que incluyen tejido adiposo, fibroso, nervios, músculos y vasos sanguíneos y linfáticos. Su comportamiento clínico es variable, dependiendo de la edad del paciente y de la localización e histotipo del tumor, con una supervivencia a 5 años estimada en torno al 50-60% de los casos1,2. Los de nuestra serie no mostraron particularidades epidemiológicas, histopatológicas ni clínicas diferentes a las de la generalidad, salvo que su tamaño al diagnóstico fue considerablemente mayor al habitual en países de nuestro entorno, que oscila en torno a los 9cm8,9. El tamaño medio de los sarcomas de nuestra serie alcanzó los 11,3cm, con 7,9cm en los superficiales y 12cm en los profundos.
Atendiendo a las cifras de incidencia de la enfermedad, según las cuales se diagnostican 2-4 SPB de los miembros por cada 100.000 habitantes y año, se calcula que un médico de AP verá uno cada 24 años y un especialista general pocos durante su práctica asistencial10. El conocimiento de la existencia y el significado de una enfermedad tan poco frecuente y trascendente, a menudo ignorada también por el paciente, es fundamental para una asistencia de calidad en tiempo y forma3,5–7,11,12, de lo que depende el pronóstico de la enfermedad13,14. La forma adecuada del tratamiento se refiere, en primer lugar, al sitio donde debe realizarse, que debe ser en centros especializados de referencia, donde el diagnóstico es más seguro en lo relativo a la biopsia12,15 y a su interpretación patológica16; y en lo relativo a los resultados terapéuticos oncológicos y funcionales17. Por cuanto respecta al tiempo, cuanto antes comience el tratamiento de un SPB, mejor. Incumplir alguno de los preceptos anteriores pone en riesgo la salud del paciente, encarece los costes18, y expone al profesional al escrutinio de la sociedad y del paciente y su familia, además de a posibles demandas médicolegales.
Para la derivación rápida de un paciente con un SPB a un centro especializado hay que partir del conocimiento de los signos de sospecha de la enfermedad, que se resumen en bultos, habitualmente profundos y poco o nada dolorosos, de más de 5cm de tamaño que crecen o reaparecen después de extirpados8. La existencia de un circuito ágil y sencillo de derivación en el contexto de una relación fluida entre los profesionales sanitarios es otro elemento fundamental17,19.
En lo que se refiere al mencionado circuito, uno de los objetivos de las guías de práctica clínica en el tratamiento de los SPB es acortar los tiempos de espera desde que la enfermedad se hace sintomática hasta el comienzo de su tratamiento. En los estudios específicos no hay uniformidad en los tiempos medidos, porque tampoco la hay en los circuitos seguidos por los pacientes, que pueden llegar a la unidad especializada remitidos por un médico de AP o por otro especialista general, a veces con escalas intermedias. En la serie de Rowbotham et al.7, por ejemplo, el 36% de los pacientes llegaron desde la AP y el 64% desde otro especialista hospitalario. Este solía ser un traumatólogo o un cirujano general que, curiosamente, habitualmente remitía a los pacientes con más procedimientos realizados previamente, inadecuados usualmente, que aquéllos. El 74% de los pacientes de la serie de George y Grimer20 consultaron inicialmente con su médico de AP con, al menos, un hallazgo de los contemplados en las guías para una referencia urgente; y solo 2 (4%) fueron referidos directamente a la unidad de tumores, mientras que 21 (43%) lo fueron a centros secundarios para pruebas adicionales.
En nuestro Sistema Nacional de Salud, el circuito de asistencia sanitaria está claramente definido, con la AP como puerta de entrada al sistema, con los servicios de urgencias como complemento para los casos urgentes. Desde cualquiera de estos sitios, cuando lo precisaran, los pacientes serían derivados a otros especialistas generales, quienes, a su vez, debieran hacer lo propio en las enfermedades que requirieran una atención más concreta, como sería la que habría que prestar a los pacientes con SPB. En nuestro estudio, el primer médico consultado fue un médico de AP en el 79% de las ocasiones y un especialista en un servicio de urgencias en el 11%, considerando que el circuito adecuado lo habrían seguido solo el 59% de los pacientes. El 41% habrían seguido otro diferente debido a haber consultado inicialmente con un especialista diferente a su médico de AP (21%) o a haber sido derivado por el médico de AP a un especialista diferente al traumatólogo (20%).
El capítulo de los tiempos transcurridos en el periplo asistencial de los pacientes con SPB tiene importancia capital puesto que, además de influir en la morbilidad, se ha descrito como factor predictivo estadísticamente significativo de la presentación de metástasis al diagnóstico y de la supervivencia global de los pacientes21, si bien esta observación no ha sido compartida por todos. Rougraff y Lawrence22, de hecho, consideran que el momento del diagnóstico en pacientes con SPB de alto grado no predice el resultado oncológico, que dependería más de otros factores biológicos de la enfermedad. También, paradójicamente, en algún caso se ha relacionado una demora asistencial larga con un buen pronóstico, si bien se trataría de tumores de bajo grado de malignidad8.
De cualquier forma, la demora diagnóstica que se considera significativa es difícil de cuantificar7, y los estudios sobre el tema suelen encontrarse con las limitaciones propias de la difícil identificación de la causa de la demora, que a menudo es multifactorial, y con la de la falta de un grupo de casos diagnosticados incidentalmente que sirva como control. De forma general, partiendo de que los retrasos suelen ocurrir antes de que el paciente llegue al centro de referencia23, se distingue entre la espera atribuida al paciente y la espera atribuida al médico. Aquélla es la que transcurre entre el primer síntoma y la primera consulta médica; mientras que la atribuida al médico es la que transcurre desde la primera consulta médica hasta que el paciente llega a la unidad oncológica.
En países con sistemas sanitarios desarrollados, las demoras medias atribuidas a los pacientes suelen oscilar entre uno y 4 meses, mientras que las atribuidas a los médicos lo hacen entre uno y 3 meses15,20. En la serie de Johnson et al.24, el tiempo transcurrido desde la presentación de la enfermedad y la consulta con el especialista fue de menos de un mes en la mitad de los pacientes. En la serie de Malik et al.25, todos los pacientes con sarcomas comenzaron su tratamiento dentro de los 2 meses después de derivados, independientemente del circuito que siguieron. En la serie de Smith et al.9 el tiempo transcurrido entre el comienzo de los síntomas y la atención del paciente en la unidad de tumores en SPB del miembro superior, inferior, del tronco y de la pelvis fue de 26, 25, 20 y 28 semanas, respectivamente.
En los casos de nuestro estudio, el tiempo medio transcurrido desde la aparición de la primera sintomatología de la enfermedad hasta la primera consulta médica fue ligeramente superior a 9 meses y medio; y el que transcurrió desde esta primera consulta médica hasta la primera consulta en nuestra UTME fue de casi 8 meses y medio. En este periodo de tiempo, el consumido hasta la primera consulta especializada fue de 80 días, mientras que los más de 5 meses restantes fue el que transcurrió desde esa consulta hasta llegar a la nuestra. Si partimos este intervalo temporal por el momento de la tramitación de la derivación del paciente a la unidad oncológica observamos que la mayor parte de aquél (98%) se consumió antes de la derivación, y que solo transcurrieron 12 días hasta la consulta en nuestra UTME. Es decir, independientemente de que en la serie hubiera casos muy desviados de la media que pudieran haber falseado los resultados, es evidente que los tiempos están muy alejados a los de los publicados, y que los pacientes consultan tarde por la enfermedad, así como que también transcurre demasiado tiempo desde la primera consulta médica hasta la primera consulta en la unidad especializada, llamando especialmente la atención el tiempo que transcurre desde la primera consulta especializada hasta el comienzo de los trámites de derivación.
Los motivos de una excesiva demora antes de la primera consulta médica probablemente sean la falta de síntomas específicos o severos de la enfermedad, a los que el paciente no atiende. En nuestro estudio, con un punto de corte en 30 días, las mayores esperas se relacionaron sobre todo con los casos de tamaño inferior a 8cm, lo que concuerda con lo esperado y publicado. El que los pacientes que residen en poblaciones sin hospital general también demoren más la primera consulta médica podría tener más que ver con la influencia del hospital en la conciencia de enfermedad de la población que con un menor nivel cultural, cuya relación se estudió y descartó. El hecho de que los pacientes con tumores que asientan en el miembro superior y con sarcomas superficiales consulten más tarde, probablemente también se relacione con la equivocada percepción que la población tiene de la enfermedad.
Los motivos de una excesiva demora en llegar a la unidad especializada tras la primera consulta médica es responsabilidad del profesional médico en opinión de Johnson et al.24, y se relacionaría con la falta de sospecha de la enfermedad, que habría sido confundida con otros procesos19. En nuestro estudio, con puntos de corte a 30, 60 y 90 días y sin haber investigado el motivo concreto de la demora, las mayores esperas se relacionaron con los pacientes que habían seguido el circuito habitual de derivación y con los de mayor supervivencia al final del estudio. La interpretación de estos resultados, lejos de sorprender, confirman la sospecha de que el circuito es lento y ha de mejorarse, pues no es normal que los que no lo siguen sean atendidos antes (muy probablemente porque acuden a servicios de urgencias desde donde se aceleran los trámites de derivación). El hecho de que los pacientes con una mayor supervivencia hayan tenido esperas terapéuticas más largas se explica porque estos fueron pacientes con la enfermedad menos grave al diagnóstico.
Un tercer actor en la responsabilidad de la demora, que apenas se ha mencionado en la literatura, podría ser el propio sistema y su intrínseca rigidez. Si bien pudiéramos estar tentados a culparle, máxime en el contexto de crisis y recortes que experimentamos, con la consiguiente sobrecarga asistencial, no parece que pueda ser el motivo de las demoras cuando se sospecha la enfermedad. Los 12 días por término medio que transcurrieron desde el comienzo de los trámites de derivación de los pacientes a nuestra UTME demuestran que, al menos en esta última parte del circuito, la responsabilidad administrativa no existe.
Teniendo en cuenta los factores pronósticos de los SPB y que nada se puede hacer para influir en muchos de ellos, un diagnóstico precoz redundaría en un menor tamaño a la presentación, lo que facilitaría el tratamiento conservador y mejoraría el pronóstico de la enfermedad8,26 a pesar de no haberse demostrado una correlación significativa entre la duración de los síntomas y el tamaño8, ni entre este y los diagnósticos tardíos del tumor27. De cualquier forma, el tamaño como criterio único de derivación de un paciente con una lesión de partes blandas a un centro de referencia es discutible, pues se ha demostrado que un 10% de las lesiones malignas pueden medir menos de 5cm, y que más de la mitad de las benignas pueden tener más de 5cm7.
Entre las medidas que habría que adoptar para mejorar la asistencia de los pacientes con SPB, manteniéndolas en el tiempo, están la educación de la población sobre los síntomas y signos de alarma de la enfermedad, y la conveniencia de una consulta médica pronta; la formación del personal médico en la sospecha de la enfermedad y su tratamiento correcto, lo que debe extenderse al colectivo de estudiantes de medicina; y la creación de guías y circuitos, que hay que publicitar, para derivar a los pacientes a los centros adecuados20. Aceptando que las campañas de concienciación en la población sobre la enfermedad no tendrán el mismo impacto que las que han tenido, por ejemplo, las relativas al cáncer de mama y que incrementarían la carga asistencial, así como que los circuitos de derivación urgente tienen muchas deficiencias, como serían su demostrado escaso rendimiento, y la interferencia en los cuidados rápidos que también habría que prestar a los pacientes que se derivan por otras vías25,28–30, las referidas medidas mejorarían la deficiente realidad expuesta.
Nuestro trabajo tiene muchas limitaciones, si bien a pesar de ellas creemos que demuestra que la asistencia a los pacientes con SPB de las extremidades en nuestro medio es mejorable en lo relativo al circuito y la filosofía asistencial. En primer lugar, se trata de un estudio retrospectivo. En segundo lugar, el tamaño muestral es relativamente pequeño, lo que repercute en una disminución de la potencia de las pruebas estadísticas utilizadas, lo que significa que aunque hayamos advertido importantes diferencias clínicas que seguramente fueran estadísticamente significativas, puede ser difícil detectarlas (falsos negativos). En tercer lugar, los casos, como es propio de la enfermedad que se estudia, son heterogéneos en su histotipo y grado de malignidad. En cuarto lugar, la población estudiada es una población ya sesgada porque son pacientes con diagnóstico de sarcoma en una unidad de referencia a la que no llegan todos los sarcomas que se diagnostican en la CC.AA. de Castilla y León. Por otra parte, las particularidades geográficas, demográficas y, posiblemente, socioeconómicas y culturales, no son las mismas a las de otras CC.AA. de nuestro país. En quinto lugar, las fechas manejadas en el estudio se basan en gran medida en el recuerdo del paciente sobre su enfermedad, lo que está sometido a sesgos. Para minimizarlos, las fechas anotadas en la historia clínica de los pacientes se compararon con las que nuevamente se preguntaron a los pacientes o a sus familiares, cuando el paciente había fallecido, comprobándose que no había diferencias significativas. En sexto lugar, no se han estudiado aspectos que podrían haber sido de interés, como los detalles de las demoras de los pacientes en la presentación a la primera consulta médica o la relación entre las demoras y los resultados del tratamiento, que dimos por demostrada. Finalmente, no se hizo análisis multivariante, que podría haber demostrado interrelación y potenciación de variables.
En conclusión, los tiempos de espera en nuestro medio, como también el volumen de los SPB al diagnóstico, son excesivamente largos y grandes, respectivamente, sobre todo hasta el comienzo de los trámites de derivación del paciente a nuestra UTME. Parece fundamental la necesidad de concienciar a la población sobre la enfermedad y recordarla entre los profesionales sanitarios, al igual que la existencia de un circuito de derivación que es necesario y obligatorio utilizar.
Nivel de evidenciaNivel de evidencia II.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha recibido el Premio Fundación SECOT de Investigación Clínica en Cirugía Ortopédica y Traumatología 2013.