El objetivo de este artículo es revisar las posibles indicaciones y controversias sobre los usos más frecuentes de los agentes estimuladores de la eritropoyetina (AEE) en el tratamiento de la anemia de los pacientes ancianos, con enfermedad oncológica y no oncológica avanzada. Para ello, hemos realizado una revisión sistemática en Pubmed, de artículos publicados desde 1985 hasta septiembre del 2016. Hemos realizado también la revisión de las principales guías de consenso españolas, europeas y americanas, en relación con el manejo de la anemia relacionada con las enfermedades reseñadas en el artículo. Hemos encontrado que existen barreras para su uso en pacientes ancianos con enfermedad avanzada, sobre todo por la falta de uniformidad y consenso en las recomendaciones, y por la ausencia de ensayos prospectivos a gran escala para explorar la eficacia de los AEE en esta población. Parece haber consenso en la utilización en los pacientes con enfermedad renal crónica avanzada, en pacientes con tumores no mieloides, en tratamiento con quimiterapia con intención no curativa, y en pacientes con síndrome mielodisplásico, todavía respondedores, para espaciar el soporte transfusional. En el resto, debe individualizarse, ya que el riesgo de mortalidad y morbilidad cardiovascular está claramente aumentado. No debe ser la solución para tratar la anemia, en casos de urgencia o de necesidad transfusional a corto plazo, muchas veces presentes en este paciente.
The aim of this article is to review possible indications and controversies about the most frequent uses of ESAs in the treatment of anaemia in elderly patients with oncological and non-oncological diseases. Using PubMed a systematic review was carried out on articles published from 1985 to September 2016, as well as a review of the main Spanish, European, and American consensus guidelines on each of the following diseases in which could pose the treatment of anaemia associated with ESA. A review was also carried out on the main Spanish, European and American consensus guidelines regarding the management of anaemia related to the diseases outlined in this article. It was found that there are limitations of its use in elderly patients with advanced disease, mainly due to the lack of uniformity and consensus in the recommendations, and the absence of large-scale prospective trials to determine the effectiveness of ESA in this population. There seems to be consensus in the use in patients with advanced chronic kidney disease, individualised in patients with non-myeloid cancer on treatment without curative intent, and in patients with myelodysplastic syndrome, still responders to space transfusional support. In the remainder, it should be individualised, since the risk of mortality and cardioembolic morbidity is clearly increased. It should not be the solution to treat anaemia, in cases of urgency or short-term transfusional need, which are often present in these patients.
La anemia (según la Organización Mundial de la Salud: cifras de hemoglobina en adultos < 13g/dl en varones o < 12g/dl en mujeres)1 es un signo clínico muy frecuente en los pacientes ancianos. Las principales causas de la anemia en estos pacientes son la anemia asociada a enfermedad crónica, la infiltración neoplásica medular, la mielofibrosis, la alteración en el metabolismo del hierro (Fe) y la malnutrición. Los síntomas de esta anemia que influyen muy negativamente en la calidad de vida son la astenia, la disnea y el malestar general2,3.
Existe consenso en que transfundir es una opción válida para controlar los síntomas asociados a la anemia en los pacientes con enfermedad muy avanzada, pero siempre que tomemos la decisión sobre la base de criterios clínicos y sintomáticos (insuficiencia cardiaca, hipotensión ortostática, astenia o disnea intensas relacionadas con la anemia) y si tenemos un pronóstico estimado de vida de al menos 2 semanas2,4. No obstante, la impresión general es que la indicación de las transfusiones se realiza «según arte», ya que son escasas las publicaciones centradas en el tratamiento de la anemia en pacientes en programas de cuidados paliativos2.
La eritropoyetina humana (EPO) es una hormona glucoproteica que regula la eritropoyesis. Transportada por la sangre, actúa sobre receptores específicos de células progenitoras eritroides de la médula ósea, induciendo un incremento en la producción de eritrocitos circulantes y de los valores de hemoglobina. Su producción y regulación se realiza sobre todo a nivel renal, en respuesta a la hipoxia tisular. Responde a un mecanismo de retroalimentación, de manera que, cuando el transporte de oxígeno al riñón aumenta, se inhibe la producción de EPO y se reduce la maduración de elementos eritroides.
Actualmente, se encuentran comercializados distintos agentes estimuladores de la EPO (AEE) en España: epoetina alfa, epoetina beta, epoetina delta, darbepoetina alfa y metoxi-polietilenglicol epoetina beta5.
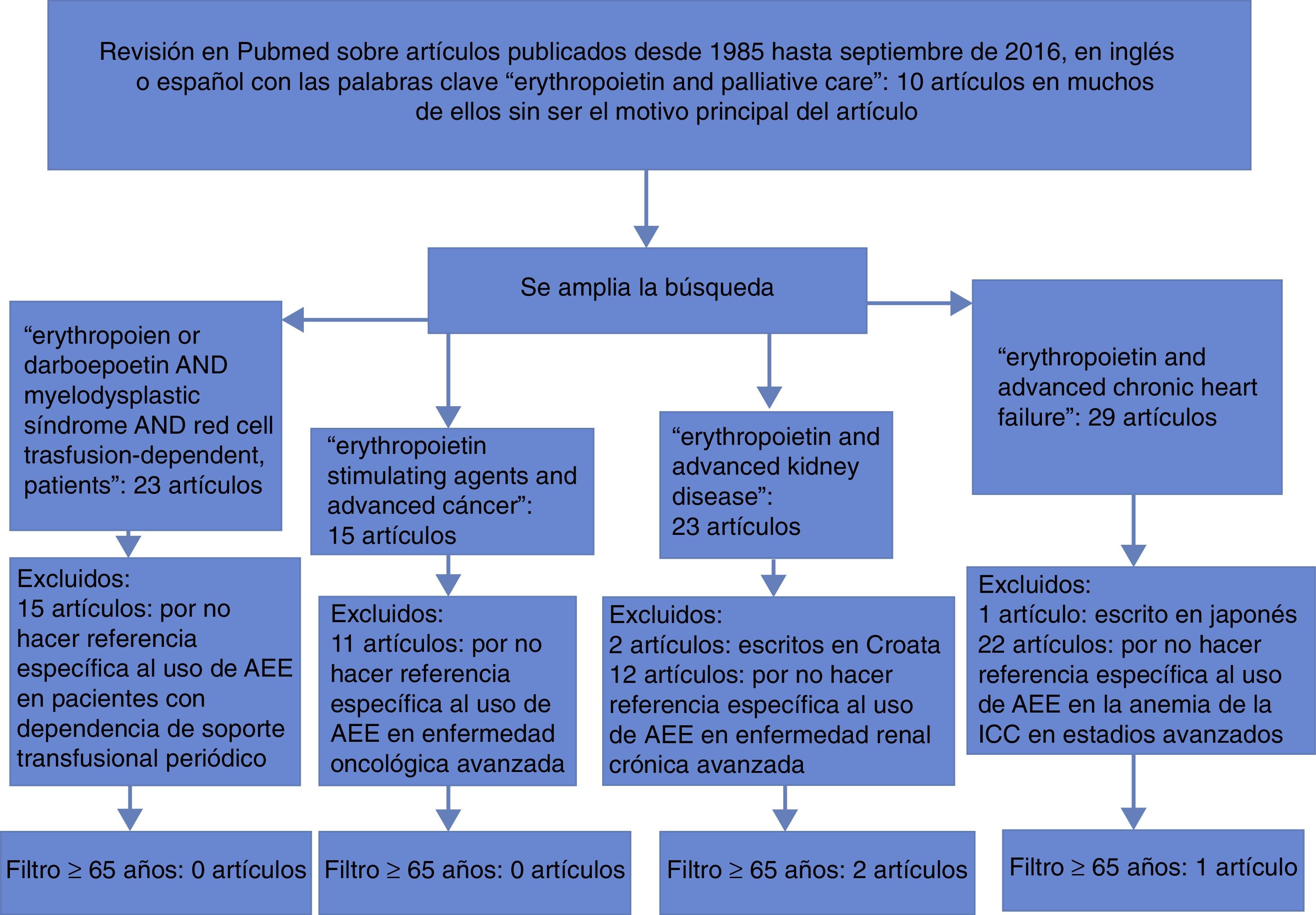
Material y métodosEl objetivo de este trabajo es revisar las posibles indicaciones y controversias sobre los usos más frecuentes de los AEE en el tratamiento de la anemia de los ancianos con enfermedad avanzada. Para ello, hemos realizado una revisión en Pubmed sobre artículos publicados desde 1985 hasta septiembre del 2016, en inglés o español. Comenzamos utilizando las palabras clave «erythropoietin and palliative care», encontrando solo 10 artículos en los que se nombraba el uso de EPO en pacientes subsidiarios de cuidados paliativos, aunque muchos de ellos sin ser el motivo principal del artículo. Tras inclusión en búsqueda avanzada con términos «elderly», «elderly patients» u «oldest», no encontramos ningún resultado. A partir de ello, hemos realizado búsquedas avanzadas (advanced search) con las palabras clave «erythropoietin and advanced kidney disease». Encontramos 23 artículos, de los cuales se excluyeron 2 artículos por estar escritos en croata y 12 artículos por no hacer referencia específica a enfermedad crónica renal avanzada. Posteriormente, se incluye también el filtro de mayores de 65 años, y solo 2 artículos hablan del uso de AEE en la anemia de la insuficiencia renal crónica avanzada. Si introducimos «erythropoietin and advanced chronic heart failure», encontramos 29 artículos, excluyendo uno por estar escrito en japonés y 22 por no hacer mención directa al uso de EPO en la anemia de la insuficiencia cardiaca crónica (ICC) en estadios avanzados. Si introducimos el filtro de mayores de 65 años, solo en un artículo se habla específicamente del tema propuesto. Buscamos también «erythropoietin or darbepoetin AND myelodysplastic syndrome AND red cell transfusion-dependent patients», encontrando 23 artículos, de los cuales solo en 8 se hacía referencia concreta a pacientes con dependencia de soporte transfusional periódico, y en ningún artículo se hablaba específicamente si se introducía el filtro de mayor de 65 años. Finalizamos la búsqueda incluyendo «Erythropoietin stimulating agents and advanced cáncer», encontrando 15 artículos, de los cuales solo en 4 se hablaba específicamente de enfermedad oncológica avanzada y en ninguno si introducimos el filtro de edad de mayor de 65 años (fig. 1).
Así mismo se han revisado las guías de la European Renal Association-European Dialysis and Transplant Association, las guías de práctica clínica de la National Kidney Foundation-KDOQI (y sus recomendaciones de práctica clínica para el manejo de la anemia en el insuficiencia renal crónica), las recomendaciones de la Agencia Europea del Medicamento (EMEA) sobre el manejo de AEE en pacientes con cáncer, las guías de diagnóstico y tratamiento de los síndromes mielodisplásicos, y la leucemia mielomonocítica crónica del Grupo Español de Síndromes Mielodisplásicos (GESMD) de la Sociedad Española de Hematología y Hemoterapia, las recomendaciones publicadas al respecto por el National Cancer Institute y las consensuadas sobre el uso de AEE en pacientes con cáncer por la Sociedad Americana de Hematología y la Sociedad Americana de Oncología6–11.
ResultadosAgentes estimuladores de la eritropoyetina en enfermedad renal avanzadaEn la enfermedad renal crónica, la anemia es muy frecuente, precoz y multifactorial, aunque el descenso en la producción de EPO endógena constituye la causa original. En estadios más tardíos, en pacientes en diálisis o con estadio 5 en tratamiento conservador, alrededor del 90% de los pacientes la presentan12.
El principal impacto fisiopatológico de esta anemia es la disminución de la liberación de oxígeno a los tejidos, con el consiguiente aumento de la astenia e intolerancia al esfuerzo, el deterioro de la función cognitiva y de la función cardiaca, trastornos del sueño, hemostasia alterada e inmunosupresión.
Las guías de la European Best Practice Guidelines and National Kidney Foundation (EBPG) recomendaron en su última edición tratar con AEE a los pacientes con insuficiencia renal, si presentan cifras de Hb<11g/dl y con suplementos de Fe para asegurar unos niveles de ferritina > 100ng/ml6,7. Se establecieron estos límites en el uso de los AEE, basándose en los resultados de los estudios CHOIR y CREATE, y un metaanálisis publicado en 200713–15, en los que se vio que objetivos de Hb>13,5g/dl incrementaban el riesgo de la morbimortalidad cardiovascular. No se debe iniciar, por lo tanto, tratamiento con AEE con cifras de Hb > 10g/dl en pacientes diabéticos u 11g/dl en no diabéticos, ni en pacientes con antecedentes de ictus, salvo en casos de Hb<9g/dl mal tolerada (y sin superar cifras de Hb = 12mg/dl).
Sólo hemos encontrado 2 estudios, de pequeña escala, en los pacientes ancianos con IRC avanzada, que indica ventaja clínica con su uso por mejora de la hemoglobina, disminución de la astenia y la tasa de hospitalización12,14, sin entrar en más análisis de morbimortalidad.
Agentes estimuladores de la eritropoyetina en insuficiencia cardiaca crónicaLa anemia es, junto a la insuficiencia renal, la principal comorbilidad en los pacientes ingresados por descompensación cardiaca, por delante incluso de la diabetes (estudio GESAIC)15. La prevalencia aumenta claramente con el tiempo de evolución de la ICC, detectándose hasta un 55% en clases funcionales más avanzadas, los estadios iii-iv de la NYHA16. Estos pacientes presentan déficit de Fe hasta en un 73% de los casos17,18 y son pacientes con importante deterioro del estado general con caquexia cardiaca y deficiencias nutricionales. Además, muchos de los fármacos necesarios en el tratamiento favorecen la aparición o el agravamiento de la anemia. Solo en un artículo se habla del tratamiento combinado de Fe y AEE para el tratamiento de la ICC avanzada en ancianos, y en él nos especifica que puede mejorar la calidad de vida19. Sin embargo, en el estudio Reduction of Events by Darbepoetin Alfa in Heart Failure (RED-HF)20, que incluyó a pacientes sintomáticos (aunque no especificando ancianos) con disfunción ventricular (NYHA II-IV y FEVI ≤ 40%) y anemia leve-moderada (Hb 9-12g/dl), se evaluó el tratamiento con darbepoetina alfa, sin encontrar diferencias significativas en el objetivo primario (muerte de cualquier causa o primer ingreso por empeoramiento de la insuficiencia cardiaca) ni en los objetivos secundarios (muerte de causa cardiovascular). Sí hubo diferencias significativas en la mejora de la calidad de vida, medida según el Kansas City Cardiomyopathy Questionnarie. Se detectaron más eventos embólicos en el grupo de tratamiento y mayor incidencia de ictus isquémico, ambos con significación estadística. Los resultados de este estudio además son concordantes con los de otros similares publicados posteriormente, como el estudio STAMINA-HeFT21, que también ensayó el uso de darbepoetina alfa en pacientes con FEVI ≤ 40% y Hb 9,5-12g/dl y en el que, aunque el tamaño muestral era mucho menor, no se encontraron diferencias estadísticamente significativas en mortalidad, reingreso ni mejora de clase funcional.
Agentes estimuladores de la eritropoyetina en tumores sólidosLa prevalencia de la anemia en la enfermedad tumoral varía con el tipo de tumor y presenta un origen multifactorial. La anemia puede comprometer la tolerancia al tratamiento y reducir la dosis o duración de los mismos, al empeorar la temida hipoxia tumoral, que hace que el tumor sea más agresivo y más resistente a la quimioterapia (QT) o a la radioterapia. No hemos encontrado ningún artículo que hable, específicamente, del tratamiento con AEE de la anemia asociada a enfermedad oncológica avanzada en ancianos, por lo que pasamos a comentar lo más relevante, aunque se tenga que basar en otros grupos etarios.
En un principio, Seidenfeld et al.22 publicaron los resultados de un metaanálisis de 22 ensayos clínicos que demuestran que las necesidades de transfusión se reducen en los pacientes tratados con epoetinas. Cella et al.23, en una revisión publicada en 2003, concluyen que los AEE elevan el valor de hemoglobina en un 50-60% de los pacientes oncológicos con anemia y mejoran su calidad de vida.
Sin embargo, se han publicado posteriormente numerosos estudios, que concluyen que el uso de AEE (epoetina alfa, beta o darbepoetina) disminuye de forma significativa el riesgo de transfusiones, pero se asocian a un aumento del riesgo tromboembólico, hipertensión arterial y muerte24–27. Así mismo, desde la publicación de los estudios PREPARE y GOG-1918, se informó de un incremento del riesgo de progresión tumoral y disminución de la supervivencia global en pacientes con cáncer de mama avanzado, cabeza y cuello, cérvix, neoplasias linfoides y cáncer de pulmón no microcítico, cuando se utilizan con el objetivo diana de obtener niveles de Hb ≥ 12g/dl.
A raíz de estos datos, instituciones de prestigio, como la National Comprehensive Cancer Network (NCCN), American Society of Clinical Oncology (ASCO) o American Society of Hematology (ASH), el Comité de Medicamentos de Uso Humano de la EMEA, y su grupo de trabajo de Farmacovigilancia, así como la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) han revisado sus recomendaciones de uso. Únicamente está aprobado para el tratamiento de la anemia sintomática, en pacientes adultos con tumores no mieloides tratados con QT, sin superar los 12g/dl de Hb, y deberá considerarse el uso de AEE como primera opción solo en aquellos pacientes en los que los beneficios, en términos de calidad de vida, superen el posible riesgo de progresión de la enfermedad. Desaconseja su uso en pacientes oncológicos que reciban QT con intención curativa, en pacientes en tratamiento con radioterapia y recalcan que el riesgo de progresión de enfermedad y aumento de morbimortalidad por eventos tromboembólicos no deben ser excluidos aun cuando el objetivo sea no superar los 12g/dl de Hb8,11,27.
Agentes estimuladores de la eritropoyetina en la anemia del síndrome mielodisplásicoLa cifra de Hb en el momento del diagnóstico de síndrome mielodisplásico (SMD) suele estar por debajo del rango normal en el 90% de los pacientes, aproximadamente un 60% presentan una Hb por debajo de 10g/dl, y un 27%, inferior a 8g/dl. La anemia crónica se asocia con un deterioro significativo del estado funcional de los pacientes con SMD, sobre todo de edad avanzada, con peor calidad de vida y con un peor pronóstico en aquellos que además asocian otras comorbilidades28. No hemos encontrado ningún estudio que hable, específicamente, del tratamiento con AEE en ancianos con SMD dependientes de soporte transfusional. Sin embargo, sabemos que el pilar del tratamiento de los SMD es el soporte transfusional con concentrado de hematíes, y este debe ser considerado en cualquier paciente con sintomatología derivada de la anemia. Las sociedades científicas9,29 han consensuado que en los pacientes con SMD y anemia crónica las cifras de Hb para valorar la trasfusión estén por debajo de 7g/dl y no se recomienda por encima de 10g/dl. Este umbral se debe modular en función del estilo de vida del paciente y de la existencia o no de comorbilidad cardiaca, respiratoria, vascular periférica o neurológica.
En este rango es donde entran en juego los tratamientos con AEE. Se han realizado 4 estudios aleatorizados en fase iii con epoetina en los pacientes con SMD: uno con epoetina frente a placebo30, 2 con epoetina+G-factores estimuladores de colonias (CSF) frente a tratamiento de soporte31,32 y un cuarto entre epoetina vs. epoetina+G-CSF33. Los 3 primeros mostraron un efecto beneficioso del tratamiento sobre los niveles de Hb y el cuarto demostró mayor eficacia de la combinación frente a epoetina sola. Además, varios metaanálisis34–36 apoyan el uso de la epoetina/darbepoetina y epoetina/darbepoetina+G-CSF en el tratamiento de la anemia en los SMD, incluso objetivando una mejora en la supervivencia frente a tratamiento de soporte, y sin que en ninguno se evidencie un aumento del riesgo de eventos cardiovasculares o de transformación a leucemia en los pacientes que han recibido AEE37,38.
La indicación, por lo tanto, de tratamiento con AEE en pacientes con SMD es la presencia de anemia sintomática, generalmente con Hb inferior a 10g/dl, y con elevada probabilidad de respuesta. Esta probabilidad de respuesta elevada viene determinada por: nivel sérico de EPO (< 500 U/l), porcentaje de blastos en MO (< 10%), tener un índice pronóstico internacional (IPSS) bajo o intermedio, diagnóstico de anemia refractaria, cariotipo normal, independencia transfusional pretratamiento y duración corta de la enfermedad. Se ha diseñado un modelo predictivo de respuesta en función de los niveles séricos de EPO y de los requerimientos transfusionales39,40.
En todos los casos se deberá asegurar unos niveles de Fe adecuados o bien en forma oral o intravenoso si procede (ferritina sérica inferior a 100ng/ml y/o índice de saturación de transferrina<20%).
La evaluación de la respuesta se deberá realizar a las 4 semanas, con los criterios de respuesta eritroide del International Working Group (IWG). En caso de respuesta, se debe ajustar el tratamiento a un mantenimiento de Hb estable no superior a 12g/dl. Si se superase este límite, se debe interrumpir el tratamiento y reiniciar cuando la Hb se sitúe en 11g/dl. En caso de falta de respuesta, añadir G-CSF. Si no hay respuesta hematológica a las 16-20 semanas, se recomienda suspender el tratamiento40.
DiscusiónExisten voces críticas con respecto al uso generalizado de los AEE, ya que en la mayoría de los ensayos, que han servido para su aprobación de comercialización, solo se ha valorado el aumento de Hb y la disminución de la necesidad de trasfusión, sin valorarse si realmente existía descenso en la morbimortalidad.
Centrándonos en la enfermedad avanzada en el anciano, no hemos encontrado estudios consistentes que nos apoyen en la toma de decisiones. Ni siquiera hay uniformidad y consenso en las recomendaciones de tratamiento de la anemia tanto en cáncer como en enfermedades crónicas muy avanzadas en otros grupos de edad, debidos a la ausencia de ensayos prospectivos a gran escala para explorar la efectividad de los AEE y el balance riesgos/beneficios. Tendremos que asumir que existen estas barreras para su utilización, que se unen a las propias de los AEE (tasa alta de no respondedores, efectos secundarios…) que en estos pacientes ancianos con enfermedad avanzada limitan su uso como tratamiento de la anemia.
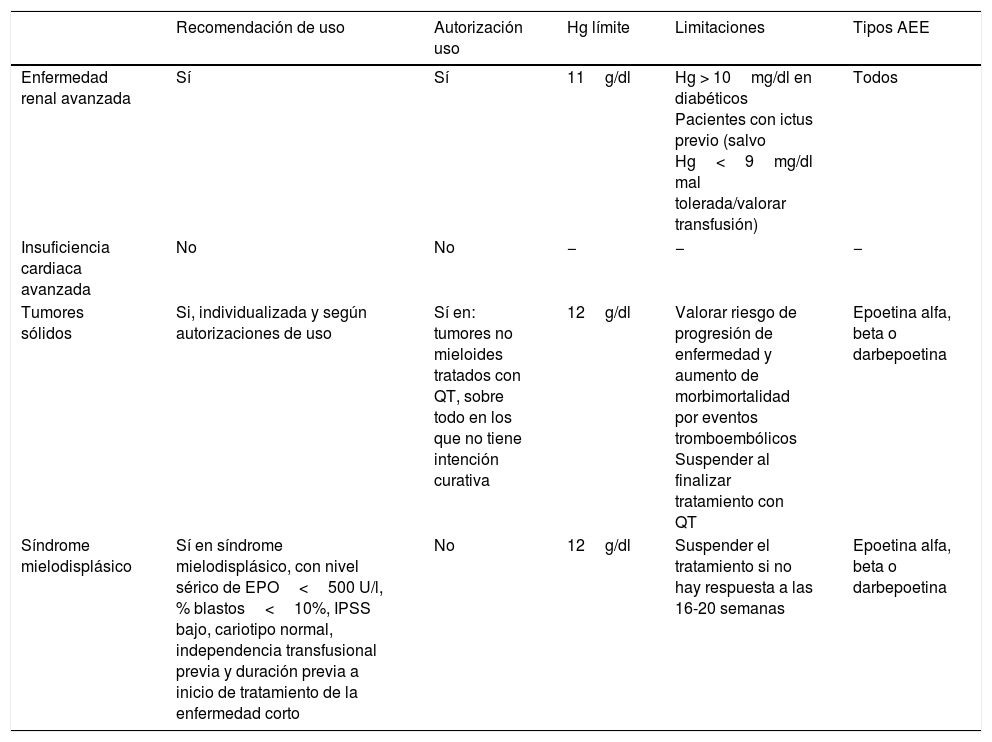
Parece haber consenso en la utilización en los pacientes con IRC avanzada con tratamiento conservador (aun tomando como referencia estudios realizados en otros grupos de pacientes con enfermedad renal crónica, incluyendo pacientes en prediálisis o trasplantados), en pacientes con tumores no mieloides tratados con QT (sin intención curativa) y para espaciar soporte transfusional en los pacientes con SMD (siempre que sean respondedores) (tabla 1).
Resumen de las principales recomendaciones y consensos de usos de los AEE
| Recomendación de uso | Autorización uso | Hg límite | Limitaciones | Tipos AEE | |
|---|---|---|---|---|---|
| Enfermedad renal avanzada | Sí | Sí | 11g/dl | Hg > 10mg/dl en diabéticos Pacientes con ictus previo (salvo Hg<9mg/dl mal tolerada/valorar transfusión) | Todos |
| Insuficiencia cardiaca avanzada | No | No | − | − | − |
| Tumores sólidos | Si, individualizada y según autorizaciones de uso | Sí en: tumores no mieloides tratados con QT, sobre todo en los que no tiene intención curativa | 12g/dl | Valorar riesgo de progresión de enfermedad y aumento de morbimortalidad por eventos tromboembólicos Suspender al finalizar tratamiento con QT | Epoetina alfa, beta o darbepoetina |
| Síndrome mielodisplásico | Sí en síndrome mielodisplásico, con nivel sérico de EPO<500 U/l, % blastos<10%, IPSS bajo, cariotipo normal, independencia transfusional previa y duración previa a inicio de tratamiento de la enfermedad corto | No | 12g/dl | Suspender el tratamiento si no hay respuesta a las 16-20 semanas | Epoetina alfa, beta o darbepoetina |
Los AEE han demostrado aumentar las cifras de Hb, lo que disminuye las necesidades de transfusión y mejora, por tanto, la calidad de vida del paciente, pero a costa de un aumento de los riesgos cardiovasculares y de la mortalidad.
No existen estudios suficientemente rigurosos sobre riesgos y beneficios de los AEE en pacientes ancianos con enfermedad avanzada oncológica y no oncológica, por lo que tenemos que basarnos en la evidencia de situaciones clínicas de enfermedad no tan avanzada y en grupos de pacientes más jóvenes.
No debe ser la solución para el tratamiento urgente de la anemia, o en aquellos casos en los que se precise soporte transfusional a corto plazo, muchas veces presentes en este paciente.
Por lo tanto, es necesario individualizar el tratamiento, orientado siempre a la mejora de calidad de vida, efectividad y eficiencia, teniendo en cuenta los efectos secundarios y basándonos en las indicaciones terapéuticas aceptadas y consensuadas a nivel mundial.
Tendremos que realizar un seguimiento estrecho por parte de todos los facultativos implicados, para no estar utilizando un fármaco que no le aporta ningún beneficio al paciente y lo expone a riesgos innecesarios.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés en relación con el artículo presentado.