La afectación hepática producida por medicamentos es un problema de salud en aumento. Entre los fármacos causantes más comunes se encuentran el paracetamol, la amoxicilina-ácido clavulánico (AAC) y los antiepilépticos1–4.
Atendiendo al tipo de daño hepático, la hepatitis farmacológica puede clasificarse en intrínseca (reacción predecible dosis-dependiente, por ejemplo, el paracetamol) o idiosincrática (menos frecuente, afecta solo a individuos susceptibles y no es dosis-dependiente, por ejemplo, el AAC)2. El patrón de daño hepático se cataloga mediante la división de alanina aminotransferasa (ALT) y la fosfatasa alcalina (FA) en relación con sus respectivos valores superiores límites de normalidad (VLN); expresada como el «cociente R=(ALT/ALT VLN)/ (FA/FA VLN)». Se considera que el patrón es hepatocelular cuando R≥5, colestásico cuando R≤2 y mixto cuando 2<R<51,2,5.
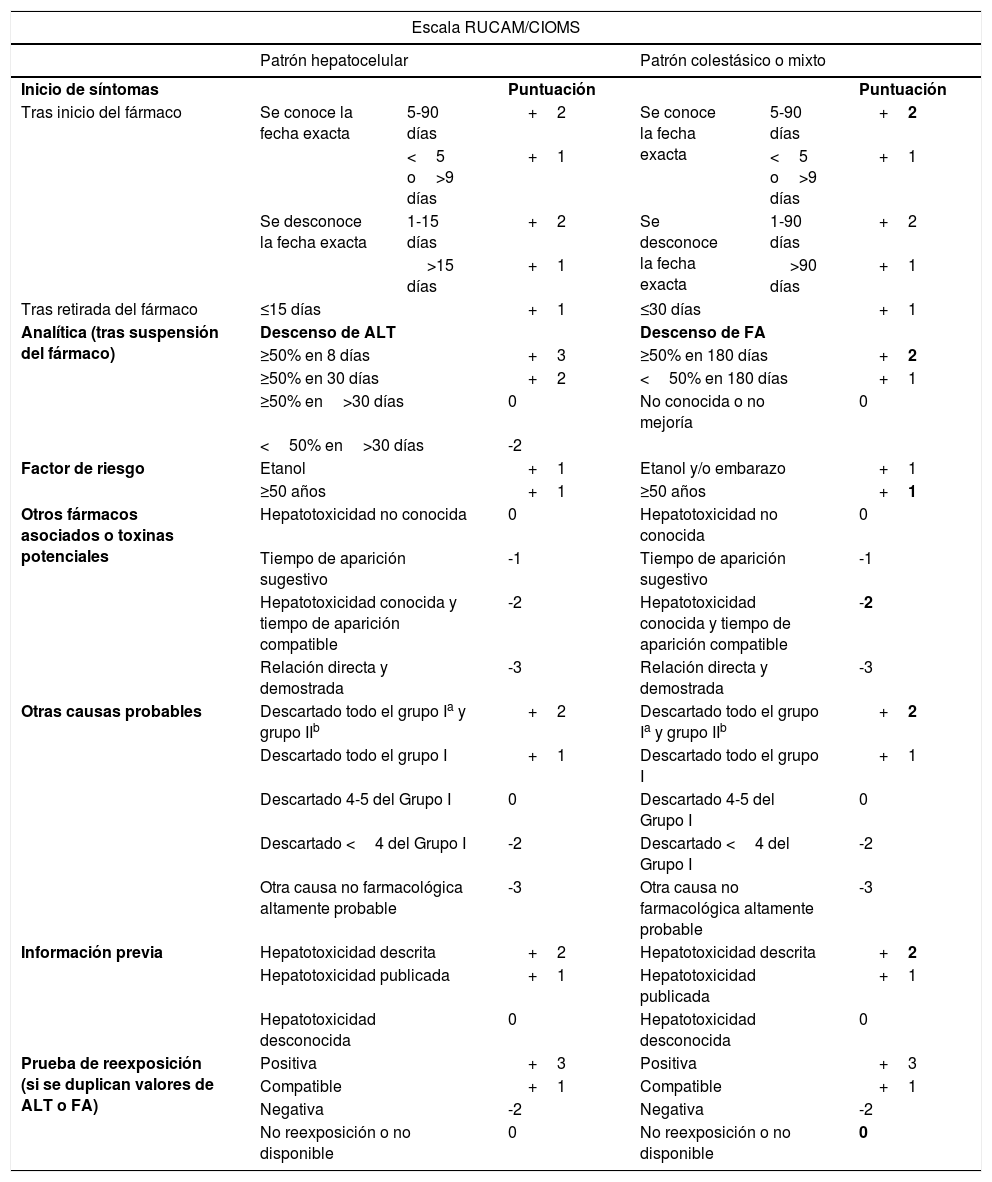
El diagnóstico etiológico es de exclusión, descartando otros diagnósticos diferenciales (hepatitis vírica, autoinmune, metabólica, alcohólica, o secundaria a trastornos hemodinámicos, entre otras). La Escala Roussel Uclaf Causality Assessment Method/Council for International Organizations of Medical Sciences (RUCAM/CIOMS), es un instrumento probabilístico que apoya la etiología medicamentosa de esta patología y solo debe aplicarse después de haber descartado otras enfermedades2. Evalúa siete variables y tiene un rango de puntuación de -9 a+15. La suma de las variables refleja la probabilidad de causalidad medicamentosa como alta probabilidad, probable, posible, poco probable o excluida (a mayor puntuación, mayor probabilidad)5. La biopsia hepática no tiene valor diagnóstico debido a la heterogeneidad de las lesiones hepáticas concomitantes en esta patología2.
Presentamos el caso de una mujer de 90 años ingresada en Geriatría por un síndrome ictérico y fallo hepático agudo. Como antecedentes presentaba fibrilación auricular, hipertensión arterial, enfermedad renal crónica y meningioma frontal izquierdo con epilepsia focal secundaria. Al ingreso, la paciente llevaba cinco días de tratamiento con AAC (875/125mg cada 8h) por infección urinaria. Como medicación habitual tomaba omeprazol, acenocumarol, espironolactona, furosemida, dexametasona, lacosamida, levetiracetam, metamizol y paracetamol ocasional. Su situación basal era de vida cama-sillón (Functional Ambulatory Categories 0/5), índice de Barthel de 10/100 y estado mental 2/5 según la escala de Cruz Roja.
Al ingreso, la paciente se encontraba estable hemodinámicamente y afebril, con bajo nivel de conciencia e ictericia en piel y mucosas. Presentaba dolor a la palpación en hipocondrio derecho sin signos de irritación peritoneal. En las pruebas complementarias destacaba una leucocitosis leve con neutrofilia, actividad de protrombina de 14%, INR de 4, insuficiencia renal (filtrado glomerular de 27,5ml/min), alteración del perfil hepático (ALT 1116 UI/L, gamma glutamil transpeptidasa 2336 UI/L, aspartato amino transferasa 690 UI/L, FA 991 UI/L, bilirrubina total 7,7mg/dl y bilirrubina directa 6,1mg/dl), proteína C reactiva 11,2mg/dl y procalcitonina negativa. La orina era normal. Se descartaron lesiones ocupantes de espacio hepáticas así como patología obstructiva biliar mediante ecografía y tomografía axial computarizada.
Se realizó diagnóstico diferencial con hepatitis infecciosas (VHA, VHB, VHC, VHE, VEB, CMV, sífilis y toxoplasma), enfermedades autoinmunes (ANA, ANCA, AAM, AML, anti-KLM) y metabólicas (ferritina, índice de saturación de transferrina, cobre, ceruloplasmina y alfa-1-anti-tripsina), con resultados negativos. Se suspendió todo tratamiento hepatotóxico (paracetamol y AAC) excepto los antiepilépticos y se le mantuvo con tratamiento de soporte.
Se clasificó el patrón de daño hepático como mixto (cociente R de 3,73). Una vez descartadas el resto de las etiologías de hepatitis y dado el antecedente de tratamiento antibiótico con AAC (potencialmente hepatotóxico), se diagnosticó de hepatitis medicamentosa por AAC. Al aplicarse la escala RUCAM/CIOMS se obtuvo una puntuación de+7, indicativa de probabilidad de etiología medicamentosa (tabla 1).
Escala RUCAM/CIOMS
| Escala RUCAM/CIOMS | ||||||
|---|---|---|---|---|---|---|
| Patrón hepatocelular | Patrón colestásico o mixto | |||||
| Inicio de síntomas | Puntuación | Puntuación | ||||
| Tras inicio del fármaco | Se conoce la fecha exacta | 5-90 días | +2 | Se conoce la fecha exacta | 5-90 días | +2 |
| <5 o>9 días | +1 | <5 o>9 días | +1 | |||
| Se desconoce la fecha exacta | 1-15 días | +2 | Se desconoce la fecha exacta | 1-90 días | +2 | |
| >15 días | +1 | >90 días | +1 | |||
| Tras retirada del fármaco | ≤15 días | +1 | ≤30 días | +1 | ||
| Analítica (tras suspensión del fármaco) | Descenso de ALT | Descenso de FA | ||||
| ≥50% en 8 días | +3 | ≥50% en 180 días | +2 | |||
| ≥50% en 30 días | +2 | <50% en 180 días | +1 | |||
| ≥50% en>30 días | 0 | No conocida o no mejoría | 0 | |||
| <50% en>30 días | -2 | |||||
| Factor de riesgo | Etanol | +1 | Etanol y/o embarazo | +1 | ||
| ≥50 años | +1 | ≥50 años | +1 | |||
| Otros fármacos asociados o toxinas potenciales | Hepatotoxicidad no conocida | 0 | Hepatotoxicidad no conocida | 0 | ||
| Tiempo de aparición sugestivo | -1 | Tiempo de aparición sugestivo | -1 | |||
| Hepatotoxicidad conocida y tiempo de aparición compatible | -2 | Hepatotoxicidad conocida y tiempo de aparición compatible | -2 | |||
| Relación directa y demostrada | -3 | Relación directa y demostrada | -3 | |||
| Otras causas probables | Descartado todo el grupo Ia y grupo IIb | +2 | Descartado todo el grupo Ia y grupo IIb | +2 | ||
| Descartado todo el grupo I | +1 | Descartado todo el grupo I | +1 | |||
| Descartado 4-5 del Grupo I | 0 | Descartado 4-5 del Grupo I | 0 | |||
| Descartado <4 del Grupo I | -2 | Descartado <4 del Grupo I | -2 | |||
| Otra causa no farmacológica altamente probable | -3 | Otra causa no farmacológica altamente probable | -3 | |||
| Información previa | Hepatotoxicidad descrita | +2 | Hepatotoxicidad descrita | +2 | ||
| Hepatotoxicidad publicada | +1 | Hepatotoxicidad publicada | +1 | |||
| Hepatotoxicidad desconocida | 0 | Hepatotoxicidad desconocida | 0 | |||
| Prueba de reexposición (si se duplican valores de ALT o FA) | Positiva | +3 | Positiva | +3 | ||
| Compatible | +1 | Compatible | +1 | |||
| Negativa | -2 | Negativa | -2 | |||
| No reexposición o no disponible | 0 | No reexposición o no disponible | 0 | |||
Se resaltan en negrita las puntuaciones obtenidas del caso que presentamos.
ALT: alanina aminotransferasa; FA: fosfatasa alcalina; RUCAM: Roussel Uclaf Causality Assessment Method; VLN: valor superior límite de la normalidad.
Grupo II: CMV, BEV, infección por virus herpes. Puntuación: ≤0: excluido; 1-2: poco probable; 3-5: posible; 6-8: probable; ≥9: altamente probable.
Fuente: Chalasani et al.2.
La paciente presentó una mejoría progresiva de las enzimas hepáticas (ALT de 119 UI/L y FA de 417 UI/L el 12.° día) aunque con evolución clínica tórpida, falleciendo por neumonía aspirativa.
Durante un periodo de diez años (1994-2004) se registraron en España 446 casos de hepatitis medicamentosa idiosincrática1, encontrando solo 52 casos de patrón mixto con una media de edad de 52 años (14-83 años). La AAC fue el principal fármaco causante de hepatitis. La afectación hepática por ingesta de AAC es del tipo idiosincrática con una latencia de corta a moderada. El patrón colestásico es la forma predominante de daño hepático, apareciendo principalmente al acabar el tratamiento antibiótico2.
Ser mujer, presentar un patrón hepatocelular o bilirrubina total aumentada son factores de riesgo asociados a hepatitis fulminante, siendo esta la principal causa de mortalidad en un 67% de los casos. Sin embargo, en mayores de 80 años, la incidencia fue superior en varones, siendo el patrón colestásico el más frecuente1. Al ser el envejecimiento un proceso heterogéneo, existe variabilidad en cuanto a los cambios farmacodinámicos y farmacocinéticos. Además, la fragilidad en el anciano se ha asociado a un mayor riesgo de enfermedad, muerte y renuencia a la hora de prescribir un fármaco3. Se comunica este caso ante la rareza de presentación en una paciente nonagenaria con presencia de patrón mixto y la alta frecuencia de uso del medicamento causal.
Muchas son las causas que hacen que el diagnóstico de esta patología siga siendo un reto médico (inexistencia de instrumentos diagnósticos, polifarmacia, cambios farmacodinámicos y farmacocinéticos en los ancianos…). Por ello, siempre debe considerarse esta posibilidad ante un paciente con daño hepático agudo o crónico inexplicable; así como también sería conveniente limitar el uso de ACC en aquellas infecciones en las que se sospeche de un microorganismo no productor de betalactamasas6.