En esta revisión pretendemos dar una visión de conjunto de una afección que, como veremos, afecta a un porcentaje muy elevado de la población.
Las diversas teorías que existen en la actualidad sobre el desarrollo de la hiperplasia benigna de próstata (HBP) son expuestas en este trabajo con especial hincapié en los factores de crecimiento. Realizamos un breve resumen de los problemas fisiopatológicos planteados, ya que muchos síntomas pueden deberse al envejecimiento o a factores concurrentes distintos del prostatismo.
Exponemos la clínica prostática más habitual, dividiendo los síntomas en irritativos y obstructivos, y detallando las distintas pruebas y técnicas diagnósticas disponibles en la actualidad. Por último, hacemos referencia a las medidas terapéuticas, especialmente a las de nueva tecnología, como el láser de KTP o el láser de Holmiun, que revolucionarán el tratamiento en los próximos años.
The present review aims to provide an overview of benign prostatic hyperplasia (BPH), which has a remarkably high prevalence. The various theories of the aetiology of the disease are discussed, with special emphasis on those that concern the influence of growth factors. Questions related to the physiopathology of BPH are briefly summarized, since many symptoms apparently related to the disease may be caused by ageing or by interacting factors other than prostatism.
The most common clinical manifestations, with symptoms divided into irritative and obstructive, as well as the currently available diagnostic procedures, are described. Finally, the therapeutic options are discussed, with special reference to KTP and Holmiun laser, which will drastically change treatment in the future.
La hiperplasia benigna de próstata (HBP) es una de las enfermedades de mayor prevalencia en el varón, y constituye una entidad que afecta de forma importante a su salud1,2. Debido a su situación anatómica plantea un serio problema en el vaciado vesical, cuando se produce un crecimiento de la glándula.
Hoy día esta afección todavía genera incógnitas como son:
- –
El conocimiento insuficiente de la epidemiología y la historia natural de la enfermedad, lo que hace difícil su prevención y prever la evolución.
- –
Aunque conocemos la relación directa de esta afección con la testosterona, la causa última de su desarrollo no es aún del todo conocida.
- –
Desde el punto de vista terapéutico, el único tratamiento curativo es el quirúrgico; el tratamiento médico sirve para mejorar la clínica3'4, pero no para curar definitivamente al paciente.
En los últimos años se ha producido un cambio importante en el tratamiento de esta enfermedad con el desarrollo del láser, que sin duda cambiará la actitud terapéutica del futuro5,6. En este trabajo exponemos las teorías actuales sobre el desarrollo de la enfermedad, la clínica que puede presentar y las perspectivas de tratamiento actual y futuro.
EPIDEMIOLOGÍA Y ETIOLOGÍALa HBP es el tumor benigno más frecuente del varón. La edad de comienzo es entre la cuarta y al quinta décadas de la vida. El crecimiento de la próstata es lento o inexistente hasta los 30 años, cuando empieza a aumentar de tamaño; este crecimiento es más marcado desde los 50 años.
El 80% de los mayores de 50 años tiene, en mayor o menor medida, HBP, de manera que el 33% de los mayores de 50 años ya presenta un adenoma bien constituido. A los 80 años un 95% tiene HBP7. Se ha calculado que la probabilidad de que un varón de 80 años de vida necesite cirugía prostática es del 30%7,8.
Teniendo en cuenta los datos antes mencionados, en España existían en el 2001 unos 6.000.000 de pacientes mayores de 50 años con HBP9. Esta tendencia es creciente, y estas cifras pueden dar una idea de la importancia de esta afección.
Si analizamos detenidamente los datos mencionados, veremos que los costes económicos de esta enfermedad son muy elevados y que pueden incrementarse. Sólo el tratamiento médico de la HBP supone en España un 2% del gasto total que se realiza en farmacia10; a esto tendríamos que añadir los costes quirúrgicos, además de la morbilidad asociada, etc.
Desde el punto de vista del origen de la enfermedad, debemos analizar diversos factores que contribuyen a su desarrollo:
- 1.
Papel de los andrógenos: se considera que son dos los factores necesarios para el desarrollo de la enfermedad: la edad y la existencia de función testicular11. Sin duda alguna, los andrógenos son el factor más importante implicado en el desarrollo de la próstata, aunque existen algunas paradojas, como el hecho de que a mayor edad suele descender el valor de andrógenos, por lo que se puede pensar que los testículos producen otras sustancias implicadas en el proceso12.
La testosterona se convierte habitualmente en dihidrotestosterona (DHT) a través de la acción de la 5 alfa-reductasa, y de esta manera adquiere su potencial androgénico sobre la próstata, al mismo tiempo que sirve de base para diversas dianas terapéuticas13'14.
- 2.
Papel de las células estromales: la próstata está constituida por diversos tipos celulares, entre ellos células estromales y epiteliales. Se ha demostrado que las células estromales presentan receptores de testosterona, y pueden desencadenar el proceso. Posteriormente, se establecería una relación entre éstas y las células epiteliales, que también presentan receptores androgénicos15,16. Por otro lado, en cultivos celulares se ha observado que los andrógenos no tienen efecto mitógeno en células epiteliales aisladas, pero sí cuando éstas tienen como acompañantes a células estromales. Las células estromales podrían ser, por tanto, el primer eslabón, e iniciarían su desarrollo a través de la producción de una serie de factores de crecimiento que favorecerían el desarrollo de la HBP17,18.
- 3.
Factores de crecimiento: los factores de crecimiento son proteínas originadas por la activación de protooncogenes que contribuyen y regulan el crecimiento normal y el desarrollo celular, así como su muerte. Actúan como sustancias autocrinas, paracrinas o endocrinas. Son polipéptidos que se adhieren a proteoglucanos de la matriz extracelular y quedan almacenados de forma inactiva. Se liberan de su enlace mediante proteólisis, y entonces pueden fijarse a un receptor de alta afinidad. Estimulan la proliferación celular y pueden tener efectos diferentes en la misma célula. En la HBP existen 3 familias importantes: la FGF-b, la TGFP, los EGF y TGF-a. Además, hay otras 2 familias de factores de crecimiento, como son el grupo IGF (insulin like growth factor), así como una familia miscelánea que engloba a otros 5 tipos (NGF, PDGF, CSF, VEGF y PD_ECGF). Son la causa de que la célula pueda pasar de la fase de reposo G0 a la primera fase de la mitosis G118,19,21.
El proceso anatomopatológico de la hipertrofia benigna de próstata comienza en la región periuretral de la glándula y se va extendiendo hacia la periferia. Inicialmente se planteó la hipótesis de la aparición en esa zona de nódulos estromales y glandulares, que eran capaces de liberar una sustancia que induce el crecimiento de las células epiteliales. Esta hipótesis se ha visto confirmada en numerosos estudios. No obstante, posteriormente se demostró que la manifestación inicial es sobre todo estromal. En el mismo año, Jacobs observó que un homogeneizado de células prostáticas tumorales era capaz de inducir el crecimiento de las células óseas, y que este factor mitogénico era el factor de crecimiento prostático (PrGF). Esta misma sustancia fue detectada en tejido de hipertrofia benigna de próstata22,23.
Familia FGFLa componen el FGF-ácido, FGF-básico y factor de crecimiento queratinocítico (KGF). Están codificados por el oncogén int-2. El factor de crecimiento prostático presenta muchas analogías con el factor de crecimiento de fibroblastos básico (FGF-b), que posee una capacidad mitogénica demostrada sobre células epiteliales, mesodérmicas y neurales18. Además, es un potente inductor de la angiogénesis. Mientras que en el adolescente la concentración de FGF-b en la zona periuretral es de 125 ng/g, en la HBP es de 208 ng/g, pero en el individuo adulto sin HBP la concentración se sitúa en 80 ng/g. El valor alto de FGF-b en las próstatas puberales es debido al potente estímulo androgénico al que se ven sometidas, lo que hace que el componente estromal y, por tanto, el FGF-b sea mayor que en el adulto. De esta manera, en próstatas normales los andrógenos regulan indirectamente su crecimiento mediante el citado factor; las concentraciones son mucho menores en la zona periférica que en la periuretral. El estroma es una fuente muy rica de FGF-b22,23.
Una vez comprobado que el FGF-b es aquí el principal factor de crecimiento, se postuló que este factor induciría la proliferación de un mesénquima primitivo y éste, a través de un factor de crecimiento epitelial (EGF), induciría la proliferación del epitelio circundante. El aumento del FGF-b podría producirse por pequeños microtraumas, como infecciones, eyaculación, micciones, etc. No obstante, su origen está aún por determinar, aunque podría encontrase en:
- –
Células epiteliales.
- –
Células estromales. Supone la teoría más aceptada en la actualidad. Se ha visto que, aunque las concentraciones no son mayores en el estroma, éste si parece ser el productor del FGF-b y que de aquí se difunde uniformemente al epitelio y a la luz glandular.
- –
Membrana basal.
El crecimiento de la próstata inmadura precisa andrógenos. Recientes estudios sugieren que el efecto mitogénico de los andrógenos en la próstata está mediado por factores de crecimiento locales; los andrógenos estimularían la producción de factores de crecimiento. Por otro lado, en la aparición del cáncer de próstata no parece clara la acción de estos factores, aunque se ha demostrado que el cambio de fenotipo hace las células mucho más sensibles al FGF-a.
Familia TGF-¡3Además del FGF-b, existen otros factores de crecimiento que influyen en el desarrollo de la HBP, como el factor de crecimiento transformador beta (TGF-|)19, el EGF ya mencionado y el factor de crecimiento transformador alfa (TGF-a)17*18. La familia TGF-| está constituida por el TGF-|1, TGF-|2 y el MIS. El TGF-| se aisló por primera vez en plaquetas humanas pero es liberado por todos los tipos celulares. Es producido no sólo por los fibroblastos, sino también por las células epiteliales, y existen varios tipos, el 1, el 2, el 3, el 4 y el 5. Son factores de crecimiento fundamentales para la embriogénesis, contribuyen de forma importante al desarrollo de la matriz extracelular, son reguladores de la adherencia celular, son factores de angiogénesis y en células no neoplásicas, generalmente, inhiben a las epiteliales y estimulan las mesenquimales.
Por consiguiente, el TGF-| tiene una misión multifuncional induciendo e inhibiendo la proliferación de distintos tipos celulares, al menos in vitro. Sorprendentemente este factor inhibe la mitosis de células prostáticas y codifica el ARN mensajero del FGF-|, estimulándolo con lo que teóricamente realizaría acciones contrapuestas20, pero la explicación parece estar en el distinto mecanismo de acción del TGF-| y el FGF-b. Mientras que el primero actúa en los receptores celulares, el segundo tendría una acción intracitoplasmática y nuclear.
En la próstata normal es un potente inhibidor de las células epiteliales; la acción de los andrógenos sobre TGF-| en estos casos es inhibitoria, y su actuación aumenta mucho en casos de castración21.
El TGF-|1 inhibe el crecimiento de las células fibroestromales en la HBP. Además, posee una capacidad mitogénica sobre las células del prepucio y en algunas células mesenquimales, aunque esto no está confirmado completamente. El TGF-|2 posee una actividad mitogénica mayor en la HBP que en la próstata normal. Así, en la HBP está íntimamente relacionado con la teoría del «despertar embrionario» de McNeal. En ella el TGF-|2 estimularía la producción de fibroblastos y esta proliferación estromal estimularía la producción de FGF-b que, a su vez, induciría tanto células estromales como epiteliales, dando lugar a un microambiente con aumento de FGF-b, TGF-|2, TGF-a y EGF, que continuarían estimulando la proliferación tisular22,23.
En el cáncer de próstata, el TGF-| está elevado24. Esta elevación puede producir una inmunodepresión, promover la angiogénesis y favorecer las metástasis a distancia. De hecho, al TGF-| se le reconoce un papel fundamental en la angiogénesis; en los tumores de mayor agresividad se produce una marcada cantidad de estos factores de crecimiento25.
Familia EGF y TGF-aAdemás de los citados, forman parte también el EGF unido a heparina y el factor de crecimiento del virus de la vacinina (VVGF). Están codificados por el oncogén c-erb B2, estimulan células epiteliales, mesenquimales y nerviosas, y tienen una estructura polipeptídica muy similar. El EGF se encuentra en todos los tejidos, excepto los tejidos hematopoyéticos, induce la proliferación prostática in vitro, aunque su acción in vivo no parece muy preponderante. El EGF, que estimula las células epiteliales prostáticas, se une a un receptor de membrana que es una glucoproteína y activa la tirosincinasa que produce la iniciación de ARN mensajero para la síntesis de proteínas. Los valores del receptor para el EGF (EGF-r) son variables en función de las distintas afecciones que presenta la próstata; aunque los estudios no son concluyentes y a veces son contradictorios, parece que en la HBP la expresión del EGF-r es mayor que en el PIN y que en éste es mayor que en el cáncer de próstata. La explicación parece que es porque en las afecciones tumorales podrían actuar distintas proteasas, entre ellas el PSA, que destruirían los receptores. Este receptor que es común para el EGF y TGF-a es muy importante porque está activo permanentemente y no sólo cuando está unido a un factor de crecimiento. De este modo es capaz de actuar directamente sobre la división celular. Una acción similar desarrollaría el TGF-a, uniéndose a receptores de membrana. Harper demostró que la expresión de TGF-a es mayor en el cáncer de próstata que en HBP y que cuanto mas indiferenciados son los tumores (mayor Gleason), mayor es la expresión del TGF-a.
Recientemente se ha demostrado la expresión de EGF y TGF-a en glándulas accesorias (vesículas seminales) de la rata. El verdadero papel de estos dos factores sobre la próstata no está claro en la actualidad, si bien parecen estimular las células epiteliales, pero el hecho de que se identifiquen diferencias de concentración entre las distintas glándulas accesorias podría suponer una diferente respuesta de los distintos tejidos a la carcinogénesis.
Factores de crecimiento en la hiperplasia benigna de próstataComo se ha mencionado, estudios recientes han demostrado que el FGF-b es capaz de estimular las células prostáticas mesenquimales y que el TGF-| puede inhibir las epiteliales, pero paradójicamente también se sabe que el TGF-p estimula al FGF-b. Al mismo tiempo, el FGF-a inhibe la acción del TGF-|. En este balance de factores estaría el equilibrio inestable de la proliferación celular.
Resumiendo, parece que el FGF-b es el factor de crecimiento más importante en la HBP, que sería liberado por células mesenquimales embrionarias dentro de un desequilibrio estrógeno/andrógeno, y que induciría la proliferación de fibroblastos, produciendo la hiperplasia estromal nodular que sería el inicio de la HBP. Éste se comportaría como un tipo de mesénquima primitivo, capaz de producir otros factores de crecimiento que estimularían la proliferación glandular. No obstante, el origen de este ciclo permanece desconocido18,19.
En la HBP, el FGF-b, TGF-a y TGF-| están muy elevados, mientras que el EGF y el TGF-|1 presentan concentraciones normales, por lo que predomina el estímulo sobre la inhibición. Parece ser que las células estromales son la causa de la producción de FGF-b y de TGF-|2, y que la variación de la relación estroma/epitelio responde a un balance entre estos dos factores de crecimiento. Por un lado, tendremos al TGF-|, que aumenta con la deprivación androgénica, y el FGF, EGF y TGF-a, que disminuyen con la aquélla, con el resultado de inhibición celular. Sucedería a la inversa en el caso contrario22,27-29.
En referencia al papel del IGF-1 y su relación con determinados cuadros clínicos donde existe hiperinsulinemia, como es el caso de la obesidad de predominio abdominal, se ha llamado la atención acerca de que la insulina puede potenciar el crecimiento prostático utilizando los receptores de IGF-1 o estrechamente vinculada a este factor de crecimiento, como ya ha sido demostrado experimentalmente in vitro e in vivo23. Efectivamente, en el síndrome metabólico, donde además de resistencia a la insulina y obesidad también existe hiperinsulinemia, se ha observado esta relación con la BPH24. Es más, se ha podido registrar una relación entre un mayor tamaño prostático en el síndrome metabólico comparado con los controles25, por lo que no extrañaría que la BPH presente con cierta frecuencia hiperinsulinemia e hiperlipemia26.
implicaciones clínicas de los factores de crecimientoLa elevación de los valores de un factor de crecimiento podría utilizarse como diagnóstico de determinados tipos de tumores30. Además, la utilización de un anticuerpo monoclonal radiomarcado que se una a una zona determinada daría lugar al diagnóstico de localización del tumor. En este sentido, la adición de un factor de crecimiento con un anticuerpo monoclonal y un quimioterápico nos permitiría ser más selectivos a la hora de determinados tratamientos.
Otras posibilidades que se ofrecen son utilizar anticuerpos antifactor de crecimiento o antirreceptor, para controlar el efecto de ese factor en la progresión de la enfermedad, y usar antagonistas celulares, que compitan con el factor de crecimiento en su unión con el receptor. El IGF estimula el cáncer de próstata metastásico; la JG-1 es una sustancia capaz de unirse al receptor de este factor de crecimiento y así inhibir el crecimiento de las células metastásicas.
En el cáncer vesical se está ensayando la T40 de forma intravesical que posee TGF-a y compite con el EGF. Esta sustancia, al unirse al receptor del EGF, libera una exotoxina de una Pseudomona que destruye las células malignas.
La suramina, fármaco aplicado en el tratamiento de la tripanosomiasis, bloquea la unión a un grupo de factores de crecimiento, y puede ser útil en el cáncer de próstata.
Además, los factores de crecimiento pueden modificar la sensibilidad de las células a la quimioterapia. En el caso del EGF, se aumentaría así el efecto citotóxico del cisplatino.
No obstante, el verdadero futuro de los factores de crecimiento consistirá en bloquear la expresión de esos factores mediante terapia génica, creando una cadena de oligonucleótidos dirigidos contra el ARN mensajero productor de un determinado factor.
FiSiOLOGÍA Y FiSiOPATOLOGÍAEl adenoma no produciría síntoma alguno si no fuera por su disposición anatómica, debajo del cuello vesical, rodeando la uretra y dificultando, cuando no impidiendo, el flujo de orina al exterior.
Podemos hablar de 3 fases en el desarrollo de la enfermedad:
- -
Prostatismo congestivo: hipertrofia del músculo vesical (detrusor), con poca clínica.
- -
Retención crónica incompleta: aparición de divertículos vesicales, inicio del mal vaciamiento vesical (residuo).
- -
Distensión vesical crónica: la vejiga es completamente incompetente y se comporta como un globo que se llena de orina y, cuando está lleno, excreta por rebosamiento. La dificultad para la salida de orina no es sólo mecánica (obstructiva), sino que también depende de la contracción del detrusor, la relajación del esfínter urinario y la modificación anatómica del cuello vesical en la micción, entre otros.
Un hecho importante en el desarrollo de la enfermedad será la correcta cuantificación de los problemas que presenta el enfermo, que no resulta fácil, aunque hay procedimientos que nos permiten hacer una aproximación. Se ha demostrado que existe una clara correlación entre el tamaño real de la próstata y el obtenido mediante ecografía transrectal, lo cual supone un buen método para la toma de determinadas decisiones31. El flujo de salida puede ser de interés médico empleando la flujometría, que es la medición de la presión del flujo. El estado de la clínica se mide mediante los índices de síntomas32-34.
No existe hoy día unanimidad a la hora de valorar la obstrucción del flujo urinario, ya que la flujometría, que es una prueba no invasiva, cuando el resultado es patológico no nos permite diferenciar si se trata de una lesión en el detrusor o una estenosis uretral. Para ello disponemos de las curvas de presión de flujo, aunque se trata de pruebas invasivas.
El problema de la cuantificación exacta de los síntomas se puede resumir en un estudio realizado por Lepor y Machi35, que aplicaron un cuestionario de síntomas de la Asociación Americana de Urología a un grupo de varones y mujeres de edad avanzada. Sorprendentemente, encontraron que no había diferencias entre las respuestas de los varones y las mujeres. Además, todos tenían síntomas parecidos, agrupados en lo que definimos como prostatismo leve, moderado y severo. Todo ello apunta a que la clínica llamada de prostatismo no parece específica de la HBP. Además; el vaciamiento vesical incompleto y las infecciones urinarias son habituales en mayores de 50 años y en los varones, a menudo atribuidos a la HBP, sin que exista una evidencia clara según este estudio35.
Hoy día parece bastante admitido que los problemas de obstrucción al flujo no dependen del tamaño prostático. También se admite que la clínica prostática depende de la obstrucción del flujo de salida, pero éste puede verse influido por un lóbulo medio que actúa como válvula, por el propio tamaño prostático envolviendo la uretra prostática, por una alteración de las propiedades contráctiles del músculo liso y, finalmente, por una cápsula prostática muy restrictiva.
El músculo liso parece desempeñar un papel determinante en la obstrucción del flujo urinario y en la disminución del flujo máximo en la flujometría36.
Continuando con lo anteriormente mencionado, podría pensarse que la clínica considerada como prostática es atribuible a la edad y se produciría igualmente en varones y en mujeres. Sin embargo, un estudio más detallado37, en el que se selecciona aleatoriamente 2 grupos de mujeres con edades comprendidas entre los 45 y los 79 años, con síntomas parecidos a los prostáticos del varón, trata a un grupo con bloqueadores a y al otro con placebo. En ambos grupos se observa una mejoría que es exactamente igual. Dada la eficacia selectiva de los bloqueadores a en varones prostáticos se apunta así que la fisiopatología prostática es específica de varones producida por la próstata. Aunque también se puede intuir que el mecanismo de producción de síntomas en varones que no responden al tratamiento con bloqueadores a es el mismo que en las mujeres y depende de la edad37.
Podemos concluir que la fisiopatología de la HBP es todavía poco conocida y que la obstrucción al flujo de salida vesical es el único factor que conduce a la sintomatología prostática. La edad, los elementos psicógenos, los patrones de comportamiento y otros factores contribuyen notablemente al desarrollo del cuadro clínico.
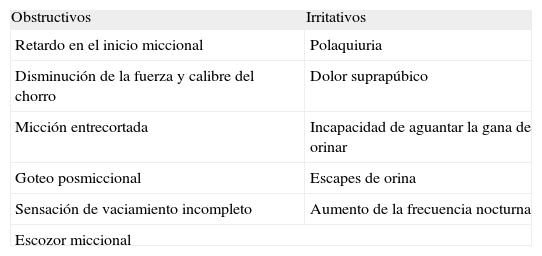
MANEJO DE LA HiPERPLASiA BENiGNA DE PRÓSTATACon la denominación de síntomas del tracto urinario inferior se agrupan 2 tipos de síntomas miccionales: obstructivos (que dependen del vaciado) e irritativos (dependientes del llenado vesical). En muchos casos, estos síntomas aumentan en su frecuencia y severidad, según aumenta la edad38,39 (tabla 1).
Síntomas del tracto urinario inferior
| Obstructivos | Irritativos |
| Retardo en el inicio miccional | Polaquiuria |
| Disminución de la fuerza y calibre del chorro | Dolor suprapúbico |
| Micción entrecortada | Incapacidad de aguantar la gana de orinar |
| Goteo posmiccional | Escapes de orina |
| Sensación de vaciamiento incompleto | Aumento de la frecuencia nocturna |
| Escozor miccional | |
Una manifestación derivada de las anteriores es la retención de orina, que puede desencadenarse por una comida copiosa, una intervención quirúrgica, un retraso en la micción, la toma de fármacos, etc. Además, hay que mencionar en este contexto la hematuria y las infecciones urinarias de repetición. Todas estas alteraciones pueden originar, a su vez, la uropatía obstructiva bilateral con afección de la función renal, formación de litiasis vesical, divertículos vesicales, etc. Muchos de los síntomas generados por la HBP pueden verse mediatizados por un afección concurrente que será necesario estudiar.
En un primer paso, se puede intentar la objetivación de los síntomas que el paciente presenta, dando un valor numérico a cada uno de ellos, como al tenesmo vesical, polaquiuria, chorro entrecortado, urgencia miccional, debilidad del chorro y nicturia, con una puntuación de 0–5, según su intensidad. Si la suma total es menor de 8, el paciente presentaría un prostatismo leve; si se encuentra entre 8–18, tendría un prostatismo moderado, y si es superior a 18, un prostatismo severo40.
La exploración física se basa, fundamentalmente, en el tacto rectal, que nos dará una idea del tamaño de la próstata y la clasificaremos en cuatro estadios, además de sus límites y consistencia. Esta exploración es, además, muy valiosa para el diagnóstico de cáncer de próstata. Nos puede interesar también la existencia de globo vesical, molestias lumbares o de alteraciones en el meato urinario, como fimosis.
Los análisis de laboratorio habituales en este tipo de pacientes deben incluir al menos un estudio de función renal y una determinación del antígeno prostático específico (PSA) para descartar el cáncer de próstata. El análisis de orina sirve para detectar o descartar la existencia de infecciones urinarias.
La ecografía suele ser otra técnica habitual en el diagnóstico de estos pacientes. Nos da información sobre el tamaño prostático y las características de la próstata41,42. Además, se puede ver la morfología renal y su posible afección, ya que si no existe un vaciamiento adecuado de la vejiga, la orina refluye desde la vejiga al riñón por los uréteres dilatados. Asimismo, se puede observar la vejiga para ver si existe litiasis intravesical o engrosamiento de la pared y, al mismo tiempo, descartar otra enfermedad vesical.
La flujometría es una prueba de rutina en el diagnóstico de la HBP. El flujo urinario depende de la presión proporcionada a la orina por el detrusor y de la resistencia de salida debida a la uretra. A su vez, la presión del detrusor depende de la potencia del detrusor y del volumen vesical43. Así pues, la flujometría dependerá de 3 variables: la capacidad contráctil vesical, la resistencia de salida y el volumen urinario. Se realiza orinando en un recipiente que es capaz de medir el volumen de la micción y su flujo máximo. Si este flujo está por debajo de 15 ml/s se considera que puede existir un problema obstructivo, y si está por encima de 15 ml/s, se descarta la existencia de una obstrucción.
La urografía intravenosa no es una exploración habitual en el diagnóstico de la HBP, aunque tiene mucho valor cuando existe la sospecha de cálculos urinarios asociados, afecciones vesicales, existencia de residuo, afección del aparato urinario superior o sospecha de alguna complicación asociada a la HBP.
La uretrocistografía, en la que se introduce un contraste a través de la uretra y posteriormente se realizan diversas radiografías, se emplea cuando se sospecha afección en la uretra, como estrecheces, que pueden dificultar la cirugía programada o simular la sintomatología prostática.
La cistoscopia, que sirve para valorar la uretra y la vejiga, es poco habitual en el entorno de la afección prostática.
El estudio urodinámico, aunque no es una prueba rutinaria, cada vez es más habitual. Como anteriormente comentamos, una flujometría con flujo máximo menor de 15 ml/s puede deberse a un problema obstructivo o bien a que el músculo vesical no se contraiga bien. Un flujo máximo normal podría coexistir con una obstrucción urinaria si el detrusor logra aumentar su trabajo contráctil, sobrepasando el incremento de resistencia uretral producido por la obstrucción. Es lo que algunos autores han denominado obstrucción con alto flujo43. Dado que la reserva funcional del detrusor es limitada44, es aconsejable seguir la evolución urodinámica en cada caso antes de tomar una decisión terapéutica. De cualquier modo, esta prueba nos da mucha información sobre el proceso de llenado y vaciamiento vesical, incluyendo todos los componentes orgánicos y funcionales que en él participan.
OPCIONES TERAPÉUTICASLa hiperplasia benigna de próstata incluye 2 líneas de tratamiento bien diferenciadas: el tratamiento médico y el quirúrgico. Se comienza con el primero, donde podemos distinguir varios grupos de fármacos.
La fitoterapia incluye medicamentos que derivan de extractos vegetales y favorecen de manera importante el vaciado vesical. Además, son fármacos descongestionantes prostáticos. Se trata de un tratamiento válido para pacientes que presentan síntomas secundarios a hiperplasia prostática en estadios iniciales o moderados. Sin embargo, carecemos de datos sobre los mecanismos de acción in vivo, de experiencia a largo plazo y, sobre todo, del papel de estos fármacos en la evolución natural de la enfermedad45,46.
Los bloqueadores de receptores alfa son los fármacos más empleados en la HBP. Aumentan la contracción del detrusor, favorecen la apertura del cuello vesical y acortan la uretra prostática, con lo que influyen positivamente en el vaciamiento vesical. No obstante, estos fármacos presentan algunos problemas, como la hipotensión ortostática, aunque las nuevas formulaciones los evitan en gran medida47-49.
Los inhibidores de la 5-alfa-reductasa, que es una enzima que convierte la testosterona en 5-DH testosterona, y así actúan sobre la próstata, al bloquearlo, reducen el volumen prostático y facilitan el vaciado vesical. Tienen los inconvenientes de asociarse a cierto grado de disfunción eréctil y de bajar los niveles de PSA, con lo que hay que tener cuidado en pacientes que ya lo tienen elevado y están en estudio por sospecha de cáncer de próstata50,51.
Ocasionalmente, en casos muy seleccionados, se emplean fármacos que provocan un bloqueo hormonal completo por lo que en pocos meses el tamaño de la próstata se reduce marcadamente. Son fármacos empleados habitualmente en el carcinoma de próstata.
La decisión de cuándo operar a un paciente depende de diversos factores. Causas absolutas son la retención aguda de orina, la hematuria, la existencia de infecciones urinarias de repetición, de litiasis urinaria o afección del tracto urinario superior. Generalmente, van acompañadas de un flujo bajo que puede conducir a la cirugía si se acompaña de manifestaciones clínicas importantes.
Las causas relativas dependen de las molestias que tenga el paciente. En general, los pacientes con cuadro obstructivo tendrán una clara mejoría con la cirugía, mientras que no resulta así en los pacientes con clínica irritativa.
La cirugía prostática ha sufrido una importante evolución. Inicialmente se realizaba la adenomectomía prostática (cirugía abierta), ya sea la vía de abordaje retropúbica o suprapúbica. Esta cirugía quedó relegada a casos de próstatas grandes. En las de tamaño medio y pequeñas (menores de 60 g), aunque depende del cirujano, se realizan mediante resección transuretral. El procedimiento consiste en pasar un resector por la uretra y mediante un sistema óptico ir cortando la próstata para después extraerla.
Recientemente han aparecido diversos láser que permiten operar la próstata, con ventajas superiores a la cirugía convencional (menor hemorragia, menos días de sonda y de hospitalización, etc.). La energía láser ocasiona sobre la próstata dos fenómenos diferentes: dependiendo de la temperatura, puede ocasionar una desnaturalización proteica y una coagulación de ésta que permite resecarla o, a temperaturas mayores, una vaporización de ésta.
El láser de Holmiun fue empleado por primera vez en 199552. Con esta técnica se puede recuperar hasta un 30% del tejido resecado, aunque de peor calidad que el conseguido con la resección transuretral53. El tiempo de sonda vesical es menor de 24 h. Las primeras series publicadas aportan resultados bastante alentadores sobre la mejoría de los síntomas53,54, es decir, reseca la próstata, es ideal para la resección, puesto que es muy hemostático, y tiene una capacidad de penetración en los tejidos de 0,4 mm. Puede usarse en endoscopios rígidos o flexibles, pero todavía esta poco extendido.
El láser de KTP fotovaporiza la próstata y, dadas sus características, interacciona con la hemoglobina y reduce casi en su totalidad la hemorragia. Está más extendido que el anterior, y hoy día se está convirtiendo en una alternativa real al tratamiento de la HBP por su fácil manejo, la disminución clara de efectos secundarios y los buenos resultados que presenta.