La enfermedad de Alzheimer es la causa más común de demencia en la población anciana. Actualmente no hay tratamientos efectivos para prevenir o retrasar el curso natural de dicha enfermedad. Numerosos estudios han proporcionado información de los procesos moleculares que subyacen en el envejecimiento biológico y, quizás más importante aún, de las posibles intervenciones para retrasar el envejecimiento y promover la longevidad saludable en sistemas modelo de laboratorio. La cuestión principal tratada en esta revisión es si una intervención que tiene propiedades antienvejecimiento puede alterar la aparición y/o progresión de la enfermedad de Alzheimer, una enfermedad en la que la edad es el mayor factor de riesgo. Diferentes intervenciones antienvejecimiento han demostrado prevenir (y posiblemente restaurar en algunos casos) varios parámetros reconocidos como síntomas centrales para el desarrollo de la enfermedad de Alzheimer. Además, se están dando los primeros pasos hacia la traslación de estos descubrimientos de laboratorio a aplicaciones clínicas.
Alzheimer's disease is the most common cause of dementia in the elderly population. Currently, there are no effective treatments to prevent or delay the natural course of the disease. Numerous studies have provided information about the molecular processes underlying biological ageing and, perhaps more importantly, potential interventions to slow ageing and promote healthy longevity in laboratory model systems. The main issue addressed in this review is whether an intervention that has anti-ageing properties can alter the appearance and/or progression of Alzheimer's disease, a disease in which age is the biggest risk factor. Different anti-ageing interventions have been shown to prevent (and in some cases possibly restore) several parameters recognised as central symptoms to the development of Alzheimer's disease. In addition, they are taking the first steps towards translating these laboratory discoveries into clinical applications.
La enfermedad de Alzheimer (EA) es la forma más común de demencia en los ancianos y se estima que afectará a más de 100 millones de personas en todo el mundo para el año 20501. La EA provoca la alteración de múltiples funciones corticales superiores, incluyendo la memoria, el pensamiento, la orientación, la comprensión, el cálculo, la capacidad de aprendizaje, el lenguaje y el juicio2. A nivel histopatológico, se caracteriza por la pérdida neuronal, placas seniles extracelulares y ovillos neurofibrilares intracelulares3. Las placas seniles están formadas principalmente por un péptido de 40 a 42 aminoácidos, beta-amiloide (βA), que se produce a partir de la proteína precursora de amiloide (APP). Debido a la escasa solubilidad, sobre todo del péptido βA42, este se agrega, formando hojas plegadas de difícil degradación. A su vez, esto activa el sistema inmune, en especial las células microgliales, que acentúan la lesión por inflamación y la liberación de radicales libres4. Los ovillos neurofibrilares están compuestos fundamentalmente por filamentos helicoidales formados por proteínas tau hiperfosforiladas. Es este estado el que provoca la precipitación y agregación de dichas proteínas, con lo cual se ve entorpecido el transporte axonal y aparece la neurodegeneración por posible apoptosis. Actualmente no existen métodos eficaces para prevenir, curar o incluso ralentizar la progresión de la enfermedad. De hecho, el tratamiento farmacológico actual empleado para la EA es sintomático, es decir, no actúa en el proceso etiopatogénico de la enfermedad2,4.
La vejez y el proceso de envejecimiento subyacente se considera que son los principales factores de riesgo independientes de enfermedades crónicas, como la aterosclerosis, la artritis, el cáncer y la demencia en el mundo occidental5,6. Una consecuencia de estas 2 tendencias es que actualmente hay muchos riesgos que compiten por la muerte y discapacidad en las personas de edad muy avanzada. Por lo tanto, cualquier beneficio en el tratamiento y diagnóstico de una sola enfermedad, en la esperanza de vida de las personas mayores, será marginal7. La persona mayor suele tener muchas comorbilidades y enfermedades crónicas, y el tratamiento o prevención de una enfermedad simplemente los deja inmediatamente susceptibles a los efectos de otras enfermedades. Por esta razón, la eliminación de una enfermedad crónica no extenderá radicalmente la esperanza de vida máxima humana. Esta circunstancia puede ser aplicable también a la EA8. Afortunadamente, la comprensión de los mecanismos moleculares del envejecimiento ha progresado rápidamente en las últimas décadas9. Esto ha propiciado un cambio de paradigma a tal punto que, actualmente, podemos afirmar que el envejecimiento no es un proceso inalterable.
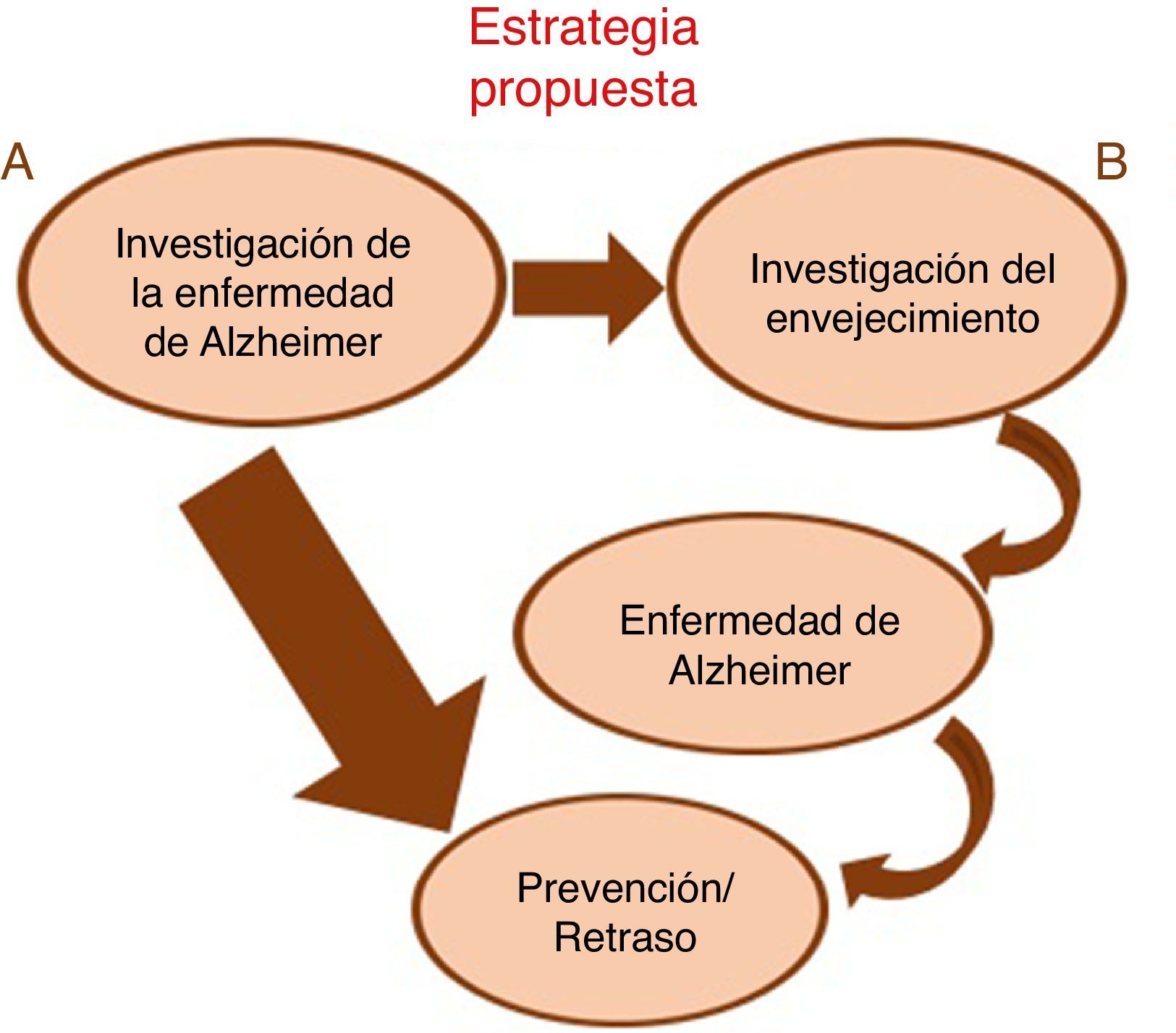
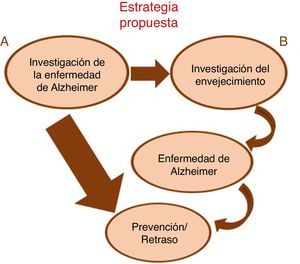
El enfoque alternativo para la prevención de la enfermedad en las personas mayores, promovido por Olshansky et al.6, se ha denominado el «dividendo de la longevidad». Al retrasar el proceso de envejecimiento, debería ser posible retrasar todas las enfermedades relacionadas con la edad y la discapacidad, como la EA, en vez de atacar las enfermedades como «entidades estanco independientes» de una en una (fig. 1). El desarrollo de nuevas intervenciones y dianas farmacológicas, basadas en la biología del envejecimiento, representa una prioridad para los seres humanos y una importante oportunidad para la industria farmacéutica10. Sin embargo, la cuestión es si esto podrá lograrse en un plazo oportuno de tiempo, dado que la evaluación de la longevidad en los seres humanos requiere décadas, y el desarrollo de terapias farmacológicas para enfermedades estándar lleva ya más de una década. La disponibilidad de modelos animales de vida corta ha permitido la realización de intervenciones que reducen en la medida de lo posible el envejecimiento a diferentes niveles, actuando en distintas dianas moleculares, y que frenan o retrasan enfermedades asociadas al envejecimiento.
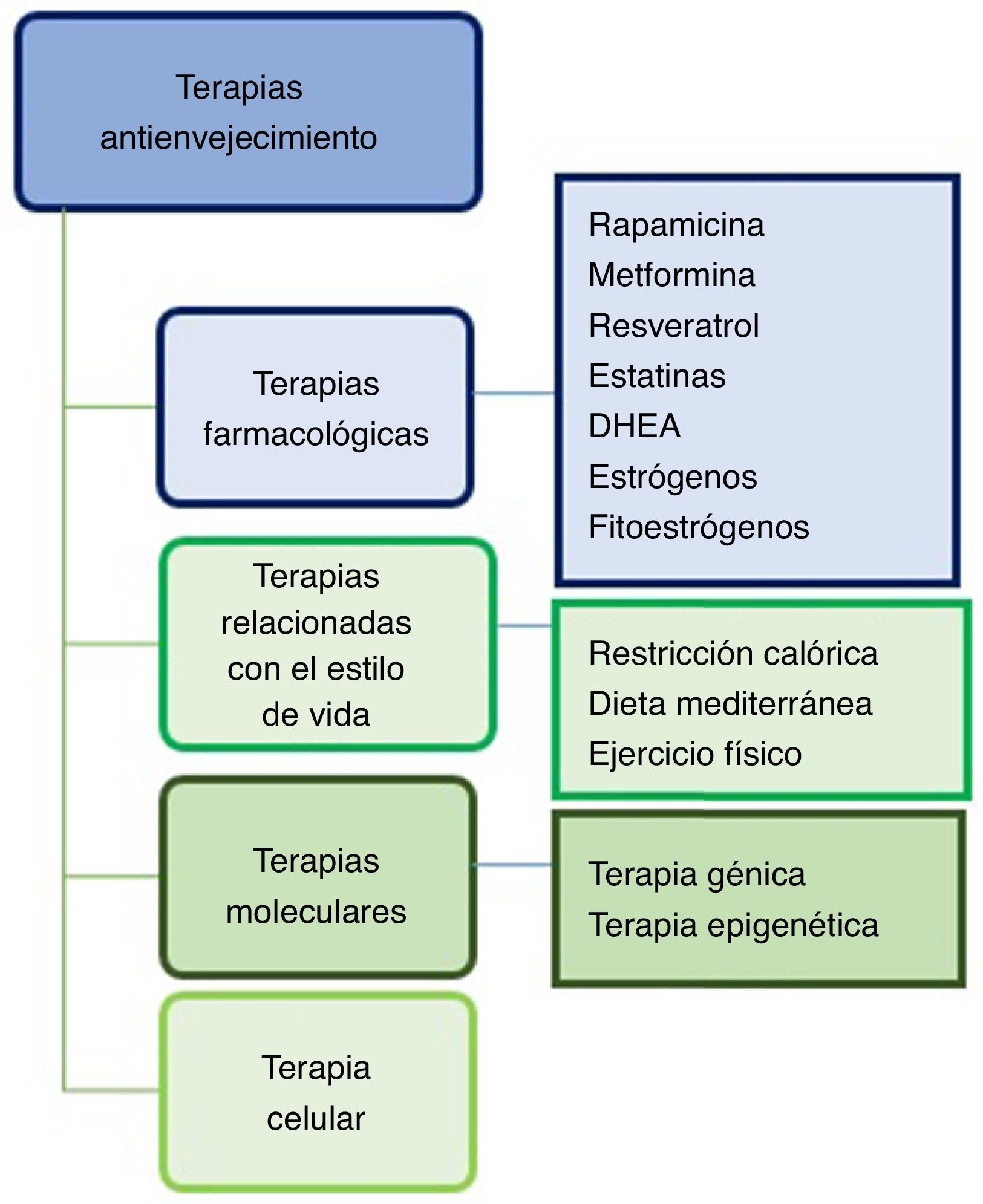
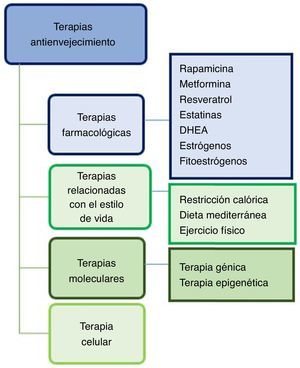
En esta revisión conoceremos las terapias antienvejecimiento mejor estudiadas en modelos animales de EA, y cuáles de estas terapias están siendo aplicadas en ensayos clínicos. Podemos clasificarlas en 4 grupos: farmacológicas, relacionadas con el estilo de vida, moleculares (génica y epigenética) y celulares (fig. 2).
Terapias farmacológicasRapamicinaLa rapamicina es un producto natural inhibidor de la vía mTOR (target of rapamycin) cinasa, además de ser un potente inductor de autofagia11. A su vez, regula las rutas de señalización celular esenciales y está implicada en el acoplamiento del estímulo de crecimiento y la progresión del ciclo celular. La rapamicina, al inhibir a mTOR, detiene la división celular12, restaura la función vascular y aumenta la actividad de la óxido nítrico sintasa endotelial13.
La rapamicina aumenta significativamente tanto la esperanza de vida como la de salud en ratones y diversos organismos simples como levaduras, gusanos o moscas14.
Los primeros estudios realizados en modelos en ratones con EA confirmaron que la rapamicina previene la pérdida cognitiva, a nivel de la memoria, y favorece la restauración del flujo sanguíneo cerebral y la densidad cerebrovascular, funciones que se ven comprometidas en la EA. Este fármaco sería útil para evitar el deterioro cognitivo en las primeras etapas de la EA15. Por otro lado, la rapamicina reduce los niveles de ciclofilina a nivel vascular, lo que supone efectos neuroprotectores significativos en la integridad vascular, suficientes para provocar una mejora a nivel cognitivo, debido a que en la EA hay valores elevados de esta citocina proinflamatoria16. Por último, además de disminuir la fosforilación de tau y, como consecuencia, su agregación, la inhibición de mTOR tiene función neuroprotectora, ya que reduce los depósitos de ßA15. Estos resultados apoyan el papel de la rapamicina como agente terapéutico potencial capaz de reducir los signos distintivos de la EA y recuperar la función cognitiva. Sin embargo, presenta importantes efectos adversos (potente inmunosupresor, reduce la fertilidad, náuseas, diarreas, dolor abdominal, aumento de la presión sanguínea, toxicidad pulmonar, neumonía, anemia, leucopenia, etc.)17 que dependen de la dosis y de la duración del tratamiento. La solución actual se centra en encontrar análogos del fármaco (rapalogos) en los que se vean disminuidos estos efectos adversos12. Se necesitan estudios adicionales para obtener conocimiento sobre la implicación de mTOR en la EA, y para estandarizar un enfoque terapéutico valioso que pueda trasladarse a humanos.
MetforminaLa metformina es una biguanida que se utiliza como tratamiento para la diabetes tipo 2, ya que disminuye la gluconeogénesis hepática e incrementa la sensibilidad a la insulina18. Además, es un potente activador indirecto de la proteincinasa activada por AMP. La proteincinasa activada por AMP está involucrada en el balance energético celular, e inhibe mTOR. También activa los factores de transcripción SKN-1/Nrf2, cuyas dianas son diversos genes antioxidantes18. Además, la metformina incrementa tanto la esperanza de vida como la esperanza de vida saludable, en diferentes cepas de ratones19.
El tratamiento crónico con metformina en ratones modelo doble transgénicos de EA reduce la fosforilación de tau en hipocampo y corteza pero, paradójicamente, también promueve la agregación de tau, y esta acción predomina sobre la primera16. Por tanto, no podría emplearse como terapia en la EA, a pesar de sus efectos en el envejecimiento (disminución de la inflamación y del daño oxidativo) y en el aumento de la esperanza de vida20.
ResveratrolEl resveratrol es un polifenol que activa de forma indirecta la sirtuina 121. Ejerce potentes efectos antiinflamatorios y antioxidantes implicados en el mantenimiento de la función cerebral, ya que es capaz de atravesar la barrera hematoencefálica. Los efectos neuroprotectores del resveratrol no están del todo claros. Estos se relacionan con la modulación de numerosas cascadas moleculares y parámetros bioquímicos, asociados con dianas de estrés celular, que regulan la expresión génica y previenen la inflamación cerebral22. El resveratrol produce un aumento en la esperanza de vida en moscas, gusanos y levaduras23. Sin embargo, en ratones y monos, solo produce protección cuando estos se usan como modelos de algún tipo de estrés, como sobrealimentación, o de alguna enfermedad asociada al envejecimiento, como diabetes tipo 224. Se considera que el resveratrol puede ser útil en el tratamiento de enfermedades neurodegenerativas como la EA. Aunque facilita la descomposición de APP, promueve la eliminación de ßA, con lo cual, se reduce el daño neuronal en estos enfermos25.
EstatinasLas estatinas son inhibidores de la 3-hidroxi-3-metilglutaril coenzima A que se emplean para reducir los niveles de colesterol. Además, tienen un efecto antiinflamatorio adicional. Se ha descrito que el tratamiento con estatinas alarga la esperanza de vida en moscas y gusanos26,27.
Estudios recientes confirman que niveles crónicos elevados de colesterol a mediana edad aumentan el riesgo de padecer EA28. Por ello, se han utilizado las estatinas para tratar esa enfermedad. Por ejemplo, la lovastatina disminuye la ßA al igual que la atorvastatina, sin embargo, la simvastatina no tiene efecto sobre la misma29. Aun existiendo esta diferencia, a grandes rasgos, los efectos pleiotrópicos neuroprotectores de las estatinas incluyen un aumento en la actividad de superóxido dismutasa, activación de proteína cinasa C, aumento de óxido nítrico sintasa endotelial y reducción de los niveles de coenzima Q 1029. Estos fármacos pueden tener un efecto positivo sobre el deterioro progresivo de la función cognitiva y el comportamiento en los enfermos de Alzheimer28. Sin embargo, existe una marcada controversia sobre el empleo de las estatinas en la EA, a pesar de que se ha observado que dicha utilidad podría deberse a la participación del colesterol en la agregación de ßA29.
DehidroepiandrosteronaLa dehidroepiandrosterona (DHEA) y su metabolito activo, sulfato de DHEA (DHEAS), son hormonas esteroides que se sintetizan y se excretan principalmente en la zona reticular de la corteza suprarrenal, en respuesta a la hormona adrenocorticotrópica30. Varios estudios aseguran que en el envejecimiento hay una disminución de la biodisponibilidad de óxido nítrico (NO), como consecuencia del estrés oxidativo, lo cual provoca deterioro del endotelio vascular. Además, la pérdida de NO endotelial podría ser un factor importante en la EA esporádica, debido a un aumento en la expresión de APP31.
El efecto terapéutico de la DHEA se basa en su posible actividad inhibitoria sobre la monoaminooxidasa cerebral, lo cual se traduce en una reducción del estrés oxidativo, tanto a nivel de la peroxidación lipídica como de producción de H2O2 y NO cerebral32.
Existe una marcada controversia en la relación entre el NO y la EA. Algunos estudios confirman que la reducción de NO cerebral agrava los síntomas de esta enfermedad y otros, sin embargo, confirman que protege frente a la formación de placas seniles31. Se ha observado también que tras la administración de DHEA a ratones con EA aumentan los niveles del factor neurotrófico derivado del cerebro y del marcador antiapoptótico (Bcl-2) y, además, disminuye la actividad de la acetilcolinesterasa. Esto hace que se incrementen los niveles de acetilcolina cerebrales. Por tanto, la DHEA podría ser una terapia adecuada para ralentizar la aparición de la EA32.
EstrógenosSe ha propuesto que los beneficios de los estrógenos son la causa de las diferencias sexuales en vitalidad, longevidad y otras características fisiológicas33. Las mujeres tienen 3 veces más probabilidades de ser diagnosticadas con EA y experimentan un mayor deterioro cognitivo a medida que avanza la enfermedad34. Esto se asocia parcialmente con una fuerte reducción de los niveles de estrógenos durante la menopausia, además del hecho de que, en general, las mujeres viven más tiempo que los hombres. Esta diferencia en la longevidad podría ser en parte debida a los mayores niveles de estrógenos en las mujeres, que las protegen contra el envejecimiento, y activan la expresión de genes relacionados con la longevidad35. La evidencias disponibles apoyan sustancialmente a los estrógenos como agentes neuroprotectores en varios dominios de la función cerebral y en la neurodegeneración. Sin embargo, los hallazgos clínicos y preclínicos de los efectos neurológicos perjudiciales, después de la terapia de reemplazo hormonal, indican que la historia del impacto de los estrógenos sobre el sistema nervioso no es tan simple.
Los estrógenos mejoran la memoria y reducen el riesgo de demencia, aunque también se han descrito resultados contradictorios como el fracaso de la terapia de reemplazo de estrógeno para el tratamiento de la EA. Un inicio temprano de la terapia hormonal (cerca del tiempo de depleción de estrógenos, menopausia en la mujer) es necesario para mejorar los déficits neurobiológicos y cognitivos asociados con esta enfermedad36. Además, pocas terapias estrogénicas proporcionan la ventaja de disminuir los niveles cerebrales de βA y de la APP, así como una mejor cognición, minimizando el impacto hormonal adverso en tejidos periféricos sensibles a estrógenos (por ejemplo, sin producir hiperplasia e hipertrofia concomitante de tejido uterino). Este es el caso descrito para un nuevo profármaco del 17β-estradiol, 17β-dihidroxiestra-1,4-dien-3-ona, selectivo del cerebro, administrado a ratones hembras ovariectomizadas, en un modelo de ratón doble transgénico de la EA37. Sin embargo, una pérdida sustancial de la APP sería perjudicial, porque esta proteína cumple papeles endógenos importantes en la función sináptica. Gran parte de las acciones neuroprotectoras de los estrógenos pueden deberse no a los estrógenos derivados de la periferia, sino a los estrógenos sintetizados dentro del sistema nervioso central. Recientemente se ha encontrado que el tratamiento temprano con 17β-estradiol podía reducir los niveles de Aβ cerebral, aumentando su aclaramiento, tanto en ratones APP23 con una deficiencia genética de aromatasa (APP/Ar+/−) en los que sus cerebros contienen niveles no detectables de estrógenos, como en ratones APP23 ovariectomizados, en los que sus cerebros contienen aún ciertos niveles de estrógenos38. Sin embargo, solo los ratones APP/Ar+/− mostraron una gran reducción en la formación de placa amiloide, junto con una reducción de β-secretasa (BACE1)38.
En resumen, los estrógenos son neuroprotectores condicionales potencialmente útiles, para prevenir o retrasar la EA. Cuando se administran, se asocian con una multitud de efectos beneficiosos, pero sus acciones biológicas son dictadas por varios factores de modulación (por ejemplo, etiología de la depleción hormonal, ventana crítica para la intervención estrogénica, tipo y dosis de estrógeno, estrógenos no feminizantes, modo y régimen de administración, riesgo genético preexistente, componentes feminizantes estrogénicos del estrógeno conjugado equino…) que pueden alterar sustancialmente dichos efectos beneficiosos.
FitoestrógenosSon varios grupos de estrógenos no esteroideos ampliamente distribuidos en el reino vegetal (productos de soja, legumbres, frutas y verduras). Los fitoestrógenos son probablemente los componentes más bioactivos de la soja y el interés en estos compuestos se debe a su similitud estructural con el 17 β-estradiol (el estrógeno circulante más abundante). Las isoflavonas son los fitoquímicos más estudiados, siendo los alimentos a base de soja los que contribuyen con la mayor fuente de isoflavonas en la dieta. En los alimentos, las isoflavonas son biológicamente inactivas (glucósidos) pero son convertidos a formas activas (agliconas) por las bacterias del intestino39. Los efectos estrogénicos de la soja pueden atribuirse a las agliconas genisteína, daidzeína y gliciteína, aunque los niveles de estas moléculas varían considerablemente entre los productos de soja. La genisteína es la isoflavona más potente. Además de su capacidad para unirse a receptores de estrógenos, ejerciendo efectos hormonales específicos en los tejidos, los fitoestrógenos tienen otros efectos biológicos que no están mediados por estos receptores. Estas habilidades son probablemente responsables de los efectos antioxidantes, antiproliferativos, antimutagénicos y antiangiogénicos de los fitoestrógenos, y de su capacidad para promover la salud humana y la longevidad40.
Los modelos animales proporcionan evidencia de los efectos neuroprotectores y antioxidantes de los fitoestrógenos, que podrían reducir la patología relacionada con la EA, potencialmente aliviando el riesgo de su progresión. En ratas, se ha demostrado que la genisteína reduce la pérdida neuronal y mejora la muerte celular inducida por βA. Además, el tratamiento de ratones modelo doble transgénicos de la EA con genisteína indujo una mejoría notable y rápida en diversos parámetros de la cognición41. Esto se asoció con una disminución de los niveles de βA en el cerebro, del número y tamaño de las placas de βA corticales, así como de la reactividad microglial. Los efectos beneficiosos de la genisteína están mediados por un aumento en la secreción de ApoE, dependiente de PPARα, a partir de astrocitos cultivados41. Tanto la genisteína como la daidzeína se han asociado con una reducción en la fosforilación de la proteína tau ligada a la formación de ovillos neurofibrilares42. Una nueva formulación fitoestrogénica (fito-β-SERM) compuesta de una mezcla de genisteína, daidzeína y equol, muestra una selectividad de unión 83 veces mayor para el receptor beta de estrógenos que para el receptor alfa de estrógenos. Esta formulación es neuroprotectora y promueve mecanismos estrogénicos en el cerebro, a la vez que carece de actividad feminizante en la periferia. Recientemente se ha empleado fito-β-SERM en un modelo de ratón triple transgénico de EA43. Los resultados demostraron que una suplementación dietética con fito-β-SERM, antes de la aparición de la patología de EA, promovía la salud física, prolongaba la supervivencia, mejoraba la memoria de reconocimiento espacial, y atenuaba la deposición de βA y la formación de placas en los cerebros de los ratones tratados. A nivel molecular, fito-beta-SERM indujo la expresión de proteínas de hipocampo implicadas en la plasticidad neural y en la degradación/aclaramiento de βA43.
En conjunto, estos resultados apoyan el potencial terapéutico de los fitoestrógenos en la prevención y/o intervención temprana de la EA. Sin embargo, los estudios en animales ponen de relieve la necesidad de considerar variables mediadoras de la relación entre fitoestrógenos y cognición, incluyendo la edad, el tipo de producto de soja y la dosis de fitoestrógeno.
Terapias relacionadas con el estilo de vidaRestricción calóricaLa restricción calórica (RC) consiste en la reducción, sin llegar a malnutrición, de la ingesta calórica. Esta reducción en humanos estaría alrededor de un 15% menos de calorías por día44. La RC reduce la liberación de hormona de crecimiento, de insulina y de factor de crecimiento insulínico tipo 1, produciendo reducción de lipogénesis y de presión sanguínea, así como aumento de la sensibilidad a la insulina45. La RC actúa sobre diversas dianas antienvejecimiento como el propio factor de crecimiento insulínico tipo 1, sirtuinas o proteincinasa activada por AMP, y se ha demostrado que aumenta la longevidad y la salud en la mayoría de los modelos utilizados, como gusanos, perros, moscas, monos o levaduras45. Numerosos estudios epidemiológicos afirman que la obesidad y la diabetes aumentan el riesgo de desarrollar EA46. Hay datos de efectos terapéuticos de la RC en la EA, como por ejemplo, una mejora en la función cognitiva y en los problemas de memoria47. Aunque se desconoce el mecanismo por el que la RC atenúa la EA a nivel neuropatológico, hay evidencias de su papel neuroprotector en la degeneración neuronal46. En varios estudios con animales transgénicos, se ha observado que la RC incrementa la resistencia al daño oxidativo (reduce la producción de especies reactivas de oxígeno) y metabólico. Además, mejora la plasticidad neuronal, la memoria espacial, y aumenta algunos factores neurotróficos, como el factor neurotrófico derivado del cerebro, contribuyendo a potenciar la neurogénesis48. Como estrategia de estilo de vida la RC puede ser un factor neuroprotector y/o preventivo en la EA.
Dieta mediterráneaLas investigaciones bioquímicas, clínicas y epidemiológicas han demostrado que un alto grado de adherencia a la dieta tradicional mediterránea da como resultado un aumento en la longevidad, y una menor incidencia de enfermedad cardiovascular y mortalidad por dicha enfermedad, cáncer, deterioro cognitivo asociado a la edad, así como un menor riesgo de enfermedades crónicas49. Por otra parte, el estudio de cohorte poblacional, Nurses’ Health Study, mostró que una mayor adherencia a la dieta mediterránea se asociaba con telómeros más largos50. Los estudios de investigación se han centrado en los beneficios para la salud atribuidos a la dieta mediterránea y sus diversos componentes, específicamente el aceite de oliva virgen extra (AOVE). Muchos de sus efectos beneficios pueden explicarse no solo por la naturaleza monoinsaturada de su ácido graso predominante (ácido oleico) sino también por la bioactividad de sus compuestos secundarios, que pueden actuar sobre las células mediante mecanismos directos e indirectos, debido a su capacidad para modular la expresión génica. Entre los constituyentes menores del AOVE destacan una serie de polifenoles y secoiridoides, incluyendo oleocantal, hidroxitirosol (HT) y oleuropeína aglicona, por su capacidad de modular muchas vías que son relevantes para el proceso de envejecimiento. Los efectos beneficiosos de algunos componentes del AOVE en la prevención y retraso de la aparición de la EA, y en la reducción de la gravedad de sus síntomas, se han encontrado en modelos de ratones transgénicos.
El ratón TgSwDI es un modelo de EA y angiopatía amiloide cerebral que presenta una patología βA consistente y de comienzo temprano, acompañada de cambios cerebrovasculares. La administración a esos ratones de una dieta enriquecida con AOVE, a una edad anterior a la acumulación de βA, disminuyó significativamente la producción de βA, aumentó el aclaramiento de βA dependiente de ApoE, y redujo los depósitos parenquimatosos y vasculares de βA así como la tau total y su fosforilación51. Hubo también una mejora significativa en el comportamiento cognitivo del ratón. Los resultados de este estudio indican que el consumo de AOVE proporciona un efecto protector y/o enlentecedor de la patología de EA y de su trastorno relacionado (angiopatía amiloide cerebral).
La suplementación dietética de oleuropeína aglicona (el polifenol principal encontrado en el AOVE) mejoró significativamente el rendimiento cognitivo de ratones TgCRND8 (un modelo doble transgénico de deposición de βA) jóvenes y de mediana edad52. Dicho comportamiento se acompañó de una reducción significativa de los niveles de βA y del tamaño de las placas. Era evidente también la migración de microglía a las placas para fagocitosis y una notable reducción de la reacción de astrocitos52. Además, los ratones alimentados con oleuropeína aglicona presentaron una intensa reacción autofágica en la corteza cerebral asociada con una recuperación del sistema lisosomal (cuya disfunción es una de las primeras alteraciones que se producen en EA).
EL HT es un eficiente antioxidante fenólico y un potente antiinflamatorio natural del AOVE. A ratones hembras doble transgénicos APP/PS1(un modelo de deposición de βA) se les administró HT a un nivel comparable al de la dieta mediterránea diaria. El HT mejoró la actividad electroencefalográfica y la función cognitiva, mediante una reducción del estrés oxidativo mitocondrial y de los niveles de marcadores inflamatorios en el cerebro, sin afectar al procesamiento de la APP53. Estos hallazgos indican que HT podría ser un ingrediente dietético funcional en la prevención de la EA.
Ejercicio físicoEl ejercicio físico regular y moderado puede reducir el riesgo de morbimortalidad tanto en roedores como humanos54. Está asociado con estabilización de la presión sanguínea, mayor tolerancia a la glucosa, un mejor perfil lipídico y una mayor densidad ósea55. Además, tiene un claro beneficio sobre el envejecimiento, ya que mejoran enfermedades relacionadas con el mismo, como son, la sarcorpenia, enfermedades cardiacas o las englobadas en el síndrome metabólico. Sin embargo, se ha demostrado que durante el envejecimiento no aumenta la esperanza de vida como lo hace en salud45.
El ejercicio físico moderado produce también numerosos efectos beneficiosos a nivel cerebral en modelos murinos de la EA. Entre ellos destacamos el retraso de la neurodegeneración en el hipocampo, la reducción de factores proinflamatorios, el aumento de factor neurotrófico derivado del cerebro, factor de crecimiento endotelial vascular y factor de crecimiento insulínico tipo 1, la reducción de βA56 y la disminución de la neuroinflamación, razón por la cual mejora la memoria espacial en estos ratones57. Por tanto, el ejercicio físico puede ser una importante estrategia de estilo de vida neuroprotectora y/o preventiva para frenar el avance de la EA.
Terapias molecularesTerapia génicaLa terapia génica se define como la introducción de ácidos nucleicos en células para modificar el curso de una condición médica o enfermedad. Inicialmente fue propuesta para el tratamiento de enfermedades monogénicas, pero actualmente es reconocida como «una nueva forma de administración de fármacos» que ofrece estrategias diversas para el tratamiento de enfermedades innatas y adquiridas58. En el envejecimiento se han descrito multitud de genes cuyos productos se desregulan. Uno de los más estudiados es el de la transcriptasa inversa de la telomerasa (TERT). La TERT es una enzima formada por un complejo proteína-ácido ribonucleico con actividad polimerasa que usa TERC (componente ARN de la telomerasa) como molde para la adición de ADN en los telómeros, compensando así la erosión de los mismos provocada por la división celular59. En un estudio en el que se sobreexpresaba la TERT, se consiguió aumentar la longevidad en ratones sin producir efectos adversos60. Con esta terapia génica se evita el desgaste de los telómeros (uno de los marcadores del envejecimiento) y, por tanto, se previene el acortamiento de los mismos. La TERT está presente en el cerebro durante su desarrollo, pero no en las neuronas del adulto, y además posee propiedades neuroprotectoras en modelos animales con desórdenes neurodegenerativos, como la EA. La longitud de los telómeros es significativamente inferior en ratones y en pacientes con EA, con respecto a los controles61,62. Esto indica que terapias génicas que logren aumentar la TERT en el cerebro podrían proteger frente a la neurodegeneración asociada con la edad, y por tanto, prevenir el Alzheimer59.
Terapia epigenéticaExiste una variedad de alteraciones epigenéticas que afectan a todas las células y tejidos del organismo durante toda la vida. Los cambios epigenéticos implican alteraciones en los patrones de metilación del ADN, modificación postraduccional de las histonas, transcripción de ARN no codificantes y remodelación de la cromatina63. Durante el envejecimiento se producen diversas de estas alteraciones epigenéticas. La más contundente es la pérdida de remodelación de la heterocromatina, ya que en enfermedades como el síndrome de progeria de Werner o el de Hutchinson-Gilford hay mutaciones que tienen como consecuencia dicha pérdida64. Se han realizado diversas terapias epigenéticas, como el aumento de histonas H3 y H4, en las que se ha logrado alargar la esperanza de vida en levaduras o gusanos65. A nivel cerebral, la regulación adecuada de la metilación y desmetilación tiene un importante efecto neuroprotector, ya que su descontrol se relaciona con desórdenes neurológicos como la EA. Por ejemplo, una reducción de la actividad catalítica de la ADN metiltransferasa (DNMT) en la corteza (con inhibidores de la DNMT) conduce a un aumento en la expresión de ARNm de APP, provocando mayor riesgo de dicha enfermedad66. También se ha observado que la administración de butirato sódico (un inhibidor de las histonas deacetilasas tipo i [HDAC] que solo se expresa en las células neuronales y gliales) a ratones con EA mejora la memoria y frena la pérdida neuronal en el hipocampo, además de mejorar la densidad sináptica y plasticidad66.
Uno de los puntos más críticos sobre el uso de inhibidores de HDAC es que se ven afectadas al mismo tiempo múltiples proteínas HDAC (entre 4 clases de 11 proteínas HDAC). Debido a esta influencia simultánea sobre un amplio espectro de proteínas HDAC, no está claro cuál de ellas es la principal responsable y diana terapéutica más apropiada para la alteración de memoria en la EA. A pesar de su efectividad, todavía es incierto si estos enfoques terapéuticos, basados en la epigenética, incluyendo los inhibidores de HDAC, pueden cambiar o modificar la patología de la enfermedad en sí misma. Tampoco queda claro si los cambios de acetilación de histonas en la EA son causa crucial de la patogénesis de la enfermedad o simplemente consecuencia de la misma. Con enorme esfuerzo de los investigadores en este campo, ayudados por grandes avances tecnológicos, se espera que la naturaleza exacta de los cambios epigenéticos en la EA se dé a conocer en un futuro próximo, lo que contribuirá prácticamente al desarrollo de un tratamiento epigenético eficaz.
Terapia celularLa tecnología recientemente desarrollada y optimizada de células madre pluripotentes inducidas (iPSC) ofrece una nueva promesa para el tratamiento de las patologías asociadas con la pérdida de tipos celulares específicos. Las iPSC pueden ser generadas a partir de células somáticas mediante el empleo de varios factores de transcripción. Las iPSC son generalmente idénticas a las células madre embrionarias (ESCc) con capacidad de autorrenovación ilimitada y de diferenciación en todos los tipos celulares.
En el envejecimiento existe un declive del pool natural de células madres que pueden remplazar a las células dañadas o senescentes67. Sin embargo, se ha conseguido formar iPSC de células viejas a través de reprogramación epigenética y del mantenimiento de la enzima telomerasa; estas células podrían usarse en medicina restauradora68. Por otra parte, la pérdida de neuronas colinérgicas del prosencéfalo basal (FBCN) en las primeras etapas de la EA conduce a deficiencias en el aprendizaje espacial y la memoria. Por tanto, la generación de células gliales (que protegen las neuronas de la degeneración en curso) o de FBCN a partir de iPSC específicas de pacientes con EA es crucial para el modelado de la enfermedad in vitro y para el desarrollo de nuevas terapias. Basado en esto, se ha descrito recientemente que FBCN derivados de iPSC con EA esporádica mostraban características bioquímicas típicas de la EA, evidenciadas por un aumento de la proporción de ßA42/ßA40 y una mayor susceptibilidad a la muerte celular mediada por glutamato69. Además, las iPSC humanas derivadas de células somáticas del propio paciente pueden servir como una fuente de células suficientes para la terapia de reemplazo celular, pudiéndose prevenir eficazmente el rechazo inmunológico y los problemas éticos que plantea el uso de ESCc. Se ha descrito que el trasplante de células madre neurales humanas, derivadas de iPSC, reduce la fosforilación de tau y la producción de ßA a través de la vía de señalización Akt/GSK3, y disminuye la expresión de mediadores inflamatorios por desactivación de la microglía70.
Las tecnologías de edición del genoma (por ejemplo, ZFN, Talens, y CRISPR/Cas9) pueden utilizarse para agregar, alterar o modificar la secuencia de genes específicos relacionados con la EA, para medir su impacto en las neuronas humanas derivadas de iPSC, y en tratamientos, idealmente, diseñados a medida del paciente71. A pesar de haber varios retos en el uso clínico de la tecnología de iPSC, los logros recientes en este campo contribuirán significativamente a explorar los mecanismos moleculares y a la promoción de la terapia clínica de la EA. La terapia celular podrá utilizarse como terapia de reemplazo celular para la EA (terapia restauradora) y cribado de alto rendimiento para agentes que promueven la supervivencia de neuronas comprometidas en la enfermedad.
Las últimas décadas de investigación genética y bioquímica han identificado múltiples dianas patogénicas (además de la βA y tau) y una extensa red de interacciones moleculares para una intervención potencial en la EA. Aunque con grandes efectos terapéuticos, uno de los inconvenientes de estos estudios preclínicos es que muchos han actuado en dianas únicas. Sin embargo, los tratamientos clínicos actuales para la EA solo ejercen un efecto sintomático marginal, no sostenido, y con poco o ningún efecto en la progresión de la enfermedad. Es posible que sea necesario actuar en múltiples dianas simultáneamente (terapias combinadas) con el fin de lograr una mejora en los síntomas y en la fisiopatología. Esto ha llevado a algunos investigadores a cuestionar si el enfoque adoptado para el desarrollo de fármacos para la EA es el óptimo. Según ellos, la terapia debe abordar múltiples dianas dentro de la red subyacente a la fisiopatología de la EA, con la idea de que una terapia combinada pueda crear un efecto que es más que la suma de los efectos de muchas monoterapias. En otras palabras, los efectos de actuar en diferentes dianas pueden ser aditivos, multiplicativos o sinérgicos. Por ejemplo, recientemente se ha descrito un programa terapéutico completo y personalizado basado en la patogénesis subyacente de la EA, y que involucra terapias combinadas diseñadas para lograr una mejora metabólica72. De los 10 primeros pacientes que utilizaron este programa, pacientes con pérdida de memoria asociada con la EA, deterioro cognitivo leve amnésico o deterioro cognitivo subjetivo, 9 demostraron una mejora subjetiva u objetiva, y mantenida, en la cognición. Estos resultados quizás no sorprenden, dado que las terapias combinadas han demostrado ser más eficaces que las monoterapias en múltiples enfermedades crónicas, como la enfermedad cardiovascular aterosclerótica, el VIH y el cáncer.
Ensayos clínicosResveratrolLas discrepancias sobre el resveratrol se fundamentan en la diferencia de resultados en los ensayos in vivo/in vitro, como consecuencia de su baja biodisponibilidad oral (baja solubilidad acuosa, estabilidad química limitada y elevado metabolismo), y en la controversia sobre la dosis diaria adecuada para conseguir los correspondientes efectos beneficiosos22.
EstatinasEn un ensayo clínico en el que participaron 98 personas con Alzheimer leve-moderado, se observó que además de la reducción del colesterol, las estatinas producen una mejora cognitiva en dichos pacientes. Por tanto, podrían emplearse en la terapia de esta enfermedad, si estos resultados estuvieran avalados por un estudio multicéntrico con un mayor número de pacientes28. Actualmente no hay datos convincentes y de alta calidad, basados en datos clínicos aleatorios, incluyendo el ensayo PROSPER, el estudio de protección cardiaca MRC-BHF y la revisión sistémica de la base de datos Cochrane, para recomendar a las estatinas en la prevención de la EA.
EstrógenosEl tratamiento hormonal parece reducir o prevenir el deterioro cognitivo asociado con el envejecimiento y la EA. Varios estudios han indicado que la terapia de reemplazo hormonal se asocia con menor riesgo de EA entre las mujeres posmenopáusicas73. Además, una serie de ensayos clínicos han indicado que los estrógenos pueden mejorar el funcionamiento cognitivo y diario en mujeres ya diagnosticadas con EA74. Sin embargo, hay también informes notables que han encontrado efectos cognitivos nulos o incluso perjudiciales, después de la administración de estrógenos73. Existe una heterogeneidad considerable en torno a los factores (señalados anteriormente) asociados con el uso y administración de la terapia hormonal. Las formulaciones, la dosificación, la edad, el momento y los modos de administración difieren entre los estudios, lo que hace difícil comparar los resultados de un experimento a otro. La precaución se justifica, ya que, además, dichos factores no se entienden completamente, e incluso algunas composiciones tienen consecuencias negativas para la salud. Esto podría explicar que actualmente no haya una terapia de reemplazo hormonal consolidada para humanos con EA.
FitoestrógenosAcorde con la evidencia epidemiológica que compara poblaciones occidentales y asiáticas, y con estudios clínicos, los fitoestrógenos parecen mejorar la función cognitiva. Sin embargo, los estudios observacionales y ensayos controlados aleatorios en seres humanos son en gran medida inconsistentes. Claramente, existe una enorme brecha de conocimiento y se necesitan estudios adicionales bien controlados y a gran escala para evaluar aún más esta relación. En particular, es necesario examinar la dosis óptima, así como la toxicidad de altas dosis de isoflavonas en seres humanos. También se requieren pautas para la duración del consumo de isoflavonas. Se deben controlar los factores mediadores, como la edad, el sexo, el estado de la menopausia, la expresión de receptores de estrógenos dependiente de la edad, la etnia y las diferencias individuales en biodisponibilidad y metabolismo de las isoflavonas. Tomando todos estos puntos en consideración, la evidencia hasta la fecha no es suficiente para hacer recomendaciones sobre la asociación entre ingesta dietética de isoflavonas y cognición en los adultos mayores.
Restricción calóricaPara llevar a cabo ensayos clínicos basados en la RC en humanos, es necesario controlar numerosos parámetros, por ejemplo, el tipo exacto de dieta a seguir, las calorías ingeridas y gastadas, así como factores intrínsecos como, por ejemplo, el metabolismo de cada persona. Esto hace que la dificultad de estos ensayos sea elevada. A pesar de ello, un reciente ensayo clínico en personas obesas con deterioro cognitivo leve ha concluido que la RC provoca pérdida de peso, estando además asociada a una mejora cognitiva47. Sin embargo, existe una importante relación entre RC y motivación cerebral, por lo que la RC puede ser una dieta poco asumible.
Dieta mediterráneaLa evidencia creciente apoya los efectos beneficiosos de la dieta mediterránea en la prevención de disfunciones relacionadas con la edad, el cáncer y las enfermedades neurodegenerativas. Esto permite ser optimistas en cuanto a que podría surgir como un tratamiento profiláctico alternativo para la demencia. En particular, una mayor adherencia a la dieta mediterránea se asocia con una menor tasa de deterioro cognitivo, un menor riesgo de conversión de deterioro cognitivo leve a EA y una reducción del riesgo de EA75,76. Sin embargo, cabe señalar que la mayoría de los resultados provienen de estudios epidemiológicos que proporcionan evidencia de una correlación entre la dieta mediterránea y la cognición, pero no de una relación causa y efecto. Se requieren ensayos más controlados para establecer una relación causal. No obstante, basándonos en la evidencia actual, es recomendable la adopción de la dieta mediterránea, tanto en la práctica clínica como en salud pública, como parte de las medidas preventivas para reducir el riesgo de deterioro cognitivo y demencia.
Ejercicio físicoDestacamos 2 ensayos clínicos: En uno de ellos se investigó el efecto del ejercicio de fuerza en pacientes con EA temprana, y aunque se observó una mejora a nivel cognitivo, existe riesgo cardiovascular asociado a este tipo de ejercicio en edades avanzadas77. En cuanto al ensayo clínico que estudió el efecto del ejercicio físico aeróbico en pacientes con Alzheimer, se descubrió que los beneficios a nivel cognitivo estaban directamente relacionados con el diseño individualizado del ejercicio, maximizando la capacidad cardiorrespiratoria (medida importante de la salud), sin requerir elevados niveles del mismo78. La recomendación actual respalda el empleo del ejercicio físico regular como parte importante del tratamiento para las personas con EA.
Terapia celularSe realizó un ensayo clínico (en fase 1) en 8 individuos con EA leve, a los que se implantó en el cerebro fibroblastos modificados genéticamente, con capacidad para expresar y liberar el factor de crecimiento nervioso. Este factor neurotrófico incrementó la función colinérgica, deteriorada en los enfermos de Alzheimer, y además mejoró la memoria. A partir de los 6 meses de ensayo se observó una mejora significativa, ya que se ralentizó la tasa de deterioro cognitivo79. La terapia celular es un área de investigación en expansión con un gran potencial para el tratamiento de la EA.
ConclusionesLa mayor parte de las intervenciones antienvejecimiento que aumentan la esperanza de vida y/o duración de la salud en modelos animales tienen una acción terapéutica en la EA. Actualmente no existe una intervención antienvejecimiento ideal que consiga corregir, frenar o revertir el curso y/o patología de la EA. Por tanto, serán necesarias varias intervenciones terapéuticas (optimizando el equilibrio entres sus efectos beneficiosos e indeseables) y nuevos enfoques de investigación en envejecimiento, para conseguir el control de esta devastadora enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.