Introducción
BIOBADASER es un registro prospectivo de pacientes en tratamiento con terapias biológicas por enfermedades reumáticas. Fue establecido en febrero de 2000 para el seguimiento activo de su seguridad, y se nutre de notificaciones tanto espontáneas como activas por parte de los centros participantes. La información completa sobre el protocolo del
registro puede consultarse en la página web del registro en http://biobadaser.ser.es y en publicaciones previas1. Los pacientes registrados en BIOBADASER son todos aquellos con enfermedades reumáticas en los centros participantes que inician tratamiento con agentes biológicos desde el segundo semestre de 1998.
Este informe corresponde al corte semestral del registro realizado en abril de 2004. En este informe, a diferencia de previos, hemos tenido en cuenta que varios centros no han estado comunicando activamente desde hace aproximadamente un año y medio. Esta situación la hemos corregido censurando los datos de los pacientes de dichos centros a fecha 31 de diciembre de 2002. En total este cambio afecta a 329 (8%) pacientes. Por otro lado, entre los meses de diciembre de 2003 y abril de 2004, se ha llevado una monitorización in situ de varios centros seleccionados por el volumen de pacientes, y se muestran los resultados al final del presente informe. Esta monitorización ha permitido la actualización comprobada de los datos de 617 pacientes (15% del total).
Resultados
Hasta la fecha de 23 de abril de 2004 se han registrado 4.102 pacientes en BIOBADASER, procedentes de 95 centros (apéndice 1), con un total de 4.544 ciclos de tratamientos (394 pacientes han estado en tratamiento con más de un agente biológico en momentos distintos de su evolución, o con el mismo agente pero separado por más de 4 veces el tiempo normal entre dosis).
Descripción de los pacientes registrados
El 66,5% de los pacientes registrados son mujeres (n = 2.729). La edad media al inicio del tratamiento es de 50 ± 15 años, y la proporción de niños (menores de 16 años) al inicio de terapia es del 1,4% (n = 56). En la tabla 1 figuran los diagnósticos de los pacientes que recibieron terapias biológicas y que están registrados en BIOBADASER. Los pacientes empiezan el tratamiento con el primer agente biológico después de una evolución media de la enfermedad de 11 ± 8 años; 13 ± 9 años en el caso de la espondilitis anquilosante y 11 ± 8 años en el caso de la artritis reumatoide.
Descripción de los ciclos de tratamiento registrados
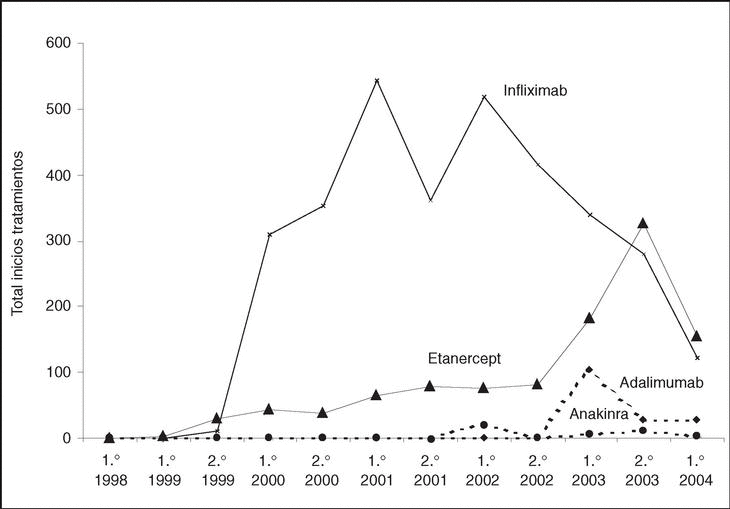
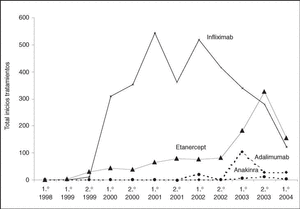
Los tratamientos biológicos registrados hasta el momento son infliximab (3.254; 72%), etanercept (1.077; 24%), adalimumab (159; 4%) y anakinra (43; 1%). En la figura 1 puede verse el ritmo de nuevos tratamientos iniciados por semestre y año de cada uno de los agentes biológicos registrados.
Figura 1. Número de tratamientos iniciados por semestre y año de cada uno de los agentes biológicos registrados en BIOBADASER.
Supervivencia del fármaco
Se han registrado 1.057 (23%) interrupciones del tratamiento, en la mayoría de las ocasiones como resultado de un acontecimiento adverso (n = 569; 54%), seguido de ineficacia (n = 338; 32%). En 149 (14%) casos el motivo de interrupción fue distinto: decisión del paciente (n = 68), mejoría (n = 14), embarazo (n = 9), entre otros. En 394 pacientes, como ya se ha mencionado, la interrupción se siguió del inicio de tratamiento con otro agente biológico o con otro ciclo distinto del mismo agente, entendiéndose por ciclo distinto del mismo agente si la duración entre la última dosis del primer ciclo y la primera del siguiente estaban separadas en el tiempo más de 4 veces el intervalo aprobado para dicho tratamiento.
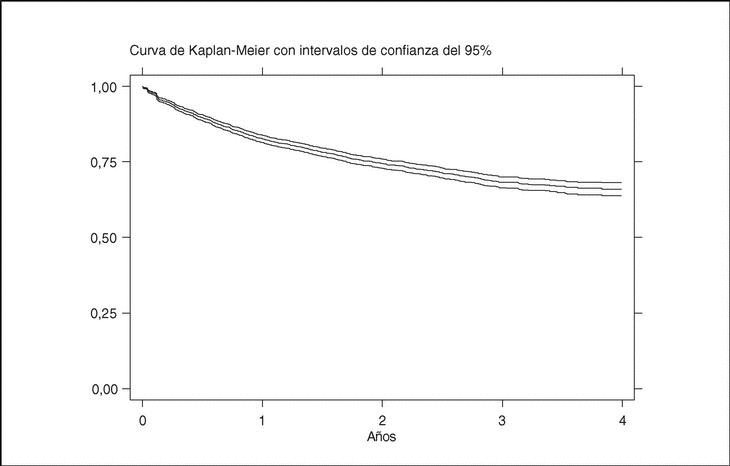
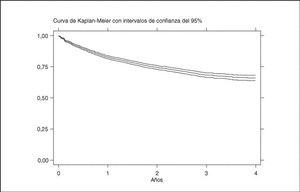
La media de tiempo en tratamiento con terapias biológicas en BIOBADASER es de 1,7 años ± 1,2 (mediana, 1,4; P25-75, 0,6-2,6). La figura 2 representa la curva de supervivencia global de las terapias biológicas registradas en BIOBADASER. La supervivencia del fármaco a 1, 2, 3 y 4 años es, respectivamente, del 83 [82-84], 75 [73-76], 69 [67-71] y 67% [64-69]. Esta supervivencia no varía si se excluye a los pacientes en los que los agentes biológicos fueron de uso compasivo. Hasta 154 pacientes han estado en tratamiento durante más de 4 años con etanercept o infliximab.
Figura 2. Curva de supervivencia de las terapias biológicas en BIOBADASER.
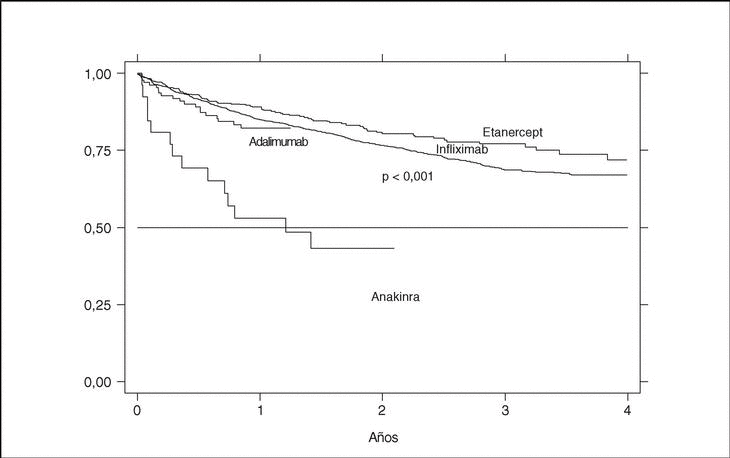
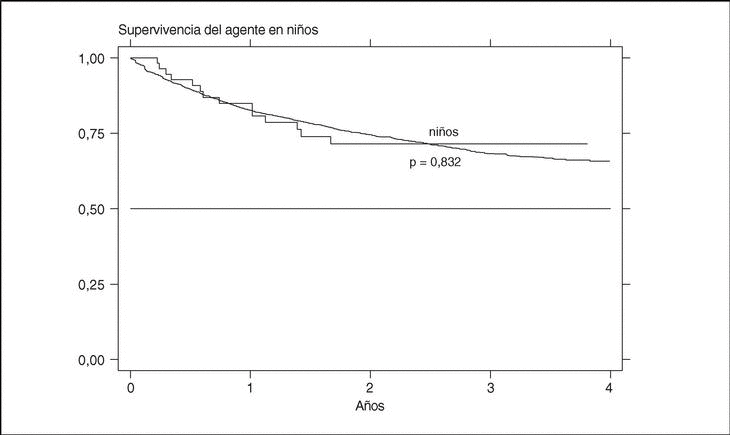
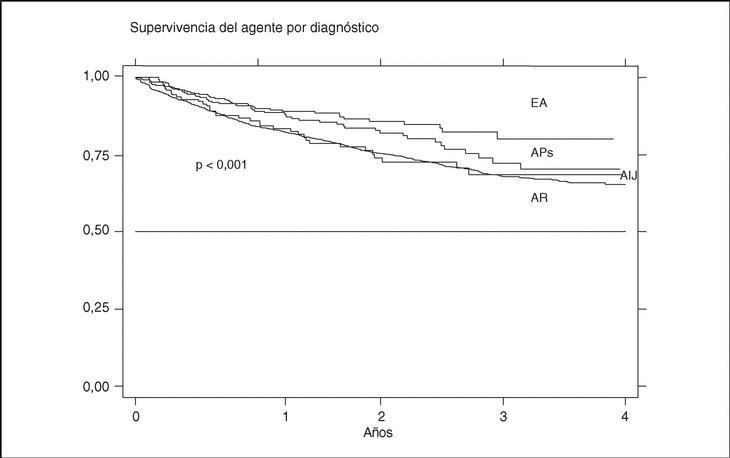
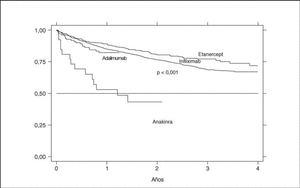
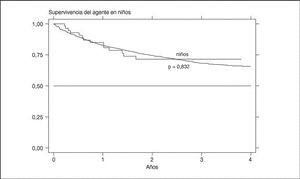
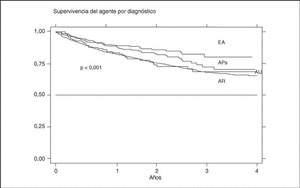
La supervivencia del fármaco es algo mejor para etanercept que para infliximab (p = 0,0035), pero sobre todo es peor para anakinra (log-rank p < 0,001) (fig. 3). La supervivencia del fármaco es menor en mujeres que en varones, con una supervivencia del fármaco a 3 años del 68 y el 71%, respectivamente (plog-rank = 0,004). Los pacientes que inician tratamiento con terapias biológicas antes de los 16 años de edad parecen tener una mejor supervivencia del fármaco al principio del tratamiento, pero a partir de los 6 meses disminuye comparada con la que se da en adultos, siendo el resultado al final del período de evaluación no significativo (plog-rank = 0,832) (fig. 4). En 13 de las 18 suspensiones de tratamiento en niños, el motivo ha sido ineficacia, mientras que en el caso de los adultos, el principal motivo de suspensión ha sido la aparición de un acontecimiento adverso (p < 0,001). Finalmente, se encuentran diferencias significativas en cuanto a la duración del tratamiento, o supervivencia del fármaco, en función del diagnóstico, que es mayor en el caso de la espondilitis anquilosante (plog-rank < 0,001) (fig. 5).
Figura 3. Curva de supervivencia del tratamiento en función del agente biológico empleado.
Figura 4. Curva de supervivencia del tratamiento en función de la edad al inicio del tratamiento.
Figura 5. Curva de supervivencia del tratamiento en función del diagnóstico. EA: espondilitis anquilosante; APs: artritis psoriásica; AIJ: artritis idiopática juvenil; AR: artritis reumatoide.
Cambios entre agentes biológicos
Se ha registrado a 394 (8,9%) pacientes que han estado en tratamiento con más de un agente biológico. Las combinaciones de orden de los agentes son muy variadas, como puede verse en la tabla 2. El fármaco más frecuentemente indicado como primer agente biológico ha sido el infliximab (3.198) y como segundo, el etanercept (302).
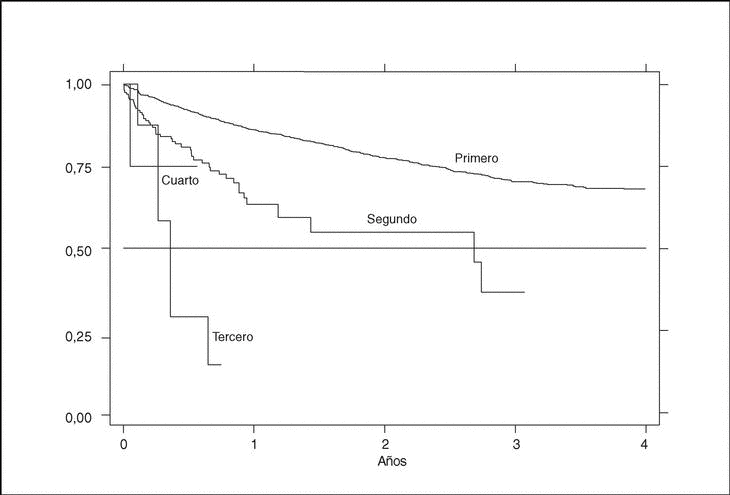
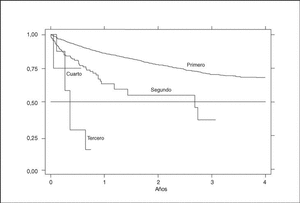
Existe una gran diferencia en la supervivencia del fármaco dependiendo del orden de tratamiento. El primer agente tiene ciertamente una supervivencia mayor, del 84% al año, que va disminuyendo con tratamientos sucesivos con otros agentes. La supervivencia a un año del segundo tratamiento es del 53%. Ningún tercer o cuarto tratamiento ha durado aún más de un año para saber cuál sería su supervivencia a tal período (fig. 6).
Figura 6. Curva de supervivencia en función del orden de tratamiento.
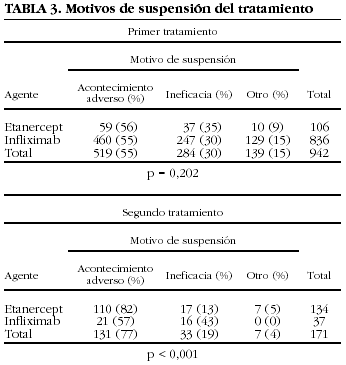
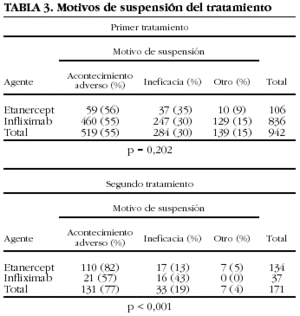
Los motivos de suspensión varían dependiendo de si se trata de la primera vez que se utilizan o son la segunda opción de tratamiento (tabla 3). Infliximab se suspende por ineficacia con más frecuencia en el segundo que en el primer tratamiento. Con etanercept ocurre justo lo contrario, aunque la diferencia entre las causas de suspensión como primero o segundo fármaco no es estadísticamente significativa. La concordancia entre los motivos de suspensión del primero y del segundo tratamiento, independientemente del fármaco, es baja (kappa = 0,27) (tabla 4). En el 52% de los casos, la causa de suspensión del segundo fármaco no es la misma que la del primero.
Investigación de tuberculosis latente y quimioprofilaxis
Desde marzo de 2002 se recogen datos en BIOBADASER sobre las radiografías de tórax y pruebas de Mantoux previas al inicio del tratamiento con biológicos.
En total sabemos que en al menos 1.877 (46%) pacientes se realizó una investigación previa de tuberculosis (TB) latente con radiografía de tórax y Mantoux y que en otros 221 (5%) se realizó al menos una de las 2 pruebas. De casi la mitad de los pacientes no sabemos si se investigó una TB latente, la mayoría de los cuales se refieren a pacientes incluidos en BIOBADASER antes de marzo de 2002. Se realizó investigación de TB latente completa en al menos 1.478 (69%) de los tratamientos iniciados con posterioridad a dicha fecha.
Definimos probable TB latente por la radiografía a cualquier resultado de los siguientes: granulomas calcificados, paquipleuritis, tuberculosis antigua, tractos cicatriciales o casquetes apicales. No consideramos como probable TB los siguientes patrones: alteraciones inespecíficas de la trama pulmonar, asbestosis, atelectasias, derrame pleural, dudosas bullas, dudoso engrosamiento pleural, dudoso granuloma, engrosamiento hiliar, enfermedad pulmonar obstructiva crónica (EPOC), esternotomía, ensanchamiento mediastínico, fibrosis pulmonar, infiltrado, mínimo engrosamiento pleural, nódulos, patrón intersticial, pinzamiento de senos, pérdida de volumen, sin alteraciones significativas o silicosis. Según esta definición, 120 (2,9%) casos tendrían un patrón compatible, 1.878 (45,8%) no lo tendrían y no sabemos si lo tenían o no 2.104 (51%).
Se comunicó un Mantoux positivo (mayor o igual a 5 mm de induración), o un booster positivo con Mantoux previo negativo, en 501 casos --en 50, el Mantoux había sido anérgico o negativo y el booster--.
Reuniendo los resultados de la radiografía de tórax y del Mantoux, sabemos que se debería haber realizado profilaxis de tuberculosis previa al tratamiento en 569 (13,9%) ocasiones. Si tenemos en cuenta sólo el grupo de pacientes en los que sabemos que se investigó una tuberculosis latente, supondría el 27% de los investigados. Ahora sabemos que se llevó a cabo quimioprofilaxis en 525 ocasiones (25% de todos los tratamientos). Esto supone que, de entre los casos que conocemos, el 85% (n = 484) tenía posible tuberculosis latente.
Descripción de los acontecimientos adversos
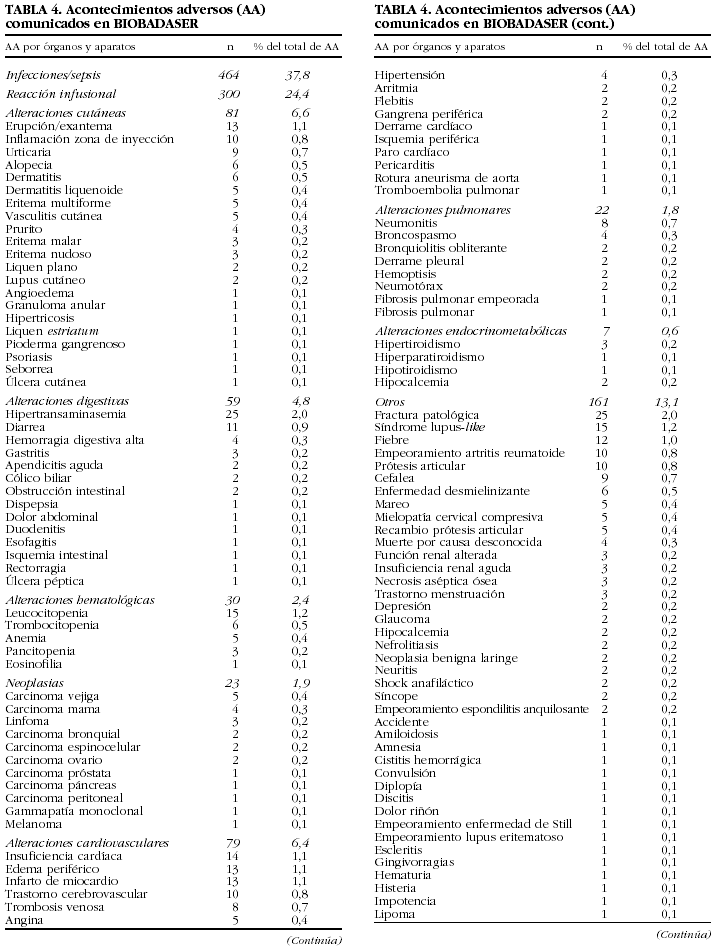
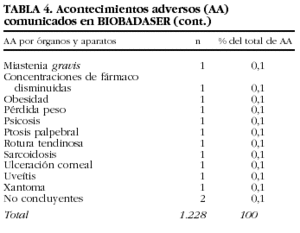
Se han comunicado 1.228 acontecimientos adversos en 731 (22,7%) pacientes (tabla 4). En 138 pacientes se comunicaron 2, en 42 pacientes, 3 y en 21 pacientes, 4 o más.
El tipo de acontecimiento adverso más frecuente fue la infección (n = 464; 38%), seguido de las reacciones infusionales (n = 300; 24%) y los trastornos cutáneos (n = 81; 7%).
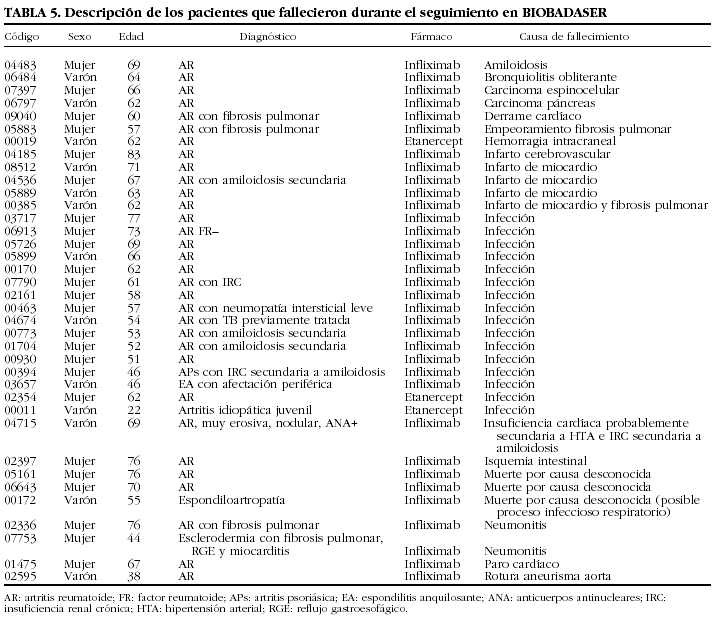
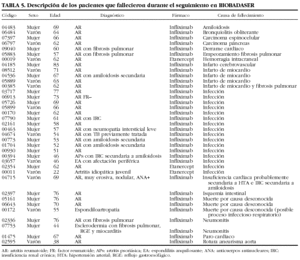
Se han comunicado 48 fallecimientos y 348 ingresos hospitalarios como consecuencia de los acontecimientos adversos. En 490 (40%) ocasiones no ocurrió ninguno y, sin embargo, el médico notificador opinaba que el acontecimiento era relevante. Las muertes ocurrieron en su mayoría por infecciones (n = 23). En la tabla 5 se muestran las características de los pacientes fallecidos durante el seguimiento en BIOBADASER.
Descripción de las infecciones
Se comunicaron 464 infecciones relevantes en 396 pacientes (26 pacientes con 2 infecciones y 10 con 3 o más). De los 56 pacientes con más de un episodio infeccioso relevante, 49 habían estado en tratamiento sólo con infliximab, 3 sólo con etanercept, 2 con adalimumab y 2 con más de un agente biológico.
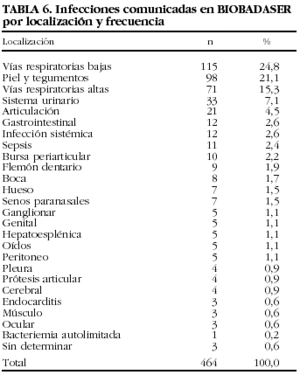
En las tablas 6 y 7 se indican las localizaciones y gérmenes implicados en las infecciones, respectivamente. Los 2 gérmenes identificados con más frecuencia fueron el virus del herpes zoster y Mycobacterium tuberculosis.
Comparando la tasa de incidencia de herpes zoster con una población control de artritis reumatoide (EMECAR)2, el riesgo de herpes zoster (medido por tasa relativa de incidencia) en pacientes con terapias biológicas es de 2,8 (intervalo de confianza [IC] del 95%, 0,7-24,2), no concluyente.
En cuanto a la tasa de tuberculosis, comparada tanto con la de la población general como con la de una población de control (EMECAR)2, es elevada (tabla 8). Se han detectado 2 casos nuevos de tuberculosis desde el inicio de la normativa de investigación y profilaxis. La tabla 8 muestra la tasa relativa de incidencia con respecto a la población control, antes y después de la comunicación de dicha normativa. Como puede observarse, tras la introducción de dicha normativa, las diferencias con las tasas esperadas no logran significación estadística. Todos los pacientes registrados con tuberculosis habían estado en tratamiento sólo con infliximab. La última tasa de incidencia comunicada en la población general española es de 25 casos por 100.000, según datos de la SEPAR3.
Insuficiencia cardíaca
Se han registrado 14 casos de insuficiencia cardíaca en los pacientes registrados en BIOBADASER, todos en pacientes mayores de 50 años (2 casos en el grupo de 50-60 años, 7 en el de 60-70 años, 4 en el de 70-80 años y un caso en mayores de 80 años). La tasa de incidencia de insuficiencia cardíaca por 100.000 pacientes/año es de 151. Comparada con la de EMECAR, no se encuentra un aumento del número de casos (tasa relativa de incidencia 0,17; IC del 95%, 0,07-0,45).
Reacciones infusionales
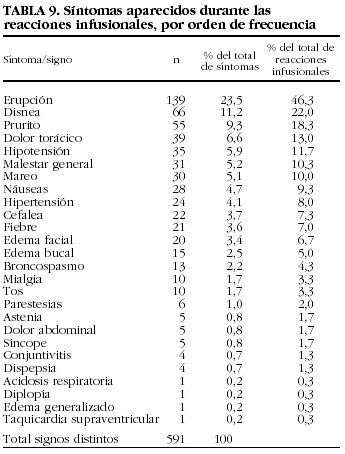
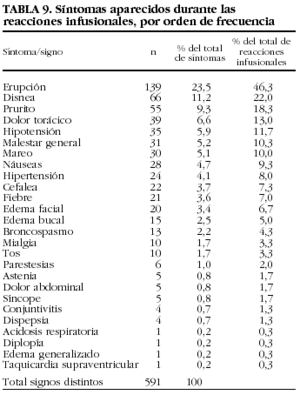
En la tabla 9 se enumeran los 591 tipos de síntomas y signos aparecidos en las 300 reacciones infusionales con infliximab. La mediana del tiempo de aparición de la reacción respecto de la infusión fue de 0 h, con un rango de entre 0 y 336 h desde la infusión (P25-75 = 0-0).
Neoplasias
Se han registrado 23 neoplasias, 2 de las cuales han causado el fallecimiento del paciente. Comparado con EMECAR, la tasa de incidencia de neoplasias en BIOBADASER es inferior: tasa relativa de incidencia 0,24 (IC del 95%, 0,12-0,50). Menos concluyente es la comparación en cuanto a la tasa de linfomas: tasa relativa de incidencia 0,22 (IC del 95%, 0,02-2,61).
Enfermedad desmielinizante
Se han registrado 6 casos de enfermedad desmielinizante, 5 con infliximab (tasa de incidencia por 100.000 personas/año, 90 [IC del 95%, 37-218]) y uno con etanercept (tasa de incidencia por 100.000 personas/año, 95 [IC del 95%, 13-680]). En EMECAR no ha aparecido ningún caso de enfermedad desmielinizante, por lo que no es posible determinar el riesgo relativo.
Hipertransaminasemia
Se ha comunicado hipertransaminasemia relevante en 26 (0,6%) de los pacientes registrados en BIOBADASER. Sabemos que al menos 9 (36%) de los pacientes que la presentaron realizaron quimioprofilaxis tuberculosa antes del tratamiento con el agente biológico y que 7 de 25 estaban con isoniazida en el momento del acontecimiento adverso. No se requirió ingreso hospitalario o prolongación de ingreso por hipertransaminasemia en ningún caso comunicado.
Monitorización in situ
Desde diciembre de 2003 hasta marzo de 2004, se ha llevado a cabo la monitorización de pacientes seleccionados aleatoriamente en 19 centros, éstos a su vez seleccionados por el volumen de pacientes, y el objetivo es la monitorización del 25% de los pacientes de cada centro. En total se seleccionó a 660 pacientes, lo que en el momento de hacer la selección era el 20% de todos los pacientes registrados. No se pudo recuperar la historia clínica de 43 pacientes durante la monitorización, por lo que, en total, se revisaron 617 historias. El 53% de los registros en BIOBADASER, cuando se comparaban con la información presente en las historias clínicas, tenían faltas leves (fecha de radiografía o de Mantoux errónea, fecha de nacimiento o de diagnóstico erróneas o ausentes, no comunicar algún tratamiento concomitante en acontecimientos adversos, etc.). En 18 casos, el diagnóstico no coincidía exactamente con el registrado en BIOBADASER, aunque sólo en un caso el diagnóstico era muy diferente (en lugar de artritis reumatoide, el paciente tenía sífilis, por lo que además sale del registro) y en 5 se había registrado artritis reumatoide aunque el diagnóstico era algún tipo de oligoartritis seronegativa.
Se definió falta grave en el registro la ausencia de comunicación del fin del tratamiento (detectada en 74 [12%] pacientes) y no comunicar efectos adversos relevantes (en 131 [19,8%] pacientes). Tres de los acontecimientos eran graves: muerte por causa desconocida, cáncer de mama y tuberculosis. No obstante, no había pasado un mes desde la fecha del acontecimiento adverso en 32 pacientes, esto es, en aproximadamente un cuarto de los acontecimientos no comunicados. En total, un 21,7% de los pacientes tenía algún error de notificación.
Todos los errores en estos 617 pacientes han sido corregidos. Si asumimos que en el resto de los 3.485 pacientes registrados se mantiene el 21,7% de error, el probable existente en BIOBADASER es
del 18%.
Discusión
Este informe refleja la actividad del registro después de 4 años de seguimiento. La cantidad de información recabada es profusa, a pesar de que son pocos los datos recogidos por paciente. Sabemos, por ejemplo, que la supervivencia del fármaco es elevada, por encima de la de los DMARD clásicos4,5. BIOBADASER no está diseñado para valorar la eficacia de estas terapias, sin embargo, la explicación más plausible del largo tiempo que están los pacientes con estos tratamientos es su efectividad, puesto que en la mayoría de los centros se realiza una estrecha vigilancia de estos pacientes por el elevado gasto que generan. Se podría argüir que la alta supervivencia de estas terapia se debe a que el registro tiene fallos. Hemos repetido el análisis de supervivencia suponiendo que el 12% de todos los pacientes que no habían finalizado el tratamiento lo habían finalizado en realidad al mes de iniciarlo y, aún así, la supervivencia del fármaco a 5 años sigue estando por encima del 50%. En cuanto a las diferencias en supervivencia que aparecen entre los distintos agentes, hemos comprobado que existen diferencias significativas en el motivo de suspensión. Además, pensamos que podría existir una infranotificación de las suspensiones de tratamiento con agentes que se administran en el domicilio del paciente, frente a los que se administran en el hospital, por ser el seguimiento generalmente más estricto en estos últimos. No obstante, hemos comprobado que los fallos en la comunicación de fechas de fin se reparte por igual entre los distintos agentes.
Otro dato a reseñar es que cada vez se utilizan más agentes biológicos en afecciones distintas de las aprobadas, casi en un 8% si no incluimos como compasivo su uso en la artritis psoriásica. Además, también empezamos a ver cómo la curva de supervivencia empieza a diferenciarse entre las enfermedades para las que se utilizan estas terapias. En concreto, llama la atención la clara diferencia entre las curvas de supervivencia en la artritis reumatoide y la espondilitis anquilosante, mucho mejor en esta última.
En cuanto a los efectos adversos, también hemos aprendido que no está claro que haya más infecciones por herpes zoster que en pacientes con artritis reumatoide sín la influencia de estos tratamientos, aunque es posible, por datos indirectos no recogidos en BIOBADASER, que se trate de episodios más difíciles de controlar y de mayor extensión. Podemos decir también que se ha logrado un hito en el control de la tuberculosis tras las medidas de detección precoz y profilaxis. Tras la introducción de las medidas de investigación y profilaxis previas al tratamiento, se ha reducido de forma significativa el número de casos de tuberculosis, hasta el punto de que no se observan diferencias con la tasa comunicada para pacientes con artritis reumatoide sin agentes biológicos. En cuanto a la insuficiencia cardíaca, la tasa es significativamente inferior a la observada en la cohorte control. Esto pudiera deberse también a que los médicos evitan prescribir estas terapias en pacientes con episodios previos de insuficiencia cardíaca por la prevención que aparece en la ficha técnica. Por último, hay que tomar con precaución el hecho de que no aumente el riesgo de neoplasias con el tratamiento con agentes biológicos comparado con la tasa en pacientes con enfermedades reumáticas inflamatorias.
Comité Científico de BIOBADASER
Juan Gómez-Reino Carnota (Reumatología, Hospital Universitario de Santiago, Santiago); Loreto Carmona (Reumatología, Hospital Clínico San Carlos, Madrid); Dolores Montero (División de Farmacoepidemiología y Farmacovigilancia, Agencia Española del Medicamento, Madrid); Emilio Martín Mola (Reumatología, Hospital la Paz, Madrid); Jordi Carbonell Abelló (Reumatología, Hospitales del Mar y de la Esperanza, Barcelona); Vicente Rodríguez Valverde (Reumatología, Hospital Marqués de Valdecilla, Santander); Eliseo Pascual Gómez (Reumatología, Hospital General de Alicante, Alicante); Jesús Tornero Molina (Reumatología, Hospital General de Guadalajara, Guadalajara); Manuel Figueroa Pedrosa (Reumatología, Hospital Ntra. Sra. de Aranzazu, San Sebastián); Rafael Cáliz Cáliz (Reumatología, Hospital Virgen de la Nieves, Granada); Juan Mulero Mendoza (Reumatología, Hospital Puerta de Hierro, Madrid); Armando Laffón Roca (Reumatología, Hospital de la Princesa, Madrid);
José Luis Marenco de la Fuente (Reumatología, Hospital de Valme, Sevilla); Luis Carreño Pérez (Reumatología, Hospital Gregorio Marañón, Madrid); Xavier Tena Marsa (Reumatología, Hospital Germans Trias i Pujol, Barcelona); Jose M. Álvaro-Gracia (Reumatología, Hospital de la Princesa, Madrid);
Participantes en BIOBADASER
Sara Marsal (CS Vall D'Hebron), Laura Cebrián Méndez (Hospital Gregorio Marañón), Isabel García Bernal (Hospital Clínico Universitario de Santiago), Blanca Hernández (Hospital Universitario Virgen Macarena), Paloma Vela Casasempere (Hospital General Universitario de Alicante), Manuel Figueroa Pedrosa (Hospital de Donostia), Sagrario Sánchez Andrada (Hospital Universitario Marqués de Valdecilla), Gema Bonilla Hernán (Hospital La Paz), Isidoro González Álvaro (Hospital Universitario de La Princesa), Enrique Júdez Navarro (Hospital Clínico Universitario San Carlos), Oscar Illera Martín (Hospital Ramón y Cajal), Raimon Sanmartí Sala (Hospital Clínic i Provincial de Barcelona), M. Victoria Irigoyen Oyarzabal (Hospital General Carlos Haya), Tomás Tinturé Eguren (Hospital de Navarra), Francisco Javier Manero Ruiz (Hospital Universitario Miguel Servet), Carlos Marras Fernández-Cid (Hospital Virgen de La Arrixaca), Ana Cruz Valenciano (Hospital Severo Ochoa), Carlos Rodríguez Lozano (Hospital de Gran Canaria Dr. Negrín), Rafael Cáliz Cáliz (Hospital Virgen de Las Nieves), Beatriz Joven Ibarra (Hospital 12 de Octubre), Rosa Roselló Pardo (Hospital General San Jorge), Joan Maymó Guarch (IMAS, Hospital de L'Esperança y Hospital del Mar), Juan Carlos Vesga Carasa (Hospital Txagorritxu), José Raúl Noguera Pons (Hospital General Universitario de Elche), Trinidad Pérez Sandoval (Hospital Virgen Blanca), Mónica Fernández Castro (Clínica Puerta de Hierro), Javier Vidal Fuentes (Hospital General Universitario de Guadalajara), José Luis Marenco de la Fuente (Hospital Universitario de Valme), Manuel Rodríguez Gómez (CH de Ourense), Isabel Ibero Díaz (Hospital General de Elda), Carmen García Gómez (Hospital de Bellvitge Prínceps d'Espanya), Ramón Mazzucchelli (Hospital Fundación Alcorcón), M. Mercedes Freire González (Hospital Juan Canalejo), Santiago Benito Urbina (CH San Millán-San Pedro), Juan Carlos Cobeta García (Hospital General de Teruel Obispo Polanco), Marta Larrosa Padro (Consorci Sanitari del Parc Taulí), Teresa Ruiz Jimeno (Hospital Comarcal Sierrallana), Iván Ferraz Amaro (Hospital Universitario de Canarias), Javier Calvo Catalá (Hospital General Universitario de Valencia), Elena Cuesta (Hospital Virgen de La Luz), Jesús Ibáñez Ruan (Policlínico Vigo, S.A. [Povisa]), Juan José García Borras (Hospital La Fe), Amalia Sánchez-Andrade Fernández (Hospital Xeral-Calde), Manel Pujol Busquets (Hospital Mútua de Terrassa), Elena Ciruelo Monge (Hospital General de Segovia), Julia García Consuegra (Hospital Infantil La Paz), Jordi Fiter Aresté (Hospital Son Dureta), Javier Rivera Redondo (Instituto Provincial de Rehabilitación), Montserrat Centellas (Hospital de Mataró), Lucía Pantoja Zarza (Hospital del Bierzo), M. Teresa Bosque Peralta (Hospital Clínico Universitario Lozano Blesa), Xavier Tena Marsá (Hospital Universitari Germans Trias i Pujol), Carmen Torres (Hospital Ntra. Sra. de Sonsoles), Xavier Arasa Fava (Hospital de Tortosa), Inmaculada Bañegil (Hospital de Mendaro), Alfredo Buisan Aguirre (Hospital Militar Universitario Gómez Ulla), José Luis Cuadra (Hospital Ntra. Sra. Del Carmen), Anna Martínez Cristóbal (Hospital de La Ribera), Ángel Aragón Díez (Hospital Ntra. Sra. Del Prado), Ana Rosa Instxaurbe (Hospital de Basurto), Emilia Aznar (Hospital Reina Sofía), Ángel García Aparicio (Hospital Virgen de La Salud), Miquel Ángel Belmonte Serrano (Hospital General de Castellón), Jordi del Blanco Barnusell (Hospital Sant Jaume de Calella), Mauricio Mínguez Vega (Hospital San Juan de Alicante), José Ivorra Cortés (Hospital General de Onteniente y Lluis Alcanyis de Xátiva), Dolors Boquet Estruch (Hospital Arnau de Vilanova), Alberto Alonso Ruiz (Hospital de Cruces), Gabriel Herrero-Beaumont (Clínica Nuestra Sra. de La Concepción), Antonio Juan Mas (Fundación Hospital Son Llátzer), Cristina Medrano Le Quement (Hospital Internacional Medimar), María Francisca Pina Pérez (Hospital Rafael Méndez), Arturo Rodríguez de La Serna (Hospital de La Santa Creu i Sant Pau), Gaspar Pérez Lidon (Hospital del Insalud, Ceuta), Saúl Mario Gelman Aizen (Hospital General de Manresa), Eugenio Chamizo Carmona (Hospital General de Mérida), Jenaro Graña Gil (Hospital Santa Teresa), José Manuel Rodríguez Heredia (Hospital Universitario de Getafe), Roser Tuneu Valls (Centre Hari Manresa), Alfonso Corrales Martínez (Hospital Comarcal de Laredo), Miquel Sala Gómez (Hospital de Figueres), Cristina Hidalgo Calleja (Hospital de La Santísima Trinidad), Jaime Fernández Campillo (Hospital del S.V.S. Vega Baja), Xavier Suris Armangue (Hospital General de Granollers), Ana Urruticoechea Arana (H Can Misses de Ibiza), Víctor Eliseo Quevedo Vila (Hospital Comarcal de Monforte), Teresa Mariné Hernández (Hospital de L'Esperit Sant), José Miguel Ruiz Martín (Hospital de Viladecans), Francisco Pérez Torres (Hospital General de Requena), Eduardo Kanterewicz Binstock (Hospital General de Vic), Isabel Rotes Mas (Hospital de San Rafael), Juan Pablo Valdazo de Diego (Hospital General Virgen de La Concha), Josep Pujol (Hospital de Sant Pau i Santa Tecla), Gerardo Iglesias de La Torre (Hospital General Río Carrión), Verónica Pérez Guijo (Hospital Universitario Reina Sofía).