La aspergilosis pulmonar invasiva (API) se observa en pacientes inmunodeprimidos por una enfermedad oncohematológica o en receptores de un trasplante alogénico de progenitores hematopoyéticos, y, con menor frecuencia, en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
El deterioro de la actividad mucociliar, la disminución de la función de los macrófagos y neutrófilos por la acción de los esteroides y el uso de antibióticos de amplio espectro intervienen en el desarrollo de la API en los pacientes con EPOC. Tanto los pacientes colonizados como los que ya tienen API son de edad avanzada, se hallan en estadios evolucionados de EPOC (GOLD≥III) y presentan un gran número de comorbilidades. La mortalidad en estos pacientes también es alta debido a la dificultad de obtener un diagnóstico definitivo de API en la EPOC. Los principales signos clínicos y radiológicos de API son inespecíficos en la EPOC y las muestras tisulares que confirman el diagnóstico son a menudo difíciles de obtener.
El mal pronóstico de la API en pacientes con EPOC mejoraría con un diagnóstico más precoz que permitiera la pronta instauración del tratamiento apropiado. Algunas herramientas, como escalas y algoritmos basados en factores de riesgo de API, podrían ayudar al reconocimiento temprano de esta complicación en la EPOC.
Invasive pulmonary aspergillosis (IPA) is a common infection in immunocompromised patients with hematological malignancies or allogenic stem cell transplantation, and is less frequent in the context of chronic obstructive pulmonary disease (COPD).
Mucociliary activity impairment, immunosuppression due to the inhibition of alveolar macrophages and neutrophils by steroids, and receiving broad-spectrum antibiotics, play a role in the development of IPA in COPD patients. Colonized patients or those with IPA are older, with severe CODP stage (GOLD≥III), and have a higher number of comorbidities. The mortality rate is high due to the fact that having a definitive diagnosis of IPA in COPD patients is often difficult. The main clinical and radiological signs of IPA in these types of patients are non-specific, and tissue samples for definitive diagnosis are often difficult to obtain.
The poor prognosis of IPA in COPD patients could perhaps be improved by faster diagnosis and prompt initiation of antifungal treatment. Some tools, such as scales and algorithms based on risk factors of IPA, may be useful for its early diagnosis in these patients.
Bajo el nombre de «aspergilosis» se engloban una serie de cuadros clínicos de diferente gravedad en relación con el grado de inmunodepresión del paciente y el deterioro anatomofuncional pulmonar. La aspergilosis pulmonar invasiva (API) es característica de los pacientes oncohematológicos que sufren una inmunodepresión importante y prolongada, así como de los receptores de un trasplante alogénico de progenitores hematopoyéticos y de los que padecen un síndrome mielodisplásico o una leucemia aguda en tratamiento con quimioterapia de inducción48. Por el contrario, las formas crónicas con inclusión del aspergiloma se han descrito clásicamente en las afecciones pulmonares estructurales, como la enfermedad pulmonar obstructiva crónica (EPOC)14,44.
Formas crónicas de aspergilosis pulmonarAspergilomaEl aspergiloma es una bola compuesta por micelios del hongo, moco, fibrina y células inflamatorias, que se desarrolla en una cavidad pulmonar previamente formada, secundaria a tuberculosis, sarcoidosis, quistes bronquiales, ampollas, tumores o infartos pulmonares4,52. La hemoptisis es su complicación más grave y se produce por la invasión de los vasos sanguíneos superficiales4,46. El tratamiento definitivo es la extirpación quirúrgica, particularmente indicada en casos con hemoptisis no controlada. Los antifúngicos, tanto sistémicos como en instilación tópica, no han demostrado una buena eficacia29,44.
Aspergilosis necrosante crónicaLa aspergilosis necrosante crónica es un proceso destructivo pulmonar indolente que progresa lentamente en meses o años por invasión local7,14,20. Suele cursar con fiebre, tos, expectoración y pérdida de peso. Radiológicamente se presenta como un infiltrado, a menudo cavitado, localizado generalmente en los lóbulos superiores y en los segmentos superiores de los inferiores. Es característico que se acompañe de un engrosamiento de la pleura adyacente y, en la mitad de los casos, la cavidad contiene un aspergiloma7,14,20,26,44. A veces predomina la fibrosis sobre la cavitación, dando lugar a una variante radiológica denominada aspergilosis pulmonar crónica fibrosante15. Estas manifestaciones clinicorradiológicas, junto con el aislamiento de Aspergillus en muestras respiratorias en el paciente con EPOC, son muy indicativas de esta entidad clínica, aunque la confirmación requiere la observación de la invasión tisular local por el hongo en una biopsia pulmonar y el crecimiento del mismo en el cultivo44. El tratamiento se puede hacer con voriconazol intravenoso u oral o anfotericina B liposómica intravenosa12,17,27,43,44. La resección quirúrgica está indicada en las formas localizadas, en aquellas con mala respuesta, y en los casos de toxicidad o intolerancia al tratamiento antifúngico en pacientes jóvenes y con reserva funcional pulmonar aceptable7.
Aspergilosis pulmonar invasivaEn las últimas dos décadas son cada vez más frecuentes las descripciones de casos de API en los pacientes con enfermedad pulmonar estructural que han estado o están recibiendo corticoides1,10,37,41. Un estudio publicado en el año 2000 en el que se incluyeron cerca de 600 casos de API, probable o probada, puso en evidencia que el 9% de los pacientes presentaban una enfermedad pulmonar38. En una revisión de 50 trabajos publicados hasta el año 2000, con un número total de 1.941 casos, se observó que el 20% de los casos de API con resultado fatal correspondía a pacientes con enfermedad pulmonar previa31. En España la API afecta al 10-20% de los pacientes con EPOC en tratamiento con corticoides, y el número de casos ha aumentado en los últimos años22,35.
La causa del aumento de los casos de API en pacientes con EPOC no está bien precisada. Se conoce que afecta a pacientes de edad avanzada, en estadios evolucionados de la enfermedad, con comorbilidad, y que han recibido tratamientos prolongados con corticoides y antibióticos5,22,33,47,51. En la actualidad, los pacientes con EPOC tienen una mayor esperanza de vida; llegan a estados de deterioro funcional muy avanzados y precisan con más frecuencia ser tratados con esteroides y antibióticos5,22,33,47. Las deficiencias del mecanismo de drenaje mucociliar bronquial presentes en la EPOC disminuyen el aclaramiento de la vía aérea de las conidias de Aspergillus inhaladas y permiten su persistencia en el moco bronquial. Por otro lado, la disminución de la actividad de los macrófagos alveolares, en gran medida por efecto de los corticoides, no evita la germinación de las conidias, que acaban invadiendo el parénquima pulmonar30,32. Estudios histológicos han demostrado que el patrón de lesión tisular pulmonar de la API depende de la situación inmunológica del paciente y no es igual en enfermos neutropénicos que en no neutropénicos tratados con esteroides. En los primeros predomina la invasión vascular y la hemorragia alveolar, mientras que en los segundos predominan la infiltración de neutrófilos y monocitos y la necrosis inflamatoria. El tipo de lesión histológica explica las imágenes radiológicas (infiltrados y nódulos sin signo del halo) observadas en los pacientes con EPOC que reciben corticoides45.
La mortalidad de los pacientes con EPOC y API es muy elevada y puede llegar incluso a superar la mortalidad de los pacientes neutropénicos con API. En un estudio en el que se comparó la API en enfermos neutropénicos con aquella en no neutropénicos, los pacientes con enfermedades pulmonares crónicas tenían una mortalidad del 89%, frente al 59% de los hematológicos13. Asimismo, los pacientes con EPOC y API tienen una mortalidad significativamente superior a la observada en los que no sufren esta complicación22. La razón de esta elevada mortalidad está en parte relacionada con el retraso en el diagnóstico e instauración del tratamiento11,50.
La API en el paciente con EPOC suele cursar con tos productiva, hemoptisis, afección del estado general, pérdida de peso y disnea. Ocasionalmente puede observarse fiebre y sudoración nocturna. El diagnóstico se establece a menudo después de varios meses de evolución, dado lo inespecífico del cuadro clínico5,11,22,33,42,47,51. La posible existencia de API se debe sospechar en todo paciente con EPOC reagudizada que no mejora a pesar de un tratamiento antibiótico adecuado y del empleo de dosis altas de esteroides, especialmente si se observa la aparición de un infiltrado en la placa de tórax, a menudo localizado en los vértices pulmonares, o si se aísla Aspergillus en el esputo50.
Desde el punto de vista de la imagen radiológica, los hallazgos no son específicos de API en los pacientes con EPOC. Los signos más frecuentes son la aparición de infiltrados y nódulos, en general sin halo ni presencia de aire en semiluna, en correspondencia con las alteraciones histológicas antes descritas5,11,22,33,42,47,51.
La obtención de muestras respiratorias (esputo, aspirado endotraqueal, lavado broncoalveolar [LBA] o biopsia pulmonar) para el aislamiento de Aspergillus siempre es recomendable en estos pacientes, como lo aconsejan las últimas guías de la SEPAR34. El examen directo del esputo permite detectar el hongo con rapidez con una sensibilidad de casi el 50%28, que alcanza el 90% si se usan técnicas de fluorescencia2. Un cultivo positivo no distingue colonización de infección, si bien la probabilidad de API aumenta conforme hay más muestras positivas21,25,36. En un estudio en el que se valoraba la carga y el significado de aislamientos de Aspergillus fumigatus en un laboratorio de microbiología, se observó que la probabilidad de API con el aislamiento en una única muestra era del 5,85%, con el aislamiento en dos muestras, del 18,42%, y con tres, del 38,23% (p<0,001)9. Por el contrario, un cultivo negativo no excluye API11,28,39. La práctica de una fibrobroncoscopia para la obtención de LBA o biopsias puede ser difícil de realizar en los pacientes con EPOC con mala función pulmonar11. La positividad del cultivo del LBA oscila entre el 46 y el 77%, y tampoco permite diferenciar la colonización de la infección11,28. El diagnóstico definitivo de API solo se obtiene con la biopsia, pero el rendimiento es variable: 50-100%3,6,11,28,49.
La determinación del antígeno galactomanano en suero en los pacientes con EPOC tiene una menor utilidad que en el paciente neutropénico, ya que la sensibilidad y especificidad son del 41-93% y del 85-95%, respectivamente23,40. Sin embargo, es más rentable cuando se determina en el LBA (sensibilidad 88,9% y especificidad 100%)24.
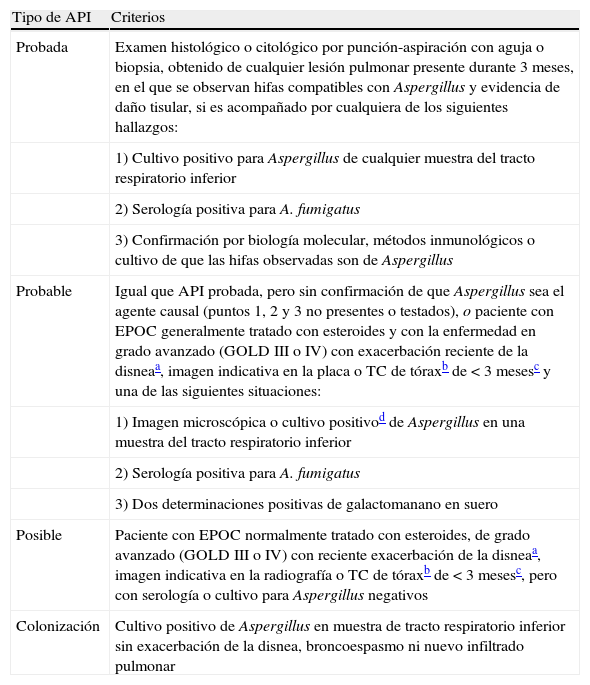
La European Organization for Research and Treatment of Cancer y el Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group han establecido recomendaciones precisas para el diagnóstico de la API (posible, probable y probada) en los pacientes neutropénicos, basadas en criterios de situación del paciente, clínicos y micológicos16, que no son aplicables a los pacientes con EPOC por ausencia de algunos de ellos (riesgo de infección, signo del halo y determinación de antígeno galactomanano en sangre). Con la finalidad de mejorar el pronóstico de la API con una sospecha diagnóstica temprana, Bulpa et al. han propuesto una clasificación de la API en los pacientes con EPOC basada en una revisión de la literatura (tabla 1)11 que, a pesar de no haberse validado, ya se ha aplicado en algunos estudios5,22,33,47,51.
Definición de aspergilosis pulmonar invasiva en paciente con enfermedad pulmonar obstructiva crónica
| Tipo de API | Criterios |
| Probada | Examen histológico o citológico por punción-aspiración con aguja o biopsia, obtenido de cualquier lesión pulmonar presente durante 3 meses, en el que se observan hifas compatibles con Aspergillus y evidencia de daño tisular, si es acompañado por cualquiera de los siguientes hallazgos: |
| 1) Cultivo positivo para Aspergillus de cualquier muestra del tracto respiratorio inferior | |
| 2) Serología positiva para A. fumigatus | |
| 3) Confirmación por biología molecular, métodos inmunológicos o cultivo de que las hifas observadas son de Aspergillus | |
| Probable | Igual que API probada, pero sin confirmación de que Aspergillus sea el agente causal (puntos 1, 2 y 3 no presentes o testados), o paciente con EPOC generalmente tratado con esteroides y con la enfermedad en grado avanzado (GOLD III o IV) con exacerbación reciente de la disneaa, imagen indicativa en la placa o TC de tóraxb de<3 mesesc y una de las siguientes situaciones: |
| 1) Imagen microscópica o cultivo positivod de Aspergillus en una muestra del tracto respiratorio inferior | |
| 2) Serología positiva para A. fumigatus | |
| 3) Dos determinaciones positivas de galactomanano en suero | |
| Posible | Paciente con EPOC normalmente tratado con esteroides, de grado avanzado (GOLD III o IV) con reciente exacerbación de la disneaa, imagen indicativa en la radiografía o TC de tóraxb de<3 mesesc, pero con serología o cultivo para Aspergillus negativos |
| Colonización | Cultivo positivo de Aspergillus en muestra de tracto respiratorio inferior sin exacerbación de la disnea, broncoespasmo ni nuevo infiltrado pulmonar |
Fuente: Bulpa et al.11
API: aspergilosis pulmonar invasiva; GOLD: Global Initiative for Chronic Obstructive Lung Disease; TC: tomografía computarizada.
Exacerbación de disnea o broncoespasmo resistente a un tratamiento apropiado con inclusión de antibióticos.
Lesión pulmonar sin respuesta a tratamiento antibiótico apropiado (dosis, ruta, espectro y actividad).
Como puede deducirse por todo lo anteriormente descrito, tanto el diagnóstico clínico de la API en la EPOC como la distinción entre colonización e infección ante el aislamiento de Aspergillus en una muestra respiratoria son difíciles de hacer de forma precoz. Por tanto, el inicio del tratamiento a menudo debe hacerse de forma empírica, basándose en el aislamiento de un hongo filamentoso en esputo junto con la presencia de factores predisponentes para API: pacientes con EPOC evolucionada en grado GOLD≥III, comorbilidad importante, uso previo de corticoides y antibióticos, estancia en una unidad de cuidados intensivos, presencia de cavidades pulmonares en la radiografía o TC de tórax y empeoramiento clínico o radiológico a pesar de un tratamiento antibiótico adecuado y el uso de esteroides5,22,51.
Si se considera este conjunto de datos, es recomendable la búsqueda de Aspergillus en muestras respiratorias de pacientes con EPOC avanzada y con comorbilidad. A partir de aislamientos de A. fumigatus se ha desarrollado una escala para determinar la probabilidad de API teniendo en cuenta varios parámetros, pero esta no es aplicable a los pacientes con EPOC por estar determinada para la población general9. También se han propuesto algoritmos diagnósticos con este mismo objetivo en el paciente crítico19,49, alguno de los cuales se ha llegado a validar, y que muestra en la EPOC un valor predictivo positivo del 45% (prevalencia de API de un 20%) al 77% (prevalencia de API de un 50%), y un valor predictivo negativo del 100%8.
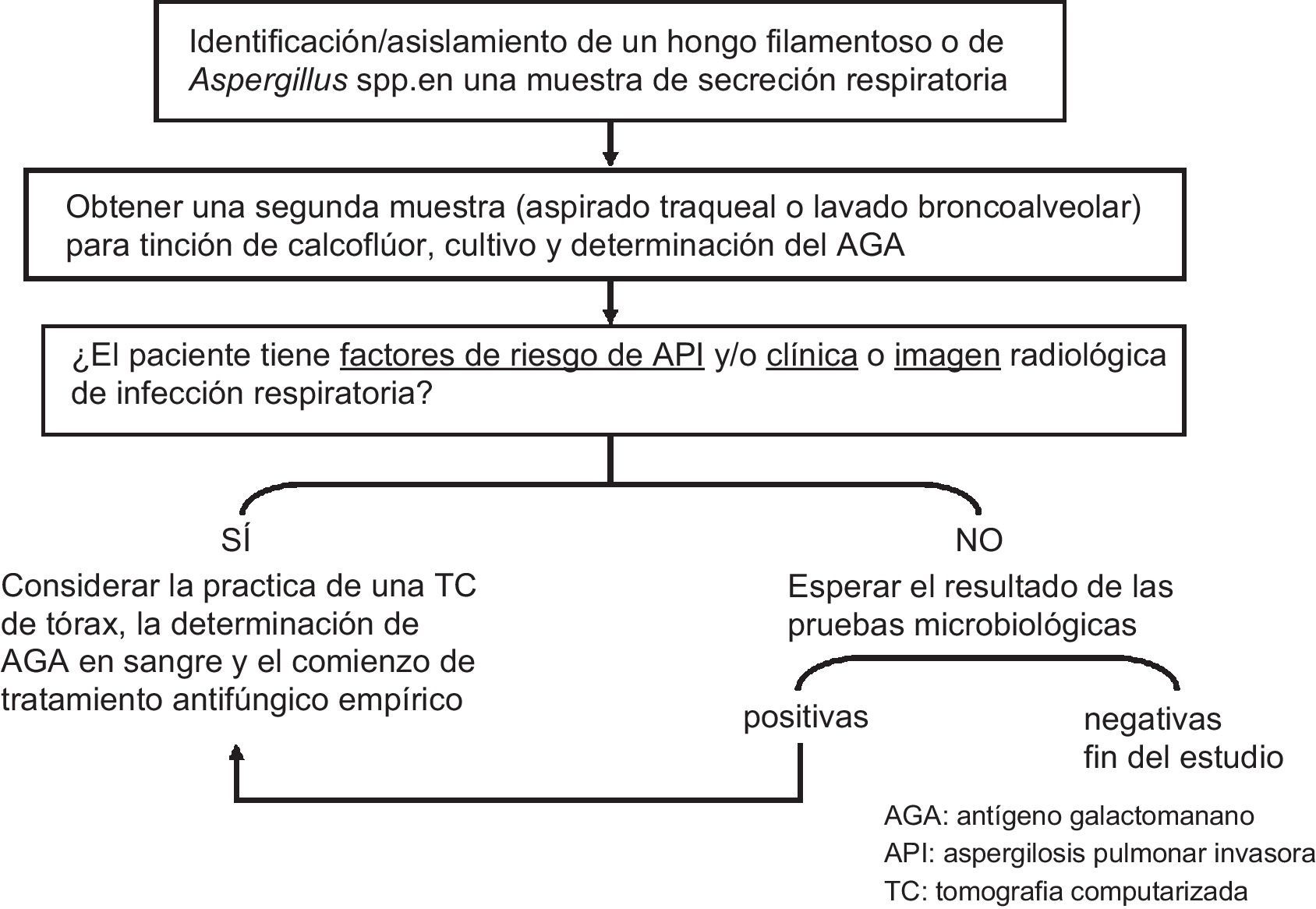
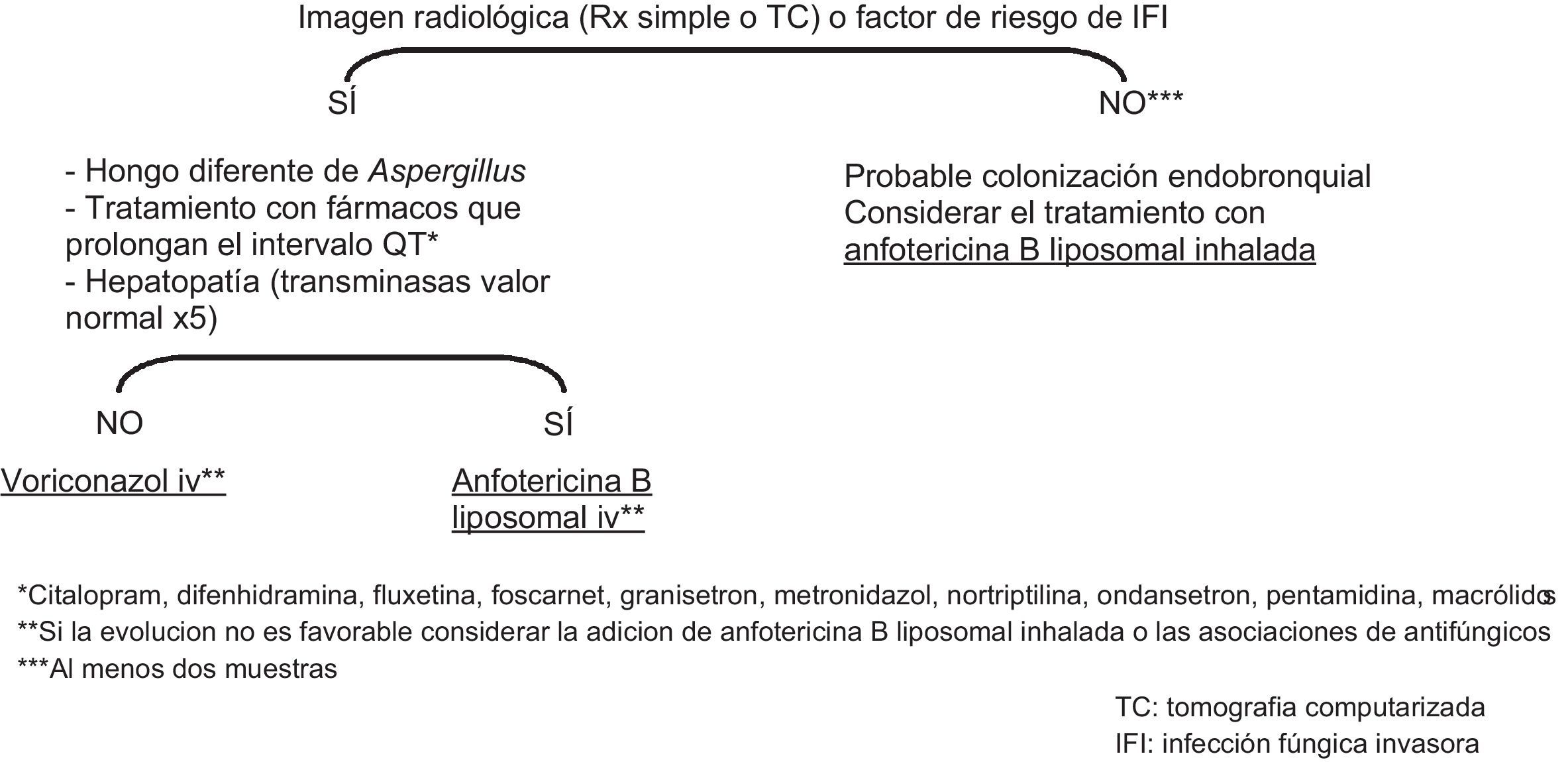
En el paciente con EPOC, el aislamiento de Aspergillus en el cultivo de una muestra respiratoria debe confirmarse con la obtención de otras muestras para cultivo, tinción con calcoflúor y, eventualmente, determinación del antígeno galactomanano en LBA. Además, si el paciente tiene factores de riesgo de API o clínica o imagen radiológica de infección respiratoria debe considerarse la realización de una TC de tórax, la determinación de galactomanano en suero y el inicio de tratamiento antifúngico empírico (fig. 1). El tratamiento debe realizarse con voriconazol. En caso de aislamiento de un hongo filamentoso distinto de Aspergillus, o de toxicidad o interferencia con el metabolismo de otros fármacos, el voriconazol puede sustituirse por anfotericina B liposómica. Si la evolución no es favorable puede considerarse la adición de anfotericina B liposómica inhalada, aunque esta indicación no está bien establecida18. Si las nuevas muestras respiratorias fueran negativas (al menos dos), probablemente se trate de una colonización bronquial o de una contaminación sin significado clínico. En caso de colonización bronquial en el paciente con EPOC avanzada en tratamiento con corticoides puede considerarse la conveniencia de instaurar tratamiento/profilaxis con anfotericina B liposómica inhalada, hasta la negativización del esputo (fig. 2). No se ha establecido la duración precisa del tratamiento, aunque se recomienda mantenerlo hasta la desaparición de la clínica y la mejoría radiológica al menos de 6 y 12 semanas19.