Las enfermedades fúngicas invasoras causadas por Scedosporium, Fusarium o mucorales (Rhizopus, Mucor o Lichtheimia) han aumentado en frecuencia y gravedad en las últimas décadas, especialmente en pacientes inmunodeprimidos. Aunque estas micosis profundas son menos frecuentes que las causadas por el género Aspergillus, suelen ser más virulentas y difíciles de tratar debido a su resistencia a la mayoría de los fármacos disponibles y también al tipo de paciente, hematológico o receptor de trasplante de órgano sólido, a los que generalmente afectan.
Los nuevos protocolos de trasplante que incluyen nuevos y más potentes fármacos inmunosupresores, y el uso frecuente de profilaxis antifúngica en estos pacientes, junto con el cambio de ciertos nichos ecológicos, puede explicar el mayor número de aislamientos de estos hongos filamentosos en pacientes inmunodeprimidos. Estos hongos patógenos también pueden afectar a individuos inmunocompetentes, especialmente después de catástrofes naturales (terremotos, maremotos, inundaciones), heridas de combate en conflictos armados o semiahogamientos.
Todas las infecciones profundas causadas por Scedosporium, Fusarium y los mucorales son muy graves y potencialmente mortales. La buena evolución de los pacientes se relaciona con un diagnóstico rápido (mediante visión microscópica directa de las muestras de lesiones biopsiadas), tratamiento antifúngico precoz (muchas veces combinando dos o más fármacos), amplia limpieza quirúrgica de las lesiones accesibles y la recuperación del estado inmunitario del paciente, sobre todo de su neutropenia.
The number of emerging organisms causing invasive fungal infections has increased in the last decades. These etiological agents include Scedosporium, Fusarium and mucorales. All of them can cause disseminated, virulent, and difficult-to treat infections in immunosuppressed patients, the most affected, due to their resistance to most available antifungal agents.
Current trends in transplantation including the use of new immunosuppressive treatments, the common prescription of antifungal agents for prophylaxis, and new ecological niches could explain the emergence of these fungal pathogens. These pathogens can also affect immunocompetent individuals, especially after natural disasters (earthquakes, floods, tsunamis), combat wounds or near drowning.
All the invasive infections caused by Scedosporium, Fusarium, and mucorales are potentially lethal and a favourable outcome is associated with rapid diagnosis by direct microscopic examination of the involved tissue, wide debridement of infected material, early use of antifungal agents including combination therapy, and an improvement in host defenses, especially neutropenia.
El número de microorganismos causantes de enfermedad fúngica invasora (EFI) aumenta constantemente. Aunque los géneros Candida y Aspergillus son los más frecuentemente implicados, otros patógenos emergentes, que incluyen levaduras, hongos hialinos, hongos dematiáceos y mucorales, se aíslan cada vez con más asiduidad. Estos nuevos patógenos causan infecciones en la piel, los tejidos blandos, los huesos, las articulaciones, los senos nasales y también infecciones generalizadas o localizadas muy graves como peritonitis, neumonías, lesiones cerebrales o incluso fungemia, en función de las condiciones previas de los pacientes y de las características del hongo.
Las EFI causadas por especies de Scedosporium, Fusarium o mucorales (Mucor, Rhizopus o Lichtheimia —antes Absidia—) han aumentado en frecuencia y gravedad en los últimos años, especialmente en los pacientes inmunodeprimidos. Aunque estas EFI son menos frecuentes que las causadas por el género Aspergillus, suelen ser más virulentas y difíciles de tratar debido a su resistencia a la mayoría de los antifúngicos disponibles y también al tipo de paciente, hematológico o receptor de trasplante de órgano sólido (TOS), a los que generalmente afectan.
El hábitat natural de estos mohos es el suelo, el agua y la materia orgánica en descomposición, y aunque su puerta de entrada habitual es la vía inhalatoria no son infrecuentes las infecciones sistémicas debidas a la ingestión, traumatismos o contaminación de heridas por conidias o esporangiosporas ambientales. Por tanto, ciertas ocupaciones o estilos de vida pueden exponer a los pacientes a un riesgo potencial de adquisición de estos patógenos ambientales: construcción o demolición de edificios, trabajos agrícolas, limpieza con arena a presión, manipulación de filtros de aire acondicionado, etc. Además, las heridas ocurridas en combates o durante catástrofes naturales como inundaciones, terremotos, tornados y tsunamis incrementan notablemente el riesgo de infección por mucorales, Scedosporium o Fusarium18,32.
Enfermedad fúngica invasora por Scedosporium y PseudallescheriaScedosporium prolificans y Scedosporium apiospermum han sido las únicas especies reconocidas del género Scedosporium (también denominado Lomentospora) hasta hace pocos años, pero recientes estudios moleculares han demostrado que S. apiospermum es realmente un complejo compuesto de ocho especies: Scedosporium boydii (teleomorfo Pseudallescheria boydii), Scedosporium apiospermum (teleomorfo Pseudallescheria apiosperma), Pseudallescheria ellipsoidea, Pseudallescheria angusta, Pseudallescheria fusoidea, Pseudallescheria minutispora, Scedosporium dehoogi y Scedosporium aurantiacum8,9. La diferenciación entre las especies del complejo es difícil y su correcta identificación debe hacerse mediante técnicas de secuenciación de ADN.
S. prolificans, aunque relacionado con las anteriores especies, es un hongo dematiáceo filogenéticamente cercano al género Petriella. Ocasiona infecciones diseminadas con una elevada mortalidad debido a su especial virulencia y resistencia a casi todos los antifúngicos disponibles25. Curiosamente, la mayoría de las EFI por S. prolificans se han descrito en la Península Ibérica, California, Reino Unido y Australia, desconociéndose las causas de esta peculiar distribución geográfica.
Las especies de Scedosporium y Pseudallescheria se encuentran habitualmente en el suelo y el agua contaminada, incluso en ambientes urbanos; por tanto, la inhalación de conidias y el contacto con aguas residuales suelen ser las vías de exposición más habituales. S. apiospermum y S. prolificans son hongos oportunistas que causan EFI con similar patogenia, manifestaciones clínicas y gravedad. Pueden colonizar superficies o cavidades corporales originando infecciones locales o diseminadas con tendencia a invadir el sistema nervioso central (SNC). En la tabla 1 se resumen las manifestaciones clínicas de las principales especies del género Scedosporium26.
Manifestaciones clínicas de las principales especies del género Scedosporium
| S. apiospermum | S. prolificans | |
| Colonización | Oído externoTraqueobronquial (fibrosis quística)Bola fúngica pulmonar o paranasalHeridas | |
| Infección local | MicetomaPiel y partes blandasArtritis y osteomielitisQueratitis | Artritis y osteomielitisQueratitisHerida quirúrgicaOnicomicosis |
| Infección profunda | SinusitisNeumoníaMeningitis y abscesos SNCEndoftalmitisDiseminación multiórgánica | EndoftalmitisEndocarditis (válvula nativa o protésica)NeumoníaDiseminación multiórgánica, especialmente al SNC |
Adaptado de San Juan et al.26.
Las infecciones por S. apiospermum suelen ser secundarias a inhalación de conidias, traumatismos o heridas penetrantes (contaminadas con tierra, estiércol o aguas residuales), cirugía o procedimientos instrumentales (raquianestesia) e inmersión en aguas contaminadas. Por tanto, el árbol respiratorio, incluyendo los senos nasales y paranasales, y la piel son el origen de la mayoría de las EFI causadas por Scedosporium, aunque la infección suele diseminarse afectando numerosos órganos y localizaciones: huesos, articulaciones, cerebro, ojos, oídos, etc.
Las EFI por estos hongos se diagnostican, sobre todo, en pacientes inmunodeprimidos, mayoritariamente oncohematológicos, pacientes tratados con corticoides, receptores de trasplante de progenitores hematopoyéticos (TPH) y TOS; entre estos últimos, los receptores de trasplante pulmonar son los más afectados en nuestro entorno, ya que los pacientes con fibrosis quística están muy frecuentemente colonizados por Scedosporium antes de ser trasplantados.
Formas clínicas de presentaciónLas infecciones por Scedosporium y Pseudallescheria desarrollan diferentes formas clínicas según el tipo de paciente afectado y la puerta de entrada. Las más habituales pueden encuadrarse en cuatro presentaciones: a) micetoma; b) infección oportunista; c) infección no oportunista; y d) infección en pacientes con semiasfixia por inmersión4.
MicetomaEste síndrome clínico caracterizado por afectación cutánea, subcutánea, articular y ósea está causado por bacterias u hongos habituales del suelo. Entre los hongos, P. boydii es el agente causal más frecuente en climas templados y subtropicales y Madurella mycetomatis en zonas tropicales. Se observa, sobre todo, en población inmunocompetente de zonas rurales (agricultores o ganaderos) expuesta a pequeños traumatismos penetrantes o heridas causadas por espinas o astillas en áreas corporales descubiertas (brazos, piernas o pies descalzos)4.
Infección oportunistaSe observa en pacientes inmunodeprimidos (infección por VIH, enfermedad granulomatosa crónica, neoplasias hematológicas, receptores de TOS y TPH o en tratamiento con antineoplásicos, corticoides u otros inmunosupresores), y causa generalmente afectación pulmonar, de tejidos blandos o, incluso, ósea. S. apiospermum suele ser el agente causal más frecuentemente aislado, aunque cada vez se comunican más episodios de EFI en estos pacientes causados por S. prolificans, muchos de ellos con aislamiento de S. prolificans en el hemocultivo25. Habitualmente, la escedosporiosis pulmonar se observa tardíamente en receptores de TOS; sin embargo, en los receptores de TPH es más temprana: antes del prendimiento del injerto, durante la recuperación de la neutropenia o durante el tratamiento de la enfermedad del injerto contra el huésped (EICH). La mortalidad en estos pacientes es muy elevada (54-91%) y se relaciona con la diseminación de la infección, neutropenia prolongada o el ingreso en UCI12.
Infección no oportunistaAunque el tracto respiratorio (inferior y superior) constituye el lugar de colonización más habitual de estos hongos, la tasa de prevalencia de Scedosporium y Pseudallescheria como constituyente habitual de la flora en personas sanas es desconocida. En nuestro medio, S. apiospermum y S. prolificans son colonizadores frecuentes del tracto respiratorio de los pacientes con fibrosis quística, originando una sintomatología similar a la de la aspergilosis broncopulmonar alérgica. Además, estos hongos también son agentes causales de queratitis, endoftalmitis, sinusitis, meningitis, artritis, osteomielitis, endocarditis, e infecciones subcutáneas y diseminadas en pacientes inmunocompetentes o inmunodeprimidos tras la inoculación de conidias por traumatismos penetrantes, cirugía, catéteres intravasculares, punciones lumbares o inhalación4.
Síndrome de asfixia por inmersiónEn pacientes inmunocompetentes que han sufrido inmersión prolongada accidental en aguas contaminadas, o tras tsunamis, y que han sobrevivido, se ha descrito un síndrome clínico de infección sinopulmonar y afectación del SNC causado por P. boydii/S. apiospermum, que es el hongo filamentoso más frecuentemente implicado en EFI tras cuadros de asfixia por inmersión (a diferencia de S. prolificans que no ha sido asociado hasta la fecha con víctimas de semiahogamiento). La infección por P. boydii después de un cuadro de asfixia por inmersión suele ocurrir en personas previamente sanas y podría estar relacionada con la hipoxia causada por el ahogamiento, o por el uso de corticoides para el tratamiento de la neumonía por aspiración tan habitual en estos casos. Se observa pocos días después del incidente, a menudo tras una mejoría pasajera del paciente. Las manifestaciones clínicas son muy variables pero suelen incluir fiebre, cefalea, alteración de la conciencia, convulsiones y signos piramidales; la presencia de hidrocefalia o edema cerebral agrava notablemente el pronóstico de estos pacientes. P. boydii puede ser aislado en las secreciones respiratorias y en el líquido cefalorraquídeo (LCR), pero en la mayoría de los casos se aísla en el material drenado (por aspiración o cirugía) de los abscesos sinusales y cerebrales4. El diagnóstico diferido de la mayoría de los episodios, y la carencia de antifúngicos con suficiente penetración en el SNC y actividad frente a P. boydii, explican el sombrío pronóstico de estos pacientes, cuya tasa de supervivencia no supera el 33%.
TratamientoLas EFI por Scedosporium son difíciles de tratar y resultan frecuentemente fatales. Incluso en pacientes inmunocompetentes su tratamiento muchas veces requiere la exéresis quirúrgica de los tejidos afectados, además de la terapia antifúngica.
Las equinocandinas, en solitario, no son activas frente a estos hongos y el voriconazol y la anfotericina B presentan una actividad variable sobre ellos. Por tanto, el uso combinado de antifúngicos es la opción terapéutica más recomendada. Tanto en estudios in vitro como en la práctica clínica el uso combinado de voriconazol más terbinafina, voriconazol más micafungina o anfotericina B más micafungina han demostrado tener actividad sinérgica y eficacia clínica frente a S. apiospermum y S. prolificans4.
Enfermedad fúngica invasora por FusariumDespués de la aspergilosis, la fusariosis es la segunda causa de infección por hongos filamentosos. En pacientes inmunocompetentes la queratitis postraumática y la onicomicois son las formas clínicas más habituales de fusariosis. La fusariosis diseminada es particularmente frecuente en pacientes receptores de TPH alogénico y en receptores de trasplante pulmonar, debido a la profunda inmunosupresión o a la prolongada neutropenia a la que son sometidos.
EpidemiologíaAunque las diferentes especies de Fusarium son cosmopolitas, pudiendo ser recuperadas de muestras ambientales (suelo, plantas, materia orgánica, etc.) o conducciones de agua (grifos, duchas, lavabos, etc.), la fuente de infección suele ser extrahospitalaria22. La mayoría de las EFI por Fusarium se adquieren por inhalación de conidias; no obstante, el mayor tamaño de las mismas (comparadas con las de Aspergillus) hace que este mecanismo de trasmisión sea más infrecuente que en la aspergilosis10.
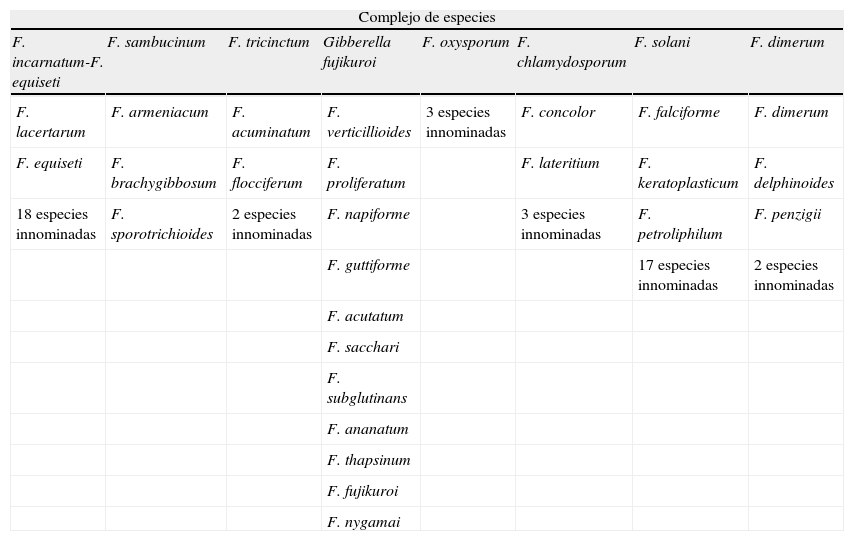
De las más de 200 especies que integran el género Fusarium tan solo unas 70 especies han sido relacionadas con infección en el ser humano y los animales. Las técnicas de secuenciación molecular han permitido reubicar taxonómicamente estas especies en varios complejos de especies: Fusarium solani, Fusarium oxysporum, Fusarium dimerum, Fusarium chlamydosporum, Fusarium incarnatum, Fusarium sambucinum, Fusarium tricinctum y Gibberella fujikuroi. Sin embargo, la mayoría de las fusariosis humanas están causadas tan solo por cuatro especies: Fusarium petroliphilum y Fusarium keratoplasticum (pertenecientes a F. solani) y dos especies innominadas, una de F. dimerum y otra de F. oxysporum (tabla 2)10.
Especies del género Fusarium patógenas para el ser humano agrupadas por complejos de especies
| Complejo de especies | |||||||
| F. incarnatum-F. equiseti | F. sambucinum | F. tricinctum | Gibberella fujikuroi | F. oxysporum | F. chlamydosporum | F. solani | F. dimerum |
| F. lacertarum | F. armeniacum | F. acuminatum | F. verticillioides | 3 especies innominadas | F. concolor | F. falciforme | F. dimerum |
| F. equiseti | F. brachygibbosum | F. flocciferum | F. proliferatum | F. lateritium | F. keratoplasticum | F. delphinoides | |
| 18 especies innominadas | F. sporotrichioides | 2 especies innominadas | F. napiforme | 3 especies innominadas | F. petroliphilum | F. penzigii | |
| F. guttiforme | 17 especies innominadas | 2 especies innominadas | |||||
| F. acutatum | |||||||
| F. sacchari | |||||||
| F. subglutinans | |||||||
| F. ananatum | |||||||
| F. thapsinum | |||||||
| F. fujikuroi | |||||||
| F. nygamai | |||||||
Adaptado de Guarro10.
Las manifestaciones clínicas de la fusariosis dependen de la puerta de entrada de la infección, del grado de inmunosupresión y también de la enfermedad de base, variando desde infecciones superficiales a localizadas o diseminadas.
Entre las infecciones localizadas en pacientes inmunocompetentes destacan la endoftalmitis (generalmente secundaria a queratitis postraumática o cirugía ocular), la sinusitis alérgica o crónica (no invasora), la neumonía nodular o cavitaria, las lesiones cutáneas (habitualmente por inoculación postraumática) y la onicomicosis.
Las infecciones diseminadas son las fusariosis más habituales en pacientes inmunodeprimidos, afectan a múltiples órganos (pulmón, piel, tubo digestivo, hígado, bazo, corazón, riñón y SNC) y suelen cursar con fiebre persistente y lesiones metastásicas cutáneas muy pleomorfas (nódulos, úlceras) que pueden evolucionar hacia necrosis central19.
DiagnósticoEl diagnóstico de EFI por Fusarium debe confirmarse mediante el aislamiento del agente causal en las biopsias de las lesiones cutáneas o en el hemocultivo, ya que a diferencia de la aspergilosis Fusarium puede aislarse en sangre hasta en el 50% de los episodios de fusariosis diseminada20. Sin embargo, la presencia de fungemia debe considerarse como predictor de mala evolución, pues obedece a la diseminación sistémica de un inóculo fúngico muy elevado.
La radiología e histopatología no ofrecen gran ayuda al diagnóstico de fusariosis diseminada debido a la escasa especificidad que ofrecen, pudiendo confundirse sus hallazgos con otras micosis profundas que precisan abordajes terapéuticos muy diferentes, como la aspergilosis. Actualmente, la utilidad diagnóstica de métodos microbiológicos independientes del cultivo (como la detección de β-glucano o galactomano) es controvertida y los resultados publicados llegan a ser contradictorios20,30, por lo que son necesarios más estudios para poder generalizar, o no, su recomendación.
TratamientoComo en toda EFI, siempre que sea posible, debe realizarse la escisión quirúrgica o desbridamiento de las lesiones accesibles como adyuvante imprescindible del tratamiento farmacológico.
Hasta la fecha no se ha realizado ningún ensayo clínico para evaluar diferentes opciones de tratamiento antifúngico en la EFI por especies de Fusarium. Además, la respuesta a los antifúngicos de las diferentes especies es desconocida, ya que en la mayoría de los casos publicados la especie no se ha identificado o la identificación es dudosa. Sin embargo, los estudios de actividad in vitro y en modelos animales coinciden en la elevada resistencia de las diferentes especies a la mayoría de los antifúngicos disponibles, con mínimas diferencias entre especies.
El voriconazol, la anfotericina B y el posaconazol son los antifúngicos que han demostrado más actividad y eficacia en el tratamiento de la fusariosis diseminada, aunque, en general, la respuesta clínica a los mismos debe considerarse como moderada y siempre en función del grado de neutropenia o situación de inmunosupresión de los pacientes. Esta pobre respuesta a los antifúngicos en monoterapia ha favorecido al uso de tratamientos combinados, aunque la experiencia clínica acumulada hasta la fecha es muy escasa y nunca con diferencias estadísticas demostradas14. Por consiguiente, se requiere mayor información para recomendar cualquiera de los regímenes de combinación ensayados, tan solo avalados por los estudios de sinergia in vitro. La anfotericina B liposomal (AmB-L) más el voriconazol, AmB-L más posaconazol, AmB-L más caspofungina, o el voriconazol junto a las equinocandinas han sido las combinaciones antifúngicas ensayadas (y publicadas) con tasas de supervivencia variables, pero siempre modestas.
Debido al mal pronóstico asociado a la fusariosis, la prevención de la misma es fundamental en pacientes inmunodeprimidos con alto riesgo de infección. Por ello, se recomienda insistentemente el uso de habitaciones con filtros HEPA y presión positiva, la limpieza exhaustiva de duchas y baños, así como la evaluación y tratamiento de lesiones cutáneas (particularmente onicomicosis) antes del inicio de la terapia antineoplásica o el trasplante.
A pesar de todos los esfuerzos terapéuticos, la mortalidad de la fusariosis diseminada sigue siendo muy elevada (superior al 50%) y la recuperación de la neutropenia continúa siendo la clave para la buena evolución de los pacientes. Todos los aspectos comentados de la fusariosis han sido englobados en una reciente publicación donde se incluye una de las series más amplias de un solo centro (26 casos) y una revisión de 97 casos previamente publicados17. En esta nueva serie, la mortalidad de las formas diseminadas es elevada (50%), pero inferior a la de series anteriores (70-90%). Los autores inciden en lo frecuente que es detectar a este hongo filamentoso en el hemocultivo (82% positivos en formas diseminadas) y lo habitual de las formas cutáneas, cómo F. solani sigue siendo la especie más frecuentemente aislada y la utilidad del voriconazol o la anfotericina B en formulación lipídica, con o sin cirugía, en el tratamiento.
MucormicosisLas mucormicosis engloban las infecciones causadas tanto por hongos mucorales como por entomoftorales. Los mucorales son hongos cosmopolitas con gran capacidad para invadir los vasos sanguíneos y, a través de ellos, diseminarse rápidamente por órganos y estructuras adyacentes. Su rapidez para invadir tejidos y diseminarse por los vasos sanguíneos (angioinvasión) es una de las causas de la alta tasa de mortalidad (>90%) que originan15. Los mucorales suelen producir infección orbitorrinocerebral, pulmonar, cutánea o diseminada, y su desarrollo se ve favorecido por ciertas enfermedades de base, como la diabetes mal controlada o la insuficiencia renal crónica, o factores de riesgo (neutropenia, inmunosupresión, estados de sobrecarga de hierro, acidosis metabólica). Por su parte, los entomoftorales son hongos de distribución tropical o subtropical que producen infecciones crónicas, habitualmente subcutáneas, sin invasión de vasos sanguíneos.
Debido a la gran velocidad de crecimiento y capacidad invasora de estos hongos el diagnóstico precoz de la mucormicosis es clave para asegurar el éxito terapéutico. Por lo tanto, ante la mínima sospecha debe biopsiarse cualquier lesión sospechosa y enviarse urgentemente la muestra al laboratorio de microbiología para su examen microscópico directo y posterior cultivo micológico.
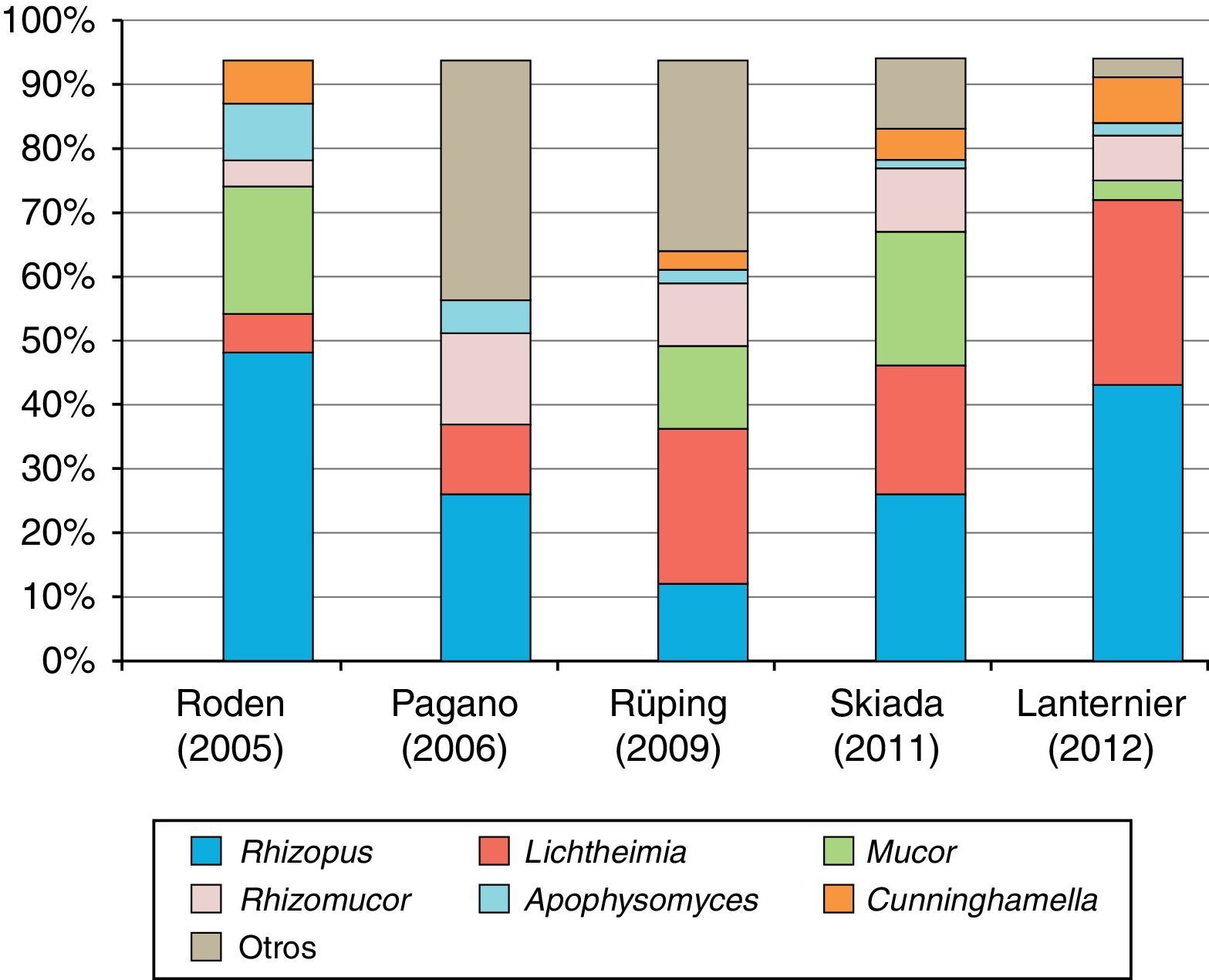
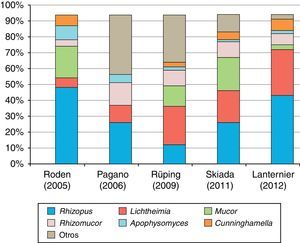
Agentes causalesEn la figura 1 se ilustra la distribución de las especies causales de mucormicosis en los últimos estudios epidemiológicos publicados. Rhizopus oryzae y Rhizopus rhizopodiformis son los mucorales más frecuentemente aislados en el ser humano. Son hongos cosmopolitas, cuyo hábitat natural es el suelo, la madera y otros restos orgánicos. Producen, sobre todo, infecciones rinocerebrales, orbitosinusales o pulmonares, secundarias a la inhalación de esporas, aunque también se han descrito infecciones locales por inoculación percutánea o de tracto digestivo por ingestión repetida de esporas23.
Lichtheimia (antes Absidia) corymbifera es una especie de amplia distribución considerada el tercer agente de la mucormicosis humana. Se aísla habitualmente en el suelo y en detritus vegetales, y puede causar infecciones cerebrales, pulmonares o renales, así como infecciones cutáneas, previa inhalación o implantación traumática de las esporas.
Cunninghamella bertholletiae es una especie cosmopolita aislada en el suelo y en la materia orgánica animal y vegetal. Produce infecciones diseminadas, sobre todo en pacientes oncohematológicos, previa inhalación de sus esporas.
Saksenaea vasiformis se aísla en suelos tropicales y se ha descrito como causa de infecciones subcutáneas, óseas y diseminadas en esas latitudes. Afecta tanto a personas inmunodeprimidas como a inmunocompetentes.
EpidemiologíaTodas las especies de mucorales producen abundantes esporas que son fácilmente difundidas mediante aerosoles, mecanismo por el que estos hongos se dispersan causando colonizaciones o infecciones sinopulmonares en los huéspedes expuestos y en riesgo. Aunque las esporangiosporas son las formas infecciosas típicas de la mucormicosis, las hifas angioinvasoras son las causantes de la invasión tisular y de la diseminación en condiciones favorables de pH, concentración de hierro y defectos en la inmunidad celular21.
La mayoría de las mucormicosis se adquieren en la comunidad; sin embargo, su adquisición nosocomial y algunos pseudobrotes hospitalarios han sido relacionados con vendajes, agujas o depresores linguales contaminados. Los factores de riesgo subyacentes más frecuentemente relacionados con el desarrollo de mucormicosis invasora son la diabetes mellitus mal controlada y la acidosis metabólica, la administración de corticoides e inmunosupresores en receptores de TPH o TOS, las quemaduras extensas y los traumatismos penetrantes, la neutropenia profunda y persistente, así como las terapias con quelantes del hierro (deferoxamina) en pacientes sometidos a hemodiálisis o transfusiones de sangre repetidas. En un estudio epidemiológico francés sobre mucormicosis, realizado en 2005-2007 y recientemente publicado13, los pacientes hematológicos representaron el 50% de los casos, seguidos de pacientes con diabetes mellitus (23%) o con traumatismos (18%).
Los hongos mucorales también pueden causar EFI en adictos a drogas por vía parenteral debido a la sistemática y parafernalia de la propia drogadicción. Además, en un número no despreciable de casos la mucormicosis cutánea o postraumática se desarrolla en pacientes sin enfermedad subyacente, o asociada a catástrofes naturales como tornados, inundaciones o tsunamis33.
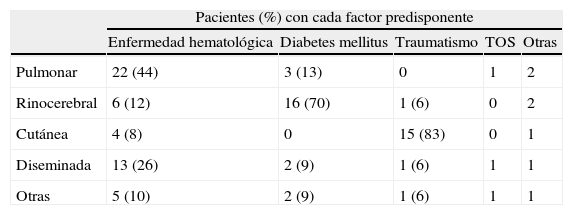
Formas clínicasEn una de las series más amplias de mucormicosis publicadas, con 929 pacientes analizados, los principales factores predisponentes fueron la diabetes mellitus (36%), las neoplasias (17%) y el TPH (5%)24. En el conjunto de la serie la forma clínica de presentación más frecuente fue la sinusal (39%), seguida de la afectación pulmonar (24%), cutánea (19%), cerebral (9%), gastrointestinal (7%) y diseminada (6%). Sin embargo, la localización pulmonar fue la forma de presentación clínica más frecuente en los pacientes oncohematológicos (60%) y en los receptores de TPH (52%), a diferencia de los pacientes con diabetes (16%). En la tabla 3 se resume la distribución de las formas clínicas de presentación según la enfermedad de base en los pacientes del último estudio epidemiológico publicado en Francia13.
Localización clínica de la mucormicosis según el factor predisponente
| Pacientes (%) con cada factor predisponente | |||||
| Enfermedad hematológica | Diabetes mellitus | Traumatismo | TOS | Otras | |
| Pulmonar | 22 (44) | 3 (13) | 0 | 1 | 2 |
| Rinocerebral | 6 (12) | 16 (70) | 1 (6) | 0 | 2 |
| Cutánea | 4 (8) | 0 | 15 (83) | 0 | 1 |
| Diseminada | 13 (26) | 2 (9) | 1 (6) | 1 | 1 |
| Otras | 5 (10) | 2 (9) | 1 (6) | 1 | 1 |
TOS: trasplante de órgano sólido.
Adaptado de Lanternier et al.13.
Aproximadamente, la mortalidad global de los pacientes con mucormicosis es del 40%, aunque en pacientes hematológicos supera el 60%. La tasa de supervivencia varía según la especie causal, la enfermedad de base, la extensión de la enfermedad y el tipo y momento de la cirugía. Además, la supervivencia está relacionada con la forma clínica de presentación: 90% en las formas cutáneas aisladas, 87% en sinusitis sin afectación cerebral, 45% en formas rinocerebrales, 36% en las pulmonares, 33% en la enfermedad cerebral focal, 16% en las formas diseminadas y 10% en las gastrointestinales.
DiagnósticoLa úlcera necrótica con escara negruzca es la lesión característica de la mucormicosis y debe alertar sobre la misma en todo paciente con factores de riesgo. Para valorar la extensión de la lesión a tejidos adyacentes son útiles las técnicas de imagen como la TC y la resonancia magnética. La utilización de estas técnicas con contraste también permite la identificación de trombos intravasculares y la identificación de lesiones en estructuras profundas y en el SNC. No obstante, ninguna de estas técnicas proporciona imágenes específicas de mucormicosis, aunque algunos autores han revelado que el denominado «signo del halo inverso» o un recuento cuantitativo elevado del número de lesiones nodulares pulmonares (>10) podría tener una mayor asociación con la mucormicosis, especialmente en pacientes oncohematológicos2,7. Con todo ello, el diagnóstico definitivo se basa en la observación microscópica y en el aislamiento del agente causal mediante cultivo microbiológico de las lesiones biopsiadas o sometidas a cirugía de exerésis.
Los mucorales tienen una presencia ubicua y pueden contaminar los cultivos micológicos. Por lo tanto, su observación directa al microscopio en las biopsias de los tejidos infectados (hifas anchas, sin tabiques y ramificadas en ángulo recto) tiene un valor diagnóstico mucho mayor que su aislamiento en el cultivo. Sin embargo, el aislamiento es de gran utilidad para corroborar los hallazgos anatomopatológicos, conocer la identidad del agente etiológico y estudiar su sensibilidad in vitro a los antifúngicos. A pesar de la gran angioinvasividad que caracteriza a las infecciones por mucorales, los hemocultivos de los pacientes con mucormicosis son habitualmente negativos. Para mejorar el rendimiento de las muestras clínicas cultivadas en el laboratorio, estas se deben desmenuzar y cortar con un bisturí con sumo cuidado. No deben triturarse ni homogeneizarse, ya que al carecer sus hifas de septos los mucorales pierden viabilidad.
A diferencia de otras EFI no se han encontrado biomarcadores útiles que ayuden al diagnóstico de la mucormicosis. Tanto el galactomanano como el β-glucano no son componentes de la pared celular de los mucorales, por lo que son indetectables en las muestras clínicas de los pacientes con mucormicosis. Actualmente se están evaluando métodos basados en técnicas de amplificación mediante PCR en tiempo real y de hibridación in situ empleando sondas de ADN con resultados esperanzadores1.
TratamientoEl tratamiento de las mucormicosis debe basarse en la rapidez y certeza diagnóstica, el control de los factores predisponentes (hiperglucemia, acidosis, tratamiento con deferoxamina, inmunosupresores, corticoides, etc.), la amplia extirpación y limpieza quirúrgica de las lesiones y el correcto empleo de los antifúngicos. Además, en enfermos neutropénicos es muy importante la recuperación del número y funcionalidad de los neutrófilos, bien espontáneamente, bien con el empleo de factores estimulantes de colonias.
El oxígeno hiperbárico inhibe el crecimiento fúngico in vitro y corrige la acidosis láctica favoreciendo la acción oxidativa de la anfotericina B; además, aumenta la fagocitosis, los factores de crecimiento, la angiogénesis y, por tanto, la respuesta terapéutica y la probabilidad de curación. Su uso puede ser beneficioso en enfermos diabéticos con formas rinocerebrales, pero su utilidad en enfermos oncohematológicos y en receptores de alo-TPH todavía es dudosa31. La utilización de deferasirox, un nuevo agente quelante del hierro, ofrecía resultados prometedores en estudios experimentales en los enfermos con sobrecarga de hierro postransfusional11. Esos resultados no se han corroborado en el único ensayo clínico hasta ahora realizado, en el cual incluso aumentaba la mortalidad en la rama de tratamiento combinado de antifúngicos junto a esta molécula quelante, probablemente por fallos en el diseño y metodología del estudio y una inadecuada selección de los pacientes6,29.
La sensibilidad in vitro de los mucorales a los antifúngicos es baja: únicamente la anfotericina B y el posaconazol muestran una actividad frente a la mayoría de estos hongos. AmB-L tiene menor toxicidad y mejor tolerancia que las otras formulaciones de anfotericina B y, además, atraviesa bien la barrera hematoencefálica; se recomiendan dosis ∼5mg/kg/día iv hasta conseguir la resolución de la enfermedad, aunque se han llegado a emplear 7,5 y 10mg/kg/día.
El tratamiento con posaconazol (400-600mg/12h o 800mg/24h) durante ≥6 meses se ha utilizado como uso compasivo en mucormicosis invasoras. De momento, este antifúngico solo puede utilizarse por vía oral y necesita administrarse con comidas de alto contenido graso, situación no siempre factible en pacientes con mucositis grave o en la EICH intestinal, lo que dificulta alcanzar las concentraciones séricas y tisulares apropiadas.
La elevada tasa de mortalidad de la mucormicosis, especialmente en pacientes hematológicos tratados con monoterapia, ha estimulado el interés por el tratamiento combinado de dos o más fármacos antifúngicos. Hasta la fecha, la combinación de AmB-L con una equinocandina es la más prometedora de todas debido a la disponibilidad de formulaciones parenterales, su sinergia en modelos animales y su correlación con los datos clínicos observados. Otras opciones sugeridas son la combinación de AmB-L más deferasirox, de AmB-L más posaconazol o incluso de AmB-L más deferasirox y una equinocandina. Pero se necesita más información procedente de ensayos clínicos aleatorizados para determinar qué combinación de todas ellas es superior a la monoterapia28. Aparte de los conocimientos derivados de los estudios in vitro y de los modelos experimentales en animales, los datos clínicos existentes provienen de casos muy determinados en los que mayoritariamente se ha empleado la anfotericina B liposomal en combinación con caspofungina o posaconazol, junto con la necesaria exéresis quirúrgica.
Dada su gravedad y mal pronóstico, para el manejo de las EFI por mucorales se aconseja consultar y utilizar las recomendaciones de las distintas guías publicadas recientemente sobre su diagnóstico, profilaxis y tratamiento, tanto en poblaciones determinadas (pacientes pediátricos, hematológicos, trasplantados, diabéticos, politraumatizados, etc.) como en lo referente a esquemas para el tratamiento en primera línea o de rescate3,16,27. Además del diagnóstico precoz y una estrategia agresiva integrada con desbridamiento quirúrgico inmediato y combinación de antifúngicos, parece que los casos sometidos a consulta y valoración por un especialista en enfermedades infecciosas pueden mejorar en su resultado y pronóstico final5.
ConclusionesLas enfermedades fúngicas invasoras causadas por hongos filamentosos distintos del género Aspergillus, como son Scedosporium, Fusarium o los mucorales (Rhizopus, Mucor o Lichtheimia) han aumentado en frecuencia y gravedad en los últimos años, especialmente en pacientes profundamente inmunodeprimidos. Aunque son menos frecuentes que las causadas por Aspergillus, suelen ser aún más virulentas y difíciles de tratar debido a su resistencia a la mayoría de los fármacos disponibles y también al tipo de paciente, generalmente inmunodeprimido, al que afecta.
Los recientes protocolos de trasplante, que incluyen nuevos y más potentes fármacos inmunosupresores, y el uso frecuente de profilaxis antifúngica que actúa como factor de selección, junto con el cambio de ciertos nichos ecológicos pueden explicar el mayor número de aislamientos de estos hongos filamentosos en pacientes inmunodeprimidos. Además, estos patógenos también pueden afectar a individuos inmunocompetentes, especialmente después de catástrofes naturales (terremotos, maremotos, inundaciones), de heridas de combate o semiahogamientos por inmersión.
Todas las infecciones profundas causadas por Scedosporium, Fusarium o mucorales son muy graves y potencialmente mortales. La buena evolución de los pacientes se relaciona con un diagnóstico rápido (mediante visión microscópica directa de las lesiones biopsiadas), tratamiento antifúngico precoz (muchas veces combinando dos o más fármacos), extensa exéresis y limpieza quirúrgica de las lesiones accesibles, y la recuperación del estado inmunitario del paciente, sobre todo de su neutropenia.
Conflicto de interesesJavier Pemán ha participado en los cinco últimos años en el asesoramiento y en conferencias científicas de Astellas Pharma, Gilead Sciences, Teva, Merck, Sharp & Dohme y Pfizer SLU.
Miguel Salavert ha participado en los últimos cinco años en asesorías médicas y ha impartido conferencias científicas promovidas por Astellas Pharma, Gilead Sciencies, Janssen, Merck, Sharp & Dohme, Novartis y Pfizer SLU.