La enfermedad fúngica invasora (EFI) por hongos filamentosos continúa causando una elevada morbimortalidad en pacientes con enfermedades hematológicas y receptores de trasplante hematopoyético. La disponibilidad de nuevos fármacos y pruebas diagnósticas ha dado lugar a diferentes estrategias terapéuticas (profiláctica, empírica, anticipada y dirigida). La evaluación adecuada del riesgo individual de EFI es crítica para elegir el mejor método profiláctico y terapéutico e incrementar la supervivencia de los pacientes. Entre los antifúngicos disponibles los más usados en el paciente hematológico son el fluconazol, los azoles con espectro para hongos filamentosos (itraconazol, posaconazol y voriconazol), las candinas (anidulafungina, caspofungina y micafungina) y la anfotericina B (en particular, sus formulaciones lipídicas). En este documento se revisan las características de las EFI por hongos filamentosos en pacientes hematológicos, las recomendaciones de prescripción del tratamiento antifúngico y los criterios para la selección de los agentes terapéuticos en las distintas situaciones clínicas.
Invasive mould infections (IMI) are a persistent problem with high morbidity and mortality rates among patients receiving chemotherapy for hematological malignancies and hematopoietic stem cell transplant recipients. Management of IMI in this setting has become increasingly complex with the advent of new antifungal agents and diagnostic tests, which have resulted in different therapeutic strategies (prophylactic, empirical, pre-emptive, and directed). A proper assessment of the individual risk for IMI appears to be critical in order to use the best prophylactic and therapeutic approach and increase the survival rates. Among the available antifungal drugs, the most frequently used in the hematologic patient are fluconazole, mould-active azoles (itraconazole, posaconazole and voriconazole), candins (anidulafungin, caspofungin and micafungin), and lipid formulations of amphotericin B. Specific recommendations for their use, and criteria for selecting the antifungal agents are discussed in this paper.
La enfermedad fúngica invasora (EFI) por hongos filamentosos ha aumentado en frecuencia durante la última década12,14,21. Este incremento se debe, por una parte, a la existencia de un mayor número de pacientes en riesgo, por someterse a tratamientos inmunosupresores o terapias invasivas y, por otra, a la mejora de los métodos diagnósticos microbiológicos y de las pruebas de imagen, especialmente la tomografía axial computarizada de alta resolución (TACAR). Sin embargo, a pesar del diagnóstico más precoz y del uso de los nuevos antifúngicos la EFI continúa asociándose con una elevada morbimortalidad. La tasa de mortalidad media relacionada con la aspergilosis invasora (AI) es superior al 50% en algunos grupos de pacientes hematológicos, como los pacientes con leucemia aguda o los receptores de trasplante de progenitores hematopoyéticos (TPH).
Aunque el agente etiológico más frecuente continúa siendo Aspergillus fumigatus, el número de especies capaces de causar enfermedad invasora ha aumentado considerablemente. Así, en los últimos años se han incrementado las infecciones por otras especies de Aspergillus, como también las causadas por los géneros Fusarium, Scedosporium y los hongos mucorales. Estas infecciones son más difíciles de diagnosticar y tratar, ya que estos hongos emergentes suelen ser más resistentes a los antifúngicos disponibles, por lo que se asocian con una mayor mortalidad19.
Aspergilosis invasora en el paciente hematológicoEpidemiologíaLas características de la EFI en los pacientes oncohematológicos están en constante evolución. Mientras en la década de 1980 la candidiasis era la micosis más prevalente, la generalización del uso profiláctico del fluconazol a principios de la década de 1990 dio lugar a un notable descenso de la EFI por levaduras. Sin embargo, la EFI por hongos filamentosos (EFI-HF) en general, y la AI en particular, ha continuado siendo un importante problema, particularmente en los pacientes con leucemias agudas mieloblásticas y linfoblásticas (LAM, LAL), en los síndromes mielodisplásicos de alto riesgo (SMD) y en los pacientes sometidos a TPH alogénico (alo-TPH).
La incidencia de EFI-HF probada o probable en los pacientes hematológicos de riesgo oscila entre el 4 y el 22%, tratándose de AI en la mayoría de los casos. Sin embargo, la verdadera dimensión del problema puede ser aún mayor, ya que es sabido que los métodos diagnósticos actuales no son suficientemente sensibles para detectar todos los casos de AI/EFI-HF en el huésped inmunodeprimido. En la mayor serie de autopsias (n=1.017) en pacientes con hemopatías malignas del MD Anderson Cancer Center, durante el periodo 1989-2003, la proporción de EFI probada por necropsia fue del 31%, la mayoría de las cuales (75%) se diagnosticaron en ese momento3,13.
Respecto a las especies de Aspergillus, aunque en otros países europeos se ha encontrado un significativo aumento de AI por especies como A. flavus o A. terreus, en nuestro país la predominante como patógeno en el paciente hematológico sigue siendo A. fumigatus1.
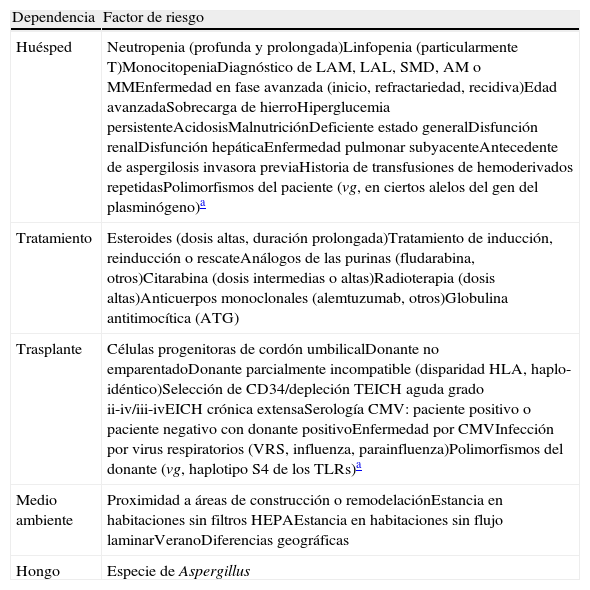
Factores de riesgoLos principales factores de riesgo asociados al desarrollo de AI en el paciente hematológico se pueden agrupar en aquellos que dependen del paciente y su situación clínica (factores del huésped), los relacionados con el tratamiento recibido, los específicos de los pacientes que se someten a un trasplante hematopoyético (procedimiento, donante, complicaciones), los relativos a las condiciones medioambientales y, finalmente, los derivados de la patogenicidad o virulencia intrínseca de cada especie de Aspergillus (tabla 1).
Principales factores de riesgo en la aspergilosis invasora
| Dependencia | Factor de riesgo |
| Huésped | Neutropenia (profunda y prolongada)Linfopenia (particularmenteT)MonocitopeniaDiagnóstico de LAM, LAL, SMD, AM o MMEnfermedad en fase avanzada (inicio, refractariedad, recidiva)Edad avanzadaSobrecarga de hierroHiperglucemia persistenteAcidosisMalnutriciónDeficiente estado generalDisfunción renalDisfunción hepáticaEnfermedad pulmonar subyacenteAntecedente de aspergilosis invasora previaHistoria de transfusiones de hemoderivados repetidasPolimorfismos del paciente (vg, en ciertos alelos del gen del plasminógeno)a |
| Tratamiento | Esteroides (dosis altas, duración prolongada)Tratamiento de inducción, reinducción o rescateAnálogos de las purinas (fludarabina, otros)Citarabina (dosis intermedias o altas)Radioterapia (dosis altas)Anticuerpos monoclonales (alemtuzumab, otros)Globulina antitimocítica (ATG) |
| Trasplante | Células progenitoras de cordón umbilicalDonante no emparentadoDonante parcialmente incompatible (disparidad HLA, haplo-idéntico)Selección de CD34/depleción TEICH aguda grado ii-iv/iii-ivEICH crónica extensaSerología CMV: paciente positivo o paciente negativo con donante positivoEnfermedad por CMVInfección por virus respiratorios (VRS, influenza, parainfluenza)Polimorfismos del donante (vg, haplotipo S4 de los TLRs)a |
| Medio ambiente | Proximidad a áreas de construcción o remodelaciónEstancia en habitaciones sin filtros HEPAEstancia en habitaciones sin flujo laminarVeranoDiferencias geográficas |
| Hongo | Especie de Aspergillus |
AM: aplasia medular; CMV: citomegalovirus; EICH: enfermedad del injerto contra el huésped; LAL: leucemia aguda linfoblástica; LAM: leucemia aguda mieloblástica; MM: mieloma múltiple; SMD: síndrome mielodisplásico; VRS: virus respiratorio sincitial.
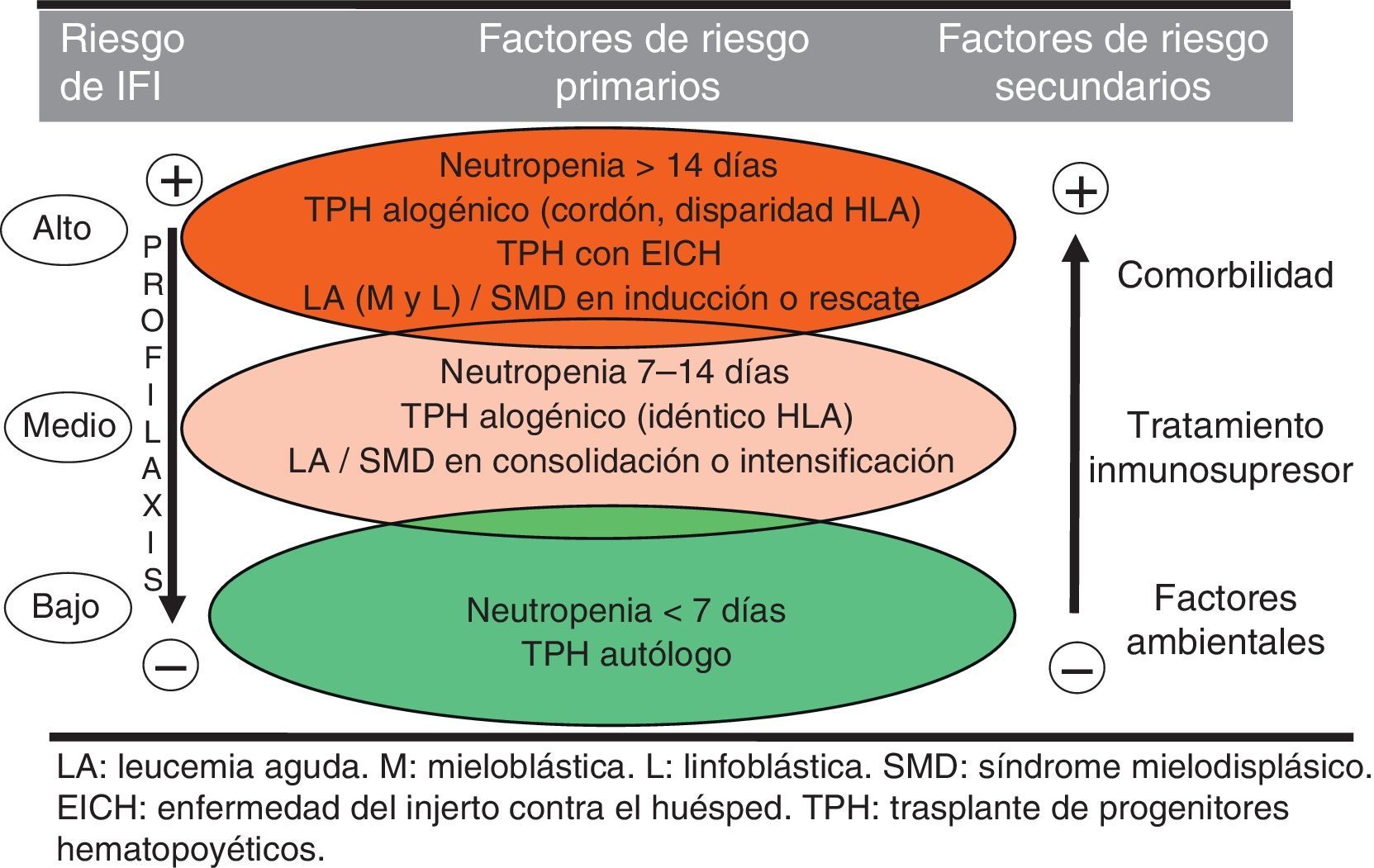
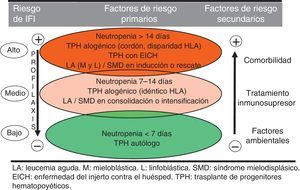
El principal factor de riesgo del huésped es la neutropenia profunda y prolongada. Está bien establecido que a partir de unos 10 días de neutropenia el riesgo de aspergilosis se incrementa en relación directa con la duración de la neutropenia3,7,9,15,19,23,24,33. Además, la neutropenia inducida por quimioterapia se asocia con linfopenia (particularmente la de las poblaciones T), así como con alteraciones del sistema mononuclear fagocítico, que constituyen también factores de riesgo para el desarrollo de AI. Determinadas enfermedades hematológicas (LAM, LAL, SMD, aplasia medular, mieloma múltiple), el estatus de enfermedad avanzada (presentación, enfermedad refractaria al tratamiento, recidiva) y la mayor edad del paciente suponen también mayor riesgo relativo de AI. Algunos factores biológicos, como la hiperglucemia persistente, la acidosis o la malnutrición pueden influir de forma adversa sobre los mecanismos inmunitarios del paciente y aumentar el riesgo de sufrir AI. Un deficiente estado general y la existencia de disfunciones orgánicas (renal y hepática, pulmonar fundamentalmente) favorecen también la presentación de AI. El antecedente de AI es otro factor predisponente bien conocido. Aproximadamente un 30-50% de los pacientes con AI previa presentan una reactivación durante un nuevo episodio de neutropenia o durante un trasplante si no se ha empleado la profilaxis secundaria adecuada.
Entre los factores de riesgo asociados al tratamiento destacan la quimioterapia de inducción o de rescate de las leucemias agudas (frente a las fases de consolidación o intensificación), y la corticoterapia prolongada o a altas dosis. Varios estudios han demostrado que los corticoides reducen la respuesta inmune del huésped frente a Aspergillus mediante la alteración de la capacidad del macrófago alveolar para eliminar las conidias fúngicas fagocitadas y la disminución de la producción de citocinas y quimiocinas proinflamatorias, importantes para el reclutamiento de neutrófilos y monocitos. Además, los corticoides producen una alteración cualitativa de la función de los neutrófilos. Si a la corticoterapia se le añaden otros factores de riesgo de AI, como la neutropenia profunda o prolongada, el riesgo de presentar la infección se potencia.
En el contexto del TPH la AI se presenta en dos etapas, una primera precoz condicionada por la enfermedad y la edad del paciente, el empleo de sangre de cordón umbilical como fuente de progenitores y la enfermedad por CMV. En la AI tardía postrasplante el factor de riesgo dominante suele ser la EICH crónica extensa, durante la cual, junto con una profunda inmunodeficiencia, se produce una alteración cualitativa de la función de los neutrófilos25.
En lo que se refiere a factores de riesgo medioambientales la AI, a diferencia de la mayoría del resto de infecciones que presenta el paciente hematológico, suele ser de origen exógeno (nosocomial o extrahospitalario). Por ello, la estancia hospitalaria en habitaciones sin filtros High Efficiency Particulate Air (HEPA), así como la proximidad a áreas de construcción o remodelación (donde la concentración de conidias en el aire ambiental es alta) incrementa significativamente el riesgo de AI.
La patogenicidad intrínseca de la especie de Aspergillus a la que el paciente se expone tiene escasa correlación con el desarrollo de una AI; sin embargo, la especie infectante de Aspergillus sí puede tener implicaciones en la agresividad, la respuesta al tratamiento y el pronóstico de la complicación15.
Considerados los factores de riesgo en su conjunto, y con fines prácticos, se pueden establecer tres niveles de riesgo, según se refleja en la figura 1.
Formas clínicasDado que la puerta de entrada suele ser la vía respiratoria, las dos formas más habituales de la AI primaria son la aspergilosis rinosinusal aguda y, sobre todo, la aspergilosis pulmonar invasora (API). La AI puede presentarse inicialmente como fiebre aislada. La infección más avanzada puede ocasionar dolor o congestión de los senos paranasales, tos, dolor torácico de características pleuríticas y hemoptisis.
La clínica de la API es muy inespecífica, en forma de tos, disnea o fiebre. La existencia de dolor torácico y hemoptisis se explica por la invasión y la obstrucción de una o varias arterias por émbolos fúngicos. Por otra parte, en el curso de la evolución de la API puede producirse cavitación de una o varias lesiones pulmonares y dar lugar a un neumotórax o a una hemoptisis más o menos masiva. Estas manifestaciones, aunque pueden tener una elevada morbilidad, no reflejan necesariamente progresión de la AI, sino que suelen presentarse durante el proceso de resolución, a menudo coincidiendo con la recuperación del recuento de neutrófilos, a modo de síndrome de reconstitución inmune. Se han definido dos patrones histopatológicos distintos de API según la situación clínica. Así, la API de los pacientes leucémicos con neutropenia se caracteriza por la abundante presencia de hifas angioinvasoras y extensa necrosis tisular coagulativa (no inflamatoria). En contraste, en la API de los pacientes trasplantados con EICH se observa escasa presencia fúngica e intensa inflamación de carácter neutrofílico. Debido al rápido crecimiento del hongo y a la diseminación hematógena tras la angioinvasión, la infección puede alcanzar el sistema nervioso central, el tracto gastrointestinal y otras localizaciones u órganos (peritoneo, piel, ojo, corazón, vía respiratoria, tracto urinario, suprarrenales, hígado, bazo, tiroides, hueso, oído, ganglio linfático, etcétera).
La AI rinosinusal aguda se caracteriza por la invasión de la mucosa con infarto y la extensión centrífuga hacia estructuras contiguas y el endocráneo (AI rinocerebral). Su sintomatología puede incluir congestión nasal, dolor rinosinusal u orbitario, cefalea, ceguera monocular, epistaxis, fiebre, tumefacción y proptosis.
Las pruebas de imagen de la aspergilosis sinusal pueden mostrar opacificación de senos con erosión del septo nasal, erosión ósea en la órbita o en el paladar duro. Las pruebas de imagen en la aspergilosis pulmonar revelan nódulos, signo del halo, bronconeumonía, consolidación lobar, neumonía segmentaria y lesiones cavitadas. El diagnóstico precoz de la aspergilosis es importante para mejorar los resultados terapéuticos. El aislamiento del hongo en el lavado broncoalveolar (LBA) o en muestras de las lesiones obtenidas mediante punción o biopsia tiene una sensibilidad limitada. La detección de galactomanano en suero y en líquido del LBA puede mejorar la detección precoz de la aspergilosis y complementa a la TACAR. Otras pruebas diagnósticas como la detección de β-D-glucano y la detección de ADN de Aspergillus por PCR pueden ser útiles, pero no están plenamente incorporadas a la práctica asistencial.
Estrategia frente a la aspergilosis invasoraLa estrategia integral frente a la AI en el paciente hematológico incluye, además del diagnóstico precoz, la profilaxis (farmacológica y no farmacológica) y el tratamiento. En el tratamiento quedan agrupadas cuatro estrategias no excluyentes: el tratamiento empírico del paciente neutropénico febril, el tratamiento anticipado (basado en pruebas radiológicas y de laboratorio de diagnóstico precoz), el tratamiento dirigido (de la AI probada o probable) de primera línea y el tratamiento de rescate (tabla 2)2,32.
Definición del tipo de tratamiento antifúngico en el paciente hematológico
| Situación clínica | Tratamiento antifúngico |
| Fiebre que persiste, a pesar de estudios microbiológicos negativos y tratamiento antibiótico de amplio espectro | Empírico |
| Antígeno galactomanano positivo (en sangre o LBA) o TAC de tórax o senos paranasales compatible con AI/EFI-HF | Anticipado |
| Evidencia de AI/EFI-HF | Dirigido |
El diagnóstico de EFI puede obtenerse a partir del aislamiento del organismo, la detección serológica del anticuerpo o antígeno (galactomanano para Aspergillus) o la evidencia histopatológica de invasión. En la actualidad la determinación de galactomanano constituye una herramienta útil en el diagnóstico de la AI. Sin embargo, la exposición a los nuevos azoles con actividad frente a Aspergillus en tratamientos profilácticos puede disminuir la sensibilidad de la técnica. Existen nuevas técnicas en marcha (β-D-glucano, PCR en tiempo real) que sin duda ayudarán a establecer un diagnóstico más rápido de la infección. Actualmente, la TACAR se ha convertido en un elemento indispensable para establecer un diagnóstico precoz. Esta presenta una cinética característica a lo largo del proceso. En el momento del diagnóstico, la fase precoz de la infección, lo más frecuente es la presencia del signo del halo, que se corresponde con una zona de edema o hemorragia de baja atenuación alrededor de una masa o nódulo. Más adelante las lesiones se cavitan y toman la apariencia de una semiluna.
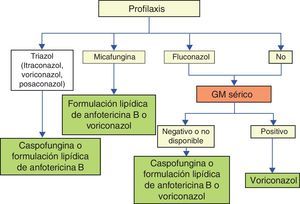
Profilaxis farmacológica de la aspergilosis invasoraSi bien las medidas profilácticas frente a Aspergillus se adoptan fundamentalmente para evitar su adquisición a partir del aire que rodea al paciente, también es posible actuar sobre las hifas que ya hayan alcanzado el árbol bronquial al disponer de antifúngicos orales eficaces frente a este hongo10. El empleo de antifúngicos orales no absorbibles (solución de anfotericina B, nistatina, clotrimazol), no parece prevenir el desarrollo de invasión fúngica superficial ni invasora y no se recomienda actualmente. La anfotericina B liposómica intravenosa e inhalada ha mostrado utilidad en la prevención de la AI y API, respectivamente. Sin embargo, los estudios publicados no han alcanzado, por ahora, la evidencia suficiente como para que pueda considerarse, por una u otra vía de administración, el fármaco de elección en la profilaxis primaria. En lo que a las candinas se refiere, no existen evidencias suficientemente relevantes para su empleo sistemático como profilaxis de la AI en enfermos hematológicos. De los estudios y metaanálisis realizados con itraconazol puede concluirse que la solución oral de itraconazol, a dosis altas (hasta 2,5mg/kg cada 8h) y tras una dosis de carga reduce la incidencia de EFI, aunque con escasa influencia en la supervivencia y, además, alrededor del 30% de los pacientes no toleran su ingesta.
La profilaxis con posaconazol ha demostrado su eficacia en la profilaxis de las EFI, en concreto de la aspergilosis en la fase de neutropenia posquimioterapia para LMA y SMD y en alo-TPH con EICH. En el estudio realizado en pacientes con EICH la eficacia del posaconazol fue superior en la prevención de la AI y mejoró la supervivencia atribuible. Sin embargo, es importante recordar que para asegurar una absorción correcta se necesita una ingesta previa de alimentación rica en grasas. Los pacientes con mucositis o insuficiente ingesta oral de alimentos, o con un tránsito rápido, pueden no beneficiarse de la administración del posaconazol4,5,30.
El voriconazol, el tercero de los azoles de amplio espectro (con cobertura de hongos filamentosos), ha demostrado eficacia en la prevención de la AI en pacientes sometidos a alo-TPH. La posibilidad de administración intravenosa, así como su buena biodisponibilidad oral (administrado en ayunas) lo convierten en un fármaco de gran interés práctico en la prevención de la AI en el paciente hematológico18.
Aunque la literatura sobre la profilaxis secundaria es escasa, se recomienda la profilaxis en los pacientes con antecedente de EFI por hongos filamentosos que se someten nuevamente a quimioterapia o TPH21. La duración óptima de la profilaxis antifúngica frente a los hongos filamentosos no está completamente aclarada y depende de los factores de riesgo subyacentes10. Así pues, en los pacientes neutropénicos resulta lógico mantenerla hasta la recuperación de la neutropenia y en los portadores de EICH activa hasta que se controle la actividad del brote y la dosis de corticoides sea, al menos, inferior a 0,5mg/kg/día de prednisona o equivalente26,27.
.
Tratamiento de la aspergilosis invasoraEl tratamiento antifúngico de la AI ha cambiado considerablemente en las dos últimas décadas con la llegada de nuevos antifúngicos. Del uso empírico casi exclusivo de la anfotericina B desoxicolato (ABD) en las dos últimas décadas del siglo xx se ha pasado al empleo de fármacos como las formulaciones lipídicas de anfotericina B, las candinas y los azoles de amplio espectro, de igual o superior eficacia, menos tóxicos y mejor tolerados2,16,32.
La justificación del tratamiento empírico se basa en dos estudios realizados con ABD hace ya 30 años, cuando no se disponía de las técnicas diagnósticas actuales, en los que se redujo la incidencia y mortalidad de la AI/EFI. Más recientemente, han adquirido esta indicación las formulaciones lipídicas de anfotericina B y de la caspofungina. Actualmente, el tratamiento empírico se aconseja en los pacientes hematológicos con riesgo intermedio o alto de EFI que presenten fiebre prolongada sin foco aparente, a pesar del tratamiento antibiótico con antibacterianos de amplio espectro.
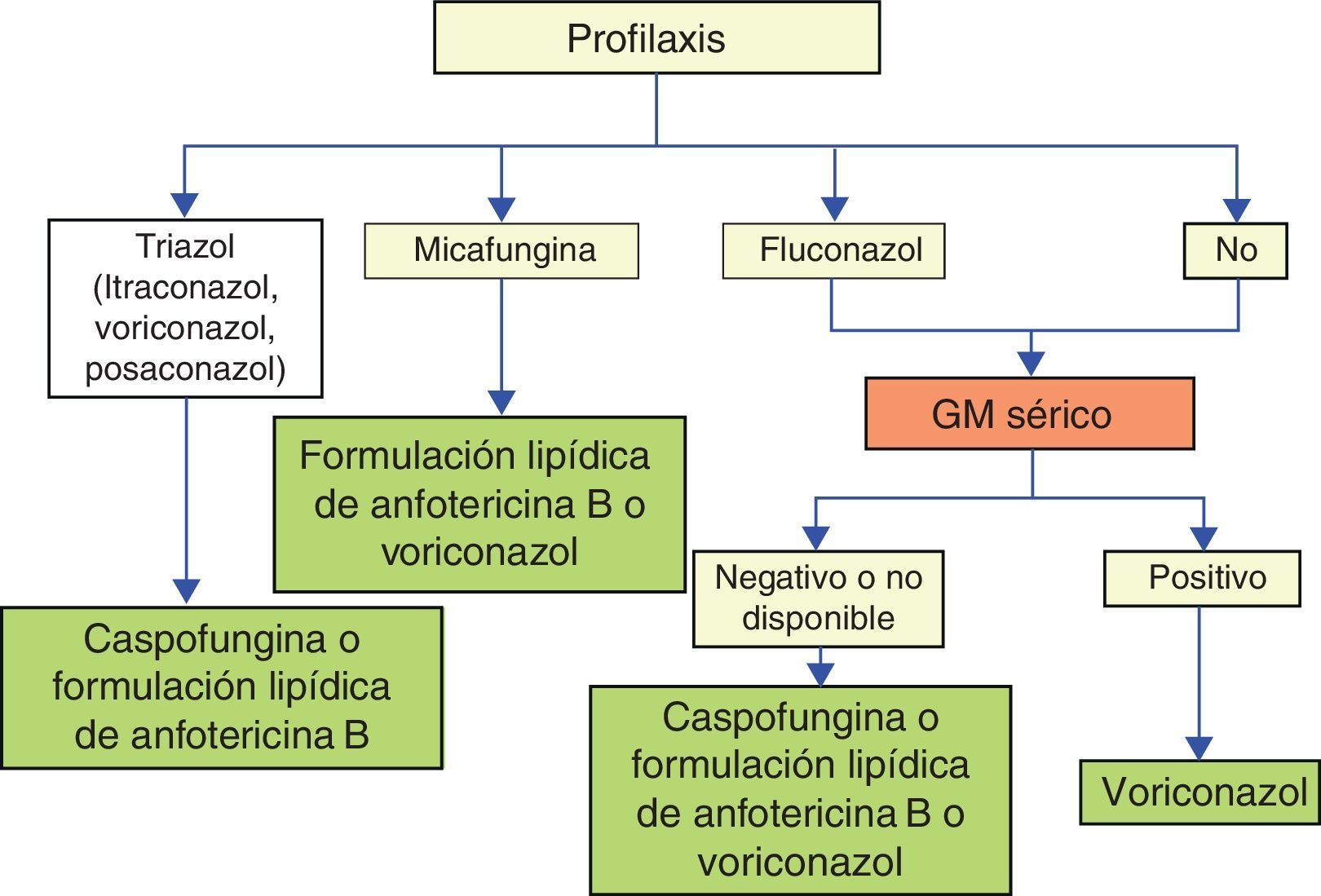
El concepto de tratamiento anticipado aplicado a la EFI (administración de antifúngicos en pacientes con positividad del galactomanano o presencia de una imagen compatible con EFI en la TAC de tórax o de senos paranasales) se propuso en 2005, con el objetivo de reducir el número de pacientes que reciben tratamiento empírico, manteniendo la precocidad del mismo. Pero este objetivo no siempre se alcanza debido, entre otros aspectos, a la demora en disponer de los resultados del laboratorio, la relativamente baja sensibilidad del galactomanano en algunas circunstancias y la poca especificidad de la imagen radiológica. El tratamiento dirigido consiste en el empleo de antifúngicos cuando hay pruebas concluyentes de EFI3,7. El antifúngico de elección para el tratamiento de la AI en el paciente hematológico es el voriconazol, siendo la anfotericina B liposómica una buena alternativa terapéutica (tabla 3)8,11.
Tratamiento de la aspergilosis invasora (niveles de evidencia/recomendación) [8]
| Fármaco | IDSA | ECIL-5 | SEIMC |
| Voriconazol | A-I | A-I | A-I |
| Anfotericina B liposómica | A-I | B-I | A-I |
| Anfotericina B complejo lipídico | -- | C-I | -- |
| Caspofungina | -- | C-II | C-II |
| Itraconazol | -- | C-III | D-III |
| CombinaciónAnidulafungina+Voriconazol | B-II | CIIIC-I | C-III |
Fuente: Fortún et al. modificado
Sin embargo, la decisión del inicio y del tipo de tratamiento antifúngico debe establecerse de forma individualizada en cada paciente en función de: a) el nivel de riesgo de AI/EFI; b) las características y la gravedad del cuadro clínico; c) la actividad frente a hongos filamentosos de la profilaxis antifúngica que el paciente haya recibido; y d) los resultados de las pruebas complementarias, básicamente la detección de galactomanano y la TAC de tórax o de senos paranasales (fig. 2).
Con respecto a la terapia combinada, hasta el momento actual no se ha publicado ningún estudio aleatorizado que demuestre la superioridad de la misma frente a la monoterapia. Sin embargo, parece ser que la combinación de voriconazol con anidulafungina, según un estudio aleatorizado presentado en un congreso, ofrece beneficio sobre la monoterapia, dato que ha supuesto un cambio en la gradación de recomendación en las nuevas guías ECIL. De confirmarse estos resultados, probablemente la terapia combinada podría sers beneficiosa al administrarla de forma más precoz a lo que se viene haciendo actualmente (AI con afectación pulmonar bilateral extensa o del SNC o el desarrollo de insuficiencia respiratoria)20. En la tabla 3 se sintetizan las recomendaciones de diferentes guías de sociedades científicas respecto al tratamiento en los pacientes hematológicos26,27.
Tratamiento de rescate de la aspergilosis invasoraLa mayoría de los estudios publicados sobre el tratamiento de rescate de la AI son de escasa calidad metodológica, lo que hace que sus conclusiones no alcancen niveles altos de evidencia. La mayoría de los agentes terapéuticos han mostrado tasas modestas de respuesta global, con escasa proporción de respuestas completas. Así pues, factores como la toxicidad esperable o la vía de administración de los distintos fármacos pueden ayudar a elegir una u otra opción terapéutica. La elección del tratamiento antifúngico de rescate debería estar supeditada, de ser posible, a la identificación del agente causal. También hay que tener en cuenta factores clínicos, como la afectación del SNC, en cuyo caso debemos emplear agentes con buena penetración en el líquido cefalorraquídeo (voriconazol, posaconazol o anfotericina B liposómica). La determinación de las concentraciones plasmáticas de los azoles podría ser de ayuda para ajustar la dosis en caso de fracaso terapéutico, dada la correlación existente entre dicha concentración y una respuesta favorable. En casos seleccionados la terapia combinada podría ser una alternativa terapéutica de rescate razonable31.
Infecciones por hongos emergentesLas EFI causadas por hongos filamentosos emergentes han incrementado su incidencia durante las últimas dos décadas2,4, aunque son menos frecuentes en Europa que en EE. UU. y se asocian a tasas muy elevadas de morbimortalidad (65-90%), especialmente en los pacientes hematológicos. En estos pacientes se han descrito infecciones producidas por mucorales (Mucor, Rhizopus y Absidia) y otros mohos (Fusarium, Scedosporium, Acremonium, Penicillium, Paecilomyces y Trichoderma)22.
Las infecciones producidas por otros hongos filamentosos, aunque pueden tener rasgos diferenciales, se asemejan en muchos casos a la AI y tienden a diseminarse con mayor frecuencia. Las infecciones por especies del género Fusarium suelen ocasionar lesiones cutáneas, y el aislamiento del hongo en el hemocultivo es más frecuente. Las infecciones producidas por mucorales suelen afectar a la esfera rinocerebral, maxilar y pulmonar con diseminación a otros órganos. Las imágenes radiológicas de las infecciones producidas por hongos filamentosos emergentes suelen ser indistinguibles de las de la AI, por lo que técnicas más agresivas, como la biopsia de la zona afectada, suelen ser necesarias para el diagnóstico etiológico. Nuevas técnicas de biología molecular, como la PCR panfúngica, serán probablemente útiles en el diagnóstico de estas infecciones.
MucormicosisLos factores de riesgo para la mucormicosis en los pacientes hematológicos incluyen la neutropenia prolongada, los corticoides, la diabetes y la sobrecarga de hierro. Se manifiesta típicamente con afectación pulmonar, sinusal, sinoorbitaria, rinocerebral o cutánea. Los pacientes con mucormicosis pulmonar pueden presentar tos, hemoptisis, dolor pleurítico y nódulos pulmonares, únicos o múltiples, que pueden mostrar un signo del halo invertido. En la enfermedad rinocerebral son comunes la fiebre, el dolor facial y la cefalea. La extensión por contigüidad puede afectar la órbita con proptosis y paresia de la musculatura extraocular, afectación del paladar duro y extensión al cerebro. La invasión de las venas que drenan los senos etmoidales y las órbitas puede dar trombosis del seno cavernoso. Una escara en el paladar o en los cornetes nasales es sugestiva de mucormicosis, pero otros hongos filamentosos pueden producir hallazgos similares. La enfermedad cutánea primaria aislada puede seguir a un traumatismo mínimo.
La terapia de la mucormicosis requiere: a) diagnóstico precoz; b) prescripción de anfotericina B; c) desbridamiento quirúrgico del tejido infectado; y d) reversión de la inmunosupresión. Es posible aumentar la actividad antifúngica mediante combinación de anfotericina B y uno o más de los siguientes agentes: posaconazol, candinas y deferasirox28.
FusariosisLas infecciones por Fusarium en pacientes hematológicos causan enfermedad sinopulmonar y diseminada. La neutropenia prolongada es el factor de riesgo más común. La puerta de entrada suele ser el tracto sinopulmonar, pero también puede ser por infección periungueal (onicomicosis, paroniquia y celulitis) y de tejidos blandos. Aproximadamente en la mitad de los casos se documenta fungemia. Las lesiones cutáneas múltiples por diseminación hematógena son frecuentes y suelen permitir el diagnóstico mediante biopsia. Otros sitios de infección incluyen el SNC, el hueso, las articulaciones, los ojos y el hígado. La identificación y el desbridamiento precoz de las lesiones localizadas en la piel pueden salvar la vida del paciente.
Dado que la sensibilidad de las especies de Fusarium es variable, la terapia inicial consiste en la combinación de anfotericina B y voriconazol mientras se esperan los resultados de sensibilidad. La identificación de la especie no es suficientemente predictiva de la sensibilidad a los antifúngicos. Cuando se dispone de la sensibilidad puede ajustarse la terapia. La supervivencia de los pacientes con fusariosis diseminada depende de la resolución de la neutropenia. De manera similar a la AI puede haber recurrencias en los siguientes episodios de neutropenia.
EscedosporiasisLas infecciones por Scedosporium causan enfermedad sinopulmonar y diseminación al SNC, que son histológicamente indistinguibles de las causadas por Aspergillus y Fusarium. Dado que Scedosporium apiospermum es a menudo resistente a la anfotericina B, pero sensible al voriconazol y al posaconazol, establecer el diagnóstico microbiológico es importante para la elección del tratamiento6.
Scedosporium prolificans, por su parte, produce una enfermedad diseminada con una presentación similar a aquella de Aspergillus, pero es resistente a todos los antifúngicos disponibles. La reversión de la inmunosupresión y la resección quirúrgica son claves para el tratamiento de las infecciones causadas por S. prolificans.
Por último, las infecciones por hongos dematiáceos (denominadas feohifomicosis) pueden causar sinusitis, neumonía, infección del SNC, fungemia, infección de tejidos blandos y enfermedad diseminada. El tratamiento consiste en terapia antifúngica sistémica y en la escisión quirúrgica de la lesión localizada cuando es factible. Según los perfiles de sensibilidad y la experiencia clínica, el agente de elección para la terapia primaria es el voriconazol.
En resumen, aunque las EFI por hongos filamentosos emergentes son infrecuentes, gran parte de su importancia reside en la agresividad de su comportamiento clínico, en el grado de inmunosupresión del huésped en el que se asientan y en el amplio perfil de resistencia a la mayoría de los antifúngicos disponibles. Por todo ello, además de un diagnóstico precoz, la combinación de varios antifúngicos, asociados en algunas ocasiones a la cirugía (como ocurre con las zigomicosis) constituye el tratamiento de elección de estas micosis17. Por último, a pesar de los avances en la movilización de donantes para la obtención de granulocitos mediante los factores de crecimiento, las transfusiones de granulocitos siguen siendo un procedimiento laborioso y poco práctico, no recomendado para la práctica habitual29.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.