Las infecciones del tracto urinario son una complicación en las unidades de cuidados intensivos. Las levaduras ocasionan el 5-12% de dichas infecciones. El valor del hallazgo de las levaduras es controvertido y no hay consenso acerca de qué parámetros son los adecuados para diferenciar entre contaminación, colonización e infección urinaria.
ObjetivosAnalizar las características epidemiológicas de pacientes con funguria, determinar potenciales puntos de corte en los cultivos para distinguir la infección urinaria de otras situaciones, identificar las especies de levaduras prevalentes y determinar el valor de la segunda muestra de orina.
MétodosSe realizó un estudio multicéntrico en unidades de cuidados intensivos de 14 hospitales. Se procesaron primeras y segundas muestras para urocultivo, se evaluaron la presencia de leucocitos y levaduras en el examen directo, se hizo un recuento de colonias y se identificaron las especies aisladas.
ResultadosHubo crecimiento de levaduras en el 12,2% de las muestras. No hubo correlación entre el número de leucocitos y el de unidades formadoras de colonias de levaduras. El 85% de los pacientes tenían catéteres vesicales. No se observó mayor prevalencia ni en mujeres ni en pacientes adultos mayores de 65 años. Candida albicans fue la especie más frecuente, seguida por Candida tropicalis y, en menor proporción, por Candida parapsilosis y Candida glabrata. En la segunda muestra se corroboró la presencia de la misma especie en el 70% de los casos, y en el 23% de ellos el segundo cultivo fue negativo.
ConclusionesNo fue posible determinar un punto de corte en el recuento de colonias que oriente al diagnóstico de infección urinaria. Las dos especies prevalentes fueron C. albicans y C. tropicalis.
Urinary tract infections are a frequent ailment in patients in intensive care units. Candida and other yeasts cause 5-12% of these infections. The value of the finding of any yeast is controversial, and there is no consensus about which parameters are adequate for differentiating urinary infections from colonization or contamination.
AimsTo analyse the epidemiological characteristics of patients with funguria, to determine potential cut-off points in cultures (to distinguish an infection from other conditions), to identify the prevalent yeast species, and to determine the value of a second urine sample.
MethodsA multicentre study was conducted in intensive care units of 14 hospitals in the Buenos Aires City Mycology Network. The first and second samples of urine from every patient were cultured. The presence of white cells and yeasts in direct examination, colony counts, and the identification of the isolated species, were evaluated.
ResultsYeasts grew in 12.2% of the samples. There was no statistical correlation between the number of white cells and the fungal colony-forming units. Eighty five percent of the patients had indwelling catheters. Funguria was not prevalent in women or in patients over the age of 65. Candida albicans, followed by Candida tropicalis, were the most frequently isolated yeasts. Candida parapsilosis and Candida glabrata appeared less frequently. The same species were isolated in 70% of second samples, and in 23% of the cases the second culture was negative.
ConclusionsIt was not possible to determine a useful cut-off point for colony counts to help in the diagnosis of urinary infections. As in other publications, C. albicans, followed by C. tropicalis, were the most prevalent species.
Las infecciones del tracto urinario son las que se producen con mayor frecuencia durante la internación hospitalaria. Los agentes etiológicos habituales son bacterias; los hongos son responsables del 5-12% de los casos18,19,23. Dentro de este último grupo, las levaduras del género Candida son la etiología de la mayoría de estas infecciones. También se han descrito como responsables de infecciones urinarias otros hongos oportunistas como Aspergillus spp., Trichosporon spp., Cryptococcus spp.2,3,5 y hongos causales de micosis sistémicas endémicas (Histoplasma capsulatum, Coccidioides immitis/Coccidioides posadasii)9,25,39,44,46.
En general, el hallazgo de elementos fúngicos en la orina se presenta como una complicación de infecciones nosocomiales o asociado a cuidados de la salud (como pacientes geriátricos),y rara vez se observa como infección adquirida en la comunidad por pacientes con tracto urinario con estructura normal.
Los pacientes de las unidades de cuidados intensivos (UCI) de adultos, de pediatría y de neonatología son los más afectados, en particular aquellos con sonda vesical permanente, obstrucción o intervención urinaria previa, algún deterioro del sistema inmune, utilización de antibióticos de amplio espectro, múltiples manipulaciones por parte del personal de salud, etc.14,21,23,33,47–49.
En las últimas décadas se ha registrado un aumento significativo de las infecciones nosocomiales por hongos del género Candida, especialmente aquellas asociadas a las vías urinarias7,13,24. El National Nosocomial Infection Surveillance System (NNIS) (Sistema Nacional de Vigilancia de Infecciones Nosocomiales) de EE. UU. publicó que el género Candida es uno de los principales agentes fúngicos causantes de infecciones urinarias (IU) en los pacientes ingresados en UCI, y que Candida albicans es la causa más frecuente de candiduria33. La incidencia de las distintas especies de Candida puede variar en los diferentes centros asistenciales y regiones geográficas1,18,23,30,33.
Como Candida forma parte de la biota humana (intestino, vagina, piel), su aislamiento a partir de cultivos de orina no es evidencia de infección. El hallazgo de levaduras en el urocultivo continúa siendo un problema, ya que es difícil establecer si corresponde a una infección fúngica que se localiza en la vejiga o involucra el tracto urinario superior, o bien es una simple colonización o contaminación8,17–19,21. El tratamiento antifúngico se reserva para los pacientes de alto riesgo de padecer candidiasis invasiva y en las candidurias sintomáticas.
El objetivo principal de este estudio fue analizar las características epidemiológicas de aquellos pacientes internados en áreas críticas que padecían IU por levaduras, establecer la correlación del examen directo con el cultivo y determinar potenciales puntos de corte en el recuento de las colonias para diferenciar la infección de otras situaciones. Otros objetivos fueron conocer la prevalencia de los agentes etiológicos de las IU por levaduras en 14 hospitales de la Red de Micología de la Ciudad Autónoma de Buenos Aires (Argentina), evaluar el valor de una segunda muestra y correlacionar los resultados de la primera con la segunda muestra de orina.
Materiales y métodosDiseño del estudioSe llevó a cabo un estudio multicéntrico retrospectivo observacional de muestras de orina durante un año (del 1 de noviembre de 2011 al 31 de octubre de 2012) en 14 hospitales pertenecientes a la Red de Micología de la Ciudad Autónoma de Buenos Aires.
Población objeto de estudioEl estudio incluía pacientes adultos y pediátricos de ambos sexos hospitalizados en UCI (terapia intensiva, terapia intermedia, unidad coronaria, neonatología y terapia pediátrica).
MuestrasSe incluyeron las orinas recogidas de las siguientes formas: orina de chorro medio, al acecho, punción de sonda vesical, por nefrostomía, por cateterismo o por punción suprapúbica. Todas las muestras se tomaron de forma estéril y se conservaron a 4–8°C hasta su procesamiento.
Procesamiento de los urocultivosSe realizó examen directo del sedimento obtenido del centrifugado de 10ml de orina; en los casos en que la muestra era escasa, se efectuó examen en fresco de una gota sin centrifugar. En el examen directo se cuantificaron leucocitos por campo (a 400 aumentos) en los siguientes rangos: 1 (de 0-1); 2 (de 2-5); 3 (de 6-10) y 4 (≥11). La presencia de levaduras se registró cualitativamente (presencia o ausencia).
El cultivo se realizó por siembra con asa calibrada en agar cistina-lactosa deficiente en electrolitos y se incubó durante 24h a 35-37°C. Si en el examen directo se observaron levaduras, la orina se sembró también en Sabouraud glucosado o agar cromogénico y se incubó durante 48h a 35–37°C. En las muestras tomadas por punción suprapúbica, nefrostomía, sonda vesical y cateterismo se sembraron también 100μl en medio de agar sangre o chocolate y la incubación se realizó durante 48h a 35–37°C. Se registró el recuento de colonias de 102 a ≥105UFC/ml11,16,27,29.
Cuando hubo desarrollo de levaduras en la primera muestra, se solicitó un segundo urocultivo para diferenciar contaminación de colonización o IU por levaduras, excepto en los casos de punción suprapúbica, neonatos o pacientes inmunodeprimidos graves. De acuerdo con el trabajo de Kauffman et al.22 la contaminación puede ser diferenciada de la colonización o la infección mediante la obtención de una nueva muestra de orina para verificar la funguria, pero es difícil diferenciar colonización e infección solamente con los datos del cultivo microbiológico.
Las levaduras se identificaron según las técnicas de la guía práctica de identificación y diagnóstico en Micología Clínica26. Se confeccionó una planilla donde se anotaron los datos del paciente y los resultados del examen directo y el cultivo.
Análisis estadísticoPara analizar si hubo algún tipo de asociación entre el recuento de leucocitos del examen directo y el recuento de colonias de levaduras en el cultivo se utilizó el test de Chi2 de Pearson con el programa estadístico Statistix 8.0.
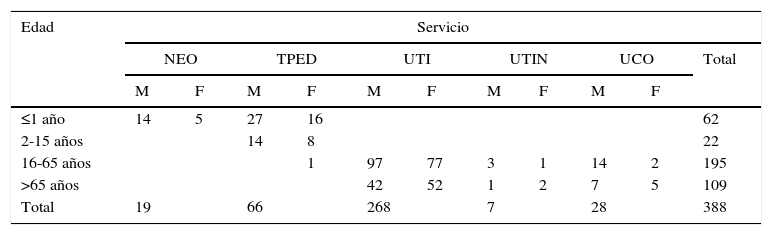
ResultadosDe los 4.694 urocultivos procesados, 1.720 presentaron desarrollo microbiano (36,6%) y 572 (12,2% del total) de ellos correspondieron a levaduras. Las 572 muestras de orina procesadas para estos últimos provenían de 388 pacientes: 304 eran pacientes adultos (16-91 años) y 84 pediátricos (22 de 2 a 15 años y 62 ≤1 año), y 219 eran de sexo masculino (56,4%) y 169 de sexo femenino (43,6%) (tabla 1).
Distribución por edad, sexo y servicio de los 388 pacientes con fungurias
| Edad | Servicio | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| NEO | TPED | UTI | UTIN | UCO | Total | ||||||
| M | F | M | F | M | F | M | F | M | F | ||
| ≤1 año | 14 | 5 | 27 | 16 | 62 | ||||||
| 2-15 años | 14 | 8 | 22 | ||||||||
| 16-65 años | 1 | 97 | 77 | 3 | 1 | 14 | 2 | 195 | |||
| >65 años | 42 | 52 | 1 | 2 | 7 | 5 | 109 | ||||
| Total | 19 | 66 | 268 | 7 | 28 | 388 | |||||
F: femenino; M: masculino; NEO: neonatología; TPED: terapia pediátrica; UCO: unidad coronaria; UTI: terapia intensiva; UTIN: terapia intermedia.
En los pacientes pediátricos la proporción de niños de sexo masculino fue mayor con una diferencia estadísticamente significativa (p=0,0064). Entre la población adulta la IU por levaduras fue más frecuente entre los varones menores de 65 años (p=0,0464). Entre los mayores de 65 años no hubo diferencia entre sexos (p=0,4435).
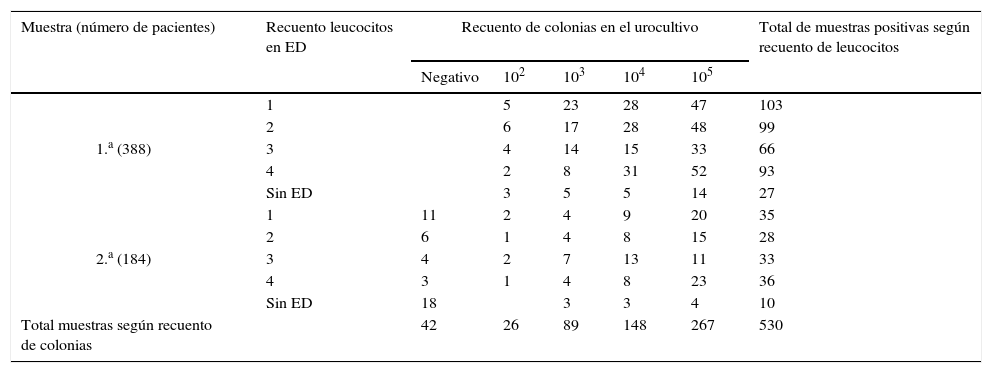
El tipo de muestra de orina de los 388 pacientes se presenta en la tabla 2. Se analizaron 388 primeras muestras y 184 segundas muestras. Además, en 20 pacientes se obtuvo una tercera muestra y en 7 de ellos también una cuarta. En el examen directo se observaron levaduras en 302 (77,8%) de las primeras muestras y en 114 (80,2%) de 142 segundas muestras positivas. En 24 primeras muestras y 28 segundas muestras no se realizó examen directo por escaso material. Se registraron los recuentos de 102 a ≥105UFC/ml. En la tabla 3 se muestra la relación entre el recuento de leucocitos y el número de UFC de levaduras.
Distribución de las muestras según tipo de toma de muestra en los 388 pacientes con fungurias
| Tipo de toma de muestra | N.° de pacientes (%) |
|---|---|
| Orina por sonda vesical | 329 (84,8) |
| Orina de nefrostomía | 2 (0,5) |
| Orina por catéter | 2 (0,5) |
| Orina chorro medio | 18 (4,6) |
| Orina al acecho | 28 (7,2) |
| Punción suprapúbica | 9 (2,3) |
Relación entre el número de leucocitos y el recuento de colonias en la primera y en la segunda muestra de orina
| Muestra (número de pacientes) | Recuento leucocitos en ED | Recuento de colonias en el urocultivo | Total de muestras positivas según recuento de leucocitos | ||||
|---|---|---|---|---|---|---|---|
| Negativo | 102 | 103 | 104 | 105 | |||
| 1.a (388) | 1 | 5 | 23 | 28 | 47 | 103 | |
| 2 | 6 | 17 | 28 | 48 | 99 | ||
| 3 | 4 | 14 | 15 | 33 | 66 | ||
| 4 | 2 | 8 | 31 | 52 | 93 | ||
| Sin ED | 3 | 5 | 5 | 14 | 27 | ||
| 2.a (184) | 1 | 11 | 2 | 4 | 9 | 20 | 35 |
| 2 | 6 | 1 | 4 | 8 | 15 | 28 | |
| 3 | 4 | 2 | 7 | 13 | 11 | 33 | |
| 4 | 3 | 1 | 4 | 8 | 23 | 36 | |
| Sin ED | 18 | 3 | 3 | 4 | 10 | ||
| Total muestras según recuento de colonias | 42 | 26 | 89 | 148 | 267 | 530 | |
ED: examen directo.
De las 27 orinas correspondientes a las terceras y cuartas muestras, 15 resultaron negativas en tanto que en 11 terceras muestras y en una cuarta muestra se encontró Candida spp., por lo que el total de aislamientos registrados ascendió a 542.
No se encontró asociación estadísticamente significativa entre el recuento de leucocitos y el número de UFC de levaduras (p=0,2961).
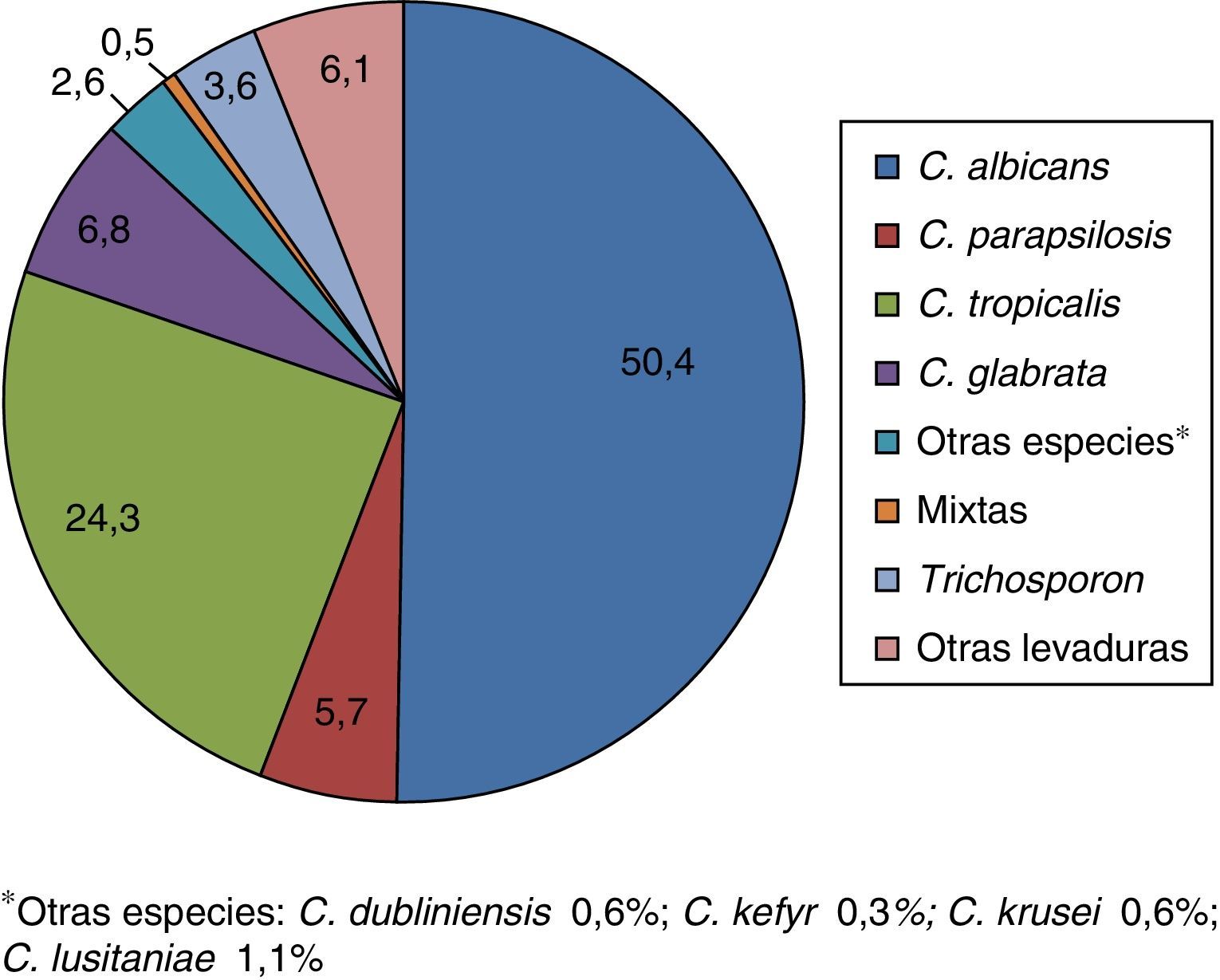
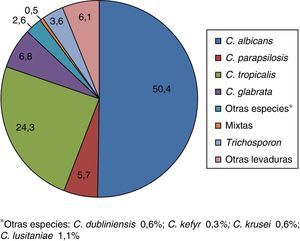
La distribución por especies de las 542 levaduras se presenta en la figura 1. En 3 casos se obtuvieron cultivos mixtos (2 por C. albicans+Candida glabrata y uno por Candida tropicalis+Candida parapsilosis).
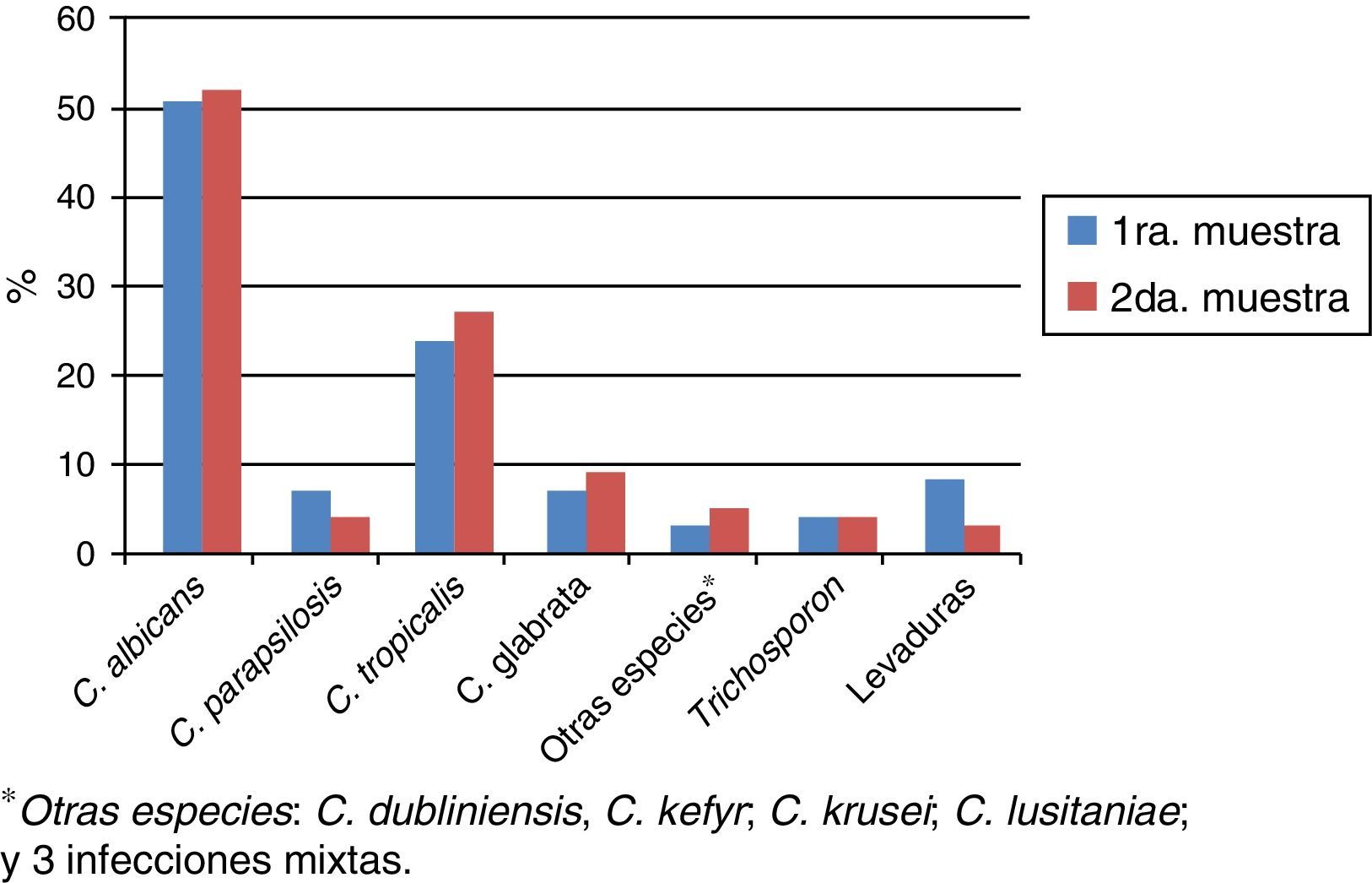
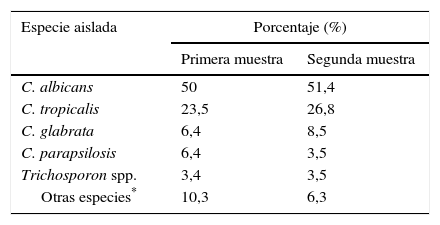
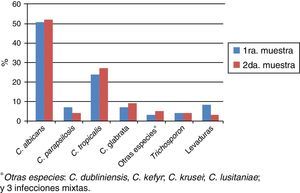
La distribución porcentual de las especies de levaduras aisladas en la primera y segunda muestra se presentan en la tabla 4. No hubo diferencia estadísticamente significativa en la proporción de dichas especies entre ambas muestras.
Distribución de las especies en la primera y segunda muestra de orina
| Especie aislada | Porcentaje (%) | |
|---|---|---|
| Primera muestra | Segunda muestra | |
| C. albicans | 50 | 51,4 |
| C. tropicalis | 23,5 | 26,8 |
| C. glabrata | 6,4 | 8,5 |
| C. parapsilosis | 6,4 | 3,5 |
| Trichosporon spp. | 3,4 | 3,5 |
| Otras especies* | 10,3 | 6,3 |
De las 184 segundas muestras, en 129 (70,1%) se aisló la misma especie que en la primera muestra y en 6 (3,3%) las especies aisladas fueron diferentes. En 7 de las muestras no pudieron compararse los aislamientos porque no se había identificado la especie en la primera muestra, y en 42 (22,8%) no se obtuvieron aislamientos (fig. 2).
DiscusiónLas infecciones del tracto urinario son las más frecuentes dentro del ámbito hospitalario. La incidencia de las infecciones causadas por hongos en pacientes hospitalizados se ha incrementado en los últimos años, principalmente por especies de Candida23.
Las levaduras del género Candida son saprófitas y colonizan las superficies mucosas y los genitales externos, por lo que pueden ser aisladas de muestras de chorro medio de orina en <1% de población adulta sana17. Dentro del ámbito hospitalario, algunos estudios indican que el 10–15% de las IU son debidas al género Candida. Este porcentaje varía según el área del hospital: es mayor en las unidades de terapia intensiva, donde el porcentaje puede superar el 20%20,24,28. Existen varios factores de riesgo que favorecen el desarrollo de esta infección. En España, un estudio multicéntrico puso en evidencia que la edad superior a 65 años y el sexo femenino son factores de riesgo para la candiduria1. En el presente estudio no se encontró que la prevalencia fuera mayor en mujeres, ni en la población adulta, ni en la pediátrica. Con respecto a la edad, solamente el 35,5% de los adultos tenían más de 65 años.
Otros factores de riesgo incluyen la terapia antimicrobiana de amplio espectro, la colocación de catéter urinario, los procedimientos urológicos, la existencia de diabetes, las anormalidades urológicas, las enfermedades hematológicas, la terapia inmunosupresora, la estancia prolongada en UCI, la nutrición parenteral o la ventilación mecánica, entre otros1,18,23,24,28,31,36. En un estudio realizado por el NNIS entre 1992 y 1997 en UCI en los EE. UU., la infección urinaria por hongos fue más frecuente en los pacientes con catéter urinario que en aquellos que no lo tenían (31,6 vs. 21,1%). Platt et al. encontraron que Candida era el agente etiológico en el 26,5% de la infecciones urinarias relacionadas con un catéter vesical33,36,41,42. En nuestra casuística el 85% de los pacientes tenían colocado catéter vesical, si bien no se registraron otros factores de riesgo mencionados en otras publicaciones.
Un problema común es decidir si la presencia de levaduras en la orina representa una infección o es meramente una colonización o contaminación10. La contaminación de la orina puede ocurrir si la muestra no se tomó o transportó en las condiciones adecuadas. La colonización se produce en general por la adherencia y el establecimiento de las levaduras en los catéteres o cuerpos extraños (formación de biopelículas). Por lo tanto, el aislamiento de Candida en muestras de urocultivos no siempre es clínicamente significativo. El hallazgo de levaduras en la orina plantea problemas de interpretación y en las decisiones terapéuticas, debido a que el aislamiento en el urocultivo puede deberse a desde una simple colonización asintomática de la vejiga hasta a abscesos renales derivados de una diseminación hematógena. La colonización vesical se produce en pacientes con sonda vesical permanente, diabetes, o con obstrucción o intervenciones urinarias previas32,50. Generalmente las candidurias asintomáticas son benignas y no requieren tratamiento48: de ser posible deben corregirse los factores de riesgo y la sola eliminación de la sonda permite la erradicación de la candiduria en el 40% de estos pacientes, en tanto que el cambio del catéter lo hace en el 20%8. Sin embargo, la candiduria asintomática es un marcador de morbimortalidad en ancianos, diabéticos y pacientes debilitados8. En este estudio se procesaron 184/388 (47,4%) segundas muestras. Los cultivos correspondientes fueron negativos en 42 (22,8%), por lo que se consideró que el primer aislamiento correspondía a una contaminación. De las 142 (77,2%) muestras positivas, en 129 (70,1% del total) se aisló la misma especie que en la primera muestra. Aunque este dato fortalece el valor del hallazgo, desde el laboratorio no se pudo diferenciar si se trataba de colonización o infección.
El diagnóstico microbiológico de IU se basa en el examen directo y el cultivo. Dentro del examen directo (examen en fresco o sedimento) se evaluó la presencia de leucocitos y levaduras. La observación de más de 5-7 leucocitos/campo se considera indicativo de IU, pero en pacientes con catéteres urinarios, neutropénicos y varones asintomáticos este hallazgo pierde especificidad37,40. Desafortunadamente, como la candiduria ocurre con mayor frecuencia en esta población, el recuento de leucocitos no sería de utilidad para el diagnóstico en la mayoría de los casos22. En el presente estudio se evaluaron los recuentos de UFC/ml desde 102 a ≥105, y se correlacionaron con la observación de leucocitos en el examen directo, tanto en las primeras como en las segundas muestras, y no se encontró relación estadísticamente significativa entre ambos (p=0,2961).
La observación microscópica de levaduras en el sedimento urinario es la prueba que orienta al médico para el diagnóstico de una IU producida por hongos. Hace varios años se pensaba que la presencia de las seudohifas en el examen directo podría ayudar a distinguir colonización de infección, pero hoy en día se sabe que esto no es correcto ya que hay algunas especies de Candida que no producen seudomicelio y pueden causar igualmente infección22. En el estudio realizado se observaron levaduras en el 77,8% de las primeras muestras y en el 80,2% de las segundas muestras positivas. En algunos trabajos la presencia de levaduras es del 60,2%.
De acuerdo con diferentes publicaciones14,21,22,35,45, ni la presencia de leucocitos en la orina ni el recuento de colonias de levaduras en el cultivo son útiles en los pacientes con sonda permanente debido a que no discriminan colonización de infección fúngica. Tanto el uso de catéteres por períodos prolongados como la cateterización intermitente se asocian con inflamación de bajo grado y escasa presencia de glóbulos blancos.
Con respecto a los cultivos cuantitativos, los estudios realizados en la década de 1970 mostraron que los recuentos en UFC/ml de Candida no permitían discriminar entre infección y colonización, en contraste con lo que sucedía con las bacterias22,45. Navarro et al. demostraron con un modelo experimental murino en el que se inoculó Candida por vía intravenosa que los recuentos de colonias en la orina no se correlacionaban con el número de organismos encontrados en el riñón34.
La gran mayoría de las infecciones fúngicas en riñón y vejiga son causadas por C. albicans y otras especies de Candida. Otros hongos pueden estar implicados como resultado de una infección diseminada, como Aspergillus, Fusarium, Trichosporon, mucorales, Cryptococcus neoformans, hongos dematiáceos y hongos dimorfos (Histoplasma capsulatum, Coccidioides, Paracoccidioides, etc.)3,15,21,28,45. Entre las distintas levaduras implicadas en esta afección, C. albicans es la predominante y representa el 50-70% de los aislamientos1,6,23,45. Las otras especies del género Candida han incrementado su incidencia de forma considerable en los últimos años, pero la prevalencia puede cambiar según el servicio clínico, la región geográfica y la edad del paciente4,20,24,38,43,45.
En el presente estudio, C. albicans fue la especie más frecuente (50,4%), seguida por C. tropicalis (24,4%), C. glabrata (6,8%), C. parapsilosis (5,7%), Trichosporon spp. (3%) y otras levaduras (4%). En otros estudios también se ha observado que C. albicans es la especie más aislada, seguida por C. tropicalis4,24,38. En los estudios realizados por da Silva et al.12 y por Weinberger et al.49, la distribución de las principales especies fue la misma que en este estudio pero con un porcentaje más elevado de C. glabrata (11 y 15% respectivamente). Por otra parte, el aislamiento de C. glabrata como segundo agente causal de candiduria ha sido observado por otros autores con una incidencia entre el 10 y el 35%20,21,23,43,45 principalmente en pacientes con neoplasias hematológicas y en trasplantados renales, que tienen un mayor riesgo de presentar infecciones por dicha especie. En el trabajo de Safdar et al.43 los pacientes trasplantados renales tenían IU por C. glabrata en aproximadamente el 50% de los casos y por C. albicans en el 30% de ellos. Este es el trabajo con más alta frecuencia de C. glabrata como causante de IU20,21.
ConclusionesC. albicans fue la especie aislada con mayor frecuencia, al igual que en la mayoría de los trabajos publicados, seguida de C. tropicalis. Otras especies como C. glabrata y C. parapsilosis aparecieron en menor proporción. No se encontró correlación estadísticamente significativa entre el recuento de leucocitos y el número de UFC, en coincidencia con otras publicaciones. El examen directo resultó de utilidad para la observación de las levaduras en el 80% de las primeras y las segundas muestras analizadas. La candiduria se confirmó con el aislamiento de la misma especie en la segunda muestra en el 70% (129/184) de los casos.
En el presente estudio solo se evaluó la distribución por edad y sexo. No se encontró que la prevalencia fuera mayor en mujeres, ni en la población adulta ni en la pediátrica. Con respecto a la edad solo el 35,5% de los adultos tenían más de 65 años.
El diagnóstico de la IU causada por levaduras sigue siendo un problema de difícil resolución, y los datos que aporta este trabajo confirman los hallazgos de numerosos autores, especialmente con respecto a las especies de Candida que se aíslan con mayor frecuencia, y reafirman el valor diagnóstico de la observación de levaduras en el examen directo. Sin embargo, no coincide con la mayor prevalencia en mujeres y adultos mayores de 65 años. No se encontró un punto de corte para el recuento de colonias que permita diferenciar IU de colonización.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Red de Micología de la Ciudad Autónoma de Buenos Aires: Mariela Schijman (Hospital Álvarez), Laura López Moral (Hospital Argerich), Silvana Cataldi (Hospital Durand), Manuela Gamarra (Hospital Gutiérrez), Mario Bianchi (Hospital Muñiz), Ana María Romeo (Hospital Penna), Nora Franco (Hospital Piñero), Gabriela Snitman (Hospital de Quemados), Mónica López (Hospital Ramos Mejía), Andrea Marucco (Hospital Santojanni), Adriana Sorge (Instituto Roffo).