Candida auris es una nueva especie de Candida responsable de diversos brotes nosocomiales en varios países del mundo, incluida España; es resistente al fluconazol y se han descrito cepas multi y panresistentes. Presenta una elevada transmisibilidad y extensa supervivencia en el entorno hospitalario, lo que es causa de brotes de larga duración difíciles de detectar en fases tempranas y dificulta su control e intento de erradicación. C.auris constituye actualmente una amenaza emergente para la salud global.
Para limitar el impacto y facilitar el control de la infección por C.auris, el presente documento ofrece un conjunto de recomendaciones basadas en las experiencias obtenidas en los brotes de España y del Reino Unido, elaboradas por un equipo multidisciplinar. La puesta en marcha de medidas de vigilancia y control es esencial para evitar la propagación del brote, que puede prolongarse en el tiempo y representar así un riesgo importante para los pacientes quirúrgicos complejos, críticos e inmunocomprometidos. La notificación inmediata del aislamiento de C.auris a los equipos clínicos y de control de infecciones, así como a las autoridades e instituciones sanitarias, es esencial para implementar las medidas de control de infecciones a todos los niveles y escalas de manera oportuna, para evitar la transmisión interna e intercentros, y para garantizar la vigilancia y la prevención del desarrollo de infecciones en pacientes que ya se encuentran colonizados.
Candida auris is a new species of Candida that causes nosocomial outbreaks in several countries around the world, including Spain. C.auris is resistant to fluconazole and multi- and pan-resistant strains have been described. It is highly transmissible and can survive long term in the hospital environment, causing long-lasting outbreaks that are difficult to detect in early stages, and making it difficult to control and eradicate. It is currently an emerging threat to global health.
This document provides a set of guidelines, developed by a multidisciplinary team, to limit the impact and facilitate the control of C.auris infection based on the experiences gathered in the Spanish and English outbreaks. The implementation of early and strict surveillance and control measures is essential to prevent the spread of the outbreak, which can spread over time, posing a significant risk to complex, critical and immunocompromised surgical patients. Immediate notification of C.auris isolation to clinical and infection control teams, as well as to health authorities and institutions, is essential to implement infection control measures at all levels in a timely manner, to prevent internal and inter-centre transmission, and to ensure a proper surveillance and prevention to patients who are already colonized and can develop an infection.
Candida auris se describe por primera vez en el año 2009, al ser aislada en el cultivo de una secreción del canal auditivo de un paciente en Japón24. Los primeros casos de candidemia se describieron en Corea en 201114. Desde entonces, C.auris ha causado brotes de infección nosocomial en varios países del mundo, más de 20 en los cinco continentes, siendo motivo de una alerta mundial5-7 debido, entre otros factores, a su patrón de resistencia a los antifúngicos que limita las actuales opciones terapéuticas4. C.auris se ha asociado con brotes de transmisión tanto intra como interhospitalarios por cepas clonales en múltiples países26, y la tasa de mortalidad cruda intrahospitalaria a los 30días en la candidemia por C.auris oscila entre el 33 y el 72%11. En abril de 2016 se detectó el primer caso de candidemia por C.auris en España, y desde entonces se han observado más de 300 casos con un brote activo y al menos cuatro centros hospitalarios españoles implicados con algún caso aislado por esta levadura22.
El objetivo de este trabajo es ofrecer un documento científico con una serie de recomendaciones básicas que puedan ayudar en el control de la infección por esta levadura a partir de las experiencias obtenidas en los brotes de España23 y Reino Unido25, y servir así de orientación práctica ante la aparición de nuevos casos en otros hospitales. Para consensuar estas recomendaciones se creó un equipo multidisciplinar de profesionales sanitarios (especialistas en microbiología, enfermedades infecciosas, medicina preventiva, medicina intensiva y enfermeras de control de la infección) que incluía expertos del Grupo de Estudio de Micología Médica e Infección Fúngica de la SEIMC (GEMICOMED) y del Grupo de Estudio de la Infección Relacionada con la Asistencia Sanitaria de la SEIMC (GEIRAS-GEIH), personal del hospital Universitario y Politécnico La Fe implicado en el manejo del brote nacional, y la colaboración especial de la Dra. Silke Schlenz, responsable del control del primer brote en el Royal Brompton Hospital (Reino Unido). Por tanto, las recomendaciones que se ofrecen a continuación están basadas principalmente en la experiencia adquirida en el manejo de los dos primeros brotes hospitalarios de C.auris en Europa.
Principales características de Candida aurisC.auris es una levadura perteneciente al género Candida que posee unas características propias no observadas previamente en otras especies del mismo género:
- •
Es difícil de identificar en el laboratorio asistencial, ya que las técnicas habituales de identificación de levaduras (basadas en la asimilación/fermentación de hidratos de carbono) no incluyen esta nueva especie en sus bases de datos, por lo que la confunden con otras especies (Candida haemulonii, Candida duobushaemulonii, Candida famata, Candida sake, Candida guilliermondii, Candida lusitaniae, Candida parapsilosis, Rhodotorula glutinis o Saccharomyces cerevisiae)4,16.
- •
Presenta una elevada resistencia a los antifúngicos (más del 90% de los aislamientos son resistentes al fluconazol, el 50% al voriconazol, el 30% a la anfotericinaB y el 7% a las equinocandinas), y puede ser resistente a dos clases (41%) y hasta a tres clases (4%) diferentes de antifúngicos4,15. Por lo tanto, es la primera especie del género Candida en la que se han descrito aislamientos panresistentes.
- •
Se trasmite rápidamente entre pacientes y su presencia en el entorno hospitalario es prolongada, lo que causa brotes de larga duración difíciles de detectar en fases tempranas y dificulta su control y su erradicación28.
- •
Es resistente a los desinfectantes comúnmente utilizados en el medio hospitalario basados en amonio cuaternario13.
- •
Causa infecciones clínicas, muchas de ellas graves y complejas, que se presentan como candidemia y/o candidiasis invasora en casi todas sus formas, de difícil tratamiento en pacientes de riesgo. El 20-25% de los pacientes colonizados pueden llegar a desarrollar infección23.
En el medio hospitalario la transmisión se produce a partir del contacto directo con un paciente colonizado o infectado por C.auris o, indirectamente, a través del personal sanitario, fómites o superficies contaminadas (mesas, camas, equipamiento médico, etc.) en el entorno inmediato de pacientes colonizados o infectados por C.auris, ya que esta especie es capaz de sobrevivir durante varias semanas en superficies plásticas no porosas30. En la tabla 1 se resumen las superficies hospitalarias y fómites de donde se ha aislado C.auris en diferentes estudios18,21,25,28,29.
Superficies hospitalarias y fómites de donde se ha aislado Candida auris en diferentes estudios18,21,25,28,29
| Prendas de lencería / ropa de cama |
| Punta de catéter |
| Mobiliario (sillas, mesas, cama) |
| Elementos fijos de la habitación (suelo, ventanas) |
| Barandillas de la cama |
| Asideros de lavabo |
| Colchones |
| Pantallas de monitores |
| Alféizares |
| Teléfonos, botones de llamada |
| Asientos de inodoro |
| Manillas de las puertas |
| Manguitos de esfigmomanómetros |
| Termómetros |
| Paredes |
| Parabanes de separación entre pacientes |
| Bombas de perfusión de medicamentos |
| Teclados de ordenador |
| Desagüe de equipo de diálisis |
| Otros dispositivos médicos |
A diferencia de otras especies, C.auris puede crecer a 40°C; en los medios cromogénicos desarrolla colonias de color blanco-rosado, similares a las de C.parapsilosis. Como ya ha sido reseñado, las técnicas comerciales disponibles para la identificación de levaduras basadas en pruebas bioquímicas (API-20C AUX®, VITEK-2 YST®, BD-Phoenix®, MicroScan® o Auxacolor®) no identifican correctamente C.auris. Por lo tanto, la identificación definitiva de esta nueva especie debe realizarse mediante técnicas moleculares, como la secuenciación de las regiones ITS o D1/D2 del ADN ribosomal fúngico10,12,20. No obstante, en los laboratorios asistenciales puede realizarse una identificación fiable y precisa de C.auris mediante dispositivos MALDITOF MS (VITEK MS® o Bruker Biotyper®) utilizando bases de datos actualizadas o la versión Research Use Only (RUO) de estos sistemas9.
En la práctica, si se utiliza un panel de identificación bioquímico, la presencia de C.auris debe sospecharse ante todo aislamiento identificado como R.glutinis, S.cerevisiae, C.haemulonii, C.famata, C.sake u otras especies de Candida no-C.albicans con una concentración mínima inhibitoria (CMI) de fluconazol inusualmente elevada (>256mg/l) u otro patrón de resistencia que no se corresponda con el habitual de la especie identificada. Como método de cribado se aconseja subcultivar los aislamientos de Candida en un medio cromogénico (CHROMagar Candida®, por ejemplo) suplementado con 32mg/l de fluconazol o incubar los medios de cultivo a 40°C.
Cuando no se dispone de los medios necesarios para identificar esta especie se recomienda contactar con el laboratorio de referencia local más próximo y con el laboratorio nacional de referencia CNM-ISCIII (Centro Nacional de Microbiología, Instituto de Salud CarlosIII).
Actuación ante la sospecha y confirmación de casos por Candida aurisDefinición de casoDebe considerarse «caso» a toda persona con un aislamiento de C.auris en alguna de las muestras de cribado epidemiológico (colonización) y/o con infección clínica demostrada por C.auris.
Sospecha de casoSe debe sospechar un caso de C.auris en:
- 1)
Pacientes con muestra clínica o de cribado en la que se observe crecimiento de levaduras con fenotipo compatible.
- 2)
Pacientes que provengan de centros en los que haya habido un brote de C.auris previamente.
- 3)
Pacientes que hayan tenido contacto directo con un caso confirmado de C.auris.
Cuando se sospeche de la existencia de un caso se recomienda:
- 1)
Identificar la especie aislada mediante secuenciación (regiones D1-D2 o ITS) o MALDITOF (siempre que la especie esté incluida en la base de datos de referencia del equipo).
- 2)
Instaurar con estos pacientes las precauciones específicas de transmisión por contacto hasta la confirmación por parte del laboratorio de que C.auris no parece estar presente en las muestras estudiadas (tabla 2).
Tabla 2.Precauciones de contacto y medidas de prevención en situaciones de sospecha de caso
1. Habitación individual • Aislamiento de los pacientes afectados en habitaciones individuales o, si no es posible, agrupar pacientes afectados en el mismo recinto y separados físicamente de los pacientes libres de colonización/infección (cohorte) • Solo se permitirá compartir habitación entre pacientes afectados/colonizados por C.auris en casos consensuados con el equipo de control de infecciones • La puerta de la habitación estará siempre cerrada • Intensificación de la limpieza de habitaciones hasta dos o tres veces/día • Cuando el paciente sea dado de alta deberá realizarse una desinfección final con hipoclorito sódico u otro agente fungicida comparable (tabla 3). Deben tomarse posteriormente muestras ambientales para comprobar que la desinfección ha sido adecuada. Las nuevas soluciones tecnológicas, como la desinfección de espacios y habitaciones mediante luz ultravioleta (UV-C), podrían ser de ayuda, aunque en el caso de C.auris y otras especies de Candida se ha descrito una resistencia relativa al efecto letal de este procedimiento pese a los prometedores resultados iniciales en el uso hospitalario 2. Personal sanitario • Mejorar el cumplimiento de las medidas de precaución estándar y especialmente de la higiene de manos • Utilizar guantes y bata desechables siempre que se tenga que mantener contacto con el paciente o su entorno • Eliminar todo el equipo de protección individual con un orden establecido de retirada (primero los guantes, después la bata y, si es el caso, la mascarilla) antes de salir de la habitación y efectuar higiene de manos • Añadir precauciones frente a la trasmisión por gotas cuando se aísla C.auris en secreciones respiratorias debido al riesgo de salpicaduras y pequeñas aerosolizaciones si se está a menos de un metro de distancia del paciente 3. Visitas y acompañantes • Informar a los familiares o cuidadores principales de los requerimientos de las precauciones por contacto y de las medidas a tomar • Las visitas serán restringidas • Limitar la entrada y circulación de familiares y visitantes en la unidad o sala con presencia de casos o brote activo 4. Material y equipamiento médico • Siempre que sea posible se usará material no compartido con otros pacientes • Dejar en la habitación (estancia o box), para uso exclusivo del paciente, esfigmomanómetro, fonendoscopio, termómetro, contenedor de material punzante, juguetes, etc. y limpiarlos (según protocolo) hasta la supresión de las precauciones de contacto • El material de utilización ocasional (ECG, pulsioxímetros, portátil de radiografías, ecógrafo a «pie de cama», etc.) debe limpiarse y desinfectarse antes de salir de la habitación para dejarlos preparados para el uso de otro paciente. Si se han establecido cohortes de pacientes, asegurar que la cohorte de pacientes colonizados o infectados no comparte material con el resto de pacientes no afectados de la unidad o sala 5. Transporte del paciente • Reducir los desplazamientos intra e interhospitalarios al mínimo imprescindible por necesidades clínicas o de manejo. Cerciorarse de que las zonas infectadas o colonizadas del cuerpo del paciente están tapadas con apósito o ropa limpia durante el transporte • El personal que acompañe al paciente debe utilizar equipo de protección individual para realizar el transporte
Una vez confirmado el caso se recomiendan las siguientes actuaciones:
- 1)
Realizar un cribado de todos los contactos directos del caso. Para un muestreo completo se recomienda tomar muestras de axila, orofaringe, fosas nasales, ingle, orina y recto. En caso de no ser factible tomar muestras de las localizaciones referidas, como mínimo se obtendrán muestras de fosas nasales/orofaringe, recto, ingle o axila.
- 2)
Cuando se detecte un caso en un paciente hospitalizado es recomendable valorar la posibilidad de realizar el cribado a todos los pacientes que entren en la misma sala de hospitalización, especialmente en la UCI, debido a los factores de riesgo asociados.
- 3)
Deben iniciarse o mantenerse (si ya se han iniciado) las precauciones tanto estándares como de contacto (tabla 2) de todos los casos confirmados.
- 4)
Es muy recomendable aprovechar esta situación para reforzar la formación de todo el personal sanitario (facultativos, enfermería, auxiliares, celadores) y de limpieza que atiende a los pacientes afectados.
- 5)
Mientras el paciente permanezca hospitalizado se deben realizar cultivos de vigilancia una vez por semana hasta el alta o, si no es posible, al menos hasta cumplir 4 semanas después de su negativización.
- 6)
Deben aplicarse con estos pacientes las medidas de control mientras permanezcan hospitalizados, ya que se han dado numerosos casos de complicaciones secundarias (varias semanas después de resolverse el episodio de candidemia) o ha reemergido el estado de colonización o de portador8,23. En el caso de que esto no sea posible, después de tres muestras de vigilancia negativas obtenidas en muestreos consecutivos (siendo al menos una de las muestras de orina) se puede considerar que el paciente tiene «carga indetectable» y se podrían suprimir las medidas de control.
- 7)
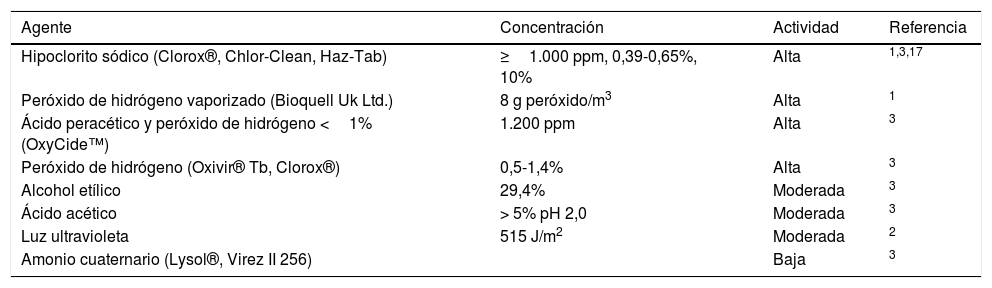
Es imprescindible realizar una limpieza intensa y completa de las instalaciones que ha ocupado el paciente y del material no desechable empleado en sus cuidados con un agente activo frente a esta especie (tabla 3), respetando los tiempos de contacto indicados por el fabricante para cada producto.
Tabla 3.Actividad de los desinfectantes de uso hospitalario sobre Candida auris
Agente Concentración Actividad Referencia Hipoclorito sódico (Clorox®, Chlor-Clean, Haz-Tab) ≥1.000 ppm, 0,39-0,65%, 10% Alta 1,3,17 Peróxido de hidrógeno vaporizado (Bioquell Uk Ltd.) 8 g peróxido/m3 Alta 1 Ácido peracético y peróxido de hidrógeno <1% (OxyCide™) 1.200 ppm Alta 3 Peróxido de hidrógeno (Oxivir® Tb, Clorox®) 0,5-1,4% Alta 3 Alcohol etílico 29,4% Moderada 3 Ácido acético > 5% pH 2,0 Moderada 3 Luz ultravioleta 515 J/m2 Moderada 2 Amonio cuaternario (Lysol®, Virez II 256) Baja 3 - 8)
Se aconseja la búsqueda retrospectiva de aislamientos de levaduras con patrón de resistencia atípico o identificación compatible para confirmar o descartar la presencia previa de C.auris en el centro.
- 9)
Todos los pacientes colonizados o infectados por C.auris que reciban el alta hospitalaria deben ser marcados con una alerta informática (trazabilidad) para facilitar su identificación en futuros ingresos hospitalarios. Además, se les debe realizar un cribado microbiológico al entrar de nuevo en contacto con el sistema sanitario y tratar como una «sospecha de caso» hasta que se descarte la colonización por C.auris.
El inicio de un brote por esta especie debe sospecharse cuando se presenten al menos dos casos en la misma sala, servicio o planta de hospitalización en el plazo de una semana o menos, o un mínimo de tres casos en el plazo máximo de un mes.
Manifestaciones clínicas de la infección por Candida aurisAl igual que otras especies de Candida, C.auris puede colonizar a pacientes sin desarrollar infección o causar infecciones invasivas8,23,25. C.auris se ha aislado en muestras clínicas normalmente estériles, incluyendo hemocultivos, líquido cefalorraquídeo y hueso, lo que implica la existencia de una infección invasiva8. Las infecciones pueden ser graves y complicadas, pero un detalle constatado por la experiencia española y extranjera es la persistencia de hemocultivos positivos durante más de cinco días, candidemia persistente e incluso candidemia recurrente23,25, a pesar de cumplir los estándares de calidad en el manejo de la candidemia, como son la administración de un tratamiento antifúngico precoz y apropiado, ajustado según pruebas de sensibilidad in vitro, el control del foco potencial de origen y la retirada del catéter vascular si estuviera implicado, la realización de hemocultivos de control y la observación del fondo de ojo. En la experiencia en España se han documentado episodios de espondilodiscitis, así como un número relevante de endocarditis y otras infecciones endovasculares23.
C.auris también ha sido aislada en otras muestras clínicas, como orina, tracto respiratorio, secreciones oculares, heridas, líquido pleural, líquido peritoneal, líquido biliar, oído, biopsia intestinal, fosas nasales, piel y secreciones vaginales8. Algunos de estos aislamientos solo representan colonización local, no infección.
Manejo de los pacientes con infección por Candida aurisPara manejar adecuadamente a los pacientes infectados por C.auris se recomienda realizar un estudio de la sensibilidad antifúngica al menos a todos los aislamientos procedentes de hemocultivos y muestras estériles para seleccionar el antifúngico adecuado. Las infecciones por C.auris nunca deben ser tratadas con fluconazol o voriconazol.
Aunque no hay ninguna evidencia al respecto, no se recomienda tratar la colonización por C.auris. Sin embargo, se aconseja considerar la profilaxis en pacientes de alto riesgo colonizados antes de una cirugía o de procedimientos instrumentales invasivos seleccionados (cateterismo cardíaco, drenajes percutáneos, colocación de stents o endoprótesis, implantación de derivaciones o shunts, trasplante de órgano sólido, etc.).
Si se decide tratar un episodio de candiduria, se debe considerar la adición de 5-fluorocitosina al tratamiento antifúngico seleccionado y, en el caso de que el paciente esté sondado, debe retirarse o sustituirse la sonda vesical, según sea prescindible o necesaria. Debe recordarse la escasa eliminación por vía urinaria de las equinocandinas, sin que ello suponga una imposibilidad de uso. En determinados casos de candiduria refractaria puede también recurrirse a las irrigaciones vesicales con anfotericinaB desoxicolato.
En todo paciente infectado deben aplicarse estrictamente las recomendaciones de desinfección y mantenimiento de los puntos de inserción y conexiones de catéteres con clorhexidina al 2% en base alcohólica.
En pacientes de alto riesgo puede considerarse la descontaminación selectiva orofaríngea y/o digestiva con nistatina, clorhexidina acuosa o anfotericinaB (teniendo en cuenta el estudio de sensibilidad in vitro del aislamiento y/o el perfil de resistencias documentado en el brote).
La higiene/limpieza de los pacientes infectados debe realizarse dos veces al día con toallitas impregnadas en clorhexidina acuosa al 2% o, en su defecto, mediante lavado con clorhexidina jabonosa al 4%.
Creación y composición del equipo de control del broteAl igual que en otros brotes causados por bacterias y hongos relacionados con la asistencia sanitaria, se recomienda constituir, en el momento en que se detecte o exista un caso sospechoso, un equipo de control de brote en el que exista un coordinador. Este equipo estará formado preferentemente por: el responsable de la dirección médica o su representante; el responsable de la dirección de enfermería o su representante; el responsable del equipo de control de la infección o su representante; un facultativo representante del/de los servicio/s afectado/s; un microbiólogo; un infectólogo; el responsable de enfermería para la prevención y el control de la infección; el jefe de servicio de la unidad donde se ha detectado el caso. Este equipo realizará una evaluación de la situación y establecerá las medidas de control. En caso de confirmación de un brote puede ser recomendable ampliar el equipo incluyendo, además de los anteriormente citados, a un representante autorizado de la empresa de limpieza, el jefe de mantenimiento e ingeniería, un representante del gabinete de prensa o del equipo de comunicación del centro, el jefe de celadores y un representante de la Dirección de Salud Pública local (de la Consejería de Sanidad autonómica correspondiente).
Es importante remarcar que para el adecuado y rápido control del brote es esencial el apoyo institucional, tanto por parte de la dirección del hospital como de las direcciones generales de salud pública, mediante la movilización de recursos humanos y materiales y la implementación de medidas. Para más información, o ante cualquier duda, se recomienda contactar con GEMICOMED (gemicomed@seimc.org) y GEIRAS (seimc@seimc.org).
Indicación y realización de los estudios ambientalesAnte todo paciente infectado o colonizado por C.auris debe asumirse que el ambiente alrededor del mismo está contaminado21. Por lo tanto, se recomienda realizar un estudio ambiental cuando la evidencia epidemiológica apunte a la existencia de vínculos concretos entre fuentes ambientales específicas y el personal, o la transmisión persista a pesar de asegurar un cumplimiento estricto de las recomendaciones y medidas de intervención28.
No se dispone aún de recomendaciones universales sobre cómo realizar el muestreo ambiental, aunque algunos protocolos, como el propuesto por Shams et al.27 o por Piedrahita et al.19, han sido utilizados con éxito en la detección de C.auris en el entorno de los pacientes30. En la tabla 1 se reflejan las superficies hospitalarias y fómites de los que se ha aislado C.auris en diferentes estudios. Dependiendo de la superficie el muestreo puede realizarse con un hisopo o una gasa de algodón impregnados en suero salino. Posteriormente, el hisopo/gasa se incuba en medio de Sabouraud-cloranfenicol líquido durante tres días a 40-42°C o, en su defecto, a 37°C. Si se observa turbidez en el caldo, este debe subcultivarse en un medio cromogénico y las levaduras de morfología compatible se identificarán mediante MALDITOF o secuenciación.
Finalización del broteUn brote puede considerarse finalizado después de 12semanas sin detección de casos nuevos desde el alta hospitalaria del último paciente.
Otras recomendaciones útiles para el control del broteNo hay que olvidar que la detección de C.auris en el entorno hospitalario debe comportar el estudio profundo del caso índice, así como el cribado de los contactos directos de ese paciente.
La puesta en marcha de medidas precoces y estrictas de vigilancia y control es esencial para evitar la propagación del brote y prevenir que se alargue en el tiempo y represente un riesgo importante para los pacientes críticos e inmunodeprimidos. Además, la notificación inmediata de los nuevos aislamientos de C.auris a los equipos clínicos y de control de infecciones es esencial para implementar las precauciones de control de infecciones de manera oportuna y para garantizar la vigilancia del desarrollo de infecciones en pacientes colonizados.
Por último, el brote debe ser notificado a las autoridades sanitarias autonómicas y nacionales para su registro oficial e inmediata toma de decisiones en cuanto a medidas de prevención y control a escala superior, seguimiento de los pacientes afectados cuando son trasladados a otros hospitales, derivación de recursos humanos y materiales necesarios, y comunicación a los organismos europeos de seguimiento, como el Centro Europeo para la Prevención y Control de Enfermedades (ECDC).
FinanciaciónLos gastos necesarios para el pago de viajes para asistir a la reunión presencial fueron cubiertos con presupuesto del Grupo de estudio de Micología Médica de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (GEMICOMED-SEIMC). El resto del trabajo se realizó sin necesidad de otras fuentes de financiación.
Conflicto de interesesEn los últimos cinco años AA-I ha recibido honorarios por actividades educativas organizadas por Pfizer, Merck Sharp & Dohme, Gilead Sciences y fondos para investigación de Gilead Science, F2G, Amplix y Scynexis.
MFR ha recibido honorarios procedentes de Astellas Pharma, Gilead Sciences y Pfizer por impartir conferencias científicas.
CG-V ha recibido honorarios por charlas o consultoría de Gilead Sciences, Merck Sharp & Dohme, Pfizer, Janssen, Novartis y Lilly. Ha recibido fondos de Investigación de Gilead Sciences y Merck Sharp & Dohme. Está financiada con INTENSIFICACIÓ grant from the «Strategic plan for research and innovation in health-PERIS 2016-2020», del Ministerio de Sanidad y Consumo, Instituto de Salud CarlosIII [FIS PI15/00744], y pertenece al grupo de investigación FungiCLINIC (AGAUR)
JG ha recibido honorarios por actividades educativas en simposios organizados por Astellas, Gilead Sciences, Merck Sharp & Dohme, Scynexis, Pfizer y United Medical; ha recibido ayudas para proyectos realizados en el Instituto de Investigación Sanitaria Gregorio Marañón y fondos de investigación de Gilead Sciences, Scynexis y Cidara.
En los últimos cinco años MSL ha participado en actividades docentes, formativas y científicas organizadas o en colaboración con las empresas Pfizer, Gilead Sciences, Merck Sharp & Dohme, Janssen, Astellas Pharma y Angelini, y ha impartido conferencias o recibido ayudas y contribuciones para asistencia a congresos o proyectos de investigación.
MTM-G ha recibido en los últimos cinco años honorarios por actividades de formación continuada o apoyo para asistencia a las mismas de Pfizer, Merck Sharp & Dohme, Gilead Sciences, Vertex, Qidel y Chiesi.
En los últimos cinco años JP ha recibido fondos para investigación, honorarios o apoyo para asistencia a congresos de Pfizer, Gilead Sciences y Merck Sharp & Dohme.
LV ha recibido financiación para asistir a congresos de Gilead Sciences, Pfizer y Merck Sharp & Dohme.
PR ha recibido honorarios por actividades de formación continuada o apoyo para asistencia a las mismas de Pfizer, Merck Sharp & Dohme, Gilead Sciences y Novartis.
El resto de los autores no tiene conflicto de intereses.
Los autores agradecen a Silke Schelenz (Royal Brompton Hospital) su participación en la discusión y puesta en común de las experiencias recogidas en estas guías.