INTRODUCCIÓN
Actualmente se está intentando profundizar en el estudio de la fertilidad masculina. Dentro de este campo, el área que más auge tiene en este momento es el estudio de la integridad de la molécula del ADN en el espermatozoide1-5. Se trata de un parámetro que en principio se piensa que no está correlacionado o que es independiente de los parámetros que analizamos de forma rutinaria en el laboratorio, y puede ser que tenga efectos directos en la fecundación. Hay estudios que demuestran una relación con los parámetros rutinarios6,7. Todos consideran que es importante realizar esta prueba de forma complementaria en pacientes que tengan algún parámetro alterado.
El ADN del espermatozoide se encuentra unas 6 veces más compactado que el del cromosoma mitótico. Esta compactación en bucles es posible gracias a la acción de las protaminas intercaladas, que sustituyen a las histonas (proteínas asociadas al ADN en las etapas iniciales de la espermatogénesis formando los clásicos nucleosomas), las cuales estabilizan rígidamente la estructura a través de la formación de puentes disulfuro entre ellas8. Esta compactación es importante para proteger al genoma espermático de agentes externos como el estrés oxidativo, el paso a través del epididímo o el tracto reproductivo femenino, ya que una matriz nuclear estable es crucial en la participación del desarrollo embrionario y errores en la organización del material genómico pueden producir un serio impacto en el principio del desarrollo.
Los mecanismos que producen el daño están en parte identificados, pero la procedencia del daño, una vez que éste se localiza en el espermatozoide maduro no se puede identificar con facilidad. Se han propuesto 3 hipótesis principales que explicarían la presencia de ADN fragmentado en el espermatozoide.
En la primera se relaciona la existencia de roturas en la cadena del ADN en células maduras con el intercambio del complejo de histonas por el de protaminas que ocurre en el proceso de la espermiogénesis9. Este intercambio, dirigido a conseguir una mayor compactación de la molécula de ADN, genera cierto nivel de estrés en la torsión de la molécula de ADN, dado que existe un súper-enrollamiento heredado de la presencia de histonas. Para eliminar este tipo de tensiones y facilitar el reemplazamiento de las histonas por protaminas se genera un cierto nivel de roturas en las moléculas de ADN que serán posteriormente reparadas10.
La segunda hipótesis implica al proceso apoptótico. Con el concurso de enzimas nucleolíticas se generarían roturas de cadena doble en la molécula de ADN11-13, de manera similar a lo que puede ocurrir en las células somáticas14. La tercera hipótesis propone que la fragmentación del ADN es la consecuencia de un exceso de estrés oxidativo en el tracto reproductivo masculino. Los altos valores de especies reactivas de oxígeno (ROS) podrían ser consecuencia de su liberación por los leucocitos activados y/o macrófagos, por ejemplo, frente a una respuesta inflamatoria generada ante un proceso infeccioso. La presencia de células inmaduras en el eyaculado y que mantienen cantidades excesivas de citoplasma, como por ejemplo la presencia de gotas citoplasmáticas proximales o distales15-19, pueden también contribuir a provocar altos valores de oxidación de tipo endógeno en este caso. El estrés oxidativo puede desencadenarse cuando la producción de ROS supera la actividad de los agentes antioxidantes presentes en el plasma seminal, incluyendo enzimas tales como la superóxido dismutasa, la catalasa o la glutatión peroxidasa, así como agentes que bloquean la cascada de reacciones redox. Normalmente, este tipo de daño suele generar daños en las bases y roturas en una de las 2 hebras de la doble cadena del ADN.
Finalmente, debemos tener en cuenta que la presencia de ADN fragmentado en un espermatozoide maduro puede ser el resultado de procesos combinados, dado que los mecanismos propuestos en las 3 hipótesis no son excluyentes y lo más probable es que no operen como fenómenos aislados. Por ejemplo, se podría asumir que el proceso apoptótico y el daño generado por ROS puedan estar asociados y lo mismo podría ocurrir tras un proceso de espermiogénesis anormal con acumulación de roturas, hecho que podría ser detectado por el proceso de señalización de la apoptosis. Adicionalmente a todo este tipo de procesos en los que se produce un incremento en las tasas basales de daño espermático, el manejo de los espermatozoides de forma extracorporal puede generar también cierto daño en el ADN.
Hay diferentes metododologías para analizar la fragmentación del ADN. Estas técnicas las podemos dividir en 2 grupos, en el primero estarían las técnicas que marcan las roturas del ADN, porque incorporan moléculas marcadas con fluorocromos a los extremos de rotura como son TUNEL (terminal d-utp nick-end labeling) 20 e ISNT (in situ nick translation)14. El segundo incluye técnicas basadas en la capacidad de desnaturalización del ADN debido a las roturas de sus cadenas y frente a determinados tratamientos, en este grupo incluimos SCSA (sperm chromatin structure assay)21-23, DBD-FISH (DNA breakage detection-fluorescence in situ hybridation)24, COMETA25-27 y SCD (sperm chromatin dispersión).
Además, también hay otros métodos como el AO (naranja de acridina) o el TB (azul de toluidina)28,29 basados en propiedades metacromáticas.
- SCD. Se fundamenta en la compactación del ADN por acción de las protaminas y las relaciones de puentes disulfuro que se establecen entre ellas. Analiza la diferente descondensación de la cromatina al tratarse con un medio ácido seguido de una desproteinización rompiendo los enlaces disulfuro y relajando la molécula de ADN formando un halo de dispersión alrededor de la estructura nuclear central.
Observaremos diferentes tipos de halos, ya que el ADN no fragmentado producirá un halo de dispersión mayor que corresponde a los bucles de ADN mientras que el ADN fragmentado ve impedida la liberación de estos bucles dando lugar a halos de menor dispersión. Valoraremos el tamaño de estos halos de dispersión de la cromatina mediante microscopia, ya sea de fluorescencia o de campo claro.
La ventaja y a su vez desventaja es que los resultados no necesitan medir colores o intensidades de fluorescencia y, por tanto, tampoco necesitan de un equipo complejo como el citómetro de flujo ni personal especializado. Por el contrario, la determinación del resultado por distintos observadores puede introducir muchos errores, ya que es una interpretación subjetiva30,31.
- AO. El tipo de fluorescencia emitida por el AO depende de la existencia de tioles/disulfuros presentes en las protaminas nucleares que se asocian al ADN. Dicho fluorocromo se intercala en la doble hélice de ADN (asociada a protaminas ricas en enlaces disulfuro) como monómero generando una fluorescencia verde. Tras la desnaturalización de la doble hélice (asociada a protaminas ricas en enlaces tioles), el AO se une formando agregados, generando una fluorescencia naranja.
Es una de las metodologías alternativas nombradas anteriormente32. Utiliza el mismo principio del SCSA, ambos están basados en la susceptibilidad del ADN nuclear espermático en condiciones ácidas y las propiedades metacromáticas del AO, pero el resultado se observa en microscopia de fluorescencia. Aquí es donde radica el mayor problema de esta técnica, que es la subjetividad de la persona que evalúa la muestra, ya que hay toda una serie de tonalidades intermedias entre el verde y el naranja. Esto también ayuda a que los resultados no sean muy reproducibles y no distingue entre pacientes fértiles e infértiles33. En cambio otros autores indican que sí existen diferencias en los valores de AO en grupos con baja fertilidad y grupos control34. Como ya hemos dicho es una simplificación del método SCSA que no requiere ni citómetro de flujo ni a una persona experimentada, aunque esta técnica tiene un valor predictivo comprometido.
Estas metodologías son variadas, cada una tiene ventajas y desventajas dependiendo del lugar en el que vayamos a utilizarlas. Han sido y siguen siendo punto de mira y de crítica por diversos autores, y hay numerosos estudios en los que se compara su eficacia. Por ejemplo, el de Erenpreiss et al, 2004 en el que comparan la técnica de TB con el SCSA y el TUNEL28, o el de Donald y Evenson, 200529 donde se compara el SCD con el SCSA, entre otros.
MATERIAL Y MÉTODOS
Para el estudio hemos analizado 82 muestras de semen de pacientes en estudio de fertilidad de la clínica Tambre. En los 82 casos se analizaron los siguientes parámetros: concentración, movilidad, vitalidad espermática y fragmentación del ADN. Estos parámetros se midieron tras un tiempo licuefacción/licuación medio de 30 min. La concentración y la movilidad se valoran, para tener un conocimiento previo de la muestra a evaluar.
Para la concentración utilizamos una cámara Makler®. En ella colocamos 6 μl del eyaculado con el cubreobjetos y dejamos atemperar en la platina calefactada durante 1 min. El recuento lo realizamos en un microscopio de contraste de fases a 20×, siendo el procedimiento ideal de barrido el de zig-zag. La cámara Makler consta de 100 cuadraditos (10 × 10), contamos 10 de esos cuadraditos, ya sea en horizontal, vertical o en diagonal. Lo ideal es contar unas 3 veces los 10 cuadraditos y hacer una media. Este resultado se traduce en millones de spz/ml.
En la valoración de la movilidad tenemos que distinguir un aspecto cuantitativo, o porcentaje de espermatozoides con movilidad, y un aspecto cualitativo, o velocidad y direccionalidad de los espermatozoides móviles. La evaluación de la movilidad espermática a través de la observación directa con el microscopio óptico tiene un handicap importante a tener en cuenta, que es la objetividad, ya que la subjetividad de la observación por el operador puede distorsionar el resultado del análisis. Para su realización se colocan 6 μl del eyaculado en la cámara Makler y tras el minuto en la platina calefactada procedemos a valorar la movilidad en el microscopio ótico con objetivo de 20×. El recuento lo realizamos en un total de 100 spz y los dividimos en 4 categorías:
- Movilidad activa de grado 3 o categoría a: el movimiento espermático de traslación es rápido, rectilíneo y cuantitativamente más importante que el desplazamiento lateral de la cabeza.
- Movilidad activa de grado 2 o categoría b: el movimiento espermático de traslación es progresivo, pero cuantitativamente menor que en la movilidad activa de grado 3 y con frecuencia no rectilíneo.
- Movilidad activa de grado 1 o categoría c: el movimiento de traslación es mínimo o inexistente, y de amplitud semejante al desplazamiento lateral de la cabeza y la cola.
- Movilidad de grado 0 o categoría d: son espermatozoides inmóviles.
La OMS 1999 aconseja aceptar una muestra de semen como normal cuando al menos el 50% de los espermatozoides están dotados de movilidad progresiva (tipo a + tipo b) o cuando haya más de un 25% de tipo a. Se denomina astenozoospérmico cuando no se cumple este requisito de movilidad. Actualmente, estos valores han variado debido a la revisión realizada recientemente OMS 2010, pero en el momento del estudio éstos fueron los parámetros establecidos.
Vitalidad. Para la determinación del porcentaje de espermatozoides vivos se utilizó la tinción de AO-bromuro de etidio que requiere de microscopio de fluorescencia con filtro (Nikon B2A).
Colocamos sobre un portaobjetos una proporción 1:1 (v/v) de semen y la solución de AO-bromuro de etidio. Colocamos un cubreobjetos y procedemos a la lectura lo más rápido posible, ya que el porcentaje de los espermatozoides con ADN desnaturalizado aumenta conforme aumenta el tiempo de exposición. El recuento se realizó en 100 espermatozoides con objetivo 40×.
Se considera un eyaculado normal cuando hay más del 75% de espermatozoides sin teñir de color naranja.
Fragmentación. La fragmentación la medimos mediante el test SCD (Halosperm; Halotech-DNA S.L., Madrid, España).
Las muestras de semen se diluyeron con PBS (tampón fosfato salino) hasta alcanzar una concentración de entre 5 y 10 millones de espermatozoides por ml. A continuación se procesa con el kit SCD y para realizar la lectura de las muestras una vez secas se puede proceder de 2 formas: teñir los portaobjetos con Diff-Quick y observarlo en microscopio de campo claro, o con microscopio de fluorescencia añadiendo un fluorocromo. En nuestro caso, las muestras una vez procesadas se tiñeron con fluorocromo GelRed, y el recuento se realizó en 300 espermatozoides en un microscopio de fluorescencia con objetivo de 40×. Este fluorocromo es muy sensible, extremadamente estable y poco contaminante para el medio ambiente. Está diseñado para reemplazar el bromuro de etidio que es muy tóxico y sirve para teñir el ADN, ya sea de simple o doble cadena, y el ARN en geles de agarosa.
En cada muestra contabilizamos los espermatozoides en 3 grupos:
- Espermatozoides con halo grande y mediano: el grosor del halo es ≥ a la longitud del diámetro menor del core.
- Espermatozoides con halo pequeño: el grosor del halo es ≤ que un tercio del diámetro menor del core, pudiendo ser de forma irregular o prácticamente inapreciable.
- Espermatozoides sin halo y degradados: los que sin mostrar halo presentan el core fragmentado en gránulos o muestran una tinción muy débil.
La suma de los 2 últimos grupos nos da el valor del índice de fragmentación. Tras esta observación asumimos que los espermatozoides que contienen ADN fragmentado son los que no presentan halo de dispersión.
Análisis estadístico
Los resultados se expresan como medias ± desviación típica.
Se utilizó el test de la t de Student para estudiar la relación con las variables dicotómicas o nominales, y el ANOVA con las variables métricas. Una diferencia de p < 0,05 se ha considerado como estadísticamente significativa.
Para la elaboración de la base de datos se utilizó Microsoft Excel, para el análisis estadístico el paquete SPSS for Windows 11.5 y la representación gráfica de los resultados se realizó con Apple grapher 2.0 para la elaboración de las curvas de regresión logística.
RESULTADOS
En la tabla 1 se muestran los resultados de concentración espermática, movilidad total, porcentaje de espermatozoides muertos (valorados con AO) e índice de fragmentación de los 82 casos expresados como media ± desviación típica.
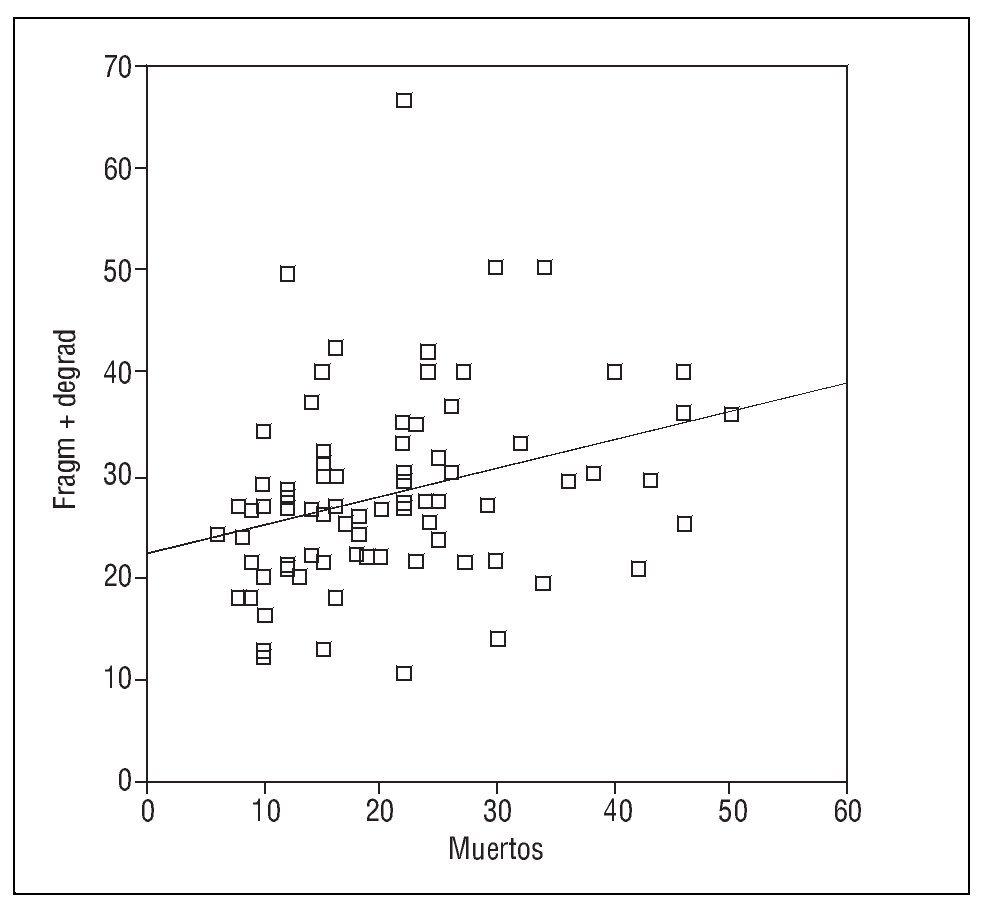
El porcentaje de espermatozoides con el ADN desnaturalizado (muertos) y con ADN fragmentado se correlaciona significativamente (r = 0,5; p < 0,001) (fig. 1).
Figura 1. Correlación entre el porcentaje de espermatozoides con anomalías de ADN medido con el test de fragmentación Halosperm y con naranja de acridina.
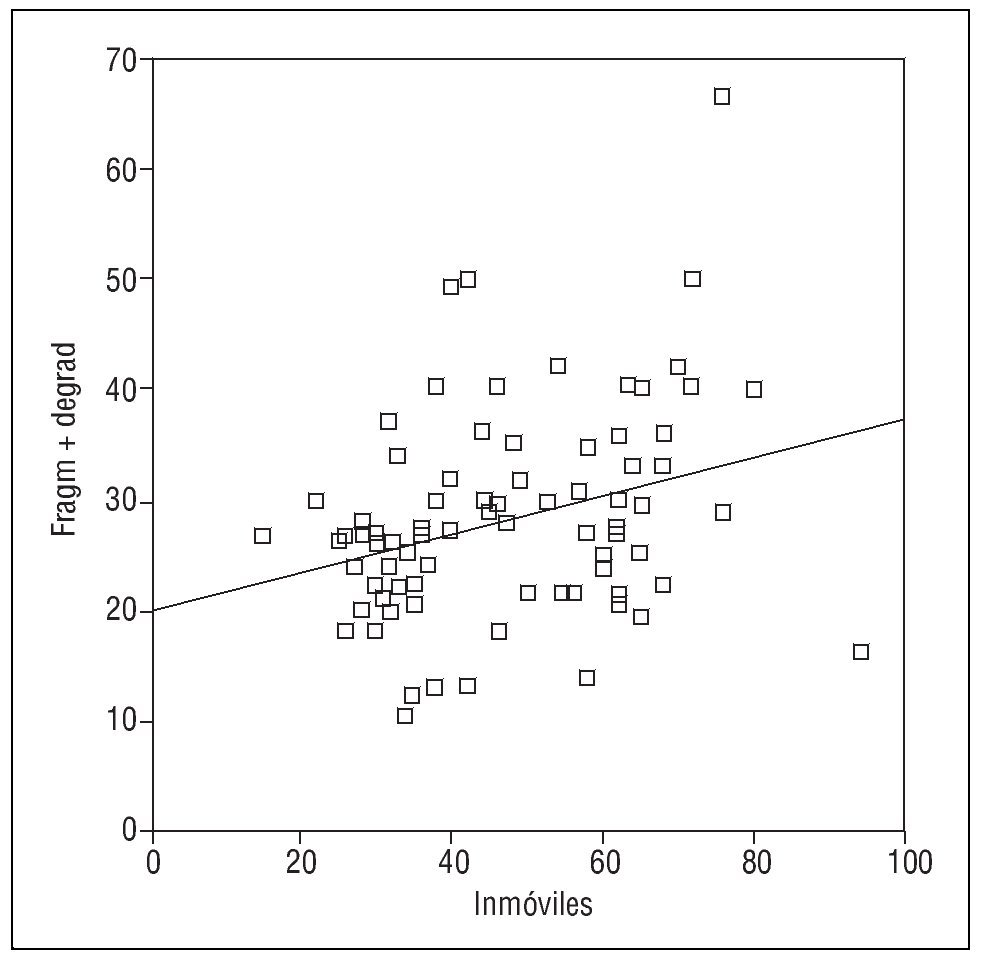
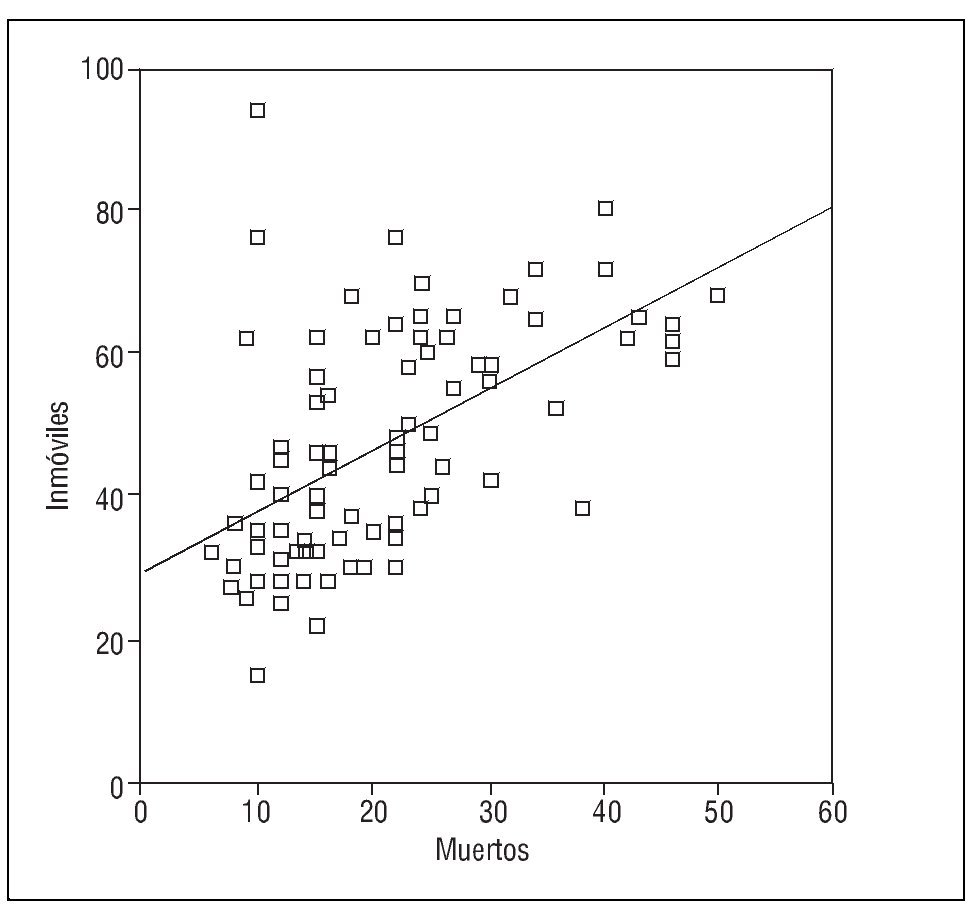
También se ha identificado una relación entre el porcentaje de espermatozoides con el ADN fragmentado y la tasa de inmóviles (r= 0,303; p < 0,005) (fig. 2) y una correlación entre los espermatozoides con ADN desnaturalizado y los inmóviles (r = 0,306; p < 0,005) (fig. 3).
Figura 2. Correlación entre el porcentaje de espermatozoides inmóviles y con anomalías de ADN (medido con el test de fragmentación Halosperm).
Figura 3. Correlación entre el porcentaje de espermatozoides inmóviles y con anomalías de ADN (medido con el test naranja de acridina).
No se ha encontrado correlación entre el porcentaje de espermatozoides fragmentados o desnaturalizados con la concentración espermática.
DISCUSIÓN
En este estudio hemos identificado importantes correlaciones entre calidad de semen, evaluada por los parámetros convencionales (concentración y movilidad), y marcadores de la integridad de ADN: estructura de la cromatina espermática y fragmentación. En este sentido se ha comprobado que hay una estrecha correlación entre los 2 tests y la movilidad espermática, pero no con la concentración. Podemos aventurar que la asociación entre estas 2 pruebas de ADN y la movilidad espermática, en realidad, reflejan las propiedades de estos tests de función que, aunque miden características diferentes, están estrechamente relacionadas con la integridad del ADN espermático.
Por otra parte, la correlación encontrada entre el test de AO, que mide desnaturalización del ADN, y el de fragmentación, que mide roturas en las cadenas, aunque lógica, ha sido muy discutida en diferentes publicaciones. Las principales razones de discusión se basan en la poca fiabilidad que ofrece el test de AO35,36 debido a su falta de subjetividad: problemas con la rápida evolución hacia espermatozoides muertos por la fluorescencia y tinciones heterogéneas. Estas dificultades han limitado la aplicación de rutina de esta técnica en los estudios diagnósticos de evaluación de la fertilidad masculina37. Para solucionar estos problemas, Evenson (1980)21 desarrolló el test de SCSA, que es similar al de AO, pero ofrece resultados más objetivos ya que utiliza citometría de flujo.
Ya que la utilización de la técnica de TUNEL que detecta daño endógeno de ADN se ha considerado la más exacta para cuantificar roturas en las cadenas de ADN de los espermatozoides38, se han realizado estudios para comparar la técnica de TUNEL con la de SCSA39, comprobándose que los resultados que muestran son similares.
Más adelante se desarrolló el SCD, que analiza la diferente descondensación de la cromatina al tratarse con un medio ácido, seguido de una desproteinización, rompiendo los enlaces disulfuro y relajando la molécula de ADN, formando un halo de dispersión alrededor de la estructura central30. Posteriormente, en el 2005, estos mismos autores publicaron una adaptación de este test: el Halosperm, el cual, basándose en las mismas propiedades es de fácil realización en la rutina del laboratorio31.
Los resultados obtenidos con este trabajo, con el cual se demuestra la correlación existente entre estas 2 pruebas de estudio de ADN, nos pueden servir para reforzar la importancia del test de AO como rutina del laboratorio de andrología. Esta prueba, que es fácil y barata, no necesita observadores experimentados, pero sin embargo nos proporciona una información muy útil de cara al factor pronóstico de infertilidad masculina.
Pacientes con resultados de necrozoospermia en función del test de desnaturalización de ADN deberían, por tanto, ser candidatos a realizarse un análisis más profundo de fragmentación de ADN, que nos aporte más información respecto a la integridad nuclear.
Sin embargo, el valor de estos tests de integridad de ADN se debe evaluar con los mismos criterios que cualquier prueba diagnóstica, utilizando una combinación de parámetros estadísticos y juicio clínico. Está claro que uno de los condicionantes para el éxito en la reproducción humana depende de la integridad del ADN. Además, parece también que está claro que roturas en la cadena de ADN pueden influir en el desarrollo embrionario y como consecuencia en la consecución de embarazo. Sin embargo, todavía no es del todo conocido cómo estas técnicas, que miden la integridad de la molécula del ADN, pueden ayudarnos a identificar problemas de fertilidad y cómo afectan a la posibilidad de gestación en reproducción asistida.
Se necesitan estudios adicionales que definan mejor el valor clínico de las pruebas de daño espermático del ADN, y el test que pueda resultar más apropiado para utilizarse en esta comprobación.
Correspondencia: Dra. L. Ortega López.
Laboratorio de Andrología. Clínica Tambre. Tambre, 8. 28002 Madrid. España.
Correo electrónico: lortega@clinicatambre.com