INTRODUCCIÓN
La incidencia de casos de infertilidad es variable según la población estudiada, pero se estima que la prevalencia (entendida como el número total de parejas infértiles frente al número total de parejas en el mismo tiempo y lugar) es de un 15%. Actualmente, en España hay alrededor de unas 900.000 parejas estériles, de las cuales aproximadamente la mitad acuden a los centros de fertilidad para tratar de corregir su problema En el 20-30% de las parejas infértiles, la causa principal es masculina, presentando alteraciones en la función testicular, obstrucción de conductos, patologías en la próstata, y alteraciones en la eyaculación o erección1.
Las clásicas valoraciones de la fertilidad masculina basadas en los 3 parámetros básicos del espermiograma: concentración, movilidad y morfología, conocidos y usados desde hace mas de 50 años2 se hacen insuficientes a la hora de buscar soluciones a los problemas de infertilidad masculina. Pacientes en los que su seminograma entra dentro de los parámetros de normalidad y, sin embargo, tienen problemas reproductivos, o pacientes que se encuentran en programas de fertilización artificial ante similares espermiogramas y técnicas usadas, obviando el factor femenino, no consiguen similares resultados. Todo ello nos lleva a pensar en que otros factores influyen en la infertilidad masculina.
Entre estos factores parece cada vez más evidente la influencia del estrés oxidativo3. Las especies reactivas de oxígeno (ROS) son los radicales libres específicos del estrés oxidativo celular. La búsqueda de un marcador de ese desequilibrio que supone el estrés oxidativo ha llevado a tener en cuenta el grado de fragmentación del ADN de los espermatozoides4. Los incrementos de ROS llevan a un daño en el ADN espermático5. Las fuentes exógenas productoras de ROS son múltiples: sustancias químicas, exposición a altas temperaturas, consumo de alcohol y tabaco, y ejercicio físico intenso. Entre las endógenas tenemos: leucocitospermia, procesos febriles, inflamatorios o estrés6-8. La mayoría de estos procesos producen un exceso de ROS y un defecto de los sistemas antioxidantes, por tanto, la corrección de los factores nocivos antes descritos y la administración de sustancias antioxidantes deben resultar beneficiosas para la fertilidad masculina9. En este trabajo, nos proponemos valorar la utilidad de un compuesto de antoxidantes (Androferti® laboratorios Q-Pharma) sobre la fragmentación del ADN espermático.
MATERIAL Y MÉTODOS
Entre octubre de 2008 y julio de 2009 se seleccionó un total de 101 varones que acudieron a nuestra clínica junto a su pareja para un tratamiento de fertilidad. La edad media de éstos fue de 39 años. Los criterios de inclusión fueron: parejas con fallos repetidos de técnica de reproducción asistida, oligozoospermia (< 10 millones/ml) o astenozoospermia (< 50% a+b) y grados de fragmentación de ADN espermático, medido por TUNEL (terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate-nick end labeling), > 20%.
Este estudio fue aprobado por la comisión de ética y la dirección del centro donde se ha realizado.
A todos ellos se les propuso la toma de 2 sobres de Androferti®, cuya composición por sobre es L-carnitina fumarato 500 mg, coenzima Q-10 10 mg, zinc 5 mg, ácido fólico 100 μg, selenio 25 μg, vitamina B12 0,50 μg, vitamina C 30 mg, vitamina E 5 mg. También se les aconsejó acerca de hábitos de vida y alimenticios. Se les realizó un control con seminograma y valoración de la fragmentación de ADN de los espermatozoides a los 70 días de tratamiento. Las roturas del ADN espermático se estudiaron mediante la técnica de TUNEL usando el kit comercial in situ cell death detection kit, fluorescein (Roche, Mannheim, Alemania). Se basa en la incorporación de deoxiuridina marcada con componentes fluorescentes, gracias a la enzima Tdt, en los puntos de rotura de la cadena de ADN sencilla o doble en el extremo 3'-OH de la cadena afectada.
Dentro de los parámetros del seminograma se estudiaron los valores de concentración, movilidad, total móviles progresivos (TMP) y forma. El total de pacientes reclutados en la fase preliminar del estudio fue de 37, en el resto de los pacientes hubo 8 que obtuvieron embarazo espontáneo antes de finalizar el tiempo del control, el resto no acudió a consulta en el tiempo indicado. El resumen de datos obtenidos se contempla en la tabla 1.
En la distribución de los datos, tras el control realizado a los 70 días, no se observan diferencias significativas. Por otro lado, la dispersión de los datos es bastante elevada en casi todas las variables. Para los valores centrales y dispersión de datos, en general, es mejor utilizar los resultados obtenidos por la mediana y por los cuartiles. En cuanto a la forma, y debido a los saltos de escala, sólo se podrán utilizar en el análisis ANOVA.
En el análisis descriptivo sí se observa un desplazamiento de la curva hacia la derecha en el caso de los espermatozoides tipo B y hacia la izquierda en los de tipo D, indicándonos una mejoría de la movilidad (figs. 1 y 2).
Figura 1. Análisis descriptivo. Espermatozoides tipo B base y tras tratamiento.
Figura 2. Análisis descriptivo. Espermatozoides tipo D base y tras tratamiento.
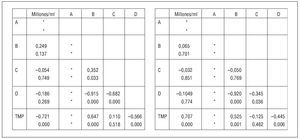
Los resultados de las correlaciones no son concluyentes, por lo que no se puede aplicar el análisis factorial y de componentes principales (fig. 3).
Figura 3. Correlaciones: millones/ml; A; B; C; D; TMP.
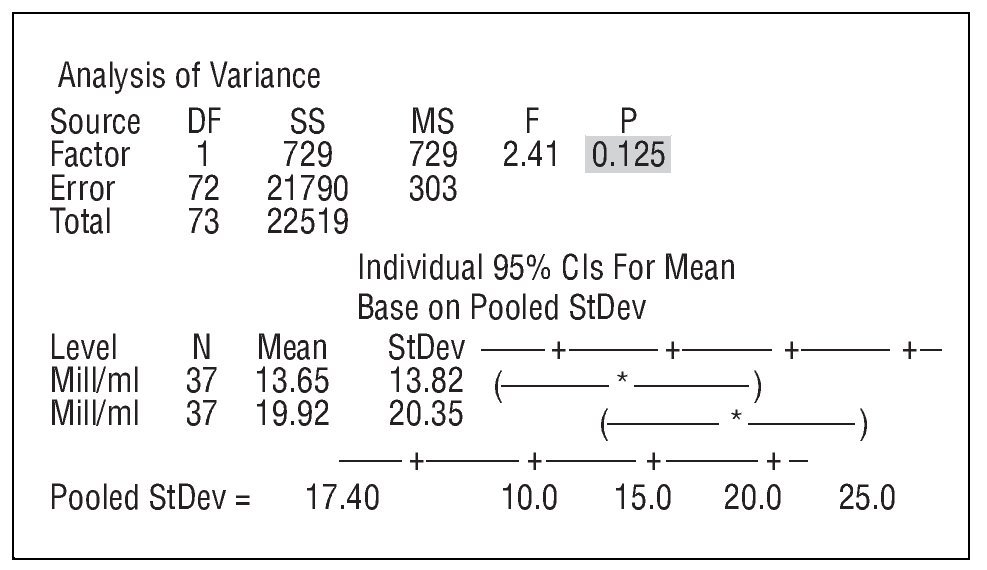
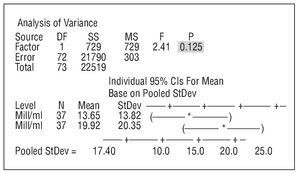
Los resultados de los análisis de las varianzas muestran que no hay diferencias significativas. Sin embargo, al ser el ANOVA dependiente de la distribución, no se recomienda, sólo la prueba de Wilcoxon (no paramétrica). Aunque las conclusiones son similares para la forma, no lo son para la variable concentración y TMP (figs. 4 y 5).
Figura 4. One-way ANOVA: concentración; concentración (control).
Figura 5. One-way ANOVA: TMP; TMP (control).
Aunque los datos no parecen significativos debido a la gran dispersión y al número de la muestra, sí parece haber de una manera genérica cierta tendencia a la mejoría de parámetros, como se puede observar de manera gráfica en la tabla de evolución individual de pacientes (figs. 6 y 7).
Figura 6. Evolución individual de cada paciente para TMP.
Figura 7. Evolución individual de cada paciente para concentración.
Con respecto a los datos de la fragmentación de ADN, la distribución de probabilidad de los datos inicialmente no se lleva a cabo de una forma normal, sin embargo, tras el control realizado se observa que hay una tendencia a una distribución normal de los datos, siendo estadísticamente significativa (fig. 8).
Figura 8. Análisis descriptivo de los valores de fragmentación de ADN.
Para los valores centrales y dispersión de datos, en general es mejor utilizar los resultados obtenidos por la mediana y por los cuartiles al inicio del estudio y tras el control los valores de la media y de la desviación estándar.
Para ver si las diferencias existentes en las medianas son estadísticamente significativas es necesario ver el punto referente al ANOVA.
Los valores de la variable fragmentación de ADN tienen un rango de 31,7 ± 9,5 antes del tratamiento y de 22,4 ± 19,1 posterior al tratamiento, con una p (Wilcoxon) = 0,004.
El estudio ANOVA, los datos nos muestran que hay diferencias significativas entre los valores al inicio y el control (tabla 2).
DISCUSIÓN
Desde hace tiempo, el uso de antioxidantes de manera empírica se sabe que, en algunos casos, mejora la calidad espermática; sin embargo, no se sabía exactamente a qué varones podría beneficiar el uso de estos compuestos10. Está siendo mejor conocido el mecanismo del estrés oxidativo y, por tanto, su respuesta a los tratamientos que se propugnan para el control de los desequilibrios de éste11.
Entre los efectos nocivos del desequilibrio del estrés oxidativo está la fragmentación de las cadenas de ADN de los espermatozoides, sobre todo la que se produce postesticular en el epidídimo y los conductos seminíferos12. La fragmentación de ADN espermático se puede traducir en fallos de implantación, alteraciones en el desarrollo embrionario o aumentos del número de abortos13. Por tanto, cualquier tratamiento o hábitos de vida encaminados a reducir la fragmentación del ADN espermático se verá reflejado en mayores tasas de fertilidad14. Parece claro que el uso de antioxidantes puede ser beneficioso para corregir los defectos del ADN espermático15.
El uso de sustancias como las vitaminas C y E, el zinc, el ácido fólico, el selenio, la coenzima Q-10, la L-carnitina han demostrado su eficacia en diferentes estudios, algunos en toma individual, otros asociados, pero nunca en un asociación de todos los componentes16-18.
El tiempo de la duración total de la espermatogénesis es de unos 65-70 días19, por lo que el uso durante ese tiempo a nivel testicular sería el óptimo, pero esos espermatozoides no serían los que obtenemos en el eyaculado a los 2 meses. Los espermatozoides que valoramos en 70 días son espermatozoides extratesticulares que se están madurando, capacitando, almacenando o concentrando en las vías seminales, sobre todo en el epidídimo20. Por tanto, si el tratamiento ya ha conseguido mejorar la fragmentación de ADN de los espermatozoides en esta zona, su uso durante un período más prolongado, unos 6 meses, nos permitirá valorar hasta qué punto se pueden mejorar los índices de fragmentación del ADN en el proceso completo, desde la espermiogénesis intratesticular hasta la eyaculación de los espermatozoides pasando por la capacitación epididimaria. Este punto es objeto en la continuación del estudio.
Cabe destacar que, si bien en estos datos preliminares el número de la muestra no es alto y hay una gran dispersión de datos en cuanto a los parámetros del seminograma, sí es interesante que la TMP y la concentración aumenten en tan sólo 70 días, ya que como antes explicamos estamos hablando de espermatozoides extratesticulares. Si analizamos a los pacientes pasados más días valoraremos también el efecto del tratamiento sobre la concentración y la TMP desde la célula madre intratesticular hasta el espermatozoide eyaculado.
Utilizamos la técnica TUNEL para la medición de la fragmentación de ADN espermático, porque creemos que es más exacta que otras técnicas ya que no tiene dependencia del observador, nos mide daño real y tiene un alto valor predictivo en reproducción asistida. Nuestro punto de corte fue considerar anormales muestras de fragmentación > 20%.
CONCLUSIONES
Los resultados preliminares del estudio demuestran que Androferti® es un buen complejo de elementos esenciales necesarios en el proceso de la formación y maduración espermática así como en el mantenimiento de su calidad hasta el momento del eyaculado. La mejoría de la fragmentación del ADN de los espermatozoides es clave, según todos los estudios actuales, para lograr mayores tasas de éxito en reproducción asistida, por lo que un tratamiento con un producto que logre esa mejoría, como el estudiado aquí, puede ser de gran utilidad en este campo.
La continuidad del estudio permitirá demostrar si Androferti® es también efectivo para mejorar otros parámetros, como: calidad embrionaria, disminución de los fallos de implantación, etc.
No obstante se hacen necesarios estudios bien diseñados, aleatorizados sobre todo este tipo de sustancias para avalar de una manera más científica lo que en la práctica clínica evidenciamos como un tratamiento útil.
Correspondencia: Dr. C. Balmori Boticario.
IVI Madrid.
Avda del Talgo, 68. 28023 Aravaca. Madrid. España.
Correo electrónico: cbalmori@ivi.es