O tratamento dos condilomas é geralmente um desafio na prática clínica. Apesar de a taxa de resolução espontânea ser elevada, uma parte significativa dos doentes procura tratamento, não pela sintomatologia, mas especialmente por questões estéticas e preocupações relacionadas com a transmissão ou agravamento de lesões já existentes. Os tratamentos disponíveis devem ser aplicados apenas sobre lesões macroscópicas, clinicamente evidenciáveis. Idealmente, as terapêuticas disponíveis devem ter um início de acção e clearance rápidos, solucionar os sintomas, reduzir a taxa de recorrência e a carga viral, ser eficaz no tratamento de lesões pequenas e ser bem toleradas. Contudo, nenhum dos tratamentos actualmente disponíveis é claramente mais eficaz do que os restantes e não existe um tratamento ideal para todos os doentes ou para todos os condilomas. Assim, a escolha terapêutica deve basear‐se na experiência do clínico, nos recursos disponíveis, na morfologia, no tamanho, número e na localização das lesões, nas lesões primárias ou recorrentes, na gravidade da doença, na preferência e nas expectativas do doente, no estado de competência imune do doente, na conveniência, tolerância e no custo do tratamento e nos resultados de terapêuticas prévias. Os tratamentos disponíveis dividem‐se em três grupos: aplicados pelo próprio doente (imiquimod 3,75 ou 5%, podofilotoxina 0,5%, sinecatequinas 10 ou 15%), aplicados pelo prestador de cuidados de saúde (ácidos bi e tricloacético 80‐90%, interferão alfa intralesional, crioterapia, remoção cirúrgica, electrofulguração, ablação por laser) e nas terapêuticas experimentais ou alternativas (cidofovir tópico, bleomicina intralesional, terapêutica fotodinâmica). As metodologias de tratamento podem ainda ser divididas quanto à sua atuação – tratamento ablativos ou destrutivos (crioterapia, electrofulguração, ablação por laser, excisão cirúrgica), tratamentos citotóxicos ou proapoptóticos (podofilotoxina 0,5%, 5‐fluoruracilo, bleomicina) e tratamentos imunomoduladores (imiquimod 3,75 ou 5%, sinecatequinas 10 ou 15%, interferão alfa intralesional). A taxa de sucesso global dos vários tratamentos disponíveis varia entre 23% e 94%. Apenas os tratamentos que incluem crioterapia ou excisão cirúrgica são adequados em condilomas que tenham qualquer localização anatómica e são as que têm maior taxa de sucesso em monoterapia. As recorrências são comuns, independentemente do tratamento recebido. Em oposição, as terapêuticas imunomoduladoras, apesar de ter taxas de clearance iniciais mais baixas, parecem apresentar probabilidades mais elevadas de cura em médio prazo, com taxas de recorrência baixas. Alguns tratamentos podem ser associados entre si e a eficácia das terapêuticas combinadas parece ser superior à monoterapia (tratamento sequencial proactivo). Os consensos para o tratamento do HPV consideram ainda a terapêutica de situações especiais: doentes imunocomprometidos, lesões do meato e intrauretrais e o tratamento da(o) companheira(o).
The treatment of condyloma is generally a challenge in clinical practice. Although the spontaneous resolution rate is high, a significant proportion of patients seek treatment, not because of symptomatology, but mainly for aesthetic issues and concerns related to the transmission or worsening of existing lesions. The available treatments should be applied only for clinically evident macroscopic lesions. Ideally, available therapies should have rapid action onset and clearance, resolve symptoms, reduce recurrence rate and viral load, be effective in treating small lesions, and be well tolerated. However, none of the currently available treatments is clearly more effective than the others and there is no ideal treatment for all patients or for all condyloma. Therefore, the therapeutic decision should be based on the clinician's experience, available resources, lesion morphology, size, number and location, primary or recurrent lesions, disease severity, patient preference and expectations, patient's immune competence, convenience, tolerance, cost of treatment and results of previous therapies. The available treatments are divided into three groups: applied by the patient himself (imiquimod 3.75 or 5%, podophyllotoxin .5%, synecatekines 10% or 15%), applied by the health care provider (bi‐ and tricloacetic acids 80%‐90%, intralesional interferon alpha, cryotherapy, surgical removal, electrofulguration, laser ablation) and experimental or alternative therapies (topical cidofovir, intralesional bleomycin, photodynamic therapy). Treatment methodologies can be further divided into their action ‐ ablative or destructive treatment (cryotherapy, electrofulguration, laser ablation, surgical excision), cytotoxic or proapoptotic treatments (podophyllotoxin .5%, 5‐fluoruracil, bleomycin) and immunomodulatory treatments (imiquimod 3.75% or 5%, synecatekines 10% or 15%, intralesional interferon alpha). The overall success rate of the various treatments available ranges from 23% to 94%. Only treatments that include cryotherapy or surgical excision are suitable in condyloma with any anatomical location and that have the highest success rate in monotherapy. Recurrences are common regardless of the treatment received. In contrast, immunomodulatory therapies despite having lower initial clearance rates appear to have higher probabilities of cure in the medium term, with low recurrence rates. Some treatments may be combined with each other and the effectiveness of combined therapies appears to be superior to monotherapy (proactive sequential treatment). The consensuses for the treatment of HPV also consider special situations: immunocompromised patients, meatus and intraurethral lesions and treatment of the partner.
O tratamento dos condilomas é geralmente um desafio na prática clínica.
Apesar de a taxa de resolução espontânea ser elevada (estimada em 30% aos seis meses1 e 65‐78% aos dois anos2,3) uma parte significativa dos doentes procura tratamento, não apenas pela sintomatologia, pois está normalmente ausente, mas por questões estéticas, que podem acarretar discriminação e sofrimento psicossocial significativo, assim como preocupações de transmissão ou agravamento das lesões já existentes4. A elevada taxa de resolução espontânea permitiria inferir que a intervenção terapêutica poderia ser desnecessária num número considerável de casos. Não obstante, o tratamento é proposto na maioria dos doentes de forma a circunscrever a transmissão a contactantes sexuais e evitar repercussões na sexualidade dos indivíduos afetados. Para além disso, se não desaparecerem ou forem eliminadas, as verrugas anogenitais manter‐se‐ão inalteradas ou poderão aumentar em tamanho e número4.
Os tratamentos disponíveis para as lesões anogenitais podem reduzir, mas provavelmente não erradicam o HPV. Actualmente ainda não é possível confirmar se a diminuição do DNA viral do HPV pós‐terapêutico minora a transmissão futura. Também não está provado que o tratamento de lesões subclínicas favoreça o curso da infecção pelo HPV nos doentes ou seus parceiros(as), nomeadamente no que respeita à taxa de transmissão e recorrência e sintomatologia. Assim, não está recomendado o rastreio ou tratamento de lesões subclínicas5. É de realçar que o tratamento deverá ser aplicado apenas sobre lesões macroscópicas, clinicamente evidenciáveis. Não deve ser efetuado tratamento perante achados citopáticos por HPV em análises histológicas de peças cirúrgicas (ex: circuncisão ou hemorroidectomia) na ausência de alterações clinicamente notórias (tabela 1).
Adaptado de Park IU, Introcaso C, Dunne EF. Human Papillomavirus and Genital Warts: A Review of the Evidence for the 2015 Centers for Disease Control and Prevention Sexually Transmitted Diseases Treatment Guidelines. Clin Infect Dis. 2015 Dec 15;61 Suppl 8:S849‐55
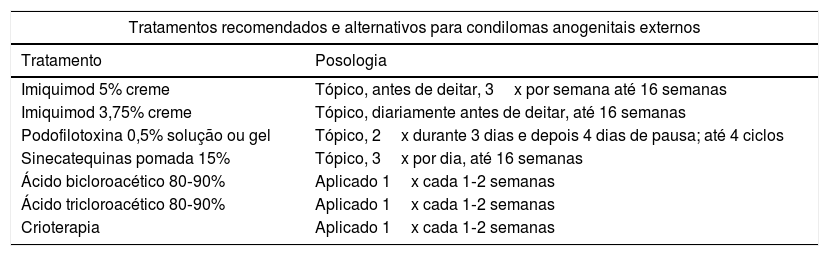
| Tratamentos recomendados e alternativos para condilomas anogenitais externos | |
|---|---|
| Tratamento | Posologia |
| Imiquimod 5% creme | Tópico, antes de deitar, 3x por semana até 16 semanas |
| Imiquimod 3,75% creme | Tópico, diariamente antes de deitar, até 16 semanas |
| Podofilotoxina 0,5% solução ou gel | Tópico, 2x durante 3 dias e depois 4 dias de pausa; até 4 ciclos |
| Sinecatequinas pomada 15% | Tópico, 3x por dia, até 16 semanas |
| Ácido bicloroacético 80‐90% | Aplicado 1x cada 1‐2 semanas |
| Ácido tricloroacético 80‐90% | Aplicado 1x cada 1‐2 semanas |
| Crioterapia | Aplicado 1x cada 1‐2 semanas |
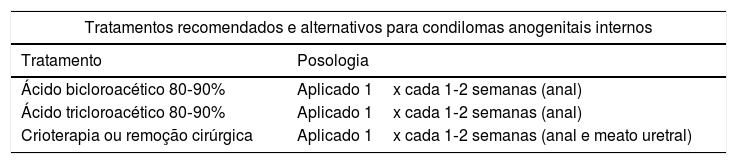
O reaparecimento de condilomas genitais meses após tratamento eficaz das lesões anteriores significa, habitualmente, recorrência e não reinfeção (tabela 2).
Adaptado de Park IU, Introcaso C, Dunne EF. Human Papillomavirus and Genital Warts: A Review of the Evidence for the 2015 Centers for Disease Control and Prevention Sexually Transmitted Diseases Treatment Guidelines. Clin Infect Dis. 2015 Dec 15;61 Suppl 8:S849‐55
| Tratamentos recomendados e alternativos para condilomas anogenitais internos | |
|---|---|
| Tratamento | Posologia |
| Ácido bicloroacético 80‐90% | Aplicado 1x cada 1‐2 semanas (anal) |
| Ácido tricloroacético 80‐90% | Aplicado 1x cada 1‐2 semanas (anal) |
| Crioterapia ou remoção cirúrgica | Aplicado 1x cada 1‐2 semanas (anal e meato uretral) |
A abordagem terapêutica e o follow‐up das lesões precursoras de cancro anogenital ultrapassam o âmbito deste documento. Todos os doentes devem receber esclarecimentos detalhados sobre a infeção, nomeadamente vias de transmissão, história natural e riscos futuros.
Objetivos do tratamento4,6:- ‐
Início de acção e clearance rápidos
- ‐
Resolução dos sintomas
- ‐
Efeito sustentado (baixa taxa de recorrência)
- ‐
Redução da carga viral, idealmente com erradicação e prevenção de futuras recorrências
- ‐
Tratamento eficaz de lesões pequenas e lesões subclínicas
- ‐
Boa tolerância
Contudo, nenhum dos tratamentos actualmente disponíveis é claramente mais eficaz do que os restantes (estudos comparativos também são escassos) e não existe um tratamento ideal para todos os doentes ou para todos os condilomas.
Material e métodosRevisão bibliográfica e reunião de consensos com painel de peritos.
Seleção da terapêutica nos condilomas anogenitaisA primeira decisão a tomar é a necessidade ou não de tratar. Pelo benefício incerto do tratamento dos condilomas interferir ou não na futura transmissão do HPV e perante a possibilidade de resolução natural, o médico, em decisão partilhada com o doente, pode prescindir da intervenção terapêutica. Mesmo com um tratamento bem‐sucedido a taxa de recorrência pode atingir os 20 a 50% três a seis meses depois7.
A escolha terapêutica deve basear‐se em4,8:
- ‐
Experiência do clínico
- ‐
Recursos disponíveis
- ‐
Morfologia, tamanho, número e localização das lesões
- ‐
Lesões primárias ou recorrentes
- ‐
Gravidade da doença
- ‐
Preferência e expectativas do doente
- ‐
Estado de imunocompetência do doente
- ‐
Conveniência e tolerância
- ‐
Custo
- ‐
Resultados de terapêuticas prévias
Podemos dividir os tratamentos disponíveis em três grupos: aplicados pelo próprio doente (imiquimod 3,75 ou 5%, podofilotoxina 0,5%, sinecatequinas 10 ou 15%) ou aplicado pelo prestador de cuidados de saúde (ácidos bi e tricloacético 80‐90%, interferão alfa intralesional, crioterapia, remoção cirúrgica, electrofulguração, ablação por laser) e terapêuticas experimentaisou alternativas (cidofovir tópico, bleomicina intralesional, terapêutica fotodinâmica). As metodologias de tratamento podem ainda ser divididas quanto à sua atuação – tratamento ablativos ou destrutivos (crioterapia, electrofulguração, ablação por laser, excisão cirúrgica), tratamentos citotóxicos ou proapoptóticos (podofilotoxina 0,5%, 5‐fluoruracilo, bleomicina) e tratamentos imunomoduladores (imiquimod 3,75 ou 5%, sinecatequinas 10 ou 15%, interferão alfa intralesional).
A taxa de sucesso global dos vários tratamentos disponíveis varia entre 23 e 94%. Apenas os tratamentos que incluem crioterapia ou excisão cirúrgica são adequados em condilomas que tenham qualquer localização anatómica e são os que têm maior taxa de sucesso (próximo de 100%) em monoterapia. As recorrências são comuns, independentemente do tratamento recebido (4,1‐77%)9,10. Em oposição, as terapêuticas imunomoduladoras, apesar de ter taxas de clearance iniciais mais baixas (28 a 57,2%), parecem apresentar probabilidades mais elevadas de cura em médio prazo, com taxas de recorrência baixas.
A maioria das lesões responde em até três meses de tratamento. Entre os factores que influenciam a favoravelmente a resposta destacam‐se a imunocompetência e a compliance terapêutica. As lesões localizadas em áreas húmidas ou intertriginosas parecem responder melhor ao tratamento tópico. Lesões muito volumosas, inclusive os tumores de Buschke‐Lowenstein devem ser excisadas cirurgicamente. Por outro lado, lesões pequenas em número e volume respondem bem a terapêuticas tópicas e técnicas ablativas.
Os tratamentos autoaplicados são eleitos por alguns doentes, uma vez que podem ser administrados no conforto e na privacidade do seu lar. Para garantir que são eficazes, os doentes devem receber as devidas instruções médicas de aplicação após minuciosa identificação de todas as lesões anogenitais acessíveis durante a consulta. Posteriores consultas de follow‐up permitirão proporcionar respostas a questões sobre o uso da medicação e avaliação dos efeitos secundários, assim como da eficácia terapêutica obtida. Apesar da imprevisibilidade, a maioria dos casos apresenta resolução completa ao fim de três meses de tratamento. A estratégia terapêutica deve ser alterada se ausência de resultados ao fim de 4‐8 semanas ou aparecimento de efeitos adversos importantes. Em caso de falência terapêutica reiterada ou evolução atípica, deverá ser ponderada a biopsia para confirmação histológica e exclusão de lesões intraepiteliais de elevado risco ou carcinoma espinocelular associados à infecção por HPV. O uso de um algoritmo terapêutico ou de uma abordagem sistemática parece melhorar os resultados11.
Embora a colocação de preservativo não seja considerada protetora (ex: infecção escrotal, vulvar ou perineal) recomenda‐se seus uso até resolução das lesões. O seu uso parece acelerar o desaparecimento dos condilomas mesmo quando ambos os parceiros têm vírus seroconcordantes12–14. A(O) parceira(o) actual pode beneficiar de avaliação para despiste de lesões de HPV ou outras ISTs. Não é recomendado, no entanto, notificar os parceiros passados1.
Tratamento sequencial proactivoAlguns tratamentos podem ser associados, há evidências que sugerem que a eficácia das terapêuticas combinadas é superior à monoterapia, seja com recurso simultâneo a métodos aplicados pelo médico e pelo doente ou a procedimentos ablativos e imunomediados15. Um tipo particular de combinação, a que se chamou terapêutica sequencial proactiva (combinação de métodos aplicados pelo clínico com métodos administrados pelo doente), compreende o uso de um método ablativo até remoção das lesões visíveis, seguido, após um período de três a cinco dias, da administração de um imunomodulador tópico na área afetada durante 12 a 16 semanas6. Poderá estar associado a uma resolução mais célere e com menor taxa de recorrências6. Existem alguns dados de estudos retrospetivos ou com número reduzido de doentes que apoiam essa abordagem, mas ainda precisam de validação através de estudos prospectivos, randomizados e controlados10,16,17. A terapêutica de associação tripla (crioablação, podofilotoxina como citotóxico e imunomodulação pós‐ablativa com sinecatequinas) tem uma taxa de resolução de 96,3% e uma taxa de recidiva de 7,4%.
Terapêuticas aplicadas pelo doente/Agentes tópicosImiquimod (creme a 3,75% e 5%)Mecanismo de acção: é um imunomodulador que estimula a resposta imunitária mediada por células por acção agonista sobre TLR7 e consequente produção de interferão alfa e outras citoquinas.
Posologia: Na forma de creme a 5%, deve ser aplicado ao deitar, três vezes por semana, até clearance das lesões, e no máximo durante 16 semanas18,19. Na dose de 3,75%, o imiquimod pode ser aplicado todas as noites. A área de aplicação deve ser lavada com água e sabão seis a 10 horas após a aplicação (de manhã). O período de aplicação pode ser prolongado em caso de resposta favorável lenta1. É aplicável em doentes imunodeprimidos e adequa‐se tanto ao tratamento de condilomas queratinizados como não queratinizados1.
Efeitos adversos: Reação inflamatória local, por vezes exuberante, que inclui eritema, induração, erosão, ulceração, vesículas ou despigmentação vitiligo‐like e que pode ser agravada pela continuidade do tratamento20–22. A suspensão temporária do tratamento pode ser necessária para ultrapassar os efeitos adversos.
Advertências: Deverá ser limitado o contacto sexual nos dias de aplicação atendendo ao risco de efeito irritativo por contacto. Os preservativos de látex e diafragmas vaginais podem ser enfraquecidos pelo contacto com o imiquimod1. Não está aprovado para uso em grávidas, apesar dos estudos em animais sugerirem baixo risco1. O uso em doentes portadores de doenças autoimunes ou inflamatórias deverá ser feito com cautela, sob risco de exacerbação da patologia de base (os efeitos sistémicos do fármaco parecem estar relacionados com a ativação local e generalização da cascata inflamatória, tendo em conta que os níveis séricos de imiquimod após múltiplas aplicações não é significativo)1,23–25.
Resultados: As taxas de resolução completa reportadas vão de 23 a 81%1,21,26–31. Cerca de 40% dos doentes responde em até quatro semanas de tratamento18. A resposta parece ser menor na pele queratinizada21. O creme a 3,75% recentemente aprovado pela FDA com base em dois estudos randomizados duplamente cegos versus placebo evidencia uma taxa de clearance de 27 a 29% (resposta ao placebo: 9‐10%) após aplicação durante 16 semanas32. As taxas de recorrência vão de 6 a 41%26,28,29,31.
Nota: O imiquimod creme 3,75% indicado para aplicação diária ainda não está disponível em Portugal.
Podofilotoxina (solução a 0,5% e creme a 0,15%)Mecanismo de acção: É um extrato purificado da podofilina com acção antimitótica, por inibição da topoisomerase II e que conduz à necrose da verruga.
Posologia: Deve ser aplicado duas vezes por dia durante três dias, seguido de quatro dias sem aplicação33,34. O esquema pode ser repetido até quatro ou cinco ciclos. Pode ser colocado pelo doente, mas quando a área da lesão é superior a 4cm2 recomenda‐se supervisão médica da aplicação1. O tratamento pode ser prolongado em caso de resposta favorável, mas lenta1.
Efeitos adversos: Os mais frequentes são locais – eritema, prurido, sensação de queimadura, parestesia e erosão13,35,36. Apesar de ter um perfil de segurança mais favorável do que a podofilina, poderá ocorrer toxicidade sistémica em alguns casos, com desenvolvimento de náuseas e vómitos, febre, diarreia, úlceras orais e mielossupressão. Para evitar a absorção sistémica e toxicidade, a aplicação deverá ser limitada a uma área<10cm2 por sessão ou a um volume de 0,5ml.
Advertências: Está aprovado pela FDA para tratamento de verrugas genitais externas, embora haja experiência no tratamento de outras áreas sem intercorrências1. A solução é apropriada para lesões penianas, o creme é mais adequado para as lesões perianais33. Recomenda‐se supervisão médica principalmente em lesões maiores do que 4cm2. Deverá ser limitado contacto sexual nos dias de aplicação para atender ao risco de efeito irritativo por contacto1. Não é recomendado seu uso nas grávidas (categoria C – estudos em animais revelaram efeitos adversos fetais)1.
Resultados: As taxas de resolução completa após uso da solução a 0,5% vão de 45‐83%, 43‐70% para o creme a 0,15%30,33–41. A eficácia é menor nas lesões do meato uretral e na pele queratinizada34. As taxas de recorrência são elevadas, há registos de 6‐100%34,35,37,38,40,41.
Nota: A podofilotoxina não está comercialmente disponível em Portugal mas é manipulável em farmácia de ambulatório, em creme ou solução, situação que torna essa opção geralmente dispendiosa.
Sinecatequinas (pomada a 10 ou 15%)Mecanismo de acção: Extrato vegetal de Camelia sinensis (folha do chá verde) que contém múltiplos agentes polifenólicos, dos quais o mais abundante é o epigalocatequina‐3‐galato. O mecanismo de acção não é totalmente conhecido, mas parece basear‐se no efeito antiproliferativo e imunomodulador associado à interação com receptores de tirosina‐cinase e consequentes ações antiviral, anti‐inflamatória e pró‐apoptoica42.
Posologia: Deve ser aplicada uma quantidade suficiente para cobrir 5mm por cada verruga (cerca do tamanho de uma ervilha) três vezes por dia sobre lesões ativas até resolução ou durante 16 semanas, não deve ser lavado após uso. Aprovado pela FDA em 2006 para tratamento de condilomas acuminados genitais externos e perianais em indivíduos imunocompetentes com idade igual ou superior a 18 anos.
Efeitos adversos: Os mais frequentes são eritema, edema, prurido e erosão43–46.
Advertências: Poderá diminuir a resistência dos preservativos de látex e diafragmas vaginais. Não está aprovado para uso em condilomas uretrais, cervicovaginais ou anorretais e não foi avaliado em doentes imunodeprimidos nem em grávidas.
Resultados: As taxas de sucesso são de 47‐59%, com taxas de recorrência baixas, entre 7‐11%43–46.
Nota: Indisponível em Portugal, mas presente em vários países europeus.
5‐Fluorouracilo (creme 5%)Mecanismo de acção: Agente citotóxico com indução de apoptose em células com elevado turnover.
Posologia: Aplicar o creme a 5% uma ou duas vezes por dia durante seis semanas.
Efeitos adversos: Irritação local, sensação de ardor e neovascularização crónica1.
Advertências: Pelo seu potencial teratogénico está contraindicado na gravidez e também não está recomendado em imunodeprimidos.
Resultados: Apesar das taxas de clearance mais baixas comparativamente com outros métodos e de, por isso, ter caído em desuso, uma revisão do grupo Cochrane concluiu que esse fármaco ainda poderá ser usado em casos particulares47. No entanto, dado existirem alternativas mais satisfatórias, o seu uso não é recomendado para o tratamento de rotina das infecções por HPV.
Nota: Em Portugal está disponível em solução cutânea associado ao ácido acetilsalicílico.
Terapêuticas aplicadas pelo médico/Ablação física/CrioterapiaMecanismo de acção: Destrói as lesões por citólise termicamente induzida com azoto líquido ou uma sonda criogénica, as temperaturas são baixas ao ponto de o dano dérmico e vascular ser permanente.
Técnica: Terapêutica feita pelo clínico, com uma ou duas sessões de congelamento rápido com 10‐30 segundos de duração, até se estabelecer um halo de geladura com alguns milímetros além do diâmetro da lesão, e descongelamento lento posterior, repetidas a cada 1‐2 semanas, depende da necessidade e tolerância1. Os profissionais de saúde devem ter formação adequada nessa técnica, pois o seu excesso ou défice podem resultar em complicações ou baixa eficácia.
Efeitos adversos: O procedimento é geralmente pouco doloroso e não implica anestesia tópica ou local, que, no entanto, poderá ser considerada em indivíduos menos tolerantes. Não obstante o referido, a dor durante e após a aplicação pode ocorrer. É comum o desenvolvimento de eritema, ulceração, vesiculação e necrose no local de aplicação48,49. Existe algum risco cicatricial, embora infrequente, apesar de ser usual o desenvolvimento de áreas sequelares hipopigmentadas.
Advertências: O manuseamento e armazenamento do azoto líquido deverá ser feito em condições próprias. O uso indevido poderá resultar em queimaduras graves.
Resultados: Vários estudos têm reportado taxas de clearance de 44‐92% e taxas de recorrência de 10‐59%15,29,48–52. Se não houver evidência de resposta ao fim de quatro semanas, deve mudar‐se a modalidade terapêutica.
Ácido tricloroacético e bicloroacético (solução aquosa 70‐90%)Mecanismo de ação: Atua como agente cáustico, destrói as lesões por desnaturação proteica com consequente necrose epidérmica.
Posologia: Aplicado pelo clínico uma vez por semana (variável de acordo com a necessidade e tolerância)33. Deve ser aplicada uma pequena quantidade na lesão e o doente apenas se pode sentar ou levantar após secagem completa (isto é, desenvolver uma película branca sobre o tecido).
Efeitos adversos: Ardor local ou dor aquando da aplicação, que geralmente reverte ao fim de 5‐10 minutos. É comum o desenvolvimento de inflamação e lesões úlcero‐erosivas, algumas penetrantes na derme, pelo que não é recomendada a sua aplicação em condilomas muito volumosos.
Advertências: Trata‐se de uma solução de baixa viscosidade e que se aplicada excessivamente pode danificar a pele sã adjacente. O ácido tricloroacético é extremamente corrosivo, pelo que a sua administração deve ser cuidadosa. Em caso de queimadura inadvertida, dor intensa ou aplicação excessiva, o ácido poderá ser neutralizado com bicarbonato de sódio a 5%, talco ou lavagem com água e sabão. Está contraindicada a aplicação de ácido bi ou tricloroacético em condilomas do meato uretral dado o risco de estenose.
Resultados: As taxas de resposta variam entre 56‐84% e as taxas de recorrência estarão na ordem dos 36%15,48,52.
Nota: O ácido tricloroacético não está comercialmente disponível em Portugal, mas é manipulável em farmácia de ambulatório.
Interferão‐alfa intralesionalMecanismo de acção: Potencia a resposta imunitária celular antiviral e tem efeitos antiproliferativos associados.
Posologia: Aplicação subcutânea (intralesional) de 3 MUI, três vezes por semana até oito semanas.
Efeitos adversos: Dor local, cefaleia, mialgias, temperatura febril, rinossinusite, artralgias. O risco de mielossupressão, cardiotoxicididade e nefrotoxicidade é baixo, mas deve ser ponderado. Em doentes transplantados, poderá potenciar rejeição do transplante.
Advertências: É um tratamento moroso, dispendioso e que implica recursos e elevado consumo de tempo assistencial, pelo que não é recomendado como terapêutica de primeira linha.
Resultados: A eficácia ronda os 66% e estima‐se uma recorrência de 21%53,54.
Nota: Existem estudos com evidência de eficácia em formulações para administração tópica e intramuscular.
Laser CO2Mecanismo de acção: Necrose tecidular termoinduzida.
Técnica: Aplicação de potência de 2 a 10W55. A ablação por laser é especialmente adequada a lesões de grande volume e pode ser usada em locais de difícil acesso (por exemplo as lesões intrauretrais).
Efeitos adversos: Origina uma lesão erosivo‐crostosa que cicatriza em 1‐2 semanas. O risco cicatricial é relativamente baixo, mas possível.
Advertências: Implica anestesia local subcutânea. As partículas de fumo produzidas poderão conter partículas viáveis de HPV, com risco de desenvolvimento de papilomatose laríngea nos indivíduos expostos – é recomendado que o tratamento se faça com máscara de proteção N‐95, numa sala ventilada e com recurso a dispositivo de aspiração de partículas.
Resultados: Apresenta uma eficácia entre 23‐52% e taxa de recidiva entre 60 e 77%.
Nota: É um tratamento dispendioso quando comparado com terapêuticas tópicas e outros métodos ablativos.
Excisão cirúrgicaMecanismo de acção: Depende do tipo de material com que se removem os condilomas – remoção tangencial com tesoura ou lâmina, curetagem ou eletrocirurgia. A eletrocirurgia induz necrose tecidular por eletrocauterização.
Técnica: A maioria das vezes o procedimento pode ser feito sob anestesia local. As principais indicações são as lesões pedunculadas e as de maiores dimensões. Devem‐se deixar pontes de tecido são entre lesões, de modo a facilitar a cicatrização e minimizar as sequelas cosméticas. A excisão cirúrgica tem a vantagem de eliminar, numa só sessão terapêutica, a maioria dos condilomas. É também uma opção para lesões queratinizadas em pequeno número1. Lesões anogenitais muito volumosas, inclusive os tumores de Buschke‐Lowenstein, devem ser excisadas cirurgicamente.
Efeitos adversos: Origina lesões erosivo‐crostosas que cicatrizam em 1‐2 semanas. O risco cicatricial é relativamente baixo, mas possível.
Advertências: Implica anestesia local subcutânea. As partículas de fumo poderão conter partículas viáveis de HPV, com potencial de infectar a pele adjacente se a sua integridade estiver comprometida ou risco de desenvolvimento de papilomatose laríngea nos indivíduos expostos. Recomenda‐se o uso de máscara N‐95 e que a técnica seja aplicada numa sala com bom sistema de ventilação e com recurso a dispositivo de aspiração de partículas.
Resultados: As taxas de clearance completa da eletrocirurgia são de 90 a 100%, com taxas de recorrência de 19‐29%49,56,57.
Nota: É necessário treino cirúrgico, equipamento e pode deixar maiores sequelas cosméticas.
Tratamentos experimentais ou alternativosHá poucos dados sobre a eficácia de tratamentos alternativos para o tratamento de condilomas anogenitais. Para além dos abaixo descritos, existe uma experiência e evidência muito limitada com o imunomodulador telúrio e o poli‐hexametileno de biguanida, até ao momento insuficiente para recomendar seu uso.
Cidofovir (creme 1‐3%)Mecanismo de acção: Inibição da DNA‐polimerase, com bloqueio da replicação viral.
Posologia: Não está bem definida, mas é recomendada uma ou duas aplicações por dia. Parece haver manutenção da eficácia com frequências de uso inferiores. A administração intralesional parece ser igualmente eficaz58.
Efeitos adversos: Irritação local. Existem relatos de agravamento de disfunção renal após terapêutica tópica58.
Advertências: Não está disponível em Portugal. Deve ser usado se com precaução em insuficientes renais e não deve ser usado durante a gravidez (categoria C). Não se têm verificado intercorrências em indivíduos imunodeprimidos58.
Resultados: Eficácia estimada de 47%59.
Bleomicina intralesionalMecanismo de acção: Disrupção do DNA celular por radicais livres resultantes da ligação a áreas ricas em guanosina‐citosina.
Posologia: Aplicada de três em três semanas, até quatro tratamentos.
Efeitos adversos: Irritação local, com possibilidade de necrose e ulceração. Existe o risco de desenvolvimento de cicatriz e hipopigmentação local.
Advertências: Deverá ser evitado em indivíduos com fenómeno de Raynaud ou outras doenças autoimunes com compromisso vascular similar. Não está recomendada em grávidas, lactantes ou imunodeprimidos.
Resultados: Apresenta uma taxa de eficácia de 14‐99%60.
Terapia fotodinâmicaMecanismo de acção: O princípio da terapia fotodinâmica consiste numa reação química ativada por luz com o intuito de provocar a destruição selectiva de um tecido. Implica agente fotossensibilizante, o ácido 5‐aminolevulínico (ALA), aplicado no tecido alvo e uma fonte de luz com comprimento de onda específico que induz a produção de radicais livres a partir do oxigénio tecidular.
Posologia e resultados: Os estudos publicados com o uso do ácido 5‐aminolevulínico (ALA a 20%) reportam uma taxa de resolução completa de 95‐96%, com uma taxa de recorrência de 6,3% ‐16,2%61–63. Apesar dos aparentes bons resultados, não existem estudos controlados por placebo, pelo que atingem um baixo grau de recomendação.
Efeitos adversos: Os principais descritos, ligeiros, são queimor, eritema, edema e erosão61–63.
Tratamento de situações especiaisDoentes imunocomprometidosOs princípios gerais de tratamento de condilomas genitais em doentes imunocomprometidos devem ser semelhantes em relação aos imunocompetentes. Os doentes com infeção HIV, particularmente os indivíduos com HIV/Sida com imunossupressão avançada, tendem a apresentar verrugas anogenitais, maiores, mais numerosas e que respondem pior à terapêutica64,65. Têm ainda maior probabilidade de recorrência das lesões66. As lesões escamosas intraepiteliais de alto grau e o cancro invasivo em relação com os condilomas genitais são mais frequentes em indivíduos imunodeprimidos. Por esse motivo, qualquer lesão hiperpigmentada ou persistente, apesar do tratamento, deve ser prontamente biopsada. O risco infeccioso dos condilomas ou das áreas inflamatórias pós‐terapêutica dos condilomas na transmissão do HIV não está devidamente esclarecido.
Apesar das particularidades dos doentes imunocomprometidos, não existem, para além das já assinaladas nas várias metodologias terapêuticas, recomendações específicas e diferentes para o tratamento dessa subpopulação.
Lesões do meato uretral e intrauretraisA terapêutica das lesões do meato uretral e intrauretrais está limitada pela dificuldade da abordagem anatómica e pela possibilidade de complicações (sobretudo estenose da uretra). Se a base das lesões for visível, os condilomas podem ser tratados com crioterapia, eletrocirurgia, laser ou imiquimod67–70. Para lesões mais internas, a excisão deverá ser feita sob visão directa, com uretroscopia, tem sido mais usada a exérese por laser68,71. Também foi descrito o tratamento de lesões uretrais internas com gel de 5‐FU, com boa taxa de resolução e baixa taxa de complicações67.
Tratamento da(o) companheira(o)A avaliação da(o) companheira(o) não é formalmente recomendada na generalidade dos casos para o tratamento dos condilomas genitais, uma vez que não há evidência de que a reinfeção desempenhe um papel significativo nas recorrências. Providenciar tratamento apenas com o propósito de prevenir uma futura transmissão não pode ser recomendado, dado que se desconhece o papel da intervenção terapêutica na prevenção da infeção. A presença de condilomas acuminados potencia claramente a transmissão viral de HPV, pelo que deverão ser aconselhadas medidas de contenção sexual ou uso de métodos de barreira, quando aplicáveis; no entanto, a transmissão viral não acarreta necessariamente o desenvolvimento de condilomas acuminados na(o) parceira(o). Não existem recomendações formais para fazer citologia do colo uterino de forma extraordinária na presença de condilomas acuminados ou para alterar a periodicidade com que o Papanicolau deverá ser feito. A quase totalidade das lesões está associada a HPV de baixo risco, pelo que a associação com CINs de alto grau é geralmente fortuita. As mulheres devem, sim, ser inquiridas e incentivadas à feitura do Papanicolau de acordo com as recomendações em vigor, mas não alertadas para um risco que não está estabelecido e que geralmente acarreta ansiedade desnecessária. Já o rastreio de ISTs deverá ser feito de forma rotineira em todos os doentes independentemente do risco/antecedentes sexuais, com serologias víricas, treponémicas, PCR para Chlamydia trachomatis, Neisseria gonorrhoeae e Mycoplasma genitalium, e, nas mulheres, pesquisa de Trichomonas vaginalis.
ConclusãoA taxa de sucesso global dos vários tratamentos disponíveis varia entre 23 e 94%. Apenas os tratamentos que incluem crioterapia ou excisão cirúrgica são adequados em condilomas que tenham qualquer localização anatómica e são as que têm maior taxa de sucesso (próximas de 100%) em monoterapia. As recorrências são comuns, independentemente do tratamento recebido (4,1‐77%). Em oposição, as terapêuticas imunomoduladoras, apesar de ter taxas de clearance iniciais mais baixas (28 a 57,2%), parecem apresentar probabilidades mais elevadas de cura em médio prazo, com taxas de recorrência baixas.
As terapêuticas autoaplicadas são eleitas por alguns doentes, uma vez que podem ser administradas no conforto e na privacidade do seu lar. Para garantir que são eficazes, os doentes devem receber as devidas instruções médicas de aplicação.
Apesar da imprevisibilidade, a maioria dos casos apresenta resolução completa ao fim de três meses de tratamento. A estratégia terapêutica deve ser alterada se ausência de resultados ao fim de 4‐8 semanas ou aparecimento de efeitos adversos importantes. Em caso de falência terapêutica reiterada ou evolução atípica, deverá ser ponderada biopsia para confirmação histológica e exclusão de lesões intraepiteliais de elevado risco ou carcinoma espinocelular associados à infecção por HPV.
O uso de um algoritmo terapêutico ou de uma abordagem sistemática parece melhorar os resultados.
A terapêutica sequencial proactiva poderá estar associada a uma resolução mais célere e com menor taxa de recorrências.
Os princípios gerais de tratamento de condilomas genitais em doentes imunocomprometidos devem ser semelhantes em relação aos imunocompetentes. No caso de lesões do meato uretral ou intrauretrais, poderá ser necessário recorrer à excisão sob visão directa, com uretroscopia, com meios ablativos. A avaliação da(o) companheira(o) não é formalmente recomendada na generalidade dos casos para o tratamento dos condilomas genitais.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.