El antígeno prostático específico es utilizado en el diagnóstico de patologías prostáticas. No existe un estudio en Perú que proponga un punto de corte de PSA index para discriminar entre cáncer de próstata e hiperplasia prostática benigna para la indicación de biopsia prostática. Actualmente, se emplean diferentes puntos de corte basados en estudios internacionales.
Material y métodosSe realizó un estudio de validación diagnóstica de PSA index para discriminar entre ambas entidades en pacientes con un PSA total entre 4,0 ng/ml y 9,9 ng/ml. Fueron incluidos 356 pacientes con diagnóstico de hiperplasia prostática benigna o cáncer de próstata mediante biopsia prostática. Se evaluó la sensibilidad, especificidad, los valores predictivos y los cocientes de probabilidad de los valores de PSA index de 15 hasta 25%. Se graficó la curva ROC.
ResultadosUn PSA index de 17% posee mejores valores de sensibilidad (87,8%), especificidad (62,2%) y valores predictivos (valor predictivo positivo de 62,4% y valor predictivo negativo de 87,4%) respecto a otros para disminuir el número de biopsias negativas. El cociente de probabilidad positivo fue 2,3 y el cociente de probabilidad negativo fue 0,1. El área bajo la curva fue 0,75 [IC 95%, 0,71 a 0,79].
ConclusiónSe sugiere un PSA index de 17% como punto de corte para discriminar entre hiperplasia prostática benigna y cáncer de próstata en pacientes que acuden a consulta ambulatoria con un PSA total entre 4,0 ng/ml y 9,9 ng/ml. Se recomienda este valor si se desea reducir el número de biopsias prostáticas negativas.
The prostate specific antigen is used in the diagnosis of prostate diseases. In Peru, there are no studies that suggest a cut-off point of PSA index to discriminate between benign prostatic hyperplasia and prostate cancer as indicator for prostate biopsy. Based on international studies different cut-off points are used.
Material and methodsA diagnostic test was performed to determine the validity of PSA index to discriminate between these two entities in patients with a total PSA between 4.0 ng/ml and 9.9 ng/ml. All 356 patients included were diagnosed of benign prostatic hyperplasia or prostate cancer by prostate biopsy. The sensitivity, specificity, predictive values and likelihood ratios of PSA index cut-off points from 25% to 15% were evaluated. The ROC curve was drawn.
ResultsA PSA index cut-off point of 17% has better values of sensitivity (87.8%), specificity (62.2%) and predictive values (positive predictive value of 62.4% and negative predictive value of 87.4%) compared to others to decrease the number of negative biopsies. The positive likelihood ratio was 2.3 and the negative 0.1. The area under the curve was 0.75 [IC 95%, 0.71 to 0.79].
ConclusionWe suggest a PSA index of 17% as cut-off point to discriminate between benign prostatic hyperplasia and prostate cancerin the urology outpatient consult of patients with a total PSA between 4.0 ng/ml and 9.9 ng/ml. We recommend this value as it could reduce the number of negative biopsies.
En hombres a partir de los 50 años es frecuente encontrar dos patologías urológicas cuyo diagnóstico no siempre es fácil de establecer pese al examen clínico y exámenes auxiliares pues estas comparten características similares (sintomatología urinaria inflamatoria y obstructiva, elevación del antígeno prostático específico, entre otras). Este es el caso de la hiperplasia prostática benigna (HPB) y del cáncer de próstata (CP)1.
La prevalencia de HPB en varones mayores de 60 años está por encima de 50%. La incidencia de CP ha aumentado a nivel mundial en las últimas décadas2. Según la Organización Mundial de la Salud cada año se presentan 899.000 casos nuevos, lo que representa el 13,6% del total de cánceres diagnósticados3. Según el último análisis estadístico del Centro para el control y Prevención de Enfermedades sobre incidencia y mortalidad de los 10 cánceres más frecuentes, realizado en el 2008, el CP encabeza la lista de incidencia en varones y ocupa el segundo lugar en cuanto a mortalidad4. La Sociedad Peruana de Urología coincide con el Centro para el control y Prevención de Enfermedades en que es la segunda causa de muerte por cáncer en hombres en nuestro país5. Su incidencia en el 2008 fue de 37 casos/100.000 habitantes y la mortalidad en la capital corresponde a 14 casos/100.000 habitantes6.
Para el tamizaje de CP (en hombres a partir de 50 años) y cuando existe sospecha clínica se emplea el tacto rectal y el antígeno prostático específico total (tPSA, por sus siglas en inglés)7. No obstante, la interpretación de los resultados resulta compleja puesto que además de compartir similar sintomatología (poliaquiuria, disuria, disminución de chorro urinario, globo vesical, etc.) tanto la HPB como el CP elevan el tPSA4,7,8.
El antígeno prostático específico (PSA, por sus siglas en inglés) es sintetizado exclusivamente por las células epiteliales de la glándula prostática en condiciones tanto fisiológicas como patológicas y puede ser dosado en distintas formas moleculares y fracciones (tPSA, PSA libre, PSA index, densidad PSA, etc.)9,10. La mayoría de los pacientes con CP presentan niveles de tPSA (cantidad total del PSA sérico) iguales o mayores a 10 ng/ml. Por esta razón, la indicación de biopsia prostática tomando en cuenta solo el tPSA se establece con estos valores con un valor predictivo positivo de 71,4%11. Para la indicación de biopsia prostática en pacientes con valores de tPSA de 4,0 ng/ml a 9,9 ng/ml (pacientes en la «zona gris») se valoran las otras variaciones del PSA. Dentro de ellas, la más utilizada en esta valoración es el porcentaje libre de PSA (PSA index o %fPSA)12.
El PSA index expresa en porcentaje la relación de la concentración de PSA libre (cantidad sérica de PSA que circula sin unión a proteínas plasmáticas) sobre el tPSA. Si se valora en el PSA index junto con el tPSA aumenta la sensibilidad para la detección de CP13. Se sabe que el PSA index se ve influenciado por el aumento del tamaño prostático, lo cual pone en manifiesto que, además del CP, la HPB también eleva, en mayor proporción, el PSA index14. Se conoce que a menor PSA index mayor probabilidad de CP mientras que a mayor PSA index mayor probabilidad de tener HPB; esta relación fue corroborada en el año 1997 en el análisis retrospectivo de Wolf et al. (Alemania)15.
En un ensayo clínico prospectivo multicéntrico un año después (1998), Catalona et al. (Estados Unidos) concluyó que un punto de corte de PSA index de 25% o menos detectaría hasta un 95% de pacientes con CP, diferenciándolos de aquellos con HPB16. En el mismo año, Gion et al. (Italia) sugirió un punto de corte de 16% para la indicación de biopsia prostática, este reducía el número de biopsias negativas en un 43%17. En el 2001, Southwick (Estados Unidos) propuso un punto de corte de 25% para discriminar entre HPB y CP, añadiendo que se ahorraría en 20% el número de biopsias negativas18. Rafi et al. en el año 2003 (Pakistán) sugirió como punto de corte un PSA index de 15%19. Dos años después, Naveed y Nawaz (Pakistán) establecieron que con un punto de corte de 18% se mejoraba el diagnóstico diferencial entre HPB y CP20. Posteriormente, en estudio retrospectivo en el año 2008 Troncoso et al. (Chile) concluyó que para su población el punto de corte óptimo es de 25%21. Por otra parte, tanto Restrepo et al. (Colombia) en el año 2009 como Chakraborty et al. (Bangladesh) en el año 2012 hallaron que un punto de corte de 15% era el mejor para la decisión de toma de biopsia prostática en pacientes con valores de PSA total en la zona gris22,23.
Los diferentes puntos de corte de PSA index para la indicación de biopsia prostática están en relación con las diferentes poblaciones estudiadas y no con los métodos de dosaje de PSA de laboratorio. La mayoría de los estudios mencionados coinciden en que es importante elegir cuidadosamente los pacientes a quienes se les realizará una biopsia prostática con el fin de disminuir el número de biopsias innecesarias y optimizar el uso de recursos (humanos, materiales y económicos) para lo cual el PSA index tendría una gran contribución, sobre todo para aquellos pacientes con valores de PSA total entre 4,0ng/ml y 9,9ng/ml.
A diferencia de la literatura extranjera, en la nacional no se han encontrado investigaciones similares; los estudios que se han encontrado en nuestra población sobre este tema evalúan la utilidad del tPSA. El primero corresponde al de Valdivia et al. en el 2002 en el cual se evaluó la eficacia del tacto rectal y el tPSA para tamizaje de CP y el segundo a Hernández y Valderrama en el 2004 donde evaluaron la eficacia del despistaje de CP en el Servicio de Urología del Hospital Almenara perteneciente a la Seguridad Social Essalud24,25. No hay estudios a nivel nacional que investiguen el valor diagnóstico del PSA index para discriminar entre HPB y CP con el fin de hallar el punto de corte más apropiado que permita optimizar la indicación de biopsia prostática en la consulta ambulatoria. Por este motivo, en nuestro país, se emplean distintos puntos de corte de PSA index basados en la literatura internacional. Se observó que mientras en el Hospital Nacional Edgardo Rebagliati Martins (HNERM) se emplea un punto de corte de PSA index de 20%, en el Hospital Nacional Guillermo Almenara Irigoyens se utiliza un punto de corte de 17% y en el Instituto Nacional de Enfermedades Neoplásicas se toma 25% como punto de corte para la indicación de biopsia prostática en pacientes con valores de PSA total en la zona gris.
El presente estudio tiene como objetivo determinar la validez diagnóstica del PSA index y establecer un punto de corte para discriminar entre HPB y CP en pacientes de consulta ambulatoria con un PSA total en la zona gris. Los resultados permitirán a los profesionales de la salud una toma de decisiones objetiva y orientada a mejorar la atención a los pacientes en la indicación de biopsia prostática y propiciarán una utilización más eficiente de los recursos.
Materiales y métodosLa presente investigación constituye un estudio de pruebas diagnósticas. La población de estudio correspondió a pacientes, de sexo masculino, que acudieron al Servicio de Urología del HNERM por consulta ambulatoria y que fueron diagnosticados de HPB o CP mediante biopsia prostática (de 6 a 12 muestras de tejido prostático por paciente) analizada por el Departamento de Patología del mismo hospital.
Los criterios de inclusión del estudio fueron los siguientes: pacientes del HNERM sometidos a biopsia prostática con un valor de PSA total entre el rango de 4,0 ng/ml a 9,9 ng/ml que cuenten con PSA libre y/o PSA index. Como criterio de exclusión se tomó en cuenta el no contar con diagnóstico final de biopsia prostática mediante estudio anatomopatológico.
Las variables del estudio fueron las siguientes: enfermedades de la próstata, categorizada en 2 (CP y HPB); edad; PSA total, definido como la cantidad de antígeno prostático específico tanto libre como unido a proteínas plasmáticas en sangre periférica y expresada en ng/ml; PSA libre, definido como la cantidad de PSA total que circula sin unión a proteínas plasmáticas en sangre periférica expresado en ng/ml y PSA index, definido como la relación de PSA libre sobre PSA total expresado en porcentaje.
El tamaño muestral fue calculado en base al estudio de Catalona et al.16 utilizando el programa EPIDAT, considerando una sensibilidad 95%, especificidad de 11%, una relación no enfermos/enfermos de 0,74 y un nivel de confianza de 95%, obteniendo una muestra total de 356 pacientes (205 con CP y 151 con HPB).
Se utilizó la base de datos del departamento de patología del año 2011 y 2012, la cual incluía los siguientes datos: nombre del paciente, número de seguro, edad, año de toma de muestra histopatológica y diagnóstico histopatológico final. El estudio histopatológico de las muestras de tejido prostático fue ciego al resultado de PSA y fue determinado en base a características propias de cada patología. Para el diagnóstico final de HPB o CP se utilizó la tinción hematoxilina-eosina. En el caso de HPB se buscó la presencia de nódulos hipertróficos de proporciones variables con componente estromal y glandular, bien delimitados, y con presencia de la población dual característica: células secretoras columnares internas y la capa externa aplanada de células basales. En el caso de CP se buscó la presencia de estructuras glandulares irregulares, infiltrantes del estroma adyacente, anaplásicas (núcleos aumentados de tamaño con nucléolos prominentes, polimorfos, muy hipercrómicos y citoplasma oscuro) tapizadas por una sola capa de células cúbicas y con ausencia de la capa celular basal, la cual se observa en glándulas normales o hipertróficas.
Una vez obtenidos los resultados de las biopsias prostáticas se solicitó al laboratorio información de los participantes que incluía: valor de PSA total y valor de PSA libre de cada participante; el porcentaje de PSA index se calculó utilizando la fórmula: PSA libre/PSA total x 100. La medición de PSA se obtuvo mediante técnicas de enzimoinmunoensayo (ELISA, por sus siglas en inglés) en fase sólida. Mediante el ELISA se genera una reacción colorimétrica donde la intensidad del color formado es proporcional a la concentración de PSA en la muestra. Se utilizó un equipo lector de micropozos con una amplitud de banda de 10nm, una longitud de onda mayor a 450nm y una densidad óptica de 0-2 OD para la medición de la absorbancia y la determinación cuantitativa de PSA.
De esta manera, se incluyó a 356 pacientes sometidos a biopsia prostática y PSA total en el rango de 4,0ng/ml a 9,9ng/ml entre diciembre 2011 y diciembre 2012.
Se creó una base de datos en Microsoft Excel 2010 en la que se introdujo lo siguiente: nombre del participante (solo iniciales), edad, PSA total, PSA libre, PSA index y el resultado de la biopsia de cada paciente. Posteriormente, utilizando un control de calidad de doble digitación, se creó una base de datos en STATA versión 11.0 tomando como base la creada en Excel para su análisis. Se obtuvo los valores de sensibilidad, especificidad, los valores predictivos y los cocientes de probabilidad de los puntos de corte de PSA index de 15 a 25%. Se graficó la curva ROC del PSA index. Finalmente, se evaluó los distintos puntos de corte con los resultados de las biopsias (gold standard) y se contrastaron con el fin de hallar el punto de corte más apropiado de PSA index para la indicación de biopsia prostática.
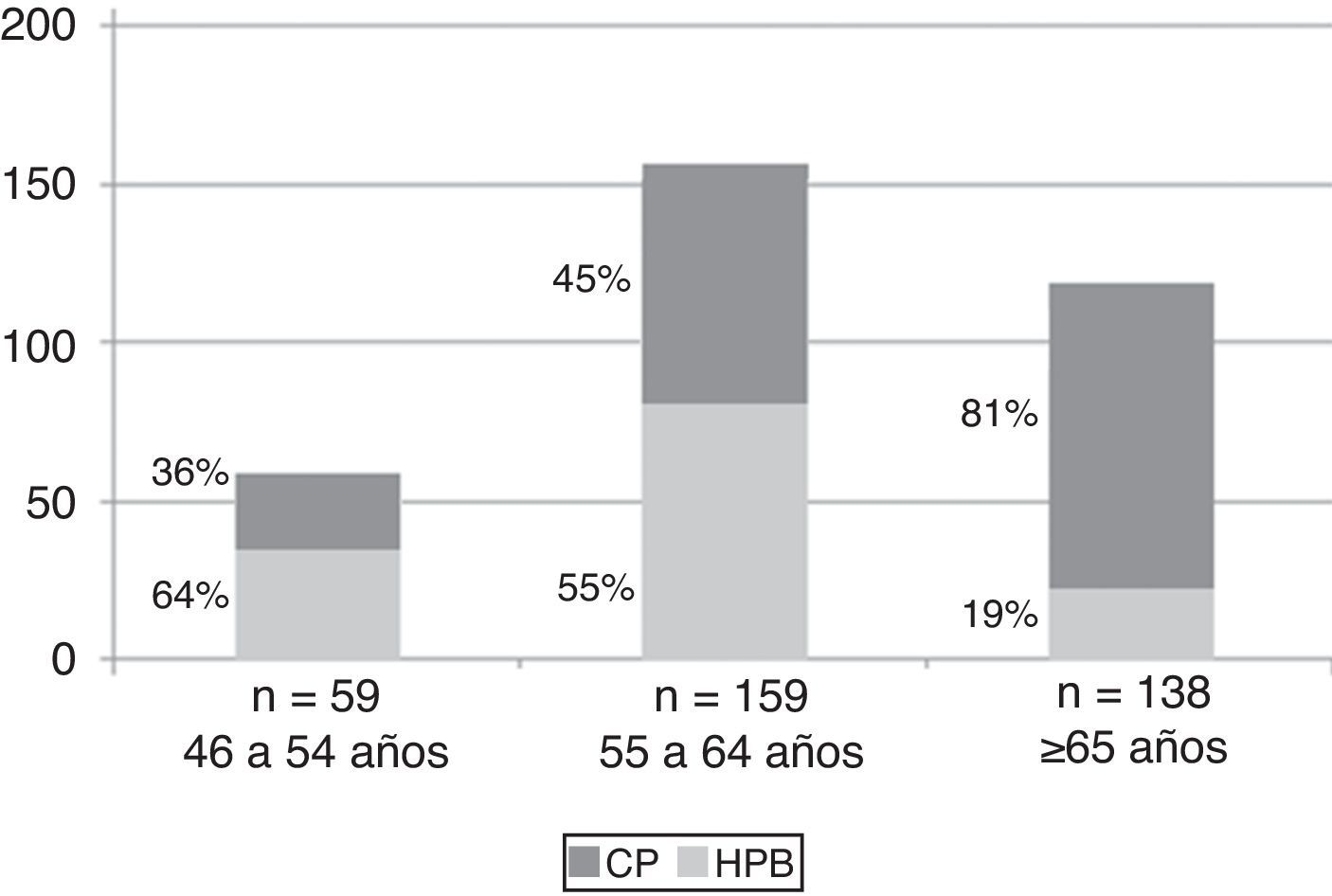
ResultadosDe los 356 varones sometidos a biopsia prostática en el estudio, la media de edad del paciente fue de 62 años ± 6,9. La población se clasificó por grupos etarios, los cuales corresponden a los siguientes: 46-54 años (N=59), de 55 a 64 años (N=159) y de ≥65 años (N=138) (ver fig. 1).
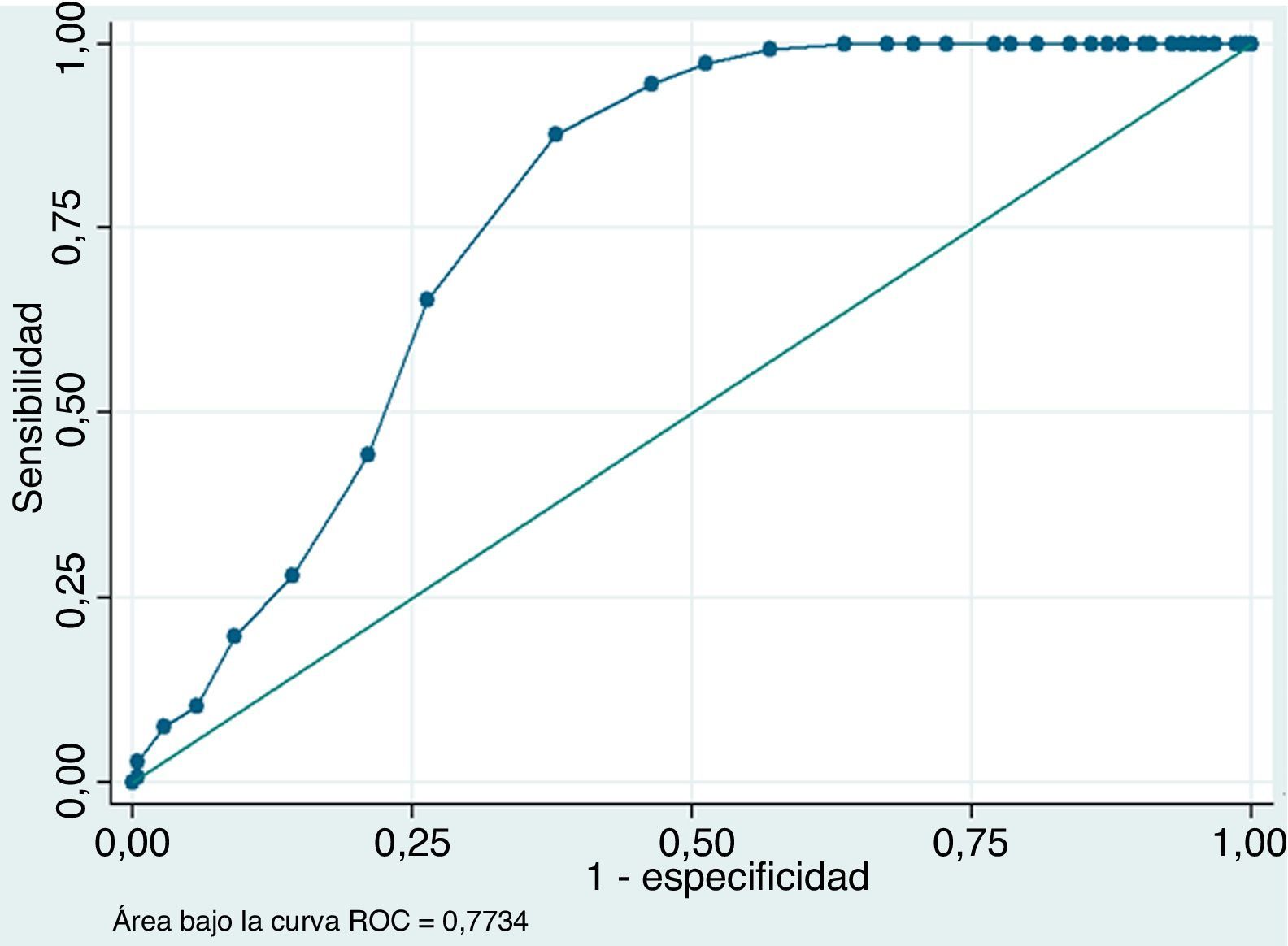
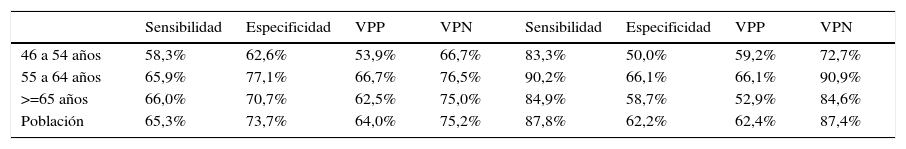
Se presenta la gráfica de la curva ROC del PSA index de la muestra del estudio (ver fig. 2). Los puntos de corte que ofrecen una mayor sensibilidad así como especificidad según la gráfica son el punto de corte de 16 y 17%. Por esta razón, se comparó el valor predictivo negativo (VPN) de estos puntos de corte y se obtuvo lo siguiente: un VPN de 75,2 y de 87,3% para los puntos de corte de PSA index de 16 y 17% respectivamente.
El punto de corte de PSA index de 17% tiene una sensibilidad de 87,8%, una especificidad de 62,2% un valor predictivo positivo (VPP) de 62,4% y un VPN de 87,4%. El cociente de probabilidad positivo (CP+) es de 2,3 [IC95%, 1,96 a 2,85] y el cociente de probabilidad negativo (CP-) es de 0,1 [IC95%, 0,13 a 0,32]. Su área bajo la curva ROC es 0,75 [IC95%, 0,71 a 0,79].
Al dividir a la población en los grupos etarios previamente mencionados el PSA index de 17% tiene valores de sensibilidad, especificidad VPP y VPN de 83,3, 50,0, 52,9 y 72,7% para el primer grupo etario (46-54 años), de 90,2, 66,1, 66,1 y 90,9% para el segundo grupo (55-64 años) y de 84,9, 58,7, 59,2 y 84,6% para tercer grupo (≥65 años) (ver tabla 1).
Punto de corte 16 y 17 de PSA Index en la población y por grupos etarios
| Sensibilidad | Especificidad | VPP | VPN | Sensibilidad | Especificidad | VPP | VPN | |
|---|---|---|---|---|---|---|---|---|
| 46 a 54 años | 58,3% | 62,6% | 53,9% | 66,7% | 83,3% | 50,0% | 59,2% | 72,7% |
| 55 a 64 años | 65,9% | 77,1% | 66,7% | 76,5% | 90,2% | 66,1% | 66,1% | 90,9% |
| >=65 años | 66,0% | 70,7% | 62,5% | 75,0% | 84,9% | 58,7% | 52,9% | 84,6% |
| Población | 65,3% | 73,7% | 64,0% | 75,2% | 87,8% | 62,2% | 62,4% | 87,4% |
Al igual que la literatura revisada, en el presente estudio se evidencia la relación existente entre HPB y CP con el PSA index. Los pacientes con diagnóstico histopatológico de HPB expresan niveles más elevados de PSA index que los pacientes con CP. La curva ROC desprendida del análisis de datos permite observar que el PSA index puede discriminar entre ambas entidades.
Se podría postular que un punto de corte de 17% del PSA index como indicación de biopsia prostática sea utilizado en aquellos pacientes con sintomatología urinaria que tengan un tPSA entre 4,0ng/ml y 9,9ng/ml en consulta externa de urología. Ello facilitará el manejo de los pacientes con sospecha clínica de CP, pues permitirá evitar someter en exceso a los pacientes a métodos diagnósticos invasivos y disminuir gastos innecesarios al reducir el número de biopsias potencialmente negativas. De haberse utilizado un punto de corte del PSA index de 17% como indicación de biopsia prostática se hubiesen evitado 151 biopsias a pacientes con diagnóstico final de HPB.
Los distintos puntos de corte de PSA index sugeridos en la literatura revisada podrían tener relación con la prevalencia (P) de cáncer de próstata a nivel mundial. Las cifras más recientes en cuanto a incidencia (casos por 100.000 habitantes) y prevalencia (anual) encontradas sobre CP a nivel mundial corresponden al año 2008. Por área geográfica, la mayor incidencia (I) y prevalencia de CP se encontró en el Continente Oceánico (I: 104 casos; P en Australia: 3,9 millones de casos), seguido por Europa Occidental (I: 93 casos) y en tercer lugar América del Norte (I: 86 casos; P en Estados Unidos: 2, 6 millones de casos).
En contraste, el Continente Asiático cuenta con la incidencia y la prevalencia más baja de CP a nivel mundial (I: 4-14 casos; P en Pakistán: 6,9 mil casos)6,26,27. Esta situación podría explicar que dos estudios realizados en los Estados Unidos, por Catalona et al. (1998) y otro por Southwick (2001), propongan como punto de corte óptimo para discriminar entre HPB y CP un PSA index de 25%, el mayor punto de corte encontrado en la bibliografía revisada, y que otros estudios en diferente área geográfica con menor prevalencia de CP sugieran puntos de corte más bajos16,18. Este es el caso de los estudios asiáticos realizados por Rafi et al. (Pakistan, 2003), Naveed y Nawaz (Pakistan, 2005) y Chakabroky et al. (Bangladesh, 2012), los cuales recomiendan puntos de corte de PSA index más bajos (15, 18 y 15% respectivamente)19,20,23.
Por otro lado, América Central y América del Sur para el año 2008 mostraron una incidencia de 34 casos y 50 casos respectivamente25. Los estudios latinoamericanos revisados son el realizado por Restrepo et al. (Colombia, 2009) que propuso un punto de corte de PSA index de 15% y el de Troncoso et al. (Chile, 2008) que propuso un PSA index de 25%21,22. La incidencia y prevalencia de CP de Chile y Colombia es similar, con un ligero predominio de CP en la población chilena respecto a Colombia. La incidencia y prevalencia de CP para el año 2008 en Chile corresponde a 57 casos y 19.143 respectivamente y en Colombia corresponde a 40 casos y 15.356 casos respectivamente6. Tomando en cuenta esta realidad, llama la atención que el estudio de Troncoso et al. establezca un punto de corte de PSA index de 25% al igual que estudios de Estados Unidos donde la incidencia y prevalencia de CP es mucho mayor.
La incidencia y prevalencia en Perú de CP en el 2008 fue de 37 casos y 12.034 casos respectivamente26. Estas cifras guardan relación con la incidencia y prevalencia de CP en países vecinos, siendo menores que en Colombia y Chile. Una posible explicación de por qué se halló mejores valores en cuanto a sensibilidad, especificidad y VPN con un punto de corte de PSA index mayor (PSA index de 17%) que el hallado por el estudio colombiano (PSA index de 15%) es que al igual que la mayoría de los estudio revisados Restrepo et al. incluyen en su muestra tanto a pacientes sintomáticos como asintomáticos y buscan un valor de PSA con mayor sensibilidad y VPP para la detección de CP22. En contraste, en nuestro estudio es poco probable que los pacientes hayan acudido a consulta ambulatoria asintomáticos.
La limitación del presente estudio la constituye el no haber incluido el resultado de la evaluación prostática mediante el tacto rectal como variable.
En conclusión, el PSA index constituye una buena prueba para descartar cáncer de próstata. Un PSA index de 17% corresponde al punto de corte más óptimo en nuestro estudio para discriminar entre HPB y CP. El cáncer de próstata se presenta con mayor frecuencia con un valor de PSA index igual o menor a este; en contraste, la hiperplasia prostática benigna se presenta con un PSA index mayor. Se sugiere utilizar un punto de corte de PSA index de 17% si se quisiera evitar la toma de biopsias negativas en pacientes con PSA total entre 4,0 y 9,9ng/ml.
El protocolo de investigación del presente estudio fue presentado para revisión y aprobado por el Comité de Ética e Investigación de la Universidad Peruana de Ciencias Aplicadas (UPC) y del HNERM, el cual pertenece a la Seguridad Social EsSalud y es la principal institución de la Red Rebagliati en Lima-Perú. Se mantuvo la confidencialidad y privacidad de los datos de los pacientes. No se trabajó con población vulnerable, ni se expuso a los participantes a riesgos durante la investigación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Dr. Nilton Yhuri Carreazo por su constante asesoramiento intelectual y metodológico en la realización del presente trabajo.