El uso de las cámaras de recuento condiciona los valores de concentración y movilidad espermática debido a su tipo de carga (capilaridad o desplazamiento de la gota) y a la altura que presenten. Recientemente, se han introducido nuevas cámaras, tanto desechables (ISAS®D4C) como reusables (Spermtrack®) con diversas alturas en cada caso.
ObjetivoEl objetivo del presente trabajo es validar su uso, analizando diversos parámetros espermáticos con un sistema CASA, el ISASv1®.
Material y métodoSe analizaron muestras de donantes voluntarios (10 para las desechables y 5 para las reusables), analizando el efecto del tipo de cámara, de la altura, del tiempo de carga y del tiempo de análisis.
ResultadosLos resultados obtenidos no mostraron diferencias significativas con el tiempo de carga para las cámaras reusables ni con el tiempo de análisis en ninguna de las cámaras.
DiscusiónLa cámara reusable de 10μm y las desechables de 10, 16 y 20μm no mostraron diferencias entre sí, mientras que la reusable de 20μm presentó resultados significativamente diferentes con respecto a las demás, por lo que su uso (siguiendo la recomendación de la Organización Mundial de la Salud) debe hacerse teniendo en cuenta este hecho.
ConclusiónLas nuevas cámaras ofrecen un resultado muy homogéneo, con independencia del tiempo de carga o de análisis.
The use of counting chambers conditions the sperm concentration and motility values by their type of filling (capillary or drop displacement) and chamber height. We have recently introduced new chambers, both disposable (ISAS®D4C) and reusable (Spermtrack®), with different heights in each case.
ObjectiveThis study has aimed to validate its use by analyzing different sperm parameters with a CASA system, that is, the ISASv1®.
Material and methodSamples from volunteer donors (10 for the disposable and 5 for reusable), analyzing the effect of chamber type, height, filling and analysis time, were used.
ResultsThe results obtained showed no differences within the filling time for the reusable chambers, or the analysis time in any cases.
DiscussionThe 10 microns reusable chamber and disposable, 10, 16 and 20 microns showed no differences between them. However, the reusable 20 microns showed significantly different results, so its use (as recommended by WHO) should be taking this into account. Conclusion: The new chambers offer very consistent results, independent of filling or time of analysis.
Desde que comenzaron a realizarse los estudios sobre calidad seminal, se puso de manifiesto que en la evaluación del semen, la concentración y la movilidad espermática tienen un gran significado en la valoración seminal. Por su parte, el uso de sistemas CASA implica un avance en la estandarización de dichas valoraciones, pero requiere de la puesta a punto de protocolos adecuados que optimicen sus resultados1.
Hasta la fecha, se ha considerado el uso de los hemocitómetros y, más concretamente, de la cámara Neubauer Improved como el sistema estándar y de referencia para la valoración de la concentración2. Este hecho obedece más a una cuestión de “tradición” que a una auténtica reflexión metodológica, como más adelante trataremos. Además, para la calibración de dichas cámaras y otras que han aparecido en el mercado, se han utilizado esferas de látex (QC-Beads, Bioscreen Icn. NY, EE. UU.), con concentraciones supuestamente definidas3. En todo caso, se ha demostrado que hay diferencias sensibles entre cámaras Neubauer de una misma marca, y las esferas referidas muestran unas oscilaciones en su “composición” que llegan a valores de 34–46 y 16–24 para las concentraciones altas y bajas, respectivamente, según las indicaciones del propio fabricante.
Estos datos sirven para evidenciar que los “supuestos” estándares no pueden ser considerados como tales, sino de una forma muy relativa.
Por ello, consideramos que no es posible adjudicar a un sistema de recuento el calificativo de “óptimo” al que hacer referencia, sino que, en cada caso, es necesario analizar los procesos físicos asociados al tipo de cámara en cuestión, valorar los posibles errores/limitaciones de construcción y centrarse en la repetitividad del análisis reali-zado3.
Así pues, hay 2 formas básicas de llenar una cámara de recuento: por capilaridad y por desplazamiento de la gota. Del primer tipo existen reusables (Neubauer, Bürker, Thoma, ISAS®R2C…) o desechables (Leja®, Microcell®, Cell-Vu®, ISAS®D4C…). De forma similar, de las del segundo tipo hay reusables (Makler®, Spermtrack®) o desechables (porta y cubre).
Pese a la relativamente extensa bibliografía referida al cálculo de la concentración y el uso de diversas cámaras de recuento, hay escasas referencias que valoren estas diferentes formas de carga de una forma adecuada. Es por ello que en el presente trabajo trataremos de incidir en dichas diferencias (utilizando las nuevas cámaras ISAS®D4C y Spermtrack®), evaluando además, cuál debe ser el protocolo de uso para su optimización con un sistema CASA (el ISAS®v1).
Material y métodoObtención de las muestrasEn total, se evaluaron muestras correspondientes a 10 donantes voluntarios, con informe consentido del uso de los datos para el presente trabajo científico. Las muestras se obtuvieron por masturbación tras un período de abstinencia eyaculatoria de 2–3 días. El estímulo erótico fue homogéneo, consistiendo en la misma iconografía fotográfica. Para la recogida, se utilizó un bote de licuefacción (ISAS®Liquefaction Cup, Proiser R+D, S.L., Paterna, Valencia, España).
Una vez obtenidas, las muestras se mantuvieron a una temperatura constante de 37 °C, pudiéndose analizar de forma inmediata gracias al uso de licuefactantes en el bote de recogida, ya que el protocolo de trabajo era considerablemente complejo y se deseaba minimizar el efecto del paso del tiempo entre la recogida y el análisis.
Cámaras de recuento utilizadasSe utilizaron 2 tipos de cámaras, unas reusables y basadas en el principio de desplazamiento de la gota, las Spermtrack® (fig. 1A), y otras desechables, basadas en el principio de difusión capilar, las ISAS®D4C (ambas cámaras, de Proiser R+D, S.L., Paterna, Valencia, España) (fig. 1B). Además, se evaluó el efecto de la altura de la cámara, utilizando 10 y 20μm para la Spermtrack® y 10,16 y 20μm para la ISAS®D4C.
En las cámaras Spermtrack®, se contaron 9 campos (fig. 2A), mientras que en la ISAS®D4C se procedió a contar en el centro de cada uno de sus 7 recuadros (fig. 2B).
Análisis computarizado de las muestrasTodos los análisis se hicieron con un sistema CASA, el ISAS®v1 (Proiser R+D, S.L., Paterna, Valencia, España). Dicho equipo consistió en un microscopio UOP-ISAS, dotado con iluminación led, equivalente a 50W, y óptica de contraste de fase negativo de 10x. La cámara utilizada fue una Proiser 782C, a una frecuencia de captura de 25 imágenes por segundo, analizándo un segundo en cada caso. El resto del set-up considerado fue el que viene indicado por defecto para el análisis de muestras humanas. Tanto las imágenes como los datos se guardaron para su posterior revaluación.
Se aleatorizó el orden en que se hicieron los análisis para evitar que influyera de forma contante en los resultados obtenidos.
Diseño experimentalEfecto del tiempo de colocación del cubre en las Spermtrack®En cámaras que siguen el principio de carga por desplazamiento de la gota, como la Makler®, se detectó que el tiempo de colocación del cubre influye en los resultados4. Por ello, procedimos a colocar dicho cubre inmediatamente tras la deposición de la gota (tiempo 0) y a los 5, 10 y 15 segundos.
Efecto de la zona de recuentoEste experimento se realizó a tiempo de análisis 0 para todas las cámaras, y también a tiempo de carga 0 para las Spermtrack®.
Puesto que las cámaras Spermtrack® presentan un diseño circular y que la expansión de la gota como consecuencia de la presión ejercida por el cubre debe distribuirse de forma radial, las 8 posiciones periféricas deberían presentar unos valores semejantes, pudiendo ser diferente tan solo en la posición 5.
En el caso de las cámaras ISAS®D4C, el llenado de las mismas se realiza por capilaridad, por lo que podrían darse diferentes distribuciones celulares en función del avance capilar de la muestra. En este caso, las posibles diferencias deberían aparecer a lo largo del recorrido, analizando las posibles modificaciones desde la posición 1 a la 7.
Efecto de la altura y del tipo de cámaraHasta la fecha, las cámaras basadas en el desplazamiento de la gota por presión han venido siendo de 10μm, si bien la Organización Mundial de la Salud1 recomienda usar cámaras de 20μm. Por su parte, las cámaras desechables presentan mayor diversidad de alturas disponibles.
Como es lógico, la altura del espacio en que se mueven los espermatozoides condiciona la movilidad y la distribución de los mismos, por lo que se analiza el efecto de dicha característica sobre los resultados obtenidos.
Efecto del tiempo de análisisEn este experimento, se analizó el efecto del tiempo transcurrido entre la carga de las cámaras y el análisis de las mismas. Con ello, se pretendía analizar la fiabilidad de las medidas con independencia de cuándo se analizan, así como descartar la toxicidad de la cámara en sí misma si los resultados se mantenían en el tiempo. Las muestras se evaluaron inmediatamente tras la carga de las cámaras (tiempo 0), a los 60, 150 y 300 segundos.
Análisis estadísticoEn los diferentes estudios, se procedió a realizar un análisis de varianza de una sola vía, según el experimento considerado. En los casos pertinentes, se aplicó un test de Tukey para el análisis a posteriori de las variaciones entre grupos de estudio. En las comparaciones entre los distintos tipos de cámaras, se consideraron tan solo los 5 donantes coincidentes entre Spermtrack® e ISAS®D4C.
ResultadosComo resultado general, en todos los experimentos cabe constatar que no se observaron diferencias significativas en los valores cinéticos en ninguno de los experimentos considerados.
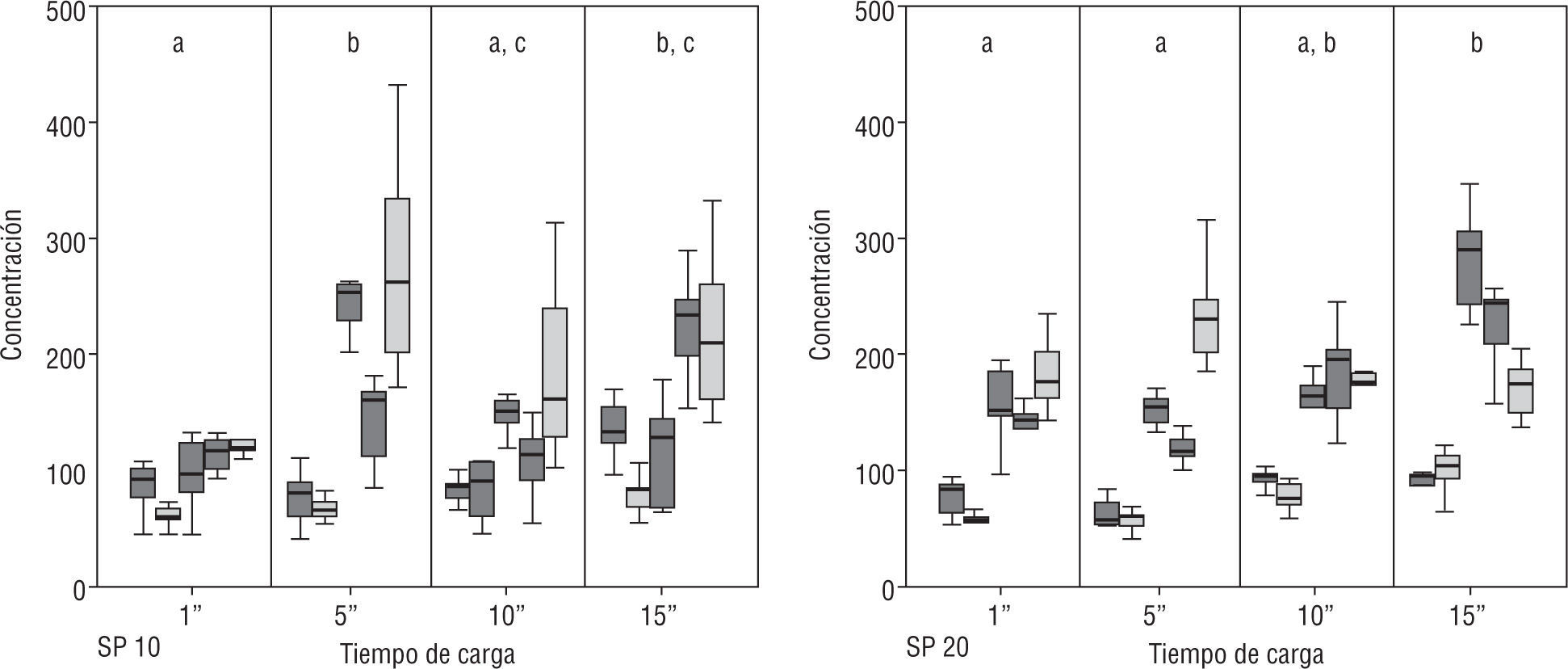
Efecto del tiempo de colocación del cubre en las Spermtrack®La primera observación interesante es que los resultados de concentración obtenidos a tiempo 0 con la cámara de 10μm presentaron una menor dispersión de datos en todos los pacientes. No obstante, el incremento en la variabilidad de los resultados entre los 9 campos analizados fue superior en unos pacientes que en otros. Este resultado no se observó con la cámara de 20μm, donde la dispersión fue homogénea entre lo diferentes tiempos y menor que la observada en las cámaras de 10μm (fig. 3). En su conjunto, a partir de los 5 segundos, se observó un incremento significativo (p<0,05) en la concentración en las cámaras de 10μm, mientras que en las de 20μm, tan solo se observó significación en el incremento tras 15 segundos (fig. 3). Cabe señalar que en ambos casos, el comportamiento fue diferente con diversos pacientes, de forma que en algunos no hubo modificación ni en una ni en otra cámara, mientras que en otros las hubo en ambos casos.
En cuanto a la medida de la movilidad total, no se observaron cambios en el caso de las cámaras de 10μm, mientras que en la cámara de 20μm hubo un incremento significativo tras un tiempo de 10 segundos o más. También en este caso, se vio un comportamiento diferencial en función del paciente (fig. 4).
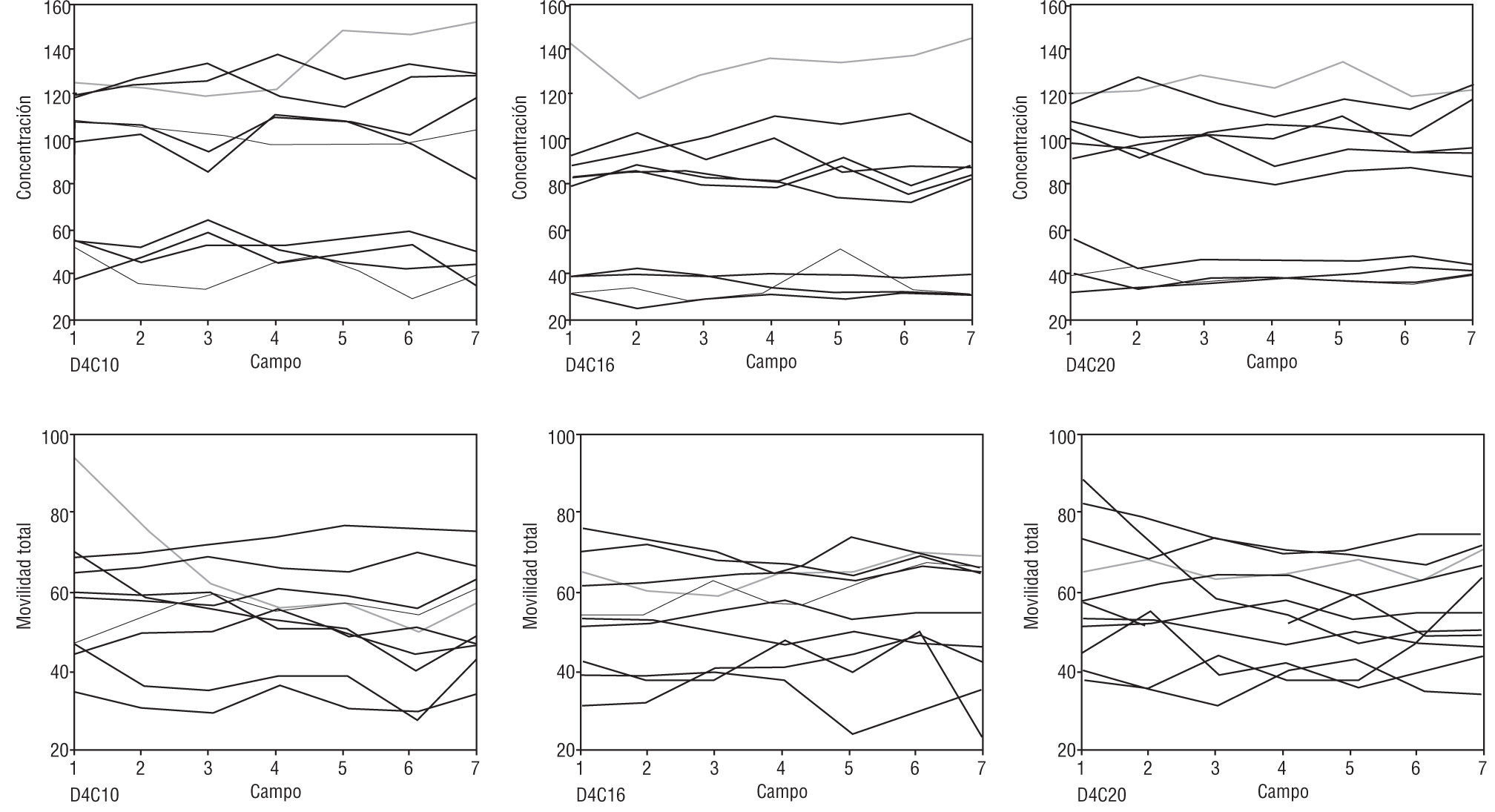
Efecto de la zona de recuentoLas variaciones observadas en las 2 cámaras Spermtrack® fueron completamente aleatorias, no observándose variaciones entre la posición central y ninguna de las periféricas, indicando que la distribución de células y su movilidad no se ve alterada por dicha variable.
En cuanto a las cámaras ISAS®D4C, se puede observar que hay una constancia considerable en los valores obtenidos en los diferentes puntos de recuento, y que las variaciones observadas son aleatorias, tanto en los valores de concentración como en los de movilidad. Tan solo en 2 de los recuentos (el correspondiente al color azul claro en la cámara de 10μm y el magenta en el de 20μm), se observó un valor claramente superior de movilidad total en la zona 1, como consecuencia de la presencia de un movimiento pasivo (drifting) (fig. 5).
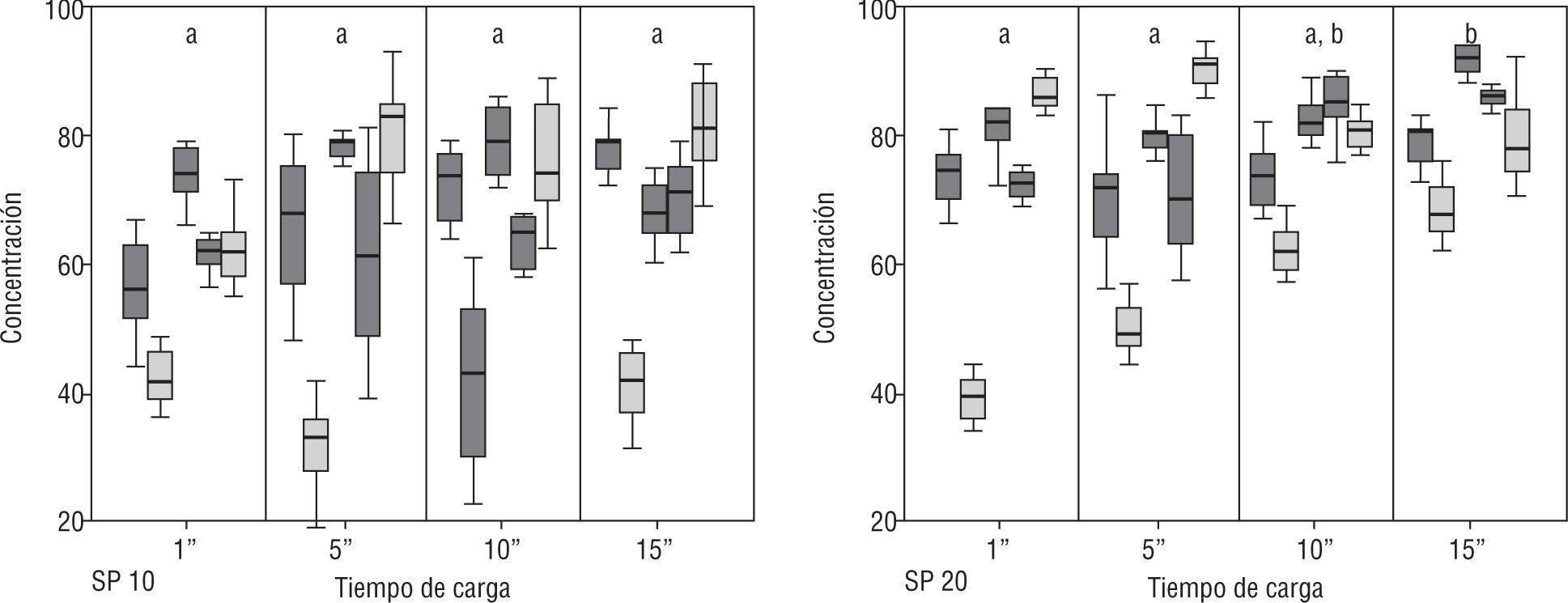
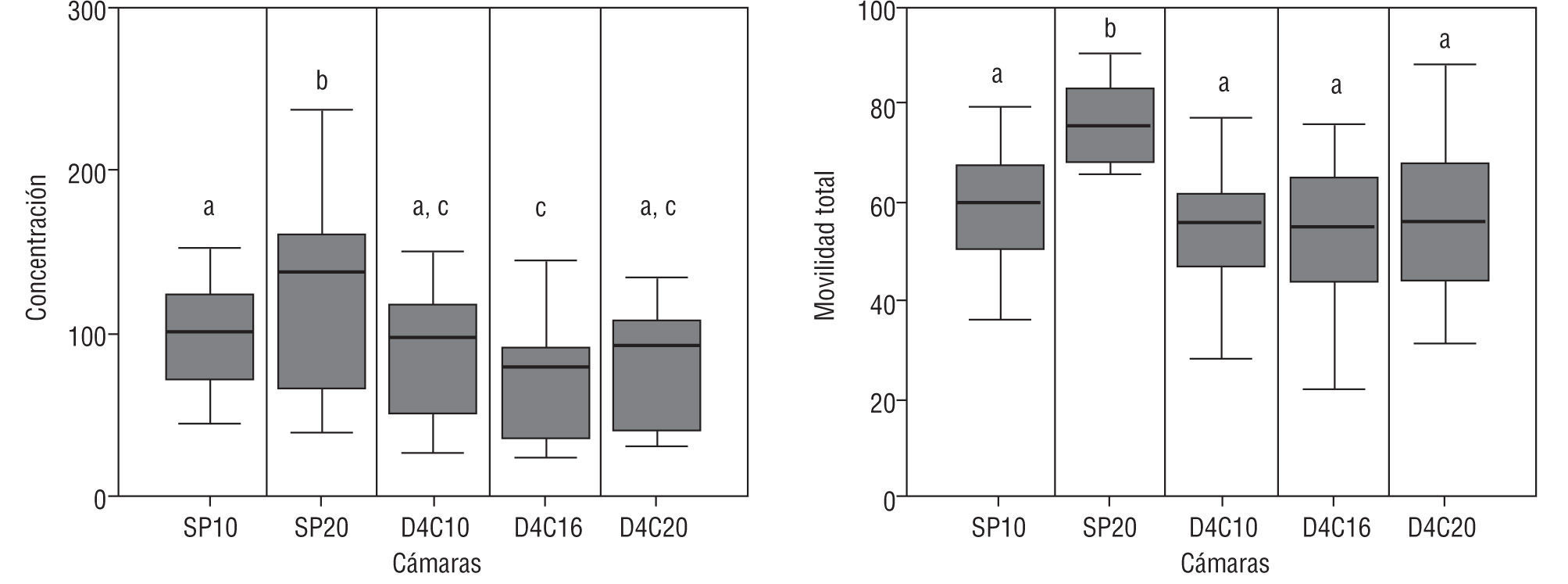
Efecto de la altura y del tipo de cámaraEn las cámaras Spermtrack®, se puso de manifiesto que tanto la movilidad como la concentración mostraron valores significativamente superiores en las de 20μm. Por su parte, los valores obtenidos con las cámaras ISAS®D4C no mostraron variación alguna, con independencia de la altura considerada.
Los valores obtenidos con la Spermtrack® de 10μm y las 3 ISAS®D4C no mostraron diferencias significativas, mientras que sí se observaron respecto de la Spermtrack® de 20μm (fig. 6).
Efecto del tiempo de análisisEn ninguna de las 2 cámaras (Spermtrack® e ISAS®D4C) ni para ninguna de las alturas consideradas, se observaron cambios significativos en la concentración ni la movilidad total durante todo el tiempo en que se analizaron las muestras.
DiscusiónLa determinación precisa de la concentración y la movilidad espermática resulta imprescindible para la correcta valoración de la calidad seminal. En concreto, la concentración se puede determinar por diversos métodos que incluyen la atenuación de un haz óptico de dispersión o absorción de la luz (fotómetro), el recuento individualizado de las células en un aparato de restricción de flujo (Coulter counter, citómetro de flujo) o a partir de los sistemas clásicos del hemocitómetro usando cámaras, sean desechables o reusables2.
A su vez, los recuentos hechos con el uso de cámaras de recuento pueden valorarse de forma manual o con el uso de sis-temas CASA4. En todo caso, la literatura científica no ha desarrollado adecuadamente la valoración de los diferentes tipos de cámara que se pueden utilizar. Además, hay que tener en cuenta que sea cual sea el método utilizado para determinar la concentración espermática, siempre se parte de tomar una porción de la muestra total, por lo que nunca se podrá hacer más que una estimación de la concentración real5.
Cuando se introduce un nuevo equipamiento, mucha gente pasa a usarlo solo porque es nuevo, mientras que otra lo rechaza apelando a la tradición6. Ambas posturas son igualmente erróneas, requiriéndose la realización de estudios pormenorizados de su uso y limitaciones. Así, cuando abordamos la realización de este estudio preliminar, lo hicimos desde la perspectiva de la valoración en profundidad del porqué de cada método, y de sus posibles limitaciones.
La mayoría de los estudios parten de considerar el uso del hemocitómetro como el Gold standard, si bien su uso presenta limitaciones considerables, como la necesidad de diluir la muestra y todo el error técnico que ello comporta7. Además, como se indicó en la introducción, para su calibrado se han hecho diversos estudios utilizando bolas de látex3, con las limitaciones que eso supone.
Partiendo de la presunción de que hay un Gold standard, diversos estudios han propuesto curvas de regresión entre el mismo y el nuevo instrumento considerado, con el fin de determinar “factores de corrección” que hagan equivalentes los resultados entre ambos8,9. Pero esta aproximación metodológica tan solo tiene sentido a partir de la suposición de que realmente existe ese Gold standard. Según nuestro punto de vista, sería más correcto hablar de un established standard, lo que tiene un significado completamente distinto. Es evidente que cualquier nuevo criterio de medida debe compararse con lo preexistente para adaptar los resultados, pero teniendo en cuenta que la calidad de una medida se refiere a su precisión y repetitividad y no al momento histórico en que aparece.
En el presente trabajo, se ha optado por centrarse en la evaluación de dichos parámetros, dejando para más adelante el estudio comparativo con otros sistemas de medida preexistentes.
En líneas generales, tanto las cámaras reusables, que seguían el principio de desplazamiento de la gota, como las desechables, que seguían el de difusión capilar, se mostraron útiles en la determinación de la concentración y la movilidad espermáticas. No se observaron cambios en la distribución de los valores en función de la zona de recuento o del tiempo transcurrido entre la carga y el análisis. Ello indica que hay una ausencia de toxicidad, y que el diseño de las cámaras es uniforme, no viéndose alterados los resultados por el mismo, como sí ocurría con otros tipos de cámaras preexistentes.
En particular, cabe señalar que no se ha observado el llamado efecto Makler®, consistente en la aparición de un incremento en la concentración, no solo de espermatozoides, sino incluso de bolas de látex. Este hecho hizo pensar que el efecto de incremento de la concentración en función del tiempo transcurrido entre la deposición de la gota y la colocación del cubre era debido a la distribución física de las partículas y no a un efecto biológico10.
Nuestros resultados han puesto de manifiesto que este efecto no se produce en la Spermtrack®, posiblemente debido a la diferente composición del material utilizado, ya que el principio físico en que se sustenta es el mismo. No obstante, se observó una marcada diferencia en la dispersión de resultados al usar las cámaras Spermtrack® de 10μm con el incremento en el tiempo de carga en unos pacientes y no en otros. Este hecho podría indicar la presencia de un efecto biológico, ya que en el volumen de la gota puede producirse una especie de swim-up, de forma que al tardar más tiempo en desplazarla podría haber un incremento de células móviles en la zona central de la misma. Llama la atención que con las cámaras de 20μm este efecto no haya sido tan evidente.
La Organización Mundial de la Salud1 recomienda el uso de cámaras de 20μm; al respecto, es interesante señalar que los resultados obtenidos no mostraron diferencias significativas entre las diferentes alturas evaluadas en las cámaras desechables, mientras que sí se manifestaron en las reusables. Ello hace pensar que el efecto debido al sistema de carga de las cámaras (desplazamiento o capilaridad) debe ser adecuadamente evaluado a la hora de decidir qué cámara utilizar y por qué hacerlo.
ConclusiónEste estudio preliminar permite afirmar que el uso de estos 2 nuevos tipos de cámaras presenta un nivel de precisión y repetitividad satisfactorio, incluso superior al que se observa en otras cámaras previamente utilizadas. No obstante, es necesario completar los presentes trabajos para llegar a conclusiones firmes, que incluyan comparaciones con otros sistemas, definiendo factores de corrección entre ellas que permitan comparar adecuadamente los resultados.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesMaría Sancho y Almudena García pertenecen a la plantilla de la compañía fabricante de las cámaras analizadas (Projectes i Serveis, R+D, S.L., Paterna, Valencia, España).
Projectes i Serveis, R+D, S.L. propociona asesoría técnica a la Universitat de València.
Deseamos agradecer a la compañía PROiSER R+D haber proporcionado todo el material necesario para el desarrollo del presente trabajo.