Estandarización de la técnica de pretratamiento y tinción para la automatización de la morfología espermática con metodología tipo computer-assisted sperm morphometry analysis, con el analizador de sémenes SCA 5.4 (Sperm Class Analyzer, Microptic).
Material y métodosLa automatización de la morfología se ha realizado con el analizador de semen SCA 5.4 (Microptic S.L., Barcelona, España). El método de tinción ha sido una modificación del equipo Hemacolor (Merck). Se procesan entre 69 y 125 sémenes, los cuales han sido muestras escogidas aleatoriamente de nuestro laboratorio.
ResultadosEl pretratamiento de la muestra de semen escogido, debido a los resultados obtenidos, fue una centrifugación suave durante 5min a 300g, se descarta el plasma seminal y se homogeneiza suavemente el sedimento con 0,2ml del propio plasma seminal. Este pretratamiento ya se comprobó que no artefactaba los espermatozoides. La tinción que se ha escogido es el kit Hemacolor (Merck), pero con modificaciones. Se tampona el fijador con buffer fosfato pH 7,2 al 10%, se reduce los tiempos aconsejados por el fabricante a fijación durante 5seg, tinción con eosina 30seg y tinción con azur 2seg. Finalmente se lava 30seg con tampón fosfato pH7,2, como indica el fabricante. Tras dicho pretratamiento y tinción estandarizadas se hallan los coeficientes de variación del pretratamiento y valores de referencia para nuestra metodología.
ConclusionesLa automatización de la morfología espermática reduce los coeficientes de variación de la determinación, aumentando su fiabilidad técnica y eliminando la subjetividad que conlleva un análisis manual. Esta estandarización constituye el primer paso para el estudio del valor diagnóstico de la morfología avanzada en la infertilidad y en enfermedades urológicas.
Standardization ofpretreatment and staining technique to realizemorphological semen evaluation with computer-assisted sperm morphometry analysis system, with semen system analyzer SCA 5.4 (Sperm Class Analyzer, Microptic).
Material and methodsMorphological analysis was performed with semen system analyzer SCA 5.4 (Microptic SL, Barcelona, Spain). The staining method was a modification of Hemacolor kit (Merck). Between 60 and 125 semen samples were chosen randomly from our laboratory.
ResultsPretreatment of semen samples was a centrifugation for 5minutes at 300g, seminal plasma was rejected and the pellet was homogenized with .2mL of the seminal plasma itself. Not change in sperm morphology have been found with this pretreatment. Staining was performed with Hemacolor kit (Merck) but with some modifications. Fixer has been buffered with phosphate buffer pH 7.2 at 10%, time recommended by the manufacturer has been reduced. Fixation for 5seconds, 30seconds with Eosin staining and 2seconds with staining Azur. Finally it was washed for 30seconds with pH 7.2 phosphate buffer, as indicated by the manufacturer. After the pretreatment and staining we have got reference values for our methodology.
ConclusionsAn automation methodology to perform sperm morphology reduces coefficient variations of determination thereby we can increase its technical reliability and remove the subjectivity of the manual analysis. This standardization can be the first step to study the diagnostic value of advanced morphology in infertility and urological diseases.
La estandarización para realizar la morfología espermática con sistemas de análisis de semen automáticos tipo computer-assisted sperm morphometry analysis (CASMA/ASMA), todavía no ha conseguido la implantación deseada en nuestros laboratorios de andrología. Se han señalado varias causas que explicarían este retraso histórico, como son la falta de una estandarización consensuada por los diferentes fabricantes del mercado de estos métodos1–4, y otras como que la realización de la morfología espermática presenta un gran número de variables a estandarizar4,5. Por ejemplo, las diferentes modalidades de pretratamiento a las que se puede someter el semen, los diversos tipos de tinciones no específicas tipo panóptica6, como Hemacolor (Merck), Diff-Quick (Siemens), Shorr, Spermac, o específicas como Spermblue7. Sin embargo, nosotros creemos que la causa principal de este retraso es la falta de consenso en la unificación de criterios válidos que definan las alteraciones en la morfología del espermatozoide. Algunos profesionales siguen los criterios de la OMS8, otros los criterios estrictos de Kruger9, y otros, que es la predominante en Europa, siguen los de la Sociedad Europea de Reproducción Humana y Embriología ESHRE ()10. Por todo ello no existe aún un protocolo de consenso a seguir.
La importancia del parámetro morfología es una constante que se repite en todos los estudios clínicos actuales de fertilidad9,11–15, relacionándose específicamente tasa de fertilidad con porcentaje de morfología normal9,12,16–19. La morfología realizada manualmente presenta altos coeficientes de variación técnica20 y requiere una prolongada formación de técnicos de laboratorio para asumir unos mínimos de fiabilidad aceptable. Además existe un gran costo de tiempo para realizar cada morfología manual. Ante el aumento de la presión asistencial al Laboratorio de Andrología que ha generado el incremento de las técnicas de reproducción asistida en nuestros hospitales, y dada la dificultad de asumir esta rutina con métodos manuales, en este trabajo se plantea una primera aproximación a la estandarización en la morfología espermática automatizada. Los métodos utilizados son tipo CASMA/ASMA, siguiendo el modelo David, de gran implantación en Francia21, dada la falta de consenso a seguir que deberían establecer las sociedades científicas tipo Sociedad Europea de Reproducción Humana y Embriología y NAFA en Europa.
Material y métodosPara la realización de la morfología espermática de forma automatizada se ha empleado el analizador de semen SCA 5.4 (Sperm Class Analyzer) de Microptic. Los aumentos a los que se ha analizado son ×100 con aceite de inmersión. Se han analizado alrededor de 200 espermatozoides por cada muestra de semen, y con ello se ha obtenido el porcentaje de formas normales como resultado principal del informe. También se ha creado una nueva plantilla adicional subtitulada «Morfoanomalías» o «Morfología avanzada», en la que se halla el porcentaje para cada una de las alteraciones de la cabeza, la zona intermedia y la cola. En el caso del análisis en fresco, que se utilizó para conocer las diferencias significativas entre nuestro método y el empleado hasta la fecha, fue a ×40.
Para la estandarización de la primera parte se han estudiado diversos métodos de pretratamiento de la muestra. La OMS propone la centrifugación y lavado del semen con diversos tampones o suero fisiológico8. Nosotros hemos efectuado un estudio preliminar para determinar qué pretratamiento de la muestra era el más adecuado para conseguir un número mínimo de elementos celulares por campo, y realizar el recuento con una fiabilidad aceptable. Por otro lado, también debíamos estandarizar la tinción. Para ello se han estudiado los diversos métodos de tinción existentes en el mercado. Panópticos no específicos tipo Diff-Quick (Siemens) o Hemacolor (Merck), o específicos como Spermblue (Microptic). Se ha escogido trabajar con el kit Hemacolor modificando su reactivo fijador tamponando y aumentando su osmolaridad, de forma que se ha conseguido estabilizar la tinción y la lectura óptima en el SCA.
Para la estandarización del proceso se han empleado las muestras de semen de 510 pacientes con una media de edad de 35,6 años. La procedencia de estos pacientes fue de 148 (29%) del servicio de esterilidad de nuestro hospital, 322 (63%) de centros de atención primaria externos, 25 (5%) de pacientes del servicio de urología de nuestro hospital y 15 (3%) de varias procedencias.
ResultadosEstandarización de la realización de la morfología automatizada con Sperm Class Analyzerrealizado ha sido obtener el factor de conversión entre píxeles y micrómetros. Se realiza encontrando la relación entre el número de píxeles y la medida de un objeto conocido en una imagen tomada con el sistema de adquisición de imágenes, configurado en la forma de trabajo. El factor de conversión hallado fue de 0,083648 píxel/micrómetro. Se utilizó una rejilla micrométrica Carl-Zeis.
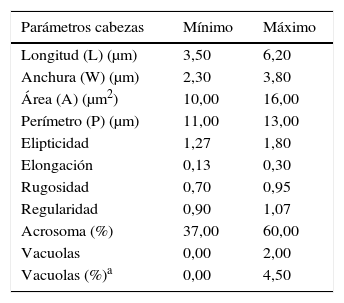
El analizador de semen automático SCA permite elegir entre utilizar criterios de la OMS, Kruger, David o personales dentro del apartado de análisis de morfología. Cada criterio conlleva unos márgenes prefijados para los parámetros de morfología: elipticidad, elongación, rugosidad, regularidad, etc. Analizados los diversos criterios, y dado que ninguno cumplía con nuestras expectativas y tampoco reflejaba el análisis del semen en fresco, hemos establecido criterios propios. En dichos parámetros de la morfología, que describe el SCA, se han fijado unos máximos y mínimos basándonos en el modelo francés de David21 y en nuestra propia experiencia, en la que se realizan 3.000 seminogramas/año. En la tabla 1 se establecen los márgenes propios para cada uno de los parámetros descriptivos del espermatozoide normal. En la tabla 2 se establecen los márgenes que clasifican las morfoanomalías de cabeza. Ellos han sido definidos tanto en función de nuestro pretratamiento y tinción del frotis, como del análisis visual propio de la muestra en fresco, y de la morfología teñida visualizada en la pantalla del SCA.
Márgenes propios para cada uno de los parámetros descriptivos de la morfología del espermatozoide normal
| Parámetros cabezas | Mínimo | Máximo |
|---|---|---|
| Longitud (L) (μm) | 3,50 | 6,20 |
| Anchura (W) (μm) | 2,30 | 3,80 |
| Área (A) (μm2) | 10,00 | 16,00 |
| Perímetro (P) (μm) | 11,00 | 13,00 |
| Elipticidad | 1,27 | 1,80 |
| Elongación | 0,13 | 0,30 |
| Rugosidad | 0,70 | 0,95 |
| Regularidad | 0,90 | 1,07 |
| Acrosoma (%) | 37,00 | 60,00 |
| Vacuolas | 0,00 | 2,00 |
| Vacuolas (%)a | 0,00 | 4,50 |
| Parámetros zona intermedia | Mínimo | Máximo |
|---|---|---|
| Área (μm2) | 0,00 | 3,30 |
| Anchura (μm) | –1,00 | 1,80 |
| Distancia inserción (μm) | 0,00 | 0,50 |
| Ángulo (°)b | 0,00 | 23,00 |
| Parámetros cola | Mínimo | Máximo |
|---|---|---|
| Longitud (μm)c | 12,00 | 100,00 |
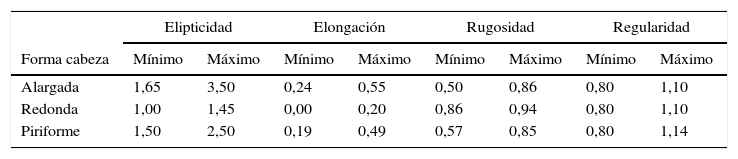
Parámetros derivados, obtenidos de fórmulas matemáticas con los parámetros primarios, que son aproximaciones para describir la morfología de cabeza del espermatozoide
| Elipticidad | Elongación | Rugosidad | Regularidad | |||||
|---|---|---|---|---|---|---|---|---|
| Forma cabeza | Mínimo | Máximo | Mínimo | Máximo | Mínimo | Máximo | Mínimo | Máximo |
| Alargada | 1,65 | 3,50 | 0,24 | 0,55 | 0,50 | 0,86 | 0,80 | 1,10 |
| Redonda | 1,00 | 1,45 | 0,00 | 0,20 | 0,86 | 0,94 | 0,80 | 1,10 |
| Piriforme | 1,50 | 2,50 | 0,19 | 0,49 | 0,57 | 0,85 | 0,80 | 1,14 |
Elipticidad (L/W), elongación (L-W/L+W), rugosidad (4πA/P2) y regularidad (πLW/4A).
Fuente: Yaniz et al.14.
Dado que el informe de anomalías morfológicas no sumaba 100%, se ha establecido una plantilla experimental en la que se contabilizaban el número de espermatozoides y se expresan en porcentaje, para cada forma espermática, con 3 grandes grupos de alteraciones: cabeza del espermatozoide (macrocefálicos, microcefálicos, alargada, redonda, piriforme, acrosoma micro y amorfos), zona intermedia (zona intermedia anómala, inserción anómala y formas inmaduras) y cola (flagelo anómalo). Este modelo para realizar la morfología se muestra en la tabla 3, con unos valores de referencia preliminares que se deben considerar como una aproximación a la estandarización de la morfología, basándonos, como hemos dicho anteriormente, en el modelo francés de David, que nos permite procesar nuestra rutina con una mínima fiabilidad técnica. El análisis de los resultados obtenidos, con el estudio de diversas enfermedades, nos permitiría establecer y trabajar los patrones futuros de estudio morfológico asociados con la fisiopatología y, así, validar o corregir nuestros criterios de estandarización, hasta que ello sea descrito por las entidades científicas.
Plantilla de configuración SCA del estudio de la morfología con valores de referencia preliminares
| Morfología | Media (%) | lim 95 | Valor de referencia (%) (OMS) |
|---|---|---|---|
| Normales | 4 | 4-6% | >4 |
| Anormales | 96 | ||
| 100 |
| Morfoanomalías (anormales) | Media (%) | lim 95 | Valor de referencia (%) (OMS) |
|---|---|---|---|
| Cabeza | |||
| Microcefálicos | 9 | 8%-10% | <10 |
| Macrocefálicos | 9 | 8%-10% | <10 |
| Alargados | 24 | 22%-25% | <25 |
| Redondos | 13 | 11-15% | <15 |
| Piriformes | 8 | 7-10% | <10 |
| Acrosoma pequeño | 13 | 12-14% | <15 |
| Amorfos | 3 | 2-4% | <5 |
| Zona intermedia | |||
| Zona intermedia anómala | 6 | 5-7% | <10 |
| Flagelo inserción anómala (angulados) | 6 | 6-7% | <10 |
| Inmaduros (gotas citoplasmáticas) | 5 | 4-6% | <10 |
| Flagelo | |||
| Anormal | 4 | 3-5% | <5 |
| 100 | |||
Los valores en negrita indican los valores de referencia según la OMS.
La OMS, para muestras con una concentración inferior a 2 millones de espermatozoides o con una viscosidad aumentada, presenta varias alternativas que permiten concentrar las muestras de forma que se pueda efectuar un frotis con un número mínimo de elementos celulares. Así se posibilita su lectura con una fiabilidad aceptable. Se propone centrifugar la muestra 600g durante 10min, se desecha el sobrenadante y se efectúa la extensión con el sedimento homogenizado. En el caso de muestras muy viscosas plantea lavar con suero fisiológico, descartar el sobrenadante y homogenizar el sedimento para efectuar la extensión8.
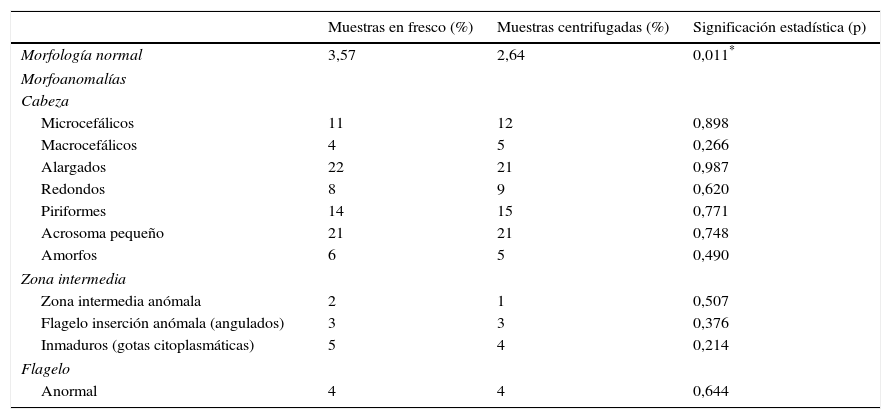
Aprovechando la alternativa que propone la OMS para muestras oligozoospérmicas, realizamos la estandarización del pretratamiento de nuestras muestras, con concentraciones tanto inferiores como superiores a 2 millones, en el que se han realizado varios estudios preliminares concentrando el semen por centrifugación, y un posterior lavado con suero fisiológico o con tampón PBS. En este estudio se observó que la centrifugación, a 900g y 600g, junto al lavado con suero fisiológico o con PBS artefactaba notablemente la forma y el tamaño de los espermatozoides en fresco. Debido a este efecto se optó por una centrifugación suave durante 5min a 300g, descartar el plasma seminal sobrenadante y homogenizar suavemente el sedimento con 0,2ml del mismo plasma restante. Es importante destacar que las muestras con concentraciones superiores a 40x106/ml no se centrifugan evitando la elevada aglomeración celular que impida la correcta captura de la imagen. El frotis se realizó utilizando un extensor semiautomático Hemaprep (CellaVision), lo que nos permitía una mejor estandarización del procedimiento. Este método descrito nos pareció el más correcto, dado que ocasionaba una menor distorsión en los espermatozoides. Seguidamente, para realizar la validación del pretratamiento se ha realizado un estudio comparativo de la morfología de 60 pacientes en fresco y con nuestro pretratamiento, estudiándose la morfología con el SCA. En la tabla 4 se muestran los resultados obtenidos. El análisis estadístico comparativo de las medias de los porcentajes de cada parámetro en fresco y centrifugado, tras su tinción, aplicando el test estadístico de la «t» de Student, nos muestra que existen diferencias significativas en las medias del porcentaje de normales, 3,57% en fresco y 2,64% centrifugada, con una p<0,05. A pesar del resultado significativo, en nuestro caso esta pequeña diferencia carece de ninguna significación clínica. Respecto a los demás parámetros se observa que la centrifugación en nuestras muestras analizadas no produce un aumento significativo de ninguna de las formas morfológicas. Con ello se valida este método para su utilización como procedimiento preanalítico para la automatización de la morfología espermática, aunque existe una leve reducción de las formas normales, como hemos señalado, por lo que será necesario establecer nuestros propios valores de referencia con esta técnica.
Resultados de las medias de 60 sémenes con el análisis de morfología de semen en fresco y tras el pretratamiento basado en centrifugación y posterior homogenización con el propio sobrenadante
| Muestras en fresco (%) | Muestras centrifugadas (%) | Significación estadística (p) | |
|---|---|---|---|
| Morfología normal | 3,57 | 2,64 | 0,011* |
| Morfoanomalías | |||
| Cabeza | |||
| Microcefálicos | 11 | 12 | 0,898 |
| Macrocefálicos | 4 | 5 | 0,266 |
| Alargados | 22 | 21 | 0,987 |
| Redondos | 8 | 9 | 0,620 |
| Piriformes | 14 | 15 | 0,771 |
| Acrosoma pequeño | 21 | 21 | 0,748 |
| Amorfos | 6 | 5 | 0,490 |
| Zona intermedia | |||
| Zona intermedia anómala | 2 | 1 | 0,507 |
| Flagelo inserción anómala (angulados) | 3 | 3 | 0,376 |
| Inmaduros (gotas citoplasmáticas) | 5 | 4 | 0,214 |
| Flagelo | |||
| Anormal | 4 | 4 | 0,644 |
Inicialmente se estudió el método Diff-Quick con los tiempos recomendados por el fabricante. En este se encontraba un número muy reducido de formas normales y una cierta artefactación en la morfología. Se observaba un número importante de forma microcefálica, que no cuadraba con la observación en fresco de la muestra. Seguidamente se estudió el método semen específico, con control de la osmolaridad de sus componentes, Spermblue7 (Microptic, España). Esta, aparte de ser muy costosa económicamente, tiñe de azul todas las estructuras del espermatozoide, por lo que hace muy difícil la realización manual de la morfología. Dado que tenemos un número importante de severas oligozoospermias, que hacen muy difícil su análisis por método automatizado, y que es obligado hacerlas manualmente, hemos desestimado la utilización de esta tinción. No obstante creemos que este tipo de tinciones es la que presenta mejores perspectivas de futuro para sistemas automáticos tipo ASMA. Finalmente, el método de tinción utilizado fue Hemaecolor (Merck). Se compone de un fijador metanol al 100%, con una osmolaridad de 82mOsmol/kg, un primer colorante de eosina, con una osmolaridad de 178mOsmol/kg, y un segundo colorante azur B, con una osmolaridad de 194mOsmol/kg. El método de tinción inicial ha sido el aconsejado por la casa comercial: fijación durante 30seg, primer colorante 6seg, segundo colorante 4seg y lavar con tampón fosfato pH7,2 durante 20seg.
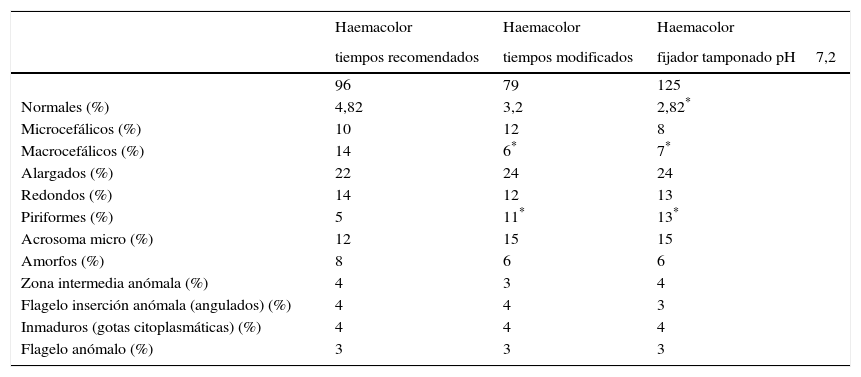
Se han procesado 96 sémenes, escogidos aleatoriamente de la rutina diaria, utilizando nuestro tratamiento preanalítico, explicado en el apartado anterior, y realizando la tinción Haemacolor según las instrucciones del fabricante. En la tabla 5 se muestran los resultados de las medias para cada parámetro morfológico. La impresión visual del frotis y el análisis inicial de estos resultados nos indicaban una deficiente fijación y tinción según cada semen, con una gran variabilidad de resultados. Ello hacía difícil su estandarización. Así, el siguiente paso para mejorar la estandarización fue cambiar los tiempos aconsejados por el fabricante. Se ha reducido el tiempo de fijación a 5seg, 30seg con el primer colorante eosina y 2seg con el segundo colorante azur B; finalmente se ha lavado con tampón fosfato pH 7,2. En la tabla 5 se muestran las medias de los resultados de procesar 79 sémenes diferentes, también escogidos aleatoriamente. El análisis estadístico de las medias de ambas poblaciones, utilizando el test de la «t» de Student para comparar las medias de los porcentajes de cada parámetro, nos muestra un descenso de espermatozoides macrocefálicos (de 14% a 6%) y un aumento de los piriformes (de 5% a 11%), de una manera significativa (p<0,05). Este efecto de disminución de las formas macrocefálicas lo atribuimos al efecto hipoosmolar del fijador, que al estar en contacto con la muestra durante más tiempo en el primer estudio haría que los espermatozoides aumenten su volumen. Estas experiencias nos han mostrado que la fijación del semen es uno de los pasos importantes a la hora de producir efectos en la morfología de los espermatozoides. Hecho que hemos ratificado analizando visualmente las muestras de los sémenes en fresco sin pretratamiento ni tinción. El siguiente paso fue modificar el fijador. Se ha tamponado este reactivo con un buffer fosfato a una concentración del 10%, con pH7,2, aumentando así su osmolaridad. El resto de componentes de la tinción se han mantenido en las mismas condiciones del ensayo anterior. Los resultados de esta modificación ya nos parecieron correctos, por lo que se procesaron 125 muestras de semen diferentes, escogidas aleatoriamente. Los resultados de esta tercera experiencia también se muestran en la tabla 5. El análisis de estos últimos resultados, comparativamente con los demás grupos de población estudiados, nos muestra una disminución de los macrocefálicos (de 14% a 6% y 7%) y un aumento de los piriformes (de 5% a 11% y 13%), estadísticamente significativos (p<0,05). Por otra parte también se observa una disminución, aunque no significativa (p>0,05), de los microcefálicos (de 10% y 12% a 8%). Podríamos pensar que la estabilización del fijador con el tampón mejora la tinción, y por ello se escogió como la mejor opción para la estandarización de nuestro procedimiento. A pesar de que reduce el número de formas normales se ajusta más a la observación en fresco de los sémenes.
Medias de los resultados del análisis de la morfología con el método de tinción Haemacolor según fabricante, con los tiempos de tinción modificados y con el fijador tamponado al 10% pH7,2 pero manteniendo los tiempos de tinción establecidos según el fabricante
| Haemacolor | Haemacolor | Haemacolor | |
|---|---|---|---|
| tiempos recomendados | tiempos modificados | fijador tamponado pH7,2 | |
| 96 | 79 | 125 | |
| Normales (%) | 4,82 | 3,2 | 2,82* |
| Microcefálicos (%) | 10 | 12 | 8 |
| Macrocefálicos (%) | 14 | 6* | 7* |
| Alargados (%) | 22 | 24 | 24 |
| Redondos (%) | 14 | 12 | 13 |
| Piriformes (%) | 5 | 11* | 13* |
| Acrosoma micro (%) | 12 | 15 | 15 |
| Amorfos (%) | 8 | 6 | 6 |
| Zona intermedia anómala (%) | 4 | 3 | 4 |
| Flagelo inserción anómala (angulados) (%) | 4 | 4 | 3 |
| Inmaduros (gotas citoplasmáticas) (%) | 4 | 4 | 4 |
| Flagelo anómalo (%) | 3 | 3 | 3 |
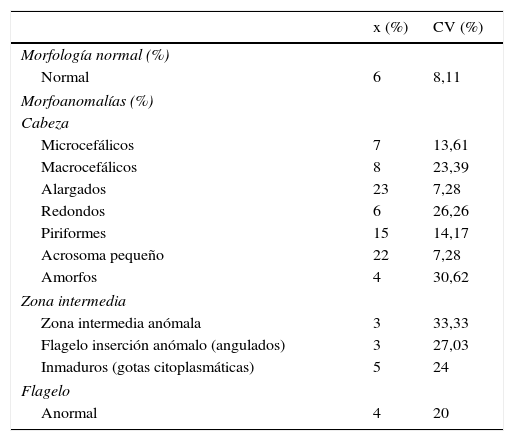
Por último, para analizar el alcance de la fiabilidad de todo el proceso de pretratamiento y tinción, un técnico especializado ha procesado 10 veces una muestra de semen con un 6% de espermatozoides normales. Se han calculado los coeficientes de variación obtenidos y realizados con el sistema automatizado SCA. Los resultados se muestran en la tabla 6. Se observa un coeficiente de variación del porcentaje de formas normales y anormales del 8%. En el apartado de morfoanomalías los coeficientes varían desde el 7% en formas alargadas al 30% en las formas amorfas. Estos resultados nos indican la idoneidad del pretratamiento.
Media (x) y coeficientes de variación intradía (CV) del análisis de la morfología espermática aplicando el pretratamiento y tinción descritos por nuestro grupo, y analizada con el sistema automatizado SCA
| x (%) | CV (%) | ||
|---|---|---|---|
| Morfología normal (%) | |||
| Normal | 6 | 8,11 | |
| Morfoanomalías (%) | |||
| Cabeza | |||
| Microcefálicos | 7 | 13,61 | |
| Macrocefálicos | 8 | 23,39 | |
| Alargados | 23 | 7,28 | |
| Redondos | 6 | 26,26 | |
| Piriformes | 15 | 14,17 | |
| Acrosoma pequeño | 22 | 7,28 | |
| Amorfos | 4 | 30,62 | |
| Zona intermedia | |||
| Zona intermedia anómala | 3 | 33,33 | |
| Flagelo inserción anómalo (angulados) | 3 | 27,03 | |
| Inmaduros (gotas citoplasmáticas) | 5 | 24 | |
| Flagelo | |||
| Anormal | 4 | 20 | |
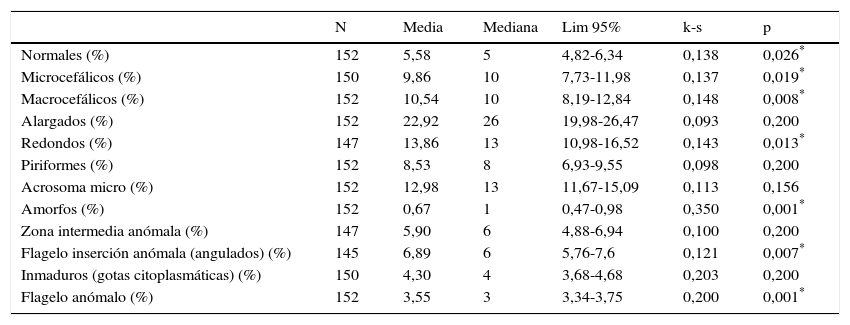
Una vez estandarizada la técnica de pretratamiento, la técnica de tinción y la lectura por el SCA, se han hallado los valores de referencia de la morfología avanzada en una población de 150 pacientes procedentes del servicio de esterilidad que presentaban un seminograma normal. En la tabla 7 se muestran los valores de referencia obtenidos analizando la distribución normal con el test de Kolmogorov-Smirnov. En los parámetros de la morfología que no presentaban una distribución normal se ha utilizado la mediana, en lugar de la media, para hallar el intervalo de referencia del 95% (p<0,05).
Valores de referencia de la morfología espermática obtenidos con el procedimiento estandarizado y analizados con el sistema automático SCA
| N | Media | Mediana | Lim 95% | k-s | p | |
|---|---|---|---|---|---|---|
| Normales (%) | 152 | 5,58 | 5 | 4,82-6,34 | 0,138 | 0,026* |
| Microcefálicos (%) | 150 | 9,86 | 10 | 7,73-11,98 | 0,137 | 0,019* |
| Macrocefálicos (%) | 152 | 10,54 | 10 | 8,19-12,84 | 0,148 | 0,008* |
| Alargados (%) | 152 | 22,92 | 26 | 19,98-26,47 | 0,093 | 0,200 |
| Redondos (%) | 147 | 13,86 | 13 | 10,98-16,52 | 0,143 | 0,013* |
| Piriformes (%) | 152 | 8,53 | 8 | 6,93-9,55 | 0,098 | 0,200 |
| Acrosoma micro (%) | 152 | 12,98 | 13 | 11,67-15,09 | 0,113 | 0,156 |
| Amorfos (%) | 152 | 0,67 | 1 | 0,47-0,98 | 0,350 | 0,001* |
| Zona intermedia anómala (%) | 147 | 5,90 | 6 | 4,88-6,94 | 0,100 | 0,200 |
| Flagelo inserción anómala (angulados) (%) | 145 | 6,89 | 6 | 5,76-7,6 | 0,121 | 0,007* |
| Inmaduros (gotas citoplasmáticas) (%) | 150 | 4,30 | 4 | 3,68-4,68 | 0,203 | 0,200 |
| Flagelo anómalo (%) | 152 | 3,55 | 3 | 3,34-3,75 | 0,200 | 0,001* |
Resultado del test de Kolmogoroz-Smirnov (k-s) y significación estadística.
Como hemos remarcado en el presente trabajo, la automatización para realizar la morfología automatizada tipo ASMA aún no ha conseguido la implantación deseada en nuestros laboratorios, ya que existe una falta de estandarización por parte de las asociaciones científicas. En Francia la implantación de alternativas como el método David20 logra un consenso en ese país. Por otro lado el aumento de la presión asistencial, que ha generado el incremento de las técnicas de reproducción asistida en nuestros hospitales, condiciona al laboratorio de andrología a dar la adecuada respuesta técnica a este desafío. Debido, una vez más, a la falta de consenso de las entidades científicas españolas como SEQC o ASEBIR, en este trabajo se describe una primera aproximación a la estandarización en el parámetro de la morfología espermática avanzada, basándonos en la que se estableció con el método David en Francia.
El primer paso ha sido estudiar diversas metodologías de concentración de las muestras, ya que los sistemas automáticos requieren un número mínimo de elementos celulares para realizar una lectura del frotis con cierta fiabilidad. Se ha establecido que centrifugar la muestra a 300g durante 5min, descartar el sobrenadante y resuspender el sedimento de espermatozoides con 0,2ml del propio plasma seminal del paciente, era el procedimiento que ocasionaba una menor artefactación celular a la vez que permitía la concentración deseada. Este procedimiento se comprueba con un estudio en el que se comparan los resultados de la morfología del semen en fresco y centrifugados de 96 pacientes (tabla 5). Nos indicó que si bien se disminuía el porcentaje de formas normales de 3,57% a 2,64%, esta disminución era clínicamente no significativa, comprobándose, así mismo, que los demás parámetros de la morfología avanzada no se modificaban significativamente (p>0,05).
El siguiente paso ha sido estudiar el proceso de tinción, donde se ha constatado la gran importancia de la osmolaridad de los componentes de la tinción. Se comprobó que el reactivo de fijación hipoosmolar de varios kits comerciales ocasionaba la aparición de formas microcefálicas y macrocefálicas al mezclar estos fijadores con los espermatozoides, proceso descrito por varios autores5–7,11, y comprobado por el análisis en fresco de estos sémenes sin teñir, que originariamente no presentaban estas alteraciones. Tras el estudio de los diferentes kits de tinción del mercado se ha escogido el kit Hemacolor (Merck), método panóptico no específico. Se ha modificado tamponando su reactivo fijador con un 10% de tampón fosfato pH7,2, que aumenta su osmolaridad, y cambiando los tiempos de reacción aconsejados por el fabricante. Seguidamente se han estudiado las posibilidades del SCA. En su vertiente de análisis de la morfología se ha elaborado una plantilla nueva y se han configurado los parámetros propios combinando las prestaciones que nos ofrecía el SCA, y destacando el porcentaje de morfología normal como principal parámetro de la morfología. Además, se ha ideado una morfología avanzada que combina las alteraciones de la cabeza, la zona intermedia y la cola, y todas ellas sumarán separadamente 100% en el mismo informe.
Finalmente, una vez estandarizado el método de pretratamiento, tinción y lectura automatizada en el SCA del semen, se han hallado los coeficientes de variación de todo el proceso. Nos muestran un 8% de coeficiente de variación del porcentaje de formas normales y anormales, y coeficientes de variación superiores en los apartados de la morfología avanzada que van desde el 7% de las formas alargadas hasta el 30% de las formas amorfas. Así se han realizado los valores normales para nuestra tecnología y población (tabla 7).
Concluimos que esta es nuestra primera aproximación a la estandarización de la morfología automatizada. Seguidamente nos disponemos a realizar un nuevo estudio con diversas enfermedades, permitiendo establecer nuevos patrones de estudio morfológico asociados a fisiopatología; además corregir nuestros criterios actuales de estandarización hasta que las entidades científicas establezcan unos criterios unificados en un parámetro tan importante como es la morfología para los estudios de infertilidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.