INTRODUCCIÓN
El cromosoma Y juega un papel fundamental no sólo en la determinación del sexo, sino en el control de la espermatogénesis. Las microdeleciones del cromosoma Y constituyen un importante factor etiológico en el fallo de la espermatogénesis. Varios estudios indican una prevalencia del 5 al 20% en varones con azoospermia u oligozoospermia severa1.
Los genes relacionados con la fertilidad masculina se localizan en el brazo largo del cromosoma Y (Yq 11), en la denominada azoospermic zone factor (AZF). En ésta se delimitan 3 intervalos bien diferenciados: AZFa, AZFb y AZFc, así como una cuarta región denominada AZFd, localizada entre AZFb y AZFc. Cada una de estas zonas presenta diferentes genes candidatos que intervienen en la esterilidad masculina2.
No hay correlación estricta entre la deleción y el fenotipo histológico en la biopsia testicular. Sin embargo, en la mayoría de los estudios se ha observado que la presencia de deleciones AZFa y AZFb proximales se relaciona con graves defectos en la espermatogénesis (síndrome de sólo células de Sertoly), mientras que deleciones de AZFb distal y AZFc tienen diferentes grados de fallo en la espermatogénesis3-5. Ya que en muchos casos las alteraciones en la producción espermática son progresivas, la criopreservación de espermatozoides testiculares es una buena opción para poder utilizar los gametos en varios ciclos de microinyección intracitoplasmática (ICSI [intracytoplasmic sperm injection]).
CASO CLÍNICO
Varón de 42 años, que acude a la consulta de esterilidad de la Clínica Tambre tras 8 años de esterilidad atribuida a una azoospermia no obstructiva. El paciente presentaba un cariotipo 46 XY normal realizado por análisis citogenético convencional. El examen físico general y genital, que valoró especialmente tamaño y morfología testicular, era normal. Asimismo, se encontraron dentro de los límites de la normalidad la FSH, LH, prolactina, testosterona y estradiol. Se realizó estudio de microdeleciones de la región AZF del cromosoma Y en el ADN extraído de linfocitos de sangre periférica, utilizándose la reacción en cadena de la polimerasa (PCR) para amplificar las distintas regiones del cromosoma Y. Los resultados obtenidos demostraron una microdeleción en la región D4S240 del gen AZF.
El estudio de la mujer, de 41 años de edad, reveló ciclos ovulatorios normales, por lo que se efectuó una biopsia de testículo del paciente para la recuperación espermática y criopreservación antes del ciclo de ICSI. La biopsia testicular bilateral se llevó a cabo bajo sedación y según técnica habitual: se abrió la túnica albugínea, se expuso el parénquima testicular y se extrajeron 2 muestras: una para estudio anatomopatológico y otra para recuperación espermática.
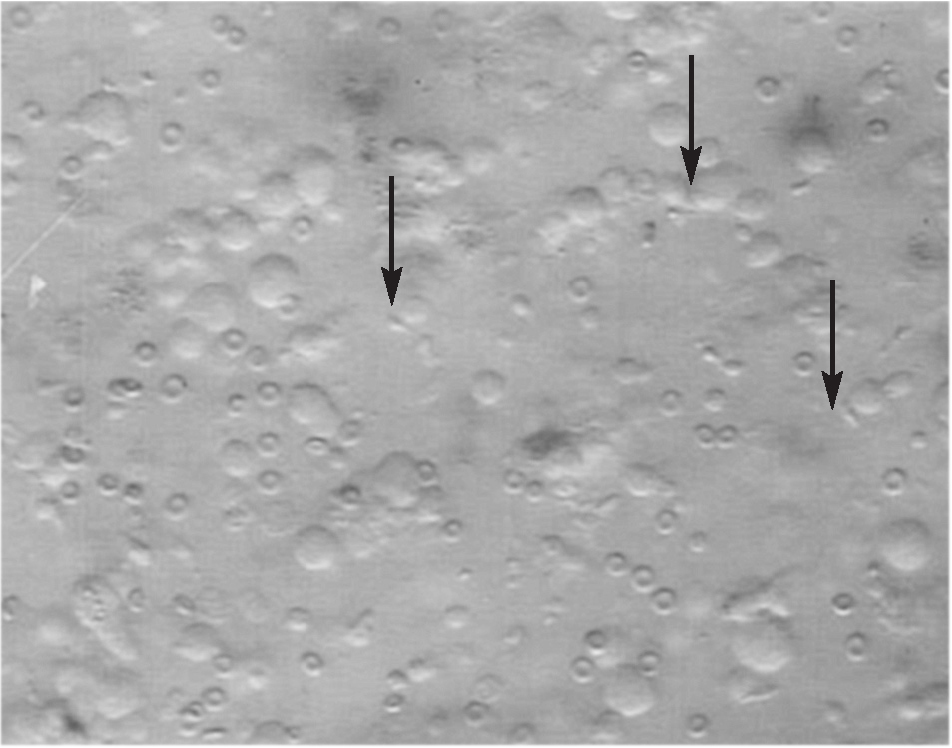
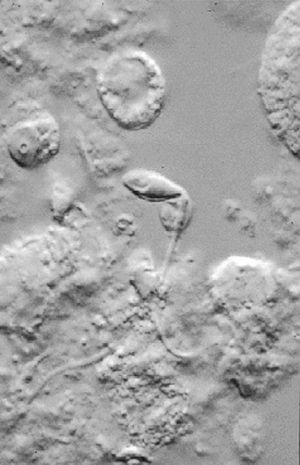
La búsqueda y recuperación espermática se realizó de la siguiente forma6: el tejido testicular obtenido en la biopsia se colocó en placas Petri con medio de cultivo Sperm Prep (Medi-Cult). Allí se dislaceró el tejido utilizando 2 portaobjetos hasta que se consigue romper en lo máximo posible los túbulos y extraer todo el contenido al medio. Una vez completada la dislaceración, se comprobó al microscopio invertido (400X) la presencia de espermatozoides. Después de recorrer más de 50 campos, únicamente se pudo hallar un único espermatozoide inmóvil. El medio de cultivo se transfirió a un tubo Falcon de 15 ml y la muestra se centrifugó durante 5 min a 300 g. Después de la centrifugación, se decantó el sobrenadante y el sedimento se resuspendió en medio IVF (Medi-Cult). Ya que prácticamente no se observaron espermatozoides, únicamente se añadió 0,2 ml de medio de cultivo. Una vez añadido el medio de cultivo se evaluó de nuevo, con 20 ml de la muestra, la presencia de espermatozoides, y se encontró algún espermatozoide aislado cada 10 o 12 campos de 203 (fig. 1). Tras la observación, se dejaron los tubos en el incubador a 37 ºC y una atmósfera del 5% de CO2 durante 1 h, después de lo cual la muestra se congeló con el método de píldoras.
Figura 1. Muestra inicial de biopsia de testículo (2003). Las flechas muestran la presencia de espermatozoides (inicialmente inmóviles).
A continuación se describe el método de congelación7,8:
1. Se diluyen las muestras de semen (una vez centrifugado el material de la biopsia testicular y resuspendido con el medio de cultivo) con el crioprotector (Criosperm) a concentración 1:1.
2. Los tubos con la muestra y el diluyente se introducen en un matraz con agua a temperatura ambiente al nivel del volumen del tubo.
3. Los matraces se mantienen en nevera (4 ºC) durante 45 min.
4. Mientras tanto, se prepara el bloque de nieve carbónica (Air Liquide): en el bloque se practican orificios dejando durante unos segundos por presión, una serie de tornillos clavados en una madera.
5. Transcurridos los 45 min se sacan los tubos de la nevera, y con una pipeta Pasteur se van situando gotas en cada uno de los orificios practicados en la nieve carbónica (cada gota tiene que ser de 10 μl).
6. En 2-3 min las gotas cambiarán de color, y cuando se hayan congelado se pasan a los criotubos, que previamente se habrán mantenido en nitrógeno líquido.
7. Los criotubos se llevan al nitrógeno líquido para su conservación a 196 ºC.
Las muestras obtenidas para estudio histológico se fijaron en Bouin acuoso, tras lo cual se siguió con la técnica hasta obtener cortes de 3 m. Los resultados anatomopatológicos mostraron la presencia de únicamente células de Sertoli en el testículo izquierdo, sin células germinales en todo el material testicular examinado. El estudio histológico en el testículo derecho era compatible con un patrón mixto con sólo células de Sertoli en el 90% de los túbulos.
La pareja realizó 2 ciclos de ICSI con espermatozoides descongelados de la biopsia de testículo. En el primer ciclo, tras inducción de ovulación con gonadotropinas recombinantes (3.100 UI de FSH recombinante) se obtuvieron 4 ovocitos, todos ellos metafase II.
La recuperación de espermatozoides móviles se realizó tras la incubación de los espermatozoides descongelados en microgotas, de la siguiente forma:
Se descongelaron 3 píldoras del total de la muestra, que se centrífugó durante 5 min a 300 g. Después de la centrifugación se decantó el sobrenadante y el sedimento se resuspendió en 0,5 ml de medio IVF.
Tras incubar a 37 ºC durante 1 h, se preparó una placa de ICSI y se colocaron 5 μl de la muestra en microgotas, y se incubó durante 2 h más.
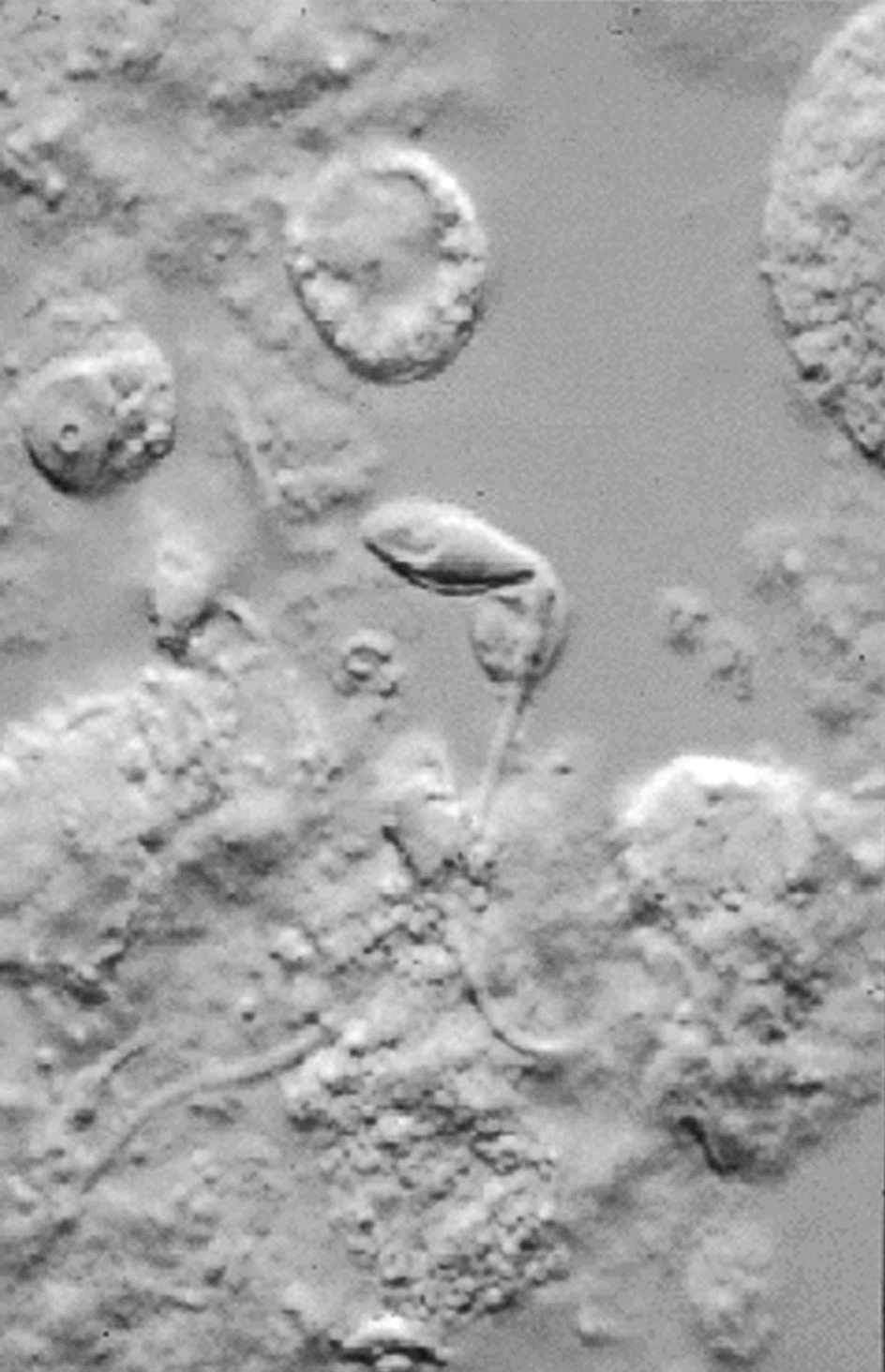
Se realizó la búsqueda de los espermatozoides móviles tras un total de 4 h de incubación (fig. 2).
Figura 2. Muestra de biopsia de testículo tras 4 h de incubación en microgotas (4003).
A las 18 h de la microinyección de los 4 ovocitos se observaron signos de fecundación en 3 ovocitos. A las 24 h se desarrollaron 3 embriones de grado 2, que se transfirieron sin conseguirse gestación.
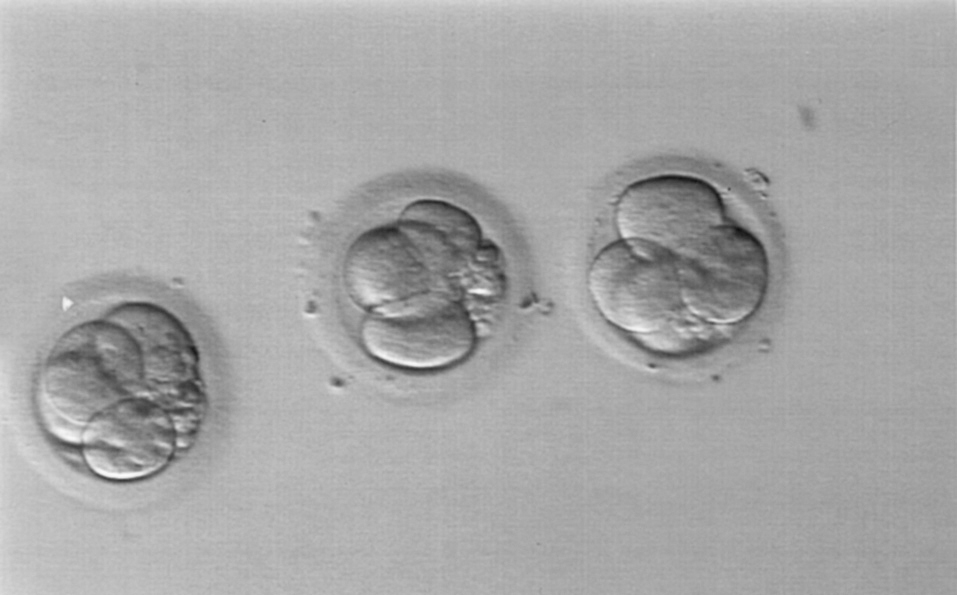
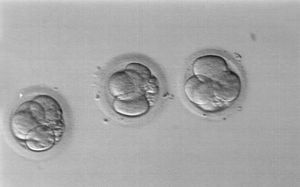
En el segundo ciclo de ICSI, con similares concentraciones de FSH recombinante, se obtuvieron también 4 ovocitos, 3 de ellos metafase II. Se observaron signos de fecundación normal a las 18 h de la microinyección en los 3 y se transfirieron 3 embriones de grados 2 y 3 a las 24 h (fig. 3). Dos semanas después de la transferencia, la concentración sérica de beta-hCG era de 258 UI/l. Cuatro semanas más tarde, se comprobó por ecografía transvaginal, un saco intrauterino único, con latido cardíaco. A las 38 semanas de gestación tuvo lugar por cesárea el nacimiento de una niña sana de 3.500 g.
Figura 3. Embriones transferidos tras la microinyección de ovocitos con espermatozoides de testículo descongelados.
DISCUSIÓN
La deleción completa de la región AZFc del cromosoma Y es responsable del fallo de espermatogénesis en varones infértiles. Aunque esta deleción se ha asociado a distintos fenotipos testiculares que pudieran ser compatibles con el desarrollo de espermatozoides, también se han constatado casos de peor pronóstico, en los que no hay progresión de la espermatogénesis o ésta está disminuida9,10. En este último caso, la criopreservación de espermatozoides testiculares es una herramienta muy valiosa para preservar la fertilidad. Sin embargo, también hay que tener en cuenta la transmisión de un defecto genético a la descendencia11.
La principal contribución de este caso se refiere a que, por primera vez, se ha conseguido una gestación con espermatozoides de un varón con microdeleción de la región AZFc del cromosoma Y con las siguientes características:
El estudio histológico mostró la presencia de espermatogénesis conservada únicamente en el 10% de los túbulos de un solo testículo, como lo indicó el hecho de encontrar muy aislados espermatozoides en el material testicular obtenido en la biopsia.
A pesar de no observar espermatozoides móviles tras la biopsia testicular, con la técnica de congelación en píldoras y posterior cultivo de éstos, se consiguió obtener espermatozoides móviles para poder realizar la microinyección espermática.
La tasa de fecundación, división y calidad embrionaria con estos espermatozoides, pese a los datos publicados en la bibliografía12,13, no fue inferior a la que se presenta normalmente en nuestra casuística.
Previo a la realización del ciclo de ICSI se informó a la pareja, que firmó el correspondiente consentimiento, de los posibles riesgos de transmisión del mismo defecto en caso de nacimiento de un varón. Sin embargo, afortunadamente, la mujer quedó gestante y dio a luz una niña sana.
CONCLUSIÓN
Como sugieren nuestros datos, la utilización de espermatozoides de testículo congelados y descongelados, en varones con microdelecíon de la región AZFc del cromosoma Y, es eficaz y puede solucionar muchos de los problemas inherentes a la utilización de espermatozoides frescos de testículo, incluso consiguiéndose muy pocos e inmóviles. Ya que la criopreservación en píldoras permite la realización de varios ciclos de ICSI, no es necesaria la realización de más biopsias de testículo con cada ciclo de inducción de la ovulación de la mujer, asegurándose la disponibilidad de espermatozoides antes de cada ciclo.
Correspondencia: Dra. R. Núñez Calonge.
Unidad de Reproducción. Clínica Tambre.
Tambre, 8. 28002 Madrid. España.
Correo electrónico: rocio@clinicatambre.com