INTRODUCCIÓN
Se sabe que los laboratorios de reproducción asistida (RA) han experimentado en los últimos años un cambio en su enfoque de lo que es y debe ser el laboratorio y su entorno, asimismo tenemos que autoimponernos un cambio de mentalidad, con esfuerzo y trabajo real de lo que tiene que ser un embriólogo y su función dentro de su ámbito.
Todos coincidimos que tanto el diseño como el funcionamiento del laboratorio deben cambiar. Hace unos años, entendíamos que los laboratorios de RA deberían experimentar unos cambios, ya que se concebían dentro de los laboratorios de análisis generales como un apéndice de éstos, donde se tendía a cubrir todo el campo de la RA en un solo espacio. Para esos cambios, considerábamos que con unas pequeñas modificaciones se podía aumentar su eficacia y mejorar sus resultados que, en definitiva, redundarían en un marcado beneficio para el embriólogo, el laboratorio o el área de RA. Sin embargo, estos "pequeños" laboratorios, ya sea por un reducido volumen de trabajo o por motivos puramente físicos, a menudo se encuentran con el problema de no poder incorporar nuevos equipos para ofrecer mejores resultados, algo sustancial para afrontar el presente y, aún más, el futuro en RA. Por todo ello, y haciendo una revisión del aparataje o del espacio de trabajo, debemos definir los requerimientos que precisa ese laboratorio que queremos. El objetivo del presente artículo es la revisión pormenorizada y la actualización de dichos requerimientos. Para ello tenemos que agrupar el equipamiento o modificación del laboratorio en 5 grupos de cambios y reformas:
1. Incorporación de equipos suplementarios.
2. Control de las condiciones medioambientales.
3. Metodología de trabajo.
4. Medios de cultivo.
5. Certificaciones de calidad.
INCORPORACIÓN DE EQUIPOS SUPLEMENTARIOS
Cámaras de flujo laminar y placas refractarias o calefactores
Muchas veces, los laboratorios de RA trabajan con cámaras de flujo laminar horizontal, que no están termostatizadas, por lo que la temperatura de trabajo es muy inferior a la óptima y esto reduce el porcentaje de fertilización y de división ovocito/embrión. La incorporación de nuevas cámaras de flujo con zonas termostatizadas es una garantía en cuanto a estandarización; pero cuando no se pueden incorporar, por las cuestionas anteriormente citadas, una placa calefactora dentro de dicha cámara es una opción razonable de trabajo.
Filtros
Los compuestos orgánicos volátiles (COV), de los que más adelante se hablará, tienen un efecto negativo en el desarrollo embrionario. Para minimizar su concentración en el aire del laboratorio se pueden utilizar torres CODA (CODA XT tm Mod GXTU-042
Estas torres se pueden encontrar de diferentes tamaños, adecuados al espacio disponible de cada laboratorio. Este tipo de filtros (absolutos y HEPA), pueden incorporarse a las instalaciones de aire acondicionado, proporcionando un aire lo más impoluto posible, asegurándonos que en todo momento trabajamos con "aire limpio".
Para que el aire de las incubadoras tenga la máxima pureza, es posible también la colocación de estos mismos filtros en su interior, así como en las salidas de CO2 de las bombonas a la incubadora.
Incubadoras
Para el buen desarrollo embrionario, es fundamental mantener la temperatura y el CO2 estables en todos los ovocitos y embriones, tanto los que se están manipulando como los que se están incubando.
Para reducir al máximo el número de veces que se abren las incubadoras, se pueden usar estufas de las que ya se dispone para incubar, de mayor tamaño de "working", es decir, donde se colocarán los ovocitos o embriones con los que se está trabajando en el momento (p. ej., los ovocitos que se están denudando, identificando, etc.), y adquirir nuevas incubadoras, mucho más pequeñas y nuevas. Está demostrado que cuanto menos se abre la incubadoraa, mejores resultados se obtienen, ya que sólo se usan para 1 o 2 pacientes máximo. Al usar el "working" se evitará abrir en exceso las estufas manteniendo un ambiente mucho más estable.
CONTROL DE LAS CONDICIONES MEDIOAMBIENTALES
Temperaturas
Evidentemente, las temperaturas tienen una importancia capital en un laboratorio de RA-fecundación in vitro (FIV)1. La manera de tenerla controlada es mediante el uso de termómetros. Pueden incorporarse en el interior de la nevera, a fin de controlar que la temperatura sea la idónea para mantener en perfecto estado los medios de cultivo. Es esencial trabajar a la temperatura deseada, ya que los "displays" no siempre nos miden la temperatura real de la placa. No hay que olvidar que la temperatura de 37 ºC es la que tiene que llegar al óvulo o embrión, con lo cual la temperatura de la placa debe ser superior. Se pueden utilizar pequeños termómetros de superficie (Model 315c-DUAL-Magnet Surface Thermometer-PTC Instruments, Los Angeles, EE.UU.), que se colocan sobre todas las superficies planas y termostatizadas del laboratorio. Todas las temperaturas deben controlarse y registrarse diariamente.
Para comprobar que en el interior de las incubadoras no hay fluctuaciones de temperatura, es conveniente hacer mediciones a intervalos regulares. Esto hace inviable la utilización de termómetros convencionales, ya que cada vez que se abriese la incubadora se modificaría su temperatura. Para evitar este problema, hay sondas que toman automáticamente la temperatura a los intervalos de tiempo deseados.
Con estas mismas sondas se pueden hacer también mediciones de CO2 (In Control 1050, de Labotect). Últimamente, se están incorporando sondas de CO2 y temperatura interna (Data Loger-Haereus) fija dentro de las incubadoras, que vía software se controlan cada 5, 10, 30 min, etc. o la frecuencia que se desee en el ordenador, y vía módems nos transmiten a nuestro ordenador o teléfono móvil si ha habido alguna bajada o subida de algún parámetro.
Cabe destacar, en este apartado, la importancia de colocar un SAI a la entrada de la corriente para asegurarnos una autonomía mínima de 12 h, que es el tiempo máximo que las compañías pueden dejarnos sin suministro. Esto siempre nos genera la duda del tiempo sin control de temperatura que han estado las incubadoras y es una solución muy buena para los cortes de electricidad.
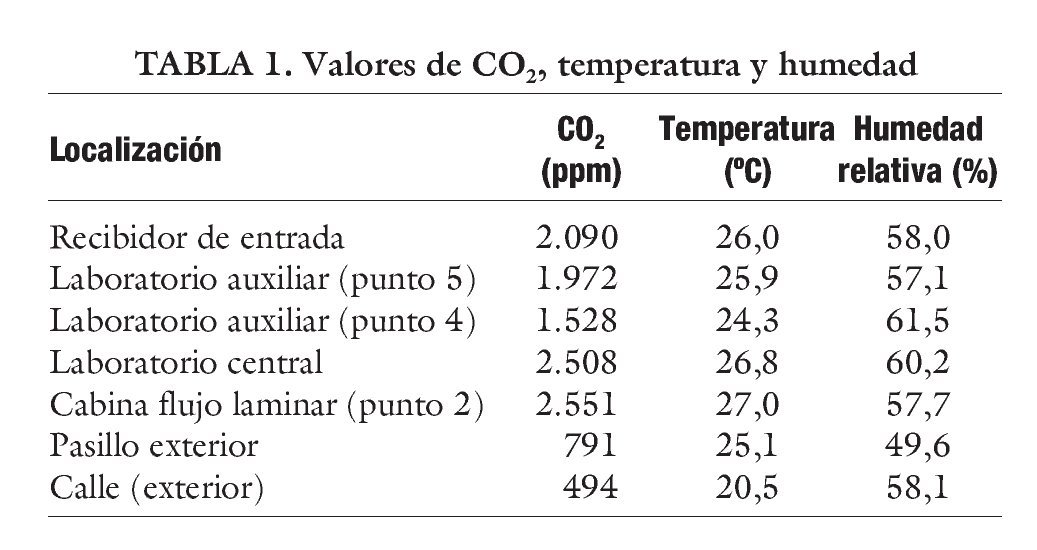
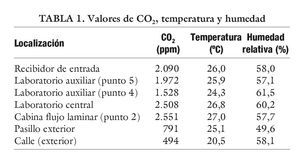
También se puede realizar mediciones ambientales de CO2 con un equipo de lectura directa aq-5001 de Metrosonics con detector de IR, que permite simultáneamente el registro de la temperatura y de la humedad relativa (tabla 1).
Los nuevos laboratorios de RA se diseñan pensando en estos parámetros, con lo cual, además del aire climatizado que regulamos, también lo hacemos con la temperatura y humedad, incorporando sondas de dichos parámetros. Lo ideal es trabajar en rangos de temperatura de 20-24 ºC y entre un 40-50% de humedad relativa.
Compuestos orgánicos volátiles2-4
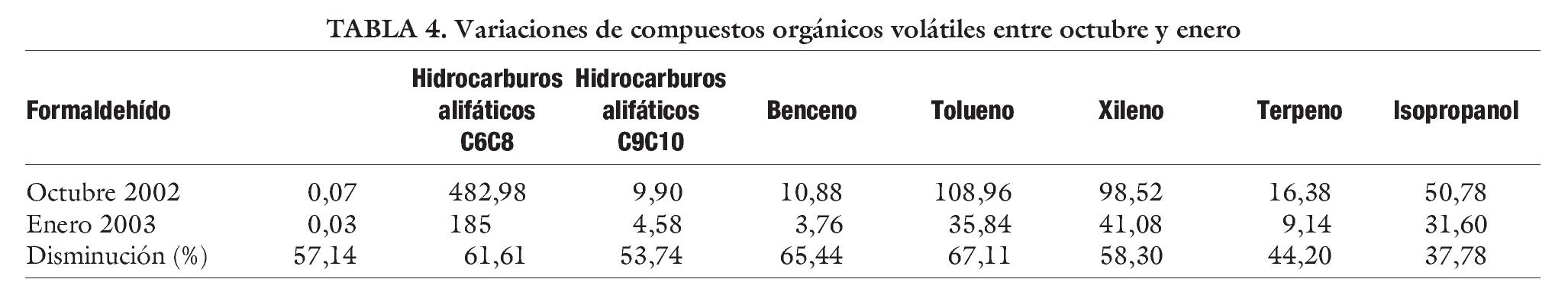
Como ya se ha comentado, valores elevados de COV influyen negativamente en el desarrollo embrionario. Para reducirlos, además de la instalación de las torres CODA, hay que intentar manipular la mínima cantidad de papel cerca de las cabinas de flujo y evitar la utilización de bolígrafos y rotuladores que despidan este tipo de compuestos, o de mecheros Bunsen dentro del área de incubadoras. ¿Cómo saber si estos cambios disminuyen de forma efectiva la concentración de COV? Estas torres demostrarán la eficacia que tienen en estos cambios. Para ello se realizó un estudio que consistía en la determinación de los valores de COV, incluido formaldehído, antes y después de poner en funcionamiento una torre CODA.
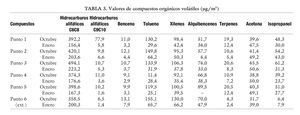
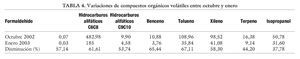
Se tomaron 19 muestras de aire en 7 puntos diferentes, 5 en el interior del laboratorio, 1 en el exterior (aunque dentro del edificio) y 1 de aire exterior. Las muestras tomadas se analizaron por espectrometría UV-VIS las de formaldehído y por cromatografía de gases, siguiendo el método analítico del Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT) MTAS/MA-032/A98, las de COV. Los resultados obtenidos a lo largo del estudio se presentan en las tablas 2, 3 y 4. Cualitativamente, los COV hallados son los correspondientes a un aire no contaminado, identificándose, principalmente, hidrocarburos alifáticos, hidrocarburos aromáticos, terpenos, acetona e isopropanol. Tras la instalación de la torre CODA el estudio reveló una disminución en los COV de entre un 50 y un 60%, lo que confirma la utilidad de este tipo de torres.
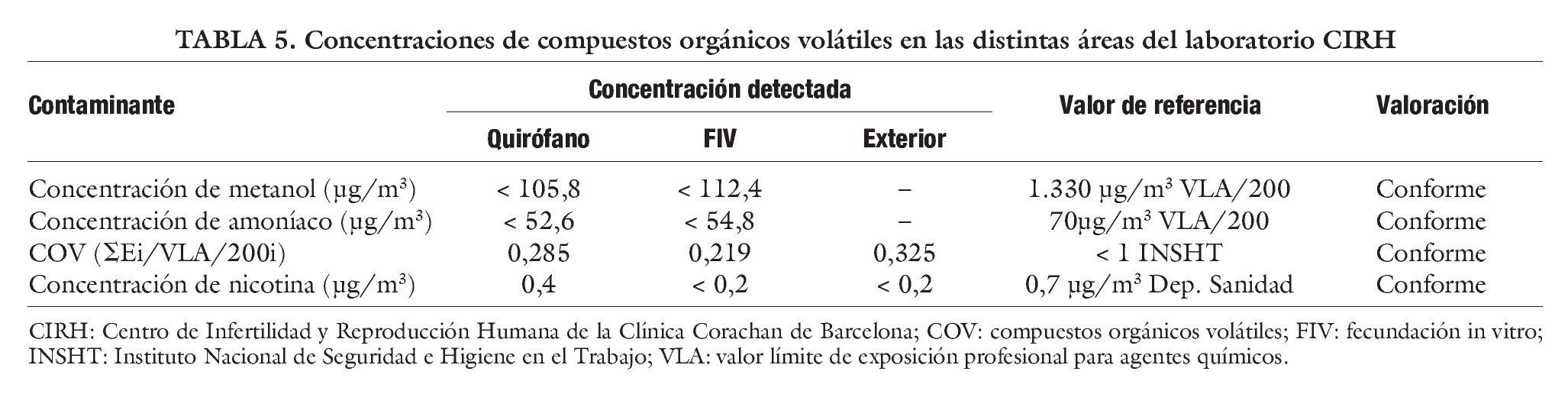
Hoy en día, en nuestro laboratorio se ha incorporado un sistema de aire climatizado con filtros absolutos y HEPA que proporciona aire puro y con presión positiva de 18 pascales las 24 h. Respecto a la calidad ambiental del aire en interiores laborales, cabe destacar que el valor límite de exposición profesional para agentes químicos del INSHT es el aplicable para las estancias donde exclusivamente haya trabajadores de la empresa. Estos valores determinan el máximo de exposición permisible a productos químicos específicos en los lugares de trabajo.
En el caso de centros donde se realicen técnicas de RA, por la tipología del trabajo, la concentración de contaminantes químicos en el ambiente debería ser la mínima posible en todos los casos, ya que no se está valorando la exposición de una persona adulta sino la exposición de un ovocito u embrión. Es por ello, que los muestreos se realizan teniendo en cuenta la casuística del proceso, para dar un mayor rango de seguridad. El umbral está en un 200% menos que el de referencia (tabla 5).
Los COV se captan mediante bombas de absorción MSA según el método NIOSH 2549, durante un tiempo aproximado de 450 min. Una vez que termina el ensayo, los COV adsorbidos son recogidos por desorción térmica y posteriormente analizados mediante cromatografía de gases. Los compuestos que se analizan por este método son: acetona, limoneno, 1,2-diclorobenceno; undecano limoneno; 1,2-diclorobenceno; undecano; 1,3,5-triclorobenceno; 1,2-4 triclorobenceno; naftaleno; nicotina; isopropanos; n-hexano; metil etil cetona; cloroformo; 1,1,1-tricloroetano; benceno; butanol; 1-metoxi2-propanol; tricloroetileno; tolueno; percloroetileno; acetato de n-butilo; etil benceno,m; p-xilenos; estirenos; o-xileno; 2-butoxietanol; alfa-pineno; n-propil benceno; 1,3,5-trimetil benceno; 1,4 diclorobenceno5.
Controles microbiológicos
Se sabe que en el interior de un laboratorio de RA, es necesario tomar ciertas medidas de asepsia, como la utilización de calzado especial o, en su defecto, polainas, además de mascarillas, gorros, uniformes exclusivos del laboratorio, etc. Estas medidas preventivas de higiene deben traducirse en una disminución de la concentración de microorganismos, lo que, a la larga, será un factor más que repercutirá en la mejora de la calidad embrionaria6. Para asegurarnos de que estas medidas son las correctas, se puede realizar un control microbiológico mensual, tanto de superficie como ambiental, a través de laboratorios especializados (tabla 6).
También es muy conveniente llevar a cabo una desinfección del aire acondicionado al menos 2 veces al año, convenientemente en las paradas técnicas. Se tiene que hacer una nebulización de los conductos para eliminar posibles brotes de Legionella. Esto trae aparejado que el laboratorio debe estar en perfectas condiciones de asepsia y que las superficies de trabajo deben de estar en perfecto estado de limpieza. Nosotros obtenemos muy buenos resultados empleando el cloruro de benzalconio al 5%thou o el X7-PF productos que no son embriotóxicos (tabla 7).
Revisiones periódicas
Es más importante de lo que parece. Es imperativo realizar revisiones periódicas, también por empresas especializadas, de todos los aparatos del laboratorio. Como mínimo deben hacerse 2 revisiones anuales de las incubadoras, cámaras de flujo laminar, congelador de embriones, sistema de aire, COV y microscopios.
Iluminación
Al trabajar con ovocitos y/o embriones, la luz puede influir negativamente en su desarrollo. Lo ideal es trabajar con luz tenue. Muchas veces, los laboratorios no están preparados para esta contingencia. Pues bien, usando un regulador de luz se optimiza este problema. Con este pequeño cambio, que no tiene un coste excesivo ni obras mayores, se logra disminuir la luz directa que incide sobre los ovocitos o embriones7.
METODOLOGÍA DE TRABAJO
Hay otros factores que influyen enormemente en el éxito de una FIV. Estos factores están referidos al momento estricto en el que se está manipulando ovocitos o embriones. Hay que minimizar el tiempo que éstos están fuera de la incubadora, cubrir las placas con el máximo volumen posible de aceite mineral cuando se trabaja con microgotas, procesar el semen en una cámara diferente a la de los ovocitos/embriones, seleccionar cuidadosamente los embriones que hay que transferir, si es posible, realizar la transferencia bajo control ecográfico, etc.
Es muy importante la formación continuada de todo el personal de laboratorio, desde técnicos a especialistas. Para ello, hoy en día se implementan las normas ISO, que es una forma muy estricta de optimizar una serie de normas que se deben cumplir por el conjunto del laboratorio para conseguir homogenizar las técnicas8.
En el momento de la identificación de ovocitos es muy importante el medio de cultivo que se usa, así como le celeridad de agruparlos y de incubarlos en una estufa "working" para luego seguir el proceso de FIV-inyección intracitoplasmática de espermatozoides (ICSI)-DGP o el que sea necesario. Aquí es donde una serie de factores entran en juego. La celeridad del embriólogo en la manipulación del gameto; la intensidad de luz que reciben estos líquidos foliculares al identificarlos; la temperatura de trabajo; las pipetas Pasteur que se utilizan para la separación, y la buena elección del medio de cultivo para realizar determinada técnica. Hay que destacar que en este apartado se debe tener muy en cuenta los materiales que e usan. Uno de ellos son los medios de cultivo embriotestados, de los cuales luego se hablará. Pero también son importantes otros materiales, como aceite mineral, reactivos, placas de cultivo que se usan y que serán aireadas previo a su uso, al igual que los tubos de plástico, ya que desprenden olores que se diluyen de un día para el otro. Esto conlleva a que constantemente se estén cambiando los protocolos normalizados de trabajo (PNT) adaptándolos a las nuevas exigencias del laboratorio de RA.
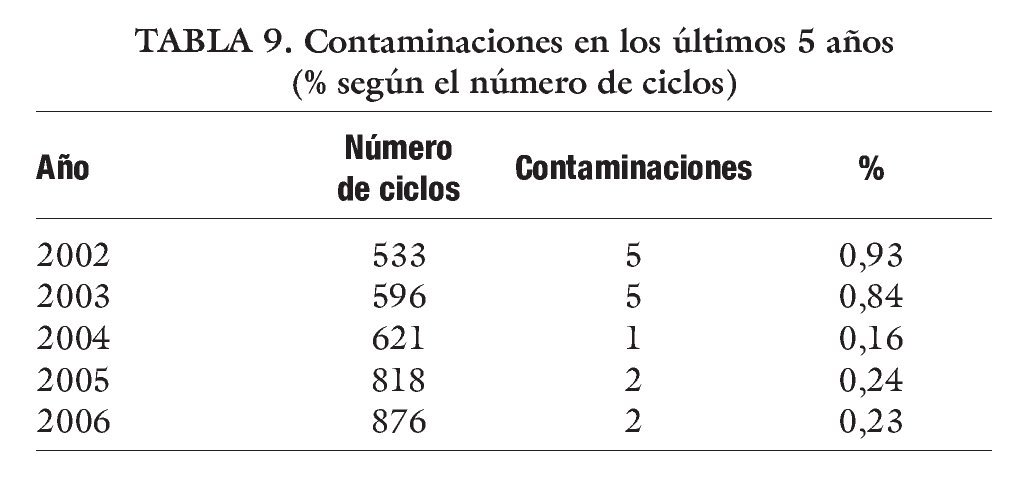
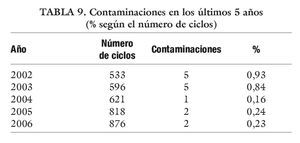
Por último, se hará mención a las posibles contaminaciones dentro del laboratorio, que como ya se ha dicho, con personal bien entrenado, el 100% de esas contaminaciones se producen por el semen que se manipula y no por mala praxis (tablas 8-10).
MEDIOS DE CULTIVO
Desde el nacimiento de la RA, el esfuerzo de todos los laboratorios se ha centrado en la obtención del mejor embrión viable para conseguir el nacimiento de un niño sano. Para alcanzar este objetivo se han ido desarrollando diferentes métodos y sistemas de cultivo que favorezcan el buen desarrollo de los embriones y que permitan una selección más precisa del embrión con la mayor capacidad implantatoria.
A lo largo de la historia los distintos medios de cultivo, su composición y los sistemas para cultivar embriones han ido evolucionando gracias al mayor conocimiento de la fisiología del tracto genital femenino, del embrión y al modelo animal aplicado a los humanos. Nos referiremos al cultivo en el día +2/+3 y cultivo a blastocisto con sus ventajas y desventajas. El objetivo es contrastar el cultivo corto hasta el día 3 frente al largo hasta blastocisto, el cultivo agrupado de embriones en condiciones de baja concentración de oxígeno frente al monocultivo en condiciones atmosféricas. También queremos referirnos a los cultivos secuenciales o con medio único, el uso de suero materno o albúmina pura, los medios comerciales frente a la utilización de medios hechos en el mismo laboratorio y, finalmente, intentaremos mirar hacia el futuro y presentar las posibilidades de nuevos sistemas de cultivo tales como la maduración in vitro de ovocitos.
Cultivo corto frente a largo
A menudo, en el laboratorio nos planteamos qué tipo de cultivo es el más adecuado para nuestros pacientes; un cultivo hasta el día 2 o 3 o bien dejar los embriones hasta el día 5/6 esperando que alguno de ellos alcance el estadio de blastocisto y así poder realizar una mejor selección embrionaria.
En nuestra opinión, el cultivo largo puede ser adecuado para las pacientes que tienen al menos 3 buenos embriones (8 células iguales, ausencia de fragmentación, etc.) en el día 3, ya que así se puede seleccionar el más evolutivo y posiblemente realizar una buena transferencia de embrión único. Por tanto, así se evitarían embarazos múltiples. En cualquier caso, transfiriendo en el día 3 ya se está seleccionando embriones evolutivos y se pueden evaluar suficientes características de éstos, como el patrón pronuclear, el número de células, la fragmentación, la multinucleación, la simetría, etc., que pueden dar pistas bastante claras de qué embrión o embriones transferir9,10.
Evidentemente no aconsejaríamos el cultivo largo de una manera sistemática. En primer lugar, hay que tener en cuenta el hecho del efecto deletéreo del cultivo in vitro en los embriones. Es posible que muchos embriones con capacidad implantatoria no lleguen a blastocisto y, por tanto, no tengan posibilidad de dar lugar a un embarazo manteniéndolos in vitro, cuando sí serían capaces de hacerlo de haber sido transferidos en un estadio más temprano. Se ha demostrado que pacientes que no tienen embriones de 8 células en el día 3 y que se han llevado hasta el día 5, dan un 0% de tasa de embarazo; en contraste, y en estos casos, con la transferencia en el día 3 se da una tasa de embarazo clínico del 33,3%11. In vitro el embrión es más lento que in vivo y algunos de ellos pueden detener su desarrollo.
De hecho, sólo un 41,9% de embriones con 7-9 células en el día 3 dan buenos blastocistos, y este porcentaje es del 13,8 y del 27,5% cuando los embriones tienen menos de 7 células o más de 9, respectivamente. Embriones con más de un 15% de fragmentación únicamente dan un 16,5% de buenos blastocistos y con menos de un 15% de fragmentación dan buenos blastos en un 33,3% de los casos12. Por tanto, se demuestra que problemas en la división embrionaria, que no afectan o afectan poco en un cultivo corto, sí afectan al embrión después de un cultivo largo. Es evidente, pues, que el útero es la mejor incubadora.
También hay estudios que demuestran alteraciones en la metilación del ADN de los embriones cultivados in vitro. Estas alteraciones son más importantes cuanto más tiempo se mantengan los embriones en cultivo13.
Por tanto, transfiriendo en el día 3 hay menos cancelaciones de transferencias y los embriones se cultivan en el lugar más fisiológico posible. Cuando no se obtienen embriones para transferir en el día 5, no se puede asegurar que estos embriones no evolucionen por causas intrínsecas a ellos mismos o por efecto del medio de cultivo.
También hay que remarcar que, aparte de ser un sistema de cultivo más simple y fácil de llevar a cabo en cualquier tipo de laboratorio, cuando se dispone de pocas incubadoras es vital evitar un número excesivo de aperturas para observaciones y cambios de medio, con lo que es mejor adelantar el día de la transferencia. Así, también se minimizan los efectos adversos que los COV y otras sustancias puedan tener en los medios de cultivo y el aceite que los cubre.
Revisando la extensa bibliografía que hay acerca de este tema se encuentran estudios para todos los gustos. Muchos de ellos afirman que se obtienen mejores tasas de embarazo e implantación transfiriendo en el día 5 que en el día 3. Así, Milki et al14 comparan el día 5 frente al día 3 y muestran una tasa de embarazo del 68 frente al 46%, respectivamente, y unas tasas de implantación del 47 frente al 20%, respectivamente, no presentando diferencia significativa en la tasa de embarazo múltiple. Papanicolau et al15 también presentan tasas significativamente mejores cuando transfieren en 5 que en 3. En estos estudios se seleccionan pacientes que al menos tengan 4 embriones de buena calidad. Otros autores presentan estudios con tasas de embarazo similares al transferir en +3 que en +511,16,17. Tampoco encuentran diferencias significativas en cuanto a la tasa de embarazo múltiple. Otros incluso encuentran tasas de embarazo superiores cuando transfieren en el día 3 que en el día 5, siendo estas tasas del 77 y el 52% cuando se tienen en cuenta las tasas acumulativas de ciclos con transferencias en fresco y en congelado18.
Este último trabajo nos lleva a pensar en el tema de la congelación y descongelación de embriones y blastocistos. La técnica de congelación lenta está plenamente implantada en todos los laboratorios, y se obtienen tasas de embarazo muy aceptables cuando se congelan embriones en el día 2 o 3. Esto no es así en todos los laboratorios y es bien sabido por todos cuando congelamos blastocistos. Hay varios grupos que presentan buenas tasas de embarazo con blastocistos descongelados, el problema es que se cancelan muchas transferencias y en muchos casos después de una transferencia en el día 5 no hay embriones sobrantes para transferir en ciclos posteriores.
La vitrificación parece ser el futuro para la congelación de blastocistos, pero esta técnica todavía no está plenamente implantada en todos los laboratorios. Hay diferentes sistemas de vitrificación, diferentes medios y distintos tipos de pajuelas. Cada laboratorio debe buscar el sistema que mejor le funcione y, antes de ofrecer de manera sistemática el cultivo largo, asegurarse de tener un buen programa de congelación para los blastocistos sobrantes. Así, al calcular y comparar las tasas de embarazo entre las transferencias con embriones tempranos o las transferencias de blastocistos, aunque las últimas sean en ocasiones superiores, se debe tener en cuenta la tasa de embarazo acumulada cuando se transfieren embriones tempranos en fresco y en congelado, ya que en la actualidad posiblemente se igualen o incluso sean superiores.
En cuanto a la tasa de implantación, esta sólo es comparable cuando se transfiere el mismo número de embriones, ya que a medida que aumenta el número de embriones que se transfiere, también aumenta la posibilidad de escoger cada vez embriones de peor calidad, asumiendo que el primero que se escoge siempre es el mejor y, por tanto, la tasa de implantación siempre es inferior en el grupo de pacientes que tiene más embriones transferidos. Este factor siempre está presente en este tipo de estudios19.
Teniendo en cuenta todo lo dicho hasta ahora, y también los resultados obtenidos por varios autores18-20, se puede concluir que aunque la transferencia de blastocistos nos ofrece ciertos beneficios, no presenta un gran aumento en la tasa de embarazo evolutivo respecto a la transferencia de embriones tempranos, sobre todo si se tiene en cuenta que hay la posibilidad significativa de tener que cancelar la transferencia y la baja probabilidad de crioconservación.
Cultivos secuenciales frente a únicos
Actualmente hay muchas casas comerciales que ofrecen diferentes medios de cultivo. Básicamente las 2 tendencias que se pueden encontrar son los medios que tratan de imitar a la naturaleza proporcionando al embrión los nutrientes necesarios en cada etapa de su desarrollo y los que permiten dar al embrión lo que necesita en cada momento, y son el resultado de la estimación concentración-respuesta, hasta encontrar una respuesta óptima. Los primeros, que se basan en la concentración de una sustancia según su presencia en el ambiente natural del embrión, son los medios secuenciales y son 2 medios diferentes: uno hasta el día 3 y otro desde el día 3 hasta el 5 o 6. Los segundos son los medios únicos, que como su nombre indica es un único medio desde el día 1 hasta el día 5 o 6.
Los medios secuenciales se diseñaron para permitir el cultivo largo hasta el día 5, con garantías de obtener un buen número de blastos viables. La idea es sustituir los cocultivos por un sistema más simple y al alcance de todos los laboratorios, pero sin comprometer los enormes beneficios que proporcionaban los cocultivos. Los cultivos secuenciales aportan nutrientes, vitaminas, oligoelementos y permiten estandarizar la técnica.
A lo largo de su desarrollo in vivo el embrión pasa por distintas etapas y sus necesidades metabólicas van variando. Durante estas etapas el embrión va recorriendo distintas partes del tracto reproductor femenino. Así, estudiando la composición de los fluidos del oviducto y del útero humano se desarrollaron los medios secuenciales21,22. Durante y después de la fecundación, los líquidos que envuelven al ovocito y al embrión son ricos en piruvato y lactato, pero no en glucosa. En estas primeras etapas de desarrollo el embrión consume piruvato y lactato. Después de la activación del genoma embrionario (8 cél-compac) el embrión necesita como fuente de energía principal la glucosa, que justo en este momento entra en el útero materno. Así la concentración de glucosa en los medios para embriones tempranos es baja, y la de lactato y piruvato es alta. Los medios para las etapas más tardías son ricos en glucosa, también contienen piruvato y son pobres en lactato.
Gardner et al21 han sido los autores que más han estudiado las necesidades nutricionales de los embriones y las distintas composiciones de los fluidos del tracto genital femenino por donde tiene su recorrido el embrión. Así los medios secuenciales son básicamente 2 medios distintos, donde el primero se utiliza desde la fecundación hasta el día 3 y que contiene bajas concentraciones de glucosa, aminoácidos no esenciales y EDTA que favorece la proliferación celular. Y un segundo medio que aumenta la concentración de glucosa y disminuye la de lactacto, manteniéndose más o menos constante la de piruvato, con aminoácidos esenciales y no esenciales. Este segundo medio no contiene EDTA, ya que parece inhibir la formación y diferenciación de blastocistos. De esta manera se pretende potenciar el desarrollo hasta blastocisto.
La extensa bibliografía que hay acerca de los cultivos hasta blastocisto se refiere, en su mayor parte, a la utilización de medios secuenciales. Al desarrollo de estos medios se debe el poder mantener nuestros embriones en cultivo hasta el día 5 o 6, y así obtener un buen porcentaje de blastocistos.
Recientemente se han presentado unos resultados que comparan las tasas de formación de embriones y blastos con la serie G3 de Vitrolife y la serie G5. Con la primera se obtiene una tasa de embriones con 8 células del 37,8% y con la segunda del 43,2% (p < 0,05). Con la serie 3 se alcanzaban unas tasas de formación de blastos del 37,2%, y con la nueva serie 5 del 40%. Aquí no se obtiene diferencia significativa por el bajo número de casos estudiados. Este tipo de medios está en un constante avance y desarrollo23.
De todas formas, hay que decir que hay varios estudios donde se muestra que con medios únicos también se pueden obtener buenas tasas de blastocistos, implantación y embarazo, comparables a las obtenidas con el uso de medios secuenciales24. Sepúlveda et al25 no encuentran diferencias significativas cuando comparan Global, de Life Global, con medios secuenciales de Irvine. Estos autores refieren tasas de embriones en 8 células en el día 3 de un 37,9% y un porcentaje de formación de blastos en el día 5 del 42,7%.
Por tanto, está claro que los 2 tipos de medios son eficaces para cultivar nuestros embriones in vitro y cada laboratorio debe elegir los medios que le proporcionen las mejores tasas de desarrollo, mejor morfología embrionaria y mayor tasa de embarazo evolutivo.
Medios comerciales frente a propios
Siguiendo un poco con el tema anterior, también podemos plantearnos si se debe comprar medios de cultivo comerciales o bien prepararlos en nuestro propio centro. Es posible que si los hacemos nosotros, tengamos una seguridad del grado de frescura de estos medios, pero todo el proceso de elaboración requiere disponer de una infraestructura y un personal que no es posible en todos los laboratorios de RA. Hay que valorar si merece la pena todo el esfuerzo en tiempo y personal con los beneficios que puede aportar la fabricación casera de medios, respecto a la facilidad, comodidad y seguridad de los medios comerciales.
Los diferentes fabricantes de medios de cultivo, consideran que es esencial proporcionar un producto de alta calidad para asegurar unos resultados óptimos. La gran competencia entre ellos asegura esta alta calidad para los consumidores. Muchos de estos fabricantes están acreditados con certificados de calidad en el proceso de fabricación, manufactura y testado final de sus productos, así como en los materiales utilizados y el empaquetado del producto acabado. Medicult y Vitrolife poseen los Certificados ISO 9001:2000 e ISO 13485:2003. Además todos los procesos cumplen los principios del GMP (good manufacturing practice) y la fabricación se realiza en "clean rooms". Las materias primas que se utilizan en la fabricación de los medios se testan antes de su utilización y las fuentes de proteínas tienen el grado de calidad requerido para la industria farmacéutica. Todos los productos se sirven con su correspondiente certificado de análisis.
El producto, una vez completado y finalizado, se somete a un estricto control de calidad, y se realizan las siguientes pruebas: pH, osmolaridad, MEA (mouse embryo assay), hybritest, test de endotoxinas LAL, test de esterilidad (todos los productos están esterilizados por filtración), test de supervivencia espermática, test de inmovilización espermática, etc.
Además de toda la seguridad y comodidad que proporcionan los medios de cultivo comerciales, actualmente se fabrican bajo pedido, de tal forma que se garantiza la frescura de los medios, y las reservas de las fábricas son muy bajas y se renuevan constantemente.
En cuanto a los resultados, calidad embrionaria y tasas de gestación se refiere, son totalmente comparables a la utilización con medios caseros.
Futuro
Decir como será la RA en el futuro, desde el punto de vista del laboratorio, no es fácil. Los avances en este campo son relativamente lentos. Posiblemente, el futuro esté en la aplicación de una manera más sistemática del diagnóstico genético preimplantacional, apoyando el cultivo de los embriones, con medios realmente eficaces, capaces de suministrar todo lo que en verdad necesita el embrión y sin aportar sustancias nocivas para ellos. La vitrificación se consolidará como la técnica de congelación más rápida y eficaz, cuando esté a punto el sistema que garantice una muy buena supervivencia de los embriones y una buena tasa de implantación y embarazo, teniendo a los embriones protegidos frente a las posibles contaminaciones del nitrógeno líquido.
En cuanto al futuro de los sistemas de cultivo embrionario no queremos terminar sin hacer mención de la maduración in vitro de ovocitos. Esta técnica permite madurar ovocitos inmaduros en el laboratorio de manera relativamente sencilla. Aproximadamente un 50% de los ovocitos recuperados maduran in vitro. La tasa de embarazo se sitúa entre un 20 y un 30%. Las ventajas de esta técnica están en que no hay estimulación ovárica, no hay riesgo de hiperestimulación, la monitorización es más sencilla y el coste es más bajo que el de la FIV convencional. Se aplica principalmente en casos de ovarios poliquísticos y cuando hay antecedentes previos de síndrome de hiperestimulación ovárica. También puede ser una alternativa para las mujeres que no quieren someterse a una estimulación ovárica. Las desventajas son que las tasas de implantación y embarazo son menores y en cambio las de aborto son mayores. Además se obtiene un menor número de embriones para congelar. En el tema de la maduración in vitro de ovocitos todavía hay un camino por recorrer, que permita obtener en el laboratorio mayor número de ovocitos maduros y, por tanto, un mayor número de embriones viables.
CERTIFICACIONES DE CALIDAD
No quisiéramos dejar de lado uno de los principales cambios en la estructura de los laboratorios, como son las diferentes certificaciones de calidad. Éstas se basan en parámetros de exigencias dentro del propio ámbito de trabajo, que se tienen que protocolizar y traducir en hábitos de procedimientos, que de no cumplirse hace que muchos laboratorios de RA no se acrediten por falta de estas certificaciones.
Los cambios empiezan por protocolizar el trabajo diario de técnicos, biólogos, etc.; proponiendo unos PNT que a continuación se describen y que, insistimos, afectan a todos los estamentos dentro del laboratorio de RA.
- Pacientes.
- Preparaciones de muestras.
- Pedidos de material fungible.
- Ordenación de almacén.
- Certificaciones de calidad de medios de cultivos embriotestados.
- Mantenimiento de aparatos.
- Controles de calidad de aire ambiental (COV).
- Controles microbiológicos.
- Informes al paciente y a los estamentos públicos (si existieran).
- Formatos de recogida de datos.
- Indicadores de funcionamiento del laboratorio.
- Indicadores de funcionamiento de los programas de FIV-ICSI.
- Monitorización diaria de temperatura, CO2, humedad, medios de cultivo, etc.
- Seguimiento detallado de la evolución de cada proceso llevado a cabo en un ciclo correspondiente.
Como se puede apreciar, todas estas variables llevan a la concesión de las certificaciones de calidad que cada vez son más imprescindibles para el buen desarrollo de los laboratorios de RA.
CONCLUSIONES
Después de todo lo desarrollado y argumentado en el presente trabajo acerca de los nuevos laboratorios de RA, su adaptación y cambio imprescindibles, proponemos, a modo de conclusiones, el siguiente esquema de controles de calidad que podemos y debemos tener en nuestros laboratorios.
A. Instalaciones de laboratorio.
- Diseño de las áreas de trabajo: laboratorio de FIV, andrología, congelación de embriones.
- Ventilación: torres CODA, aire climatizado con filtros absolutos y HEPA.
- Materiales: paredes lavables, suelo de linoleo y alfombras bacteriológicas a la entrada y salida de cada área de trabajo.
- Limpieza: usar medios no embriotóxicos (X7-PF, cloruro de benzalconio al 5%thou, fertisafe).
B. Equipos.
- Control de temperatura de laboratorio.
- Cabinas de flujo laminar termostatizadas (K-systems).
- Incubadoras pequeñas de CO2.
- Microscopios invertidos con platinas termostatizados.
- Congeladores de embriones con programas predeterminados.
- Tanques criogénicos, centrífugas, etc., con mantenimiento periódico.
C. Reactivos y materiales.
- Tubos y placas de cultivo: aireación previa.
- Aceite mineral y medios de cultivo y catéteres de transferencia: embriotestados.
- Enzimas para decumulación de ovocitos.
- Procesamiento estandarizado de preparación de semen.
- Pipetas estándares calibradas.
D. Protocolos de laboratorio.
- Protocolos estandarizados del laboratorio.
- Formatos de recogidas de datos.
- Monitorización diaria de: a) temperatura y grado de humedad; b) pCO2, temperatura y humedad de incubadoras; c) placas calefactadas (microscopios, cámaras de flujo laminar); d) si es posible medición diaria de COV y partículas de aire del laboratorio, y e) control microbiológico de zonas de trabajo.
E. Indicadores de funcionamiento del laboratorio de FIV.
- Grado de madurez ovocitaria.
- Tasa de fertilidad de FIV.
- Tasa de fertilidad de ICSI.
- Tasa de fallos de fecundación.
- Tasas de embriones pronucleares.
- Tasas de división el día 2 o 3.
- Calidad embrionaria por incubadora.
- Tasas de blastocistos obtenidos.
- Tasas de supervivencia y embarazos de TEC.
- Tasas de fecundación por biólogo.
- Tasas de embarazos por edades, técnicas, patologías, etc.
- Tasas de implantación.
Correspondencia:
Dr. A. Brassesco.
Centro de Infertilidad y Reproducción Humana (CIRH).
Plaza Eguilaz, 14, bajo. 08017 Barcelona. España.
Correo electrónico: Arturo Brassesco-cirh@cirh.es