INTRODUCCIÓN
Las caveolinas son dominios especializados de la membrana plasmática que participan en el secuestro de una amplia variedad de moléculas de lípidos y proteínas. Se ha indicado que las caveolas tienen un papel pivotal (en 2 fases) en una diversidad de procesos bioquímicos: metabolismo de lípidos, regulación del crecimiento, transducción de señales y apoptosis.
Las caveolinas interactúan y regulan los heterodímeros de la proteína G. Normalmente hay 3 miembros de la familia multigénica de la caveolina que codifican una proteína integral de membrana y que comprenden el principal componente estructural de la membrana caveolar in vivo. Los dominios de la caveolina actúan como inhibidores de las proteínas cinasas por unión a las secuencias de apareamiento aromáticas1.
Los genes de las caveolinas 1 (cav-1) se localizan en las cercanías de la región genómica del locus D7S522, que frecuentemente se elimina en una variedad de cánceres humanos (mama, colon, ovario, cabeza y cuello). La inactivación del gen de la cav-1 afecta la capacidad de responder a la presencia de los estrógenos2.
Se demostraron concentraciones altas del ácido ribonucleico mensajero, que codifica este tipo de proteína, mediante hidridización in situ, durante el desarrollo del ovario, comparado con valores moderados a bajos en el desarrollo del testículo3.
La espermatogénesis es una forma única de diferenciación celular que se regula por factores genéticos y epigenéticos. En estudios recientes se ha mostrado que algunos factores epigenéticos se expresan exclusivamente durante la espermatogénesis.
A pesar de los grandes avances en el tratamiento de la infertilidad grave de factor masculino, una cantidad importante de pacientes no pueden ser tratados efectivamente de su diagnóstico de detención de la espermatogénesis y taponamiento tubular de grado variable. Actualmente, el tratamiento de pacientes con estos diagnósticos es extremadamente incierto y limitado4.
Por lo tanto, es importante estudiar y analizar la regulación de la espermatogénesis y la fisiopatología de las fallas testiculares que se manifiestan a través de una azoospermia, que eventualmente podrían estar relacionadas con la regulación de los fenómenos de membrana asociados a la expresión de las caveolinas.
Finalmente, y dada la importancia de las caveolinas en diversos procesos celulares, se propone estudiar y analizar la presencia y la distribución de la cav-1 en el testículo de ratón adulto CF1 (modelo animal) y su relación con los estadios del ciclo de la espermatogénesis, según los tipos celulares asociados en cada túbulo.
MATERIAL Y MÉTODO
Material biológico
Los testículos se obtuvieron de ratones CF1, machos, de 2,5-3 meses de edad (n = 10) mantenidos en bioterio. Los testículos se fijaron inmediatamente en formol tamponado (pH 7,2) durante 48 h. A la primera hora de fijación, se procedió a realizar un corte en los polos del órgano para facilitar la penetración del fijador. Posteriormente, se procedió según las técnicas histológicas habituales con impregnación en parafina (punto de fusión entre 56 y 58 ºC) y la obtención de secciones de 5 μm de espesor. Las secciones se montaron en portaobjetos silanizados y se procesaron para tinciones de H&E e inmunohistoquímica específica (anticuerpos anticaveolinas ab54421, ABCAM). La eutanasia de los animales se realizó siguiendo los protocolos internacionalmente aceptados y adoptados por la Facultad de Medicina de la Universidad de Chile.
Método de inmunohistoquímica
Las secciones de tejido para el desarrollo de la inmunohistoquímica fueron previamente tratados para mejorar la exposición de antígenos, según las recomendaciones del proveedor de los anticuerpos primarios anticaveolina-1 (ab54421, ABCAM Co.)
Recuperación de antígeno
Para romper los puentes metilénicos en las proteínas y el enmascaramiento de los sitios antigénicos, los tejidos se trataron en tampón citrato durante 30 min, mediados por calor en vaporera (Vector Inc.). El revelado se desarrolló con la tinción inmunohistoquímica ABC y el cromógeno de detección de diaminobencidina (DAB) (Vector Inc.).
Las preparaciones obtenidas (n = 10 × 10) se observaron al microscopio óptico (Nikon) con objetivo de ×40 y ocular de ×10 (aumento total de ×400). Con cámara digital (Coolpix 450) incorporada al microscopio, se capturaron imágenes de túbulos de corte transversal a los cuales se identificó el estadio del ciclo de la espermatogénesis de acuerdo a la clasificación de Russell et al5. Se analizaron las muestras y se identificaron las células positivas para inmunohistoquímica contra la proteína cav-1 en los distintos estadios de la espermatogénesis del ratón (coloración marrón).
RESULTADOS
La identificación de la presencia de cav-1 en la espermatogénesis del ratón adulto a través de inmunohistoquímica y revelada con DAB resultó ser fuertemente positiva en espermatocitos I y espermatocitos II.
La celularidad con reacción positiva a la presencia de cav-1 es diferente según el estadio del ciclo de la espermatogénesis (estadios del I al XII, específicos del ratón).
En las placas analizadas no se encontraron túbulos con celularidad propia del estadio I, ni del estadio X.
La identificación de la presencia de cav-1 en la espermatogénesis del ratón adulto a través de inmunohistoquímica y revelada con DAB resultó ser expresada fuertemente en espermatocitos I y espermatocitos II en la histodiferenciación hacia espermátida redonda.
La celularidad con reacción positiva a la presencia de cav-1 es diferente según el estadio del ciclo de la espermatogénesis (estadios del I al XII, específicos del ratón).
Estadio I
Este estadio se caracteriza por presentar espermatogonias del tipo A solamente, espermatocitos en profase I (paquiteno), espermátidas 1 y 13 (redondas y alongadas, respectivamente), que es el primer estadio de la espermatogénesis. En las secciones analizadas no se encontraron túbulos en este estadio.
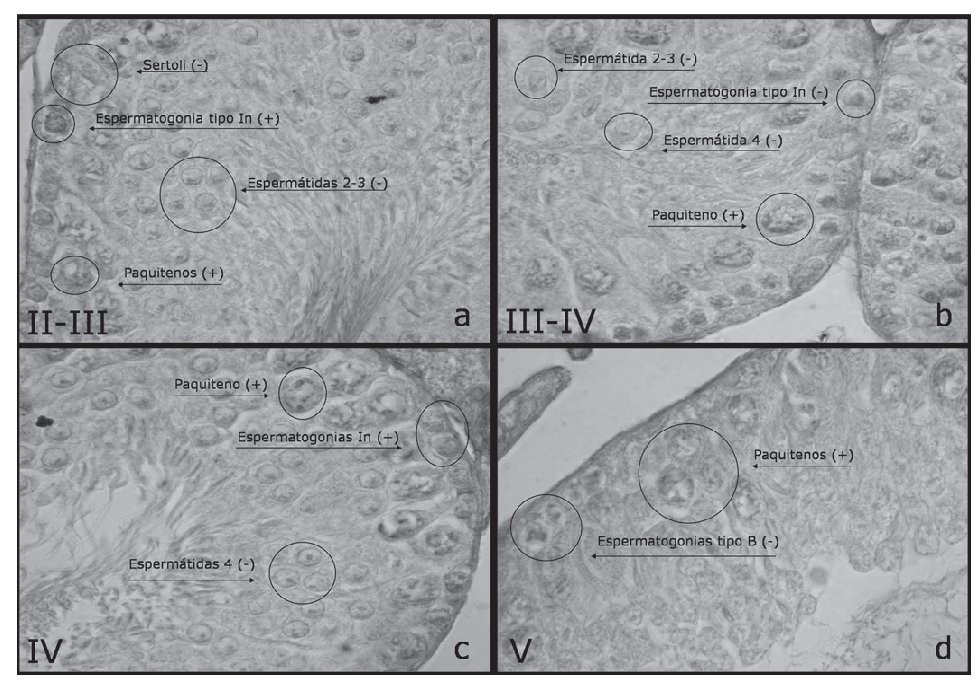
Estadios II-III (figs. 1a y 1b)
Figura 1. Secciones transversales de túbulos seminíferos con la reacción de inmunohistoquímica específica para cav-1 (DAB). Las flechas indican células del epitelio seminífero y células de Sertoli. Se indican los estadios del II al V del ciclo de la espermatogénesis (× 1.000). In: intermedio.
Estos estadios se caracterizan por presentar espermatogonias tipo A y tipo intermedio (In), espermatocitos en paquiteno temprano, espermátidas 2-3 y 14 (redondas y elongadas, respectivamente). De estos tipos celulares de la espermatogénesis y en estos estadios específicos se observaron las espermatogonias tipo In con reacción positiva a inmunohistoquímica de cav-1 y los paquitenos tempranos con una reacción levemente positiva. Las espermátidas redondas de la línea germinal y las células de Sertoli de las células somáticas fueron negativas a cav-1.
Estadios IV (fig. 1c)
Estos estadios se caracterizan por presentar espermatogonias tipo A y tipo In, espermatocitos en paquiteno temprano, espermátidas 4 y 15 (redondas y elongadas, respectivamente). De estos tipos celulares de la espermatogénesis y en estos estadios específicos, se observaron las espermatogonias tipo In con reacción positiva a inmunohistoquímica de cav-1, y los paquitenos tempranos con una reacción levemente positiva. Las espermátidas de la línea germinal resultaron negativas a cav-1.
Estadios V (fig. 1d)
Estos estadios se caracterizan por presentar espermatogonias tipos A y B, espermatocitos en paquiteno intermedio, espermátidas 5 y 15 (redondas y elongadas, respectivamente). De estos tipos celulares de la espermatogénesis y en esto estadio específico se observaron sólo espermatocitos en paquiteno con reacción positiva a inmunohistoquímica de cav-1. Las espermatogonias tipo B aparecieron negativas a cav-1.
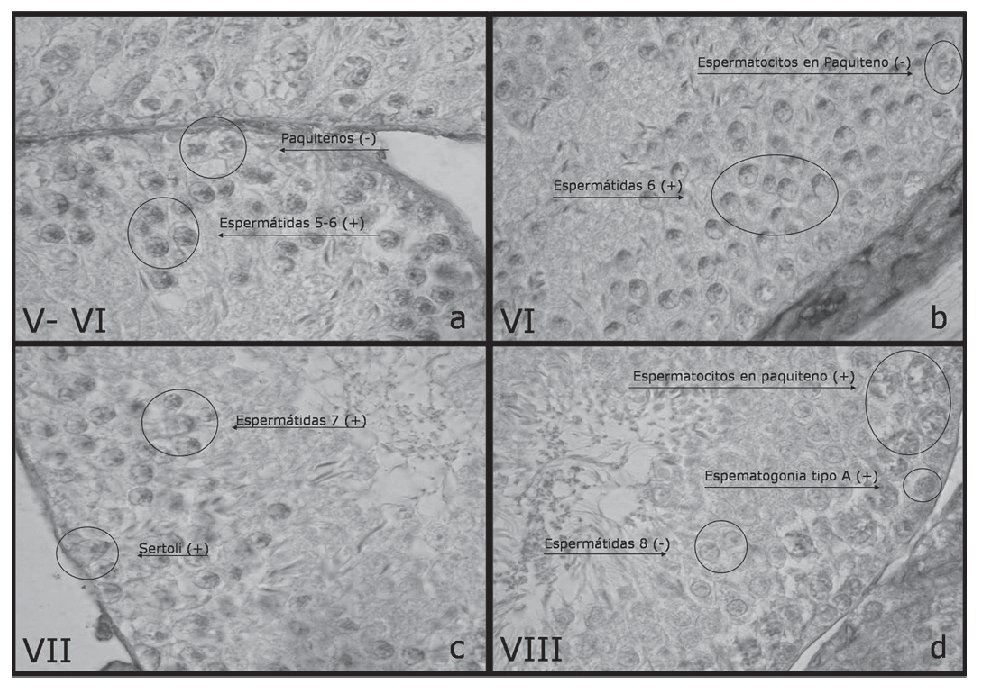
Estadios V-VI (figs. 2a y 2b)
Figura 2. Observación de secciones transversales de túbulos semi-níferos con la reacción de inmunohistoquímica específica para cav-1 (DAB). Las flechas indican células de Sertoli y de la espermatogénesis. Se indican los estadios del V al VIII del ciclo de la espermatogénesis (×1.000).
Estos estadios se caracterizan por presentar espermatogonias tipo A y tipo B, espermatocitos en paquiteno intermedio, espermátidas 5-6 y 15 (redondas y elongadas, respectivamente). De estos tipos celulares de la espermatogénesis y en estos estadios específicos se observaron sólo las espermátidas redondas con reacción positiva a inmunohistoquímica de cav-1. Las células somáticas de Sertoli fueron negativas a cav-1.
Estadios VII (fig. 2c)
Este estadio se caracteriza por presentar espermatogonias solamente del tipo A, espermatocitos en profase I (preleptotenos y paquiteno), espermátidas 7 y 16, (redondas y elongadas, respectivamente), y es un estadio previo a la espermiación. De estos tipos celulares de la espermatogénesis y en este estadio específico se observaron sólo las espermátidas redondas con reacción positiva intensa a inmunohistoquímica de cav-1. Se destaca que las células de Sertoli fueron positivas a cav-1.
Estadios VIII (fig. 2d)
Este estadio se caracteriza por presentar espermatogonias solamente del tipo A, espermatocitos en profase I (preleptotenos y paquitenos), espermátidas 8 y 16 (redondas y elongadas, respectivamente) y es el estadio en que debe ocurrir la espermiación. De estos tipos celulares de la espermatogénesis y en este estadio específico, se observaron sólo algunas y escasas espermatogonias tipo A y la mayoría de las espermatocitos en profase I (preleptoteno y paquiteno) con reacción positiva intensa a inmunohistoquímica de cav-1, mientras que las espermátidas redondas esta vez son negativas. Las células de Sertoli se mostraron negativas a cav-1.
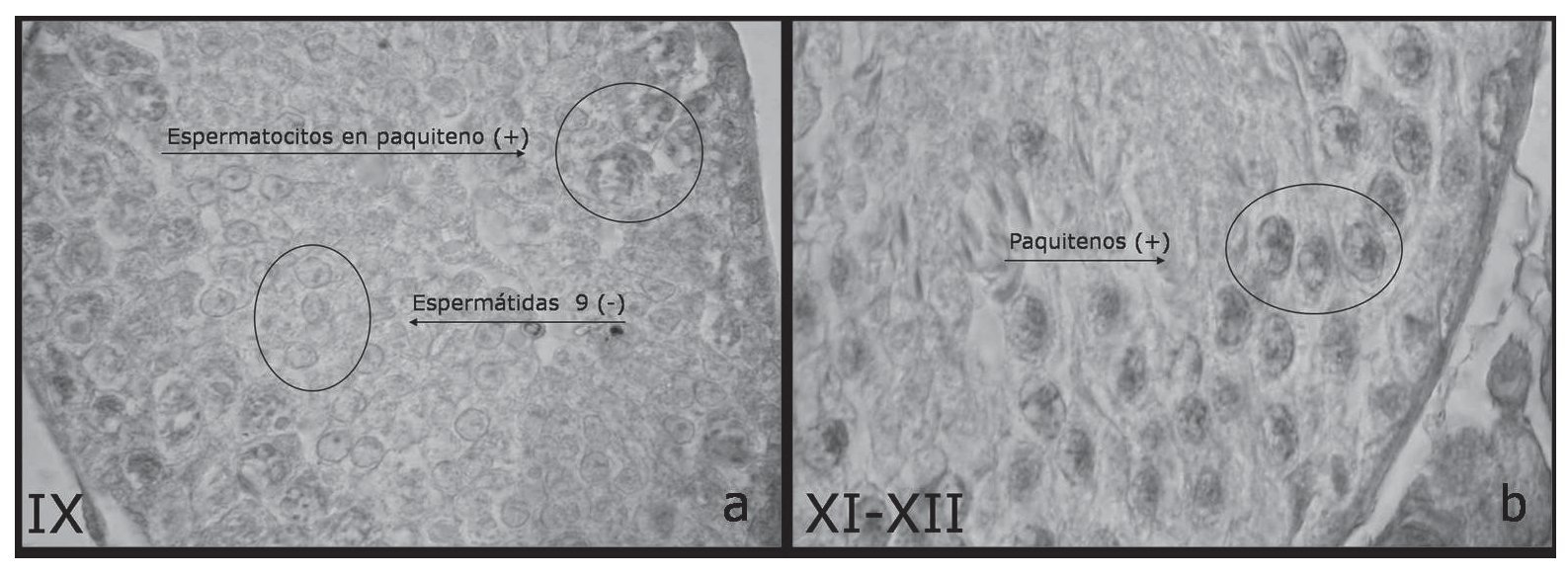
Estadios IX (fig. 3a)
Figura 3. Muestra secciones transversales de túbulos seminíferos con la reacción de inmunohistoquímica específica para cav-1 (DAB). Las flechas indican células de la espermatogénesis. Se indican los estadios del IX al XII del ciclo de la espermatogénesis (×1.000).
Este estadio se caracteriza por presentar espermatogonias solamente del tipo A, espermatocitos en pro-fase I (leptotenos y paquitenos), y espermátidas 9 (elongadas). Es el estadio inmediato después de haber ocurrido la espermiación, por lo que no se observan cabezas de espermatozoides. De estos tipos celulares de la espermatogénesis y en este estadio específico se observó la mayoría de los espermatocitos en profase I (preleptotenos y paquiteno) con reacción positiva a inmunohistoquímica de cav-1, mientras que las espermátidas redondas resultaron abundantes y negativas.
Estadios X
Este estadio se caracteriza por presentar espermatogonias solamente del tipo A, espermatocitos en profase I (leptoteno y paquitenos), espermátidas en etapa 10 (elongadas). En las secciones analizadas no se encontraron túbulos en este estadio.
Estadios XI-XII (fig. 3b)
Estos estadios se caracterizan por presentar espermatogonias tipo A, espermatocitos en profase I (zigoteno, paquiteno y diploteno), espermátidas elongadas en etapas 11 y 12. De estos tipos celulares de la espermatogénesis y en estos estadios específicos se observaron sólo las células en profase I (zigoteno, paquiteno y diploteno) con reacción positiva a inmunohistoquímica de cav-1. Las células somáticas de Sertoli fueron negativas a cav-1.
Los resultados indican que la expresión génica de la proteína cav-1 se hace evidente de forma diferencial entre los distintos tipos de las células del epitelio germinal y células de Sertoli, según el estadio del ciclo de la espermatogénesis del ratón adulto.
DISCUSIÓN
En mamíferos la espermatogénesis es un proceso cíclico con extensas remodelaciones genómicas y celulares. El desarrollo de las células germinales ocurre en íntima asociación con las células de Sertoli. Las diferentes generaciones de células germinales no están distribuidas en forma aleatorizada en el epitelio del túbulo seminífero, sino que están ordenadas en una asociación celular estrictamente definida6. El número de estadios de la espermatogénesis en una especie es definido por el número de asociaciones de células germinales morfológicamente reconocibles en las secciones transversales de los túbulos seminíferos. Particularmente en el ratón, se describen 12 estadios, en la rata 14 y en el hombre 65. Durante la totalidad del ciclo de la espermatogénesis es posible reconocer morfológicamente los procesos de mitosis, meiosis y espermiohistodiferenciación.
Las caveolinas son una familia de proteínas que consiste en la expresión de 3 tipos: caveolina 1, caveolina 2 y la caveolina músculo específico 3, con un papel estructural y regulador en las caveolas7-9. La cav-1 regula múltiples vías de señales de traducción y es intermediario en el transporte intracelular del colesterol10. Estas caveolas están frecuentemente asociadas a segmentos lipídicos de membrana (raft) cuyos microdominios son abundantes en colesterol y una mezcla compleja de glucoesfingolípidos. Los microdominios lipídicos participan en papeles como transporte de membrana, morfogénesis celular y señales celulares11-15. Estos microdominios de membrana tienen mayor hidrofobicidad que la membrana circundante y una de sus denominaciones es DIG (detergent-insoluble glycosphingolipid-enriched)16. Las fracciones DIG se encuentran relacionadas con las caveolas11.
Se ha demostrado que en los túbulos seminíferos las fracciones DIG de las células de Sertoli no presentan el segmento común asociado a caveolinas, a diferencia de las células peritubulares mioides, que contienen concentraciones significativas de caveolina15. Esta construcción molecular específica de las células de Sertoli podría explicar la expresión diferencial de la cav-1 según el estadio del ciclo de la espermatogénesis de ratón CF1.
En algunos roedores se ha descrito la presencia de cav-1 en la membrana plasmática de la región acrosómica y del flagelo de los espermatozoides eyaculados17,18. En los espermatozoides se han descrito modificaciones de la distribución y la cantidad de cav-1 a medida que transcurre la capacitación y la reacción acrosómica19. En etapas tempranas de la capacitación ocurren cambios en la composición y la distribución lipídica. La pérdida de esteroles espermáticos comienza tan pronto el espermatozoide es removido desde el plasma seminal, siendo un evento obligatorio para la capacitación espermática. La no remoción de los esteroles inhibe la reacción acrosómica inducida por progesterona y ionósforo de calcio en el espermatozoide humano20, al igual que la reacción acrosómica inducida por la zona pelúcida en el espermatozoide de ratón21. La remoción se realizaría en microdominios lipídicos ricos en esteroles, que se han descrito en espermatozoides de erizo de mar, ratones, cobayos y cerdos17,22,23. En espermatozoides humanos se demostró la presencia de una colección heterogénea de microdominios lipídicos, algunos de los cuales están alterados en su composición y/o número debido a la pérdida de esteroles durante la capacitación24.
En los resultados mostrados en la figura 1, es posible observar que la reacción positiva a la inmunohistoquímica es variable según el tipo celular y el estado del ciclo de la espermatogénesis. En la distribución de los estadios desde el I al XII, se observó una escasa positividad de las células de Sertoli a cav-1, y sólo en el estadio VII, estadio previo a la espermiación, se encontraron células marcadas para la presencia de la proteína cav-1. Estos fenómenos diferenciales según los estadios del ciclo de la espermatogénesis probablemente se relacionan con la variabilidad de la composición lipídica de las membranas plasmáticas dinámicas de las células de Sertoli durante la espermatogénesis.
En ratas se ha descrito una composición variable del contenido de lípidos en las células de Sertoli: el aumento del contenido de lípidos en las células de Sertoli ocurre al estadio IX (de XIV estadios en la rata) cercano al período de la espermiación y formación de los cuerpos residuales. La generación de los cuerpos residuales durante la espermatogénesis es predecible en el tiempo según las formaciones vesiculares25, fenómenos también asociados a la apoptosis de las células germinales26.
En estudios de ultraestructura, se demostró en las células de Sertoli la presencia de vesículas endocíticas ubicadas en el citoplasma apical que posteriormente formarían los cuerpos vesiculares, aunque se desconoce su relación con la espermatogénesis27.
Los resultados obtenidos muestran una expresión de cav-1 sólo en las espermatogonias tipo In (intermedias) y en la profase I de la meiosis, incluidos principalmente los estadios de espermatocitos en paquitenos, y en menor grado en preleptotenos, leptotenos y cigotenos. Estos hallazgos son similares a lo descrito por Scheel et al28, donde cav-1 se expresa intensamente en las células de línea germinal con un papel importante en la progresión de los procesos de la meiosis.
Entre otros hallazgos se observó que las espermátidas redondas 1, 6 y 7 expresan cav-1, en etapas que coinciden con una ausencia de positividad de cav-1 en el resto de la celularidad de los túbulos que se encuentran en los estadios VI y VII.
Es posible que las espermatogonias en preparación para el inicio de la meiosis no requieran de la expresión de cav-1 para entrar a preleptoteno (estadios V y VI). Probablemente utilizan otras vías de señalización intracelular de modo transicional (estadios VII). Sin embargo, en ninguna de las etapas de las espermátidas elongadas se observó la expresión de cav-1, pudiendo permanecer secuestrada en los fragmentos de membrana enriquecidos en lípidos. Travis et al17 han descrito la presencia de cav-1 en las membranas del espermatozoide de ratón, distribuida principalmente en el acrosoma y el flagelo. Algunos grupos han descrito propiedades similares al estudiar las caveolas en células de cultivo, y han concluido que las caveolinas son estructuras altamente inmóviles y de baja tasa de renovación en la membrana plasmática29.
Finalmente, se puede concluir que hay una regulación dinámica de la expresión de cav-1 en los distintos estadios del ciclo de la espermatogénesis en el ratón CF1 adulto sano. Además que las células de Sertoli son altamente específicas en la expresión de cav-1, mientras que en la espermatogénesis la expresión de cav-1 es importante en los procesos de mitosis meiosis e histodiferenciación.
AGRADECIMIENTOS
Se agradece especialmente la participación del Sr. Juan Borja, asistente técnico de investigación, el cual participó en el desarrollo de las técnicas histológicas. Y al financiamiento parcial otorgado por la Universidad de Tarapacá, Proyecto UTA-N.º 4792.
Correspondencia: Dr. H. Rodríguez Bustos.
Unidad de Histoembriología. Facultad de Medicina. Universidad de Chile
Avda. de la Independencia, 1027. Casilla 79700-7. PO Box 8389100. Santiago de Chile. Chile.
Correo electrónico: hrodrigu@med.uchile.cl