Reportar a nossa experiência nos últimos 17 anos na preservação da fertilidade masculina por doença oncológica, genética, imunológica e endocrinológica, assim como por alterações graves da espermatogénese.
Material e métodosavaliação de parâmetros demográficos, características do esperma e resultados obtidos com amostras descongeladas em ciclos de procriação medicamente assistida (PMA).
ResultadosDuzentos e setenta e um homens com uma idade média de 31,5±6,3 anos (16‐52 anos) foram referenciados para PF.
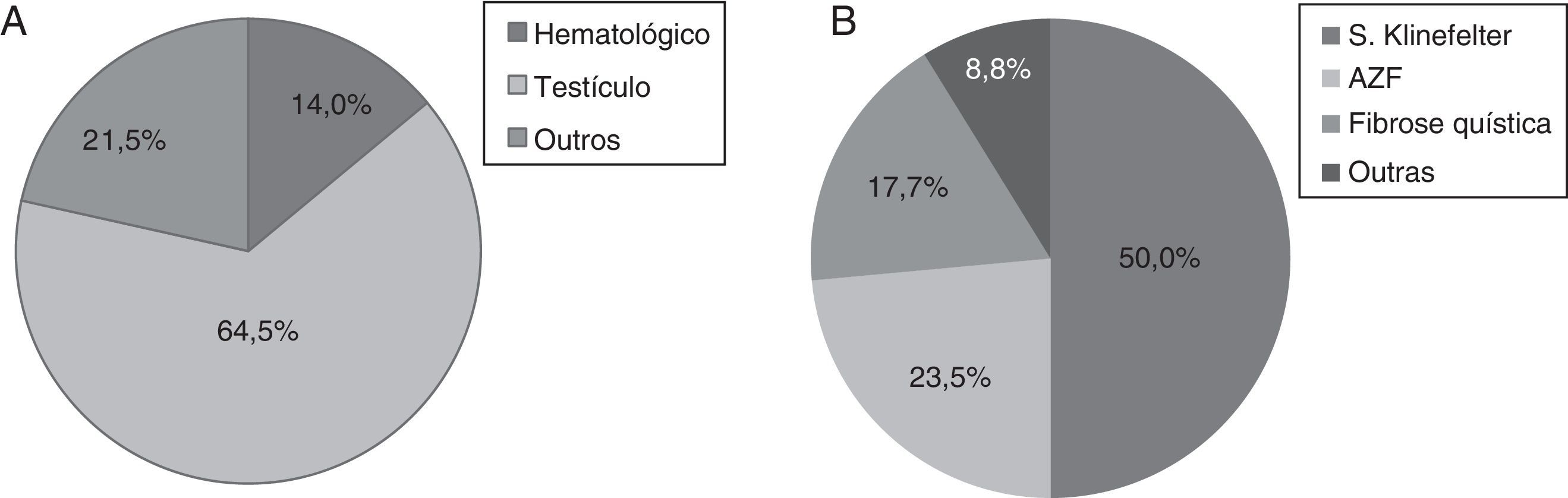
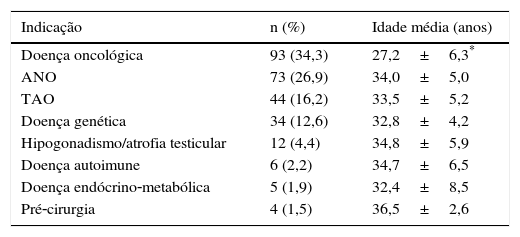
A doença oncológica foi a causa mais comum (34,3%), seguida de azoospermia secretora ou não obstrutiva, oligoastenoteratozoospermia (TAO) grave, doença genética, hipogonadismo/atrofia testicular, doença auto‐imune, doença endócrino‐metabólica e pré‐cirurgia potencialmente comprometedora da fertilidade. Dentro da doença oncológica, o tumor do testículo foi a neoplasia mais comum (64,5%), seguido do cancro hematológico e de etiologias variadas. Na doença genética, a síndrome de Klinefelter foi a condição mais frequente (50%).
No total 194 homens ficaram com amostras criopreservadas (1.099 amostras no total; 5,7±3,4 por paciente). Os homens com doença oncológica tiveram, em média, um número significativo superior de amostras congeladas (p<0,001). Os casos de tumor do testículo apresentaram uma concentração média de espermatozoides/ml significativamente inferior face aos outros tumores (p<0,005).
Durante estes 17 anos, 58 homens (29,9%) procuraram o centro para realização de técnicas de PMA com amostras descongeladas. Foram realizados 87 ciclos, com 19 gestações (21,8%). Nasceram 15 recém‐nascidos (RN) saudáveis.
ConclusõesAinda que o número de homens que tenham procurado o uso das amostras armazenadas, não se pode desvalorizar o impacto psicológico positivo da PF, tendo em conta que pode ser a única possibilidade de paternidade biológica.
A report is presented of 17 years of experience in male fertility preservation due to oncological, genetic, immunological and endocrinological disease, as well as severe spermatogenesis alterations.
Material and methodsAn evaluation is made of demographic parameters, sperm characteristics and results of assisted reproduction techniques cycles with thawed samples.
ResultsA total of 271 men with a mean age 31.5±6.3 years (16 to 52 years) were referred to sperm banking. The most common cause was oncological disease (34.3%), followed by secretory azoospermia, oligoasthenoteratozoospermia, genetic disease, testicular atrophy/hypogonadism, auto‐immune disease, endocrine‐metabolic disease, and prior to potentially fertility damage surgery.
Among oncological disease, testicular tumour was the most common cancer (64.5%), followed by haematological cancer, and other aetiologies. Klinefelter syndrome was the most common (50%) among the genetic diseases.
A total of 194 men had samples cryopreserved (1099 total samples; 5.7±3.4 per patient). Men with oncological disease had a significantly higher number of cryopreserved samples (p<.001). Testicular tumour cases had a mean lower sperm concentration relative to other tumours (p<.005).
During these 17 years, 58 men (29.9%) asked to have assisted reproduction techniques performed with their thawed samples. The 87 cycles performed resulted in 19 pregnancies (21.8%) and 15 healthy newborns.
ConclusionsAlthough the number of men asking to use their cryopreserved samples is low, we cannot undervalue the positive psychological impact of fertility preservation, taking in consideration that it can be the only possibility to biological fatherhood.
Existem determinadas situações clínicas cuja própria doença, ou seus tratamentos, podem alterar a fertilidade, pelo que deve sempre oferecer‐se previamente técnicas de preservação da fertilidade (PF). Estas situações incluem determinadas cirurgias, alterações genéticas, neoplasias, doenças autoimunes e doenças endócrino‐metabólicas com indicação para tratamentos potencialmente gonadotóxicos (agentes citostáticos ou imunossupressores).
Apesar da incidência de algumas destas situações ter vindo a aumentar nos últimos anos, os avanços no diagnóstico e tratamento têm permitido um aumento da expectativa de cura e sobrevida dos pacientes. Neste contexto, a capacidade reprodutiva dos pacientes é um parâmetro a ter em consideração, já que estas doenças afetam jovens e adultos em idade reprodutiva. Por outro lado, os efeitos na fertilidade podem ser temporários (até 5 anos o término dos tratamentos), definitivos e/ou de manifestação tardia, sendo difícil predizer quem vai ficar, ou não, infértil1–3.
Surge assim, não só a necessidade de aumentar a esperança e qualidade de vida, mas também a PF, aproximando a medicina da reprodução de outras valências médicas.
No homem em idade reprodutiva as neoplasias mais comuns são o tumor do testículo, o linfoma não Hodgkin (LNH), o melanoma, o linfoma de Hodgkin (LH), a leucemia, o tumor cerebral e o colorretal4. Uma vez que alguns tumores atingem taxas de cura na ordem dos 90%, os efeitos secundários adquirem grande interesse5. Os homens com síndrome de Klinefelter, microdeleções do cromossoma Y no locus AZF ou outras alterações graves na qualidade espermática têm igualmente indicação para PF, pelo risco de infertilidade inerente à sua alteração genética.
Entidades como a Sociedade Americana de Oncologia Clínica (ASCO) e a Sociedade Europeia de Oncologia Médica (ESMO) têm publicado linhas de orientação de prática clínica. Estas diretrizes consideram a PF uma necessidade médica, pelo que os pacientes devem ser direcionados o mais precocemente possível para uma equipa de reprodução medicamente assistida e apoio psicossocial1,2,6. Consideram igualmente que não deve ser estabelecida uma idade mínima para a PF e que esta deve ser oferecida a todos os pacientes antes de quimio (QT) ou radioterapia (RT)3, uma vez que uma única sessão pode induzir danos na qualidade do esperma e na integridade do ADN espermático1.
Após avaliação por uma equipa multidisciplinar, as possibilidades de PF devem ser transmitidas de forma clara, concisa, compreensível e realista, e a equipar deve estar preparada para responder a questões básicas, tais como esclarecer que a criopreservação não implica, necessariamente, atraso nos tratamentos gonadotóxicos.
No jovem e homem adulto a principal estratégia de PF baseia‐se na criopreservação de espermatozoides após sua exposição a crioprotetores e seu armazenamento em azoto líquido a ‐196°C. Os espermatozoides podem provir do esperma (mais usual e generalizado) ou do tecido testicular.
A supressão testicular com proteção gonadal mediante administração de análogos da GnRH tem sido uma técnica cuja eficácia ainda não foi comprovada1,6.
Nos rapazes pré‐púberes a única opção é a criopreservação de tecido testicular para posterior diferenciação das espermatogónias ou transplantação, no entanto, ainda é considerada uma técnica experimental2.
O objetivo deste trabalho foi analisar os casos de PF masculina realizados no nosso centro ao longo de 17 anos. Foram avaliados parâmetros demográficos, características do esperma e resultados obtidos com amostras descongeladas em ciclos de procriação medicamente assistida (PMA).
Material e métodosEntre fevereiro de 1997 e dezembro de 2014 todos os homens referenciados para PF tiveram um atendimento, no máximo, nas 48 horas seguintes. Nessa altura foram discutidas as opções de PF e, sempre que possível, a mesma foi agendada após recolha da história clínica, verificação de marcadores biológicos de infeção negativos por VIH (Ac. anti‐VIH1 e VIH2), hepatite C (Ac. anti‐VHC), hepatite B (Ag Hbs, Ac. anti‐HBc) e sífilis. Todos os pacientes receberam informação sobre as opções de uso futuro das amostras, probabilidade de sucesso com técnicas de PMA e assinaram consentimento informado.
Na maioria das situações as amostras foram colhidas por masturbação em recipientes esterilizados de polipropileno. Após liquefação o esperma foi analisado segundo os critérios da Organização Mundial de Saúde nas suas diferentes edições7–9. Sempre que possível, e necessário, efetuou‐se a colheita e a preparação de mais do que uma amostra com intervalos entre 24‐48 horas. Neste estudo foram apenas considerados os valores de concentração e motilidade da primeira colheita. Uma vez que os critérios morfológicos mudaram ao longo do tempo, este parâmetro não foi analisado.
Nas situações de azoospermia, TAO grave ou dificuldade de colheita realizou‐se biópsia testicular extrativa sob anestesia local, tendo‐se colhido vários fragmentos de tecido testicular, que foram fragmentados e macerados com lâminas de bisturi.
Sempre que se observaram espermatozoides móveis (independentemente da concentração) as amostras foram diluídas com crioprotetor à base de glicerol e congeladas em azoto líquido mediante protocolo standard do laboratório. As amostras foram armazenadas em criotubos (Cryovials®, Nunc®, anteriormente a 2000) ou palhetas de alta segurança (CBS™, Paris, França, posteriormente a 2000).
A descongelação foi efetuada à temperatura ambiente, após o que se seguiu lavagem com meio de cultura de gâmetas para retirar o crioprotetor e swim‐up.
Foi utilizado o teste t de Student para análise estatística, tendo sido estabelecido um p<0,05 como tendo significado estatístico.
ResultadosUm total de 271 homens com uma idade média de 31,5±6,3 anos (16‐52 anos) foram referenciados ao nosso centro para PF. A maioria veio por indicação médica (97,4%), eram casados (52,1%), mas apenas 6,6% tinham filhos. Cento e sessenta e quatro homens (60,5%) pertenciam à área de referenciação de Vila Nova de Gaia.
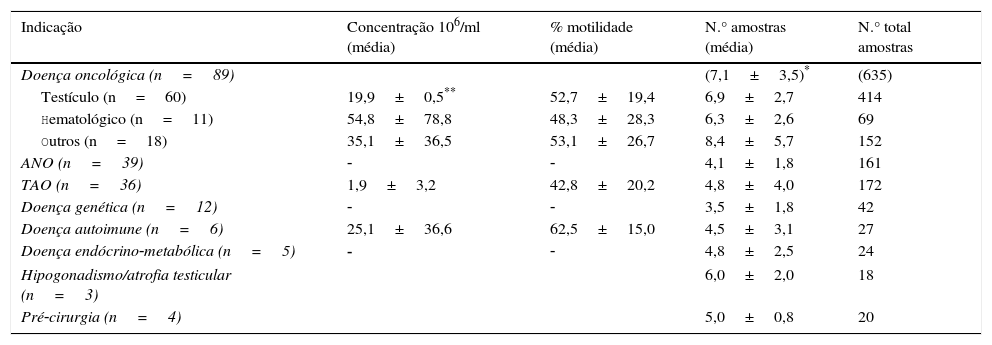
A doença oncológica foi a causa mais comum (n=93; 34,3%), seguida de azoospermia secretora ou não obstrutiva (ANO; n=73; 26,9%), TAO grave (n=44; 16,2%), doença genética (n=34; 12,6%), hipogonadismo/atrofia testicular (n=12; 4,4%) doença autoimune (n=6; 2,2%), doença endócrino‐metabólica (n=5; 1,9%) e pré‐cirurgia potencialmente comprometedora da fertilidade (n=4; 1,5%) (tabela 1).
Caracterização dos homens com indicação para PF (n=271)
| Indicação | n (%) | Idade média (anos) |
|---|---|---|
| Doença oncológica | 93 (34,3) | 27,2±6,3* |
| ANO | 73 (26,9) | 34,0±5,0 |
| TAO | 44 (16,2) | 33,5±5,2 |
| Doença genética | 34 (12,6) | 32,8±4,2 |
| Hipogonadismo/atrofia testicular | 12 (4,4) | 34,8±5,9 |
| Doença autoimune | 6 (2,2) | 34,7±6,5 |
| Doença endócrino‐metabólica | 5 (1,9) | 32,4±8,5 |
| Pré‐cirurgia | 4 (1,5) | 36,5±2,6 |
Em média os homens com doença oncológica tinham uma idade inferior (27,2±6,3 anos) comparativamente com as outras indicações (p<0,005). Curiosamente, 39 destes homens já tinham realizado cirurgia anteriormente (32 das quais foram orquidectomias unilaterais por tumor testicular), um já tinha sido submetido a QT e 3 já tinham realizado, simultaneamente, QT e RT.
Dentro da doença oncológica, o tumor do testículo foi a neoplasia mais comum (n=60, 64,5%), seguido do cancro hematológico (n=13, 14%) e de etiologias variadas (n=20, 21,5%) (fig. 1A).
Dentro da doença genética, a síndrome de Klinefelter esteve presente em metade dos homens (n=17; 50%), seguida das microdeleções no cromossoma Y (gene AZF) (n=8; 23,5%), mutação no gene da fibrose quística (n=6; 17,7%) e outras alterações no cariótipo (n=3; 8,8%) (fig. 1B).
Não se procedeu à PF em 77 homens devido à ausência total de espermatozoides em 62 casos, opção futura de nova colheita a fresco em 14 casos e uma desistência após informação sobre impossibilidade de realizar técnicas de PMA no Sistema Nacional de Saúde (uma vez que a esposa já tinha 42 anos e uma filha em comum).
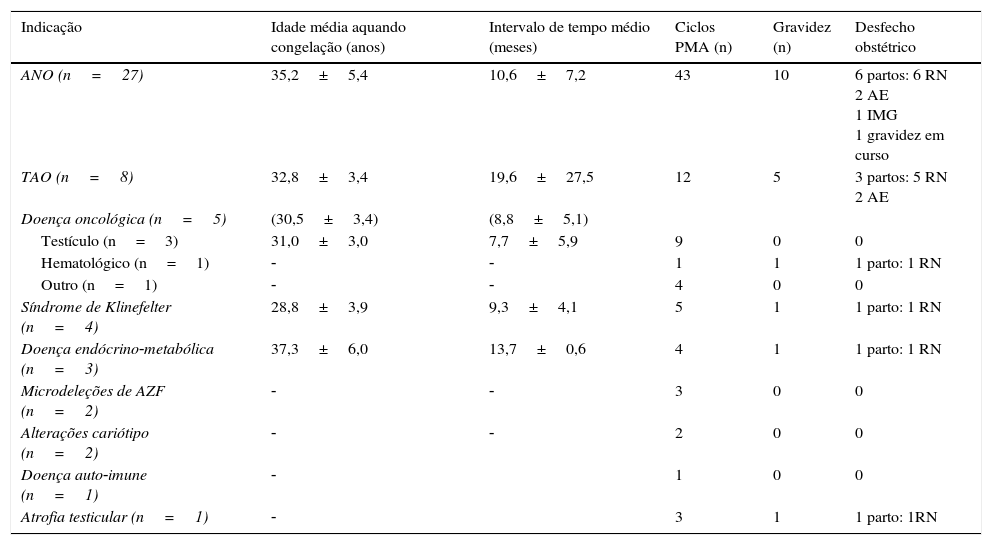
No total 194 homens ficaram com criotubos/palhetas criopreservado(a)s, tendo sido armazenadas 1099 amostras, numa média de 5,7±3,4 amostras por paciente. Os homens com doença oncológica tiveram, em média, um número significativo superior de amostras congeladas (p<0,001), representado mais de metade das amostras armazenadas (tabela 2). Os casos de tumor do testículo apresentaram uma concentração média de espermatozoides/ml significativamente inferior face aos outros tumores (p<0,005).
Caracterização das amostras criopreservadas numa população de 194 homens
| Indicação | Concentração 106/ml (média) | % motilidade (média) | N.° amostras (média) | N.° total amostras |
|---|---|---|---|---|
| Doença oncológica (n=89) | (7,1±3,5)* | (635) | ||
| Testículo (n=60) | 19,9±0,5** | 52,7±19,4 | 6,9±2,7 | 414 |
| Hematológico (n=11) | 54,8±78,8 | 48,3±28,3 | 6,3±2,6 | 69 |
| Outros (n=18) | 35,1±36,5 | 53,1±26,7 | 8,4±5,7 | 152 |
| ANO (n=39) | ‐ | ‐ | 4,1±1,8 | 161 |
| TAO (n=36) | 1,9±3,2 | 42,8±20,2 | 4,8±4,0 | 172 |
| Doença genética (n=12) | ‐ | ‐ | 3,5±1,8 | 42 |
| Doença autoimune (n=6) | 25,1±36,6 | 62,5±15,0 | 4,5±3,1 | 27 |
| Doença endócrino‐metabólica (n=5) | ‐ | ‐ | 4,8±2,5 | 24 |
| Hipogonadismo/atrofia testicular (n=3) | 6,0±2,0 | 18 | ||
| Pré‐cirurgia (n=4) | 5,0±0,8 | 20 |
Durante estes 17 anos, 58 homens (29,9%) procuraram o centro para realização de técnicas de PMA com amostras descongeladas (tabela 3). No total foram realizados 87 ciclos, dando origem a 19 gestações (21,8%). Nasceram 15 recém‐nascidos (RN) saudáveis. Está uma gravidez em curso, houve 4 abortamentos espontâneos do primeiro trimestre (AE) e uma interrupção médica da gravidez (IMG) por trissomia 18. Metade dos ciclos foi realizada em homens com ANO.
Resultado dos ciclos PMA realizados com espermatozoides descongelados (n=58)
| Indicação | Idade média aquando congelação (anos) | Intervalo de tempo médio (meses) | Ciclos PMA (n) | Gravidez (n) | Desfecho obstétrico |
|---|---|---|---|---|---|
| ANO (n=27) | 35,2±5,4 | 10,6±7,2 | 43 | 10 | 6 partos: 6 RN 2 AE 1 IMG 1 gravidez em curso |
| TAO (n=8) | 32,8±3,4 | 19,6±27,5 | 12 | 5 | 3 partos: 5 RN 2 AE |
| Doença oncológica (n=5) | (30,5±3,4) | (8,8±5,1) | |||
| Testículo (n=3) | 31,0±3,0 | 7,7±5,9 | 9 | 0 | 0 |
| Hematológico (n=1) | ‐ | ‐ | 1 | 1 | 1 parto: 1 RN |
| Outro (n=1) | ‐ | ‐ | 4 | 0 | 0 |
| Síndrome de Klinefelter (n=4) | 28,8±3,9 | 9,3±4,1 | 5 | 1 | 1 parto: 1 RN |
| Doença endócrino‐metabólica (n=3) | 37,3±6,0 | 13,7±0,6 | 4 | 1 | 1 parto: 1 RN |
| Microdeleções de AZF (n=2) | ‐ | ‐ | 3 | 0 | 0 |
| Alterações cariótipo (n=2) | ‐ | ‐ | 2 | 0 | 0 |
| Doença auto‐imune (n=1) | ‐ | 1 | 0 | 0 | |
| Atrofia testicular (n=1) | ‐ | 3 | 1 | 1 parto: 1RN |
O tempo médio entre a congelação e a descongelação foi de 11,3 meses. Não se encontrou qualquer relação entre a idade dos homens aquando da congelação e a altura da primeira descongelação, ainda que o intervalo de tempo tenha sido menor nos doentes oncológicos e superior nos casos de TAO grave.
DiscussãoOs autores consideram que uma amostra de 271 homens durante 17 anos foi pequena, principalmente tendo em conta a prevalência das indicações consideradas nos homens em idade fértil e o caráter gratuito da PF no Sistema Nacional de Saúde. Entre as causas que parecem determinar esta procura estão os conhecimentos/atitudes dos clínicos e a acessibilidade a um centro que realize a criopreservação de gâmetas.
Na nossa população a indicação foi maioritariamente médica, especialmente por parte de urologistas. De facto a urologia constitui uma valência que articula diretamente com a medicina da reprodução, pelo que a divulgação da informação é maior, o mesmo não acontecendo noutras valências.
Na realidade, vários estudos têm mostrado que os oncologistas, apesar de conhecerem as opções de PF, até as discutirem com os pacientes, a maioria acaba por não os referenciar para o especialista em fertilidade. A falta de tempo, dificuldade em indicar centros de PF e a preocupação de que os custos das técnicas sejam proibitivos para os pacientes têm sido as principais razões enumeradas10–14.
Relativamente à acessibilidade os autores não consideram que tenha constituído um entrave, até porque a maioria dos homens (60,5%) não pertencia à área de referência de Gaia.
Ainda que nenhum paciente encaminhado para o nosso centro tivesse uma idade inferior a 16 anos, de um ponto de vista unicamente científico, a criopreservação de esperma em jovens pós‐púberes é uma opção válida e comprovada. Nos rapazes pré‐púberes pode ser oferecida a criopreservação de tecido testicular para posterior diferenciação das células estaminais espermatogónias ou sua transplantação15. Ainda que esta possibilidade levante questões éticas, legais e psicológicas complexas, e seja considerada uma técnica experimental, há autores que a defendem com base no pressuposto de que quando estes jovens estiverem em idade reprodutiva a ciência terá encontrado soluções e haverá maior segurança nos resultados16. Apesar de todas as condicionantes a posição do Instituto Nacional para a Saúde e Cuidados de Excelência Inglês (NICE) é a de que não deveria ser estabelecida uma idade mínima para a PF em doentes oncológicos, mas a sua realização deveria ser realizada apenas em determinados centros especializados2.
No nosso estudo a doença oncológica foi a principal indicação para PF (34,3%), e dentro desta o tumor do testículo foi a neoplasia mais comum e a que ocorreu no grupo mais jovem (p<0,005), o que está de acordo com outros estudos17–19.
No geral, aceita‐se que o cancro afeta a qualidade espermática tanto ao nível testicular20,21 como ejaculatório22. De entre os diferentes tipos de cancro há vários autores que referem que o tumor do testículo em geral e o seminoma em particular, afetam mais a qualidade espermática do que os cancros hematológicos, e dentro destes o LH afeta mais do que os LNH ou a leucemia20,21. As causas não são totalmente conhecidas e especula‐se que possam estar envolvidos múltiplos fatores, tais como anomalias pré‐existentes nas células germinativas, efeitos tumorais locais, alterações endócrinas e efeitos autoimunes e sistémicos do próprio tumor23.
Os nossos resultados (tabela 1) conferem estas observações, uma vez que os casos de tumor do testículo apresentaram piores concentrações espermáticas do que os outro tipos de cancro (p<0,005). Paralelamente foi neste grupo que se congelaram mais palhetas/criotubos (p<0,001), fruto de colheitas múltiplas.
Ainda que de um modo geral, a qualidade espermática ficar comprometida após orquidectomia unilateral e ser aconselhada a congelação prévia, na nossa população 32 homens com tumor do testículo foram encaminhados para o nosso centro após cirurgia, o que vai ao encontro de Tomlinson et al.24 que comprova esta possibilidade, ainda que não seja a situação ideal. De um modo geral, qualquer amostra com espermatozoides móveis (independentemente da sua concentração ou morfologia) deve ser armazenada, uma vez que graças aos avanços das técnicas de PMA é possível ter sucesso.
Por outro lado, os homens devem ser referenciados antes do início de qualquer tratamento. No entanto, por vezes, esta situação não é possível e há vários estudos que referem a possibilidade de PF ser realizada após início da QT ou RT, ainda que com algumas reservas relativamente à integridade do ADN espermático e ao tempo mínimo recomendado entre os tratamentos e a colheita2,25. Na nossa população tivemos 4 pacientes que já tinham realizado QT e/ou RT previamente à PF (média de 4,5 anos atrás).
Através da análise cromossómica, vários estudos demonstram não haver transmissão de instabilidade genómica nos descendentes de pacientes que fizeram QT/RT, nem associação de mutações minisatélite na linhagem germinativa26. Sendo consensual que os tratamentos induzem elevados danos no ADN espermático (que podem permanecer até um ano), os mecanismos de reparação de ADN parecem corrigir estes mesmos danos27. Outra explicação para as baixíssimas taxas de malformações ou alterações cromossómicas em filhos de sobreviventes de cancro após QT e/ou RT, poderá ser a de que os espermatozoides com danos significativos no ADN falham a fecundação do ovócitos ou que o embrião resultante falha a implantação ou aborta28,29.
Por outro lado os sobreviventes de cancro na infância que realizaram QT e/ou RT não parecem ter risco aumentado de maus resultados obstétricos, ainda que a dactinomicina tenha sido associada a menores taxas de nascimentos e a procarbazina a maiores taxas de abortamento. Relativamente às anomalias congénitas, sexo ratio e incidência de cancro na infância, a maioria dos estudos não associa piores resultados, exceto nas situações de cancro com predisposição genética30–32. São ainda necessários mais estudos para validar estes dados.
Quanto aos possíveis danos induzidos pelas técnicas de criopreservação no ADN espermático, a literatura não é consensual, devido à existência de diferentes protocolos de congelação, testes de análise de fragmentação e técnicas de preparação de espermatozoides, tornando difíceis as conclusões.
Analisando os pedidos de descongelação para PMA, verificámos que 58 homens o efetuaram. Destes 5 eram doentes oncológicos, o que representa 5,6% de pedidos de descongelação do grupo dos 89 pacientes oncológicos que armazenaram as amostras. Estes dados são concordantes com a literatura, que apresenta valores entre os 3‐20% para estes doentes5,17–19,21,22,33,34. As causas desta escassa utilização são múltiplas: recuperação da função gonadal, sem projeto de paternidade devido a idade ainda jovem, preocupação face a riscos para os descendentes, incerteza sobre a sua saúde a longo prazo ou morte do paciente5,21.
No nosso centro a maioria dos pedidos foi de casos de ANO, com um intervalo médio entre a congelação e o seu uso das amostras de 10,6 meses. Estes homens eram em média mais velhos, tinham uma relação estável e a sua fertilidade estava a ser investigada no âmbito da PMA quando foi oferecida a PF.
Do total de 43 ciclos de PMA realizados resultaram 10 gestações. Os 5 homens oncológicos realizaram 9 ciclos, dos quais resultou uma gravidez com nascimento de uma criança saudável.
Dados na literatura apontam para casos de sucesso com amostras armazenadas há mais de 20 anos35–37. Em Portugal, o período de armazenamento inicial é de 3 anos, podendo ser renovado por iguais períodos sucessivos. Diferentes países têm diferentes prazos e as orientações da NICE recomendam que o período inicial deveria ser de 10 anos, potencialmente renovável3. Do mesmo modo, recomendam que sempre que a fertilidade tenha sido restituída as amostras sejam destruídas, uma vez que o armazenamento desnecessário tem implicações financeiras e logísticas.
Em resumo, ainda que o número de homens enviados para PF seja reduzido, o mesmo acontecendo para os que procuram o uso das amostras armazenadas, não se pode desvalorizar o impacto psicológico positivo da PF, tendo em conta que esta pode ser a única possibilidade de paternidade biológica.
O sucesso da PF depende da sua acessibilidade, assim como da participação ativa de todos os elementos da equipa multidisciplinar, numa coordenação conjunta de esforços para uma correta informação e orientação, não só aos pacientes, como aos seus prestadores de cuidados médicos.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaramque os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.