El objetivo de este estudio es determinar la prevalencia de microdeleciones del cromosomaY en hombres chilenos infértiles.
Material y métodosSe incluyeron 102 hombres con diagnóstico de azoospermia u oligozoospermia severa que consultaron en la Unidad de Andrología por infertilidad. Se llevó a cabo análisis de microdeleciones de la región del factor de azoospermia (AZF) del cromosomaY a través de reacción en cadena de la polimerasa, utilizando ADN genómico extraído de leucocitos de sangre periférica. Cada paciente fue analizado utilizando sequence tagged sites para las regiones AZFa, AZFb y AZFc.
ResultadosSesenta y siete pacientes presentaron azoospermia y 35 oligozoospermia severa. Se encontraron microdeleciones del cromosomaY en el 9,8% de los pacientes. La mutación más prevalente fue AZFc, afectando al 3,9% de la muestra, seguida por AZFbc (2,9%), AZFa (2,0%) y AZFb (1,0%). Solo los hombres azoospérmicos presentaron las mutaciones.
ConclusionesLa prevalencia de microdeleciones del cromosomaY en hombres chilenos infértiles es similar a la presentada en estudios internacionales. Estas mutaciones deben ser buscadas cuando se enfrenta a un paciente infértil con alteraciones cuantitativas severas del seminograma, ya que AZFa y AZFb están asociados con ausencia completa de gametos viables, y la portación de AZFc tiene importantes consecuencias en el potencial de fertilidad de la descendencia masculina.
The aim of this study is to determine the prevalence of Ychromosome microdeletions in infertile Chilean men.
Material and methodsA group of 102 infertile men with azoospermia or severe oligozoospermia were screened while attending a fertility clinic for microdeletions in the azoospermia factor (AZF) region of Ychromosome by multiplex polymerase chain reaction. Genomic DNA was extracted from peripheral blood samples. Each patient was analysed for the presence of sequence tagged sites in the AZFa, AZFb, and AZFc regions.
ResultsAzoospermia and severe oligozoospermia was found in 67 and 35 patients, respectively. Microdeletions were found in 9.8% of patients. The most prevalent mutation was AZFc, affecting 3.9% of the sample. This was followed by AZFbc with 2.9%, AZFa with 2.0%, and AZFb with 1.0%. Only azoospermic men were found to have these genetic alterations.
ConclusionsPrevalence of Ychromosome microdeletions in infertile Chilean men is similar to the prevalence presented in international studies. As AZFa and AZFb mutations are associated with complete absence of viable gametes, and AZFc has important consequences in the fertility potential of the offspring, these mutations have to be searched when presented with an infertile patient with severe sperm alterations.
Infertilidad se define como la incapacidad de obtener un embarazo, en una pareja sexualmente activa que no utiliza métodos anticonceptivos, a lo largo de un año. Aproximadamente el 15% de las parejas se encuentra en este grupo1. Diferentes estudios han sugerido una contribución masculina a la infertilidad de pareja entre un 45-50% de los casos. La infertilidad masculina afecta aproximadamente al 7% de los hombres, presentándose hasta el 15% de ellos con azoospermia, es decir, ausencia de espermatozoides en el semen2.
El cromosoma Y tiene un rol fundamental en el desarrollo y maduración de los gametos masculinos. Diferentes genes localizados en este cromosoma están involucrados en diversos procesos de la espermatogénesis humana. Múltiples grupos alrededor del mundo han descrito deleciones de genes o secuencias génicas en el cromosomaY de pacientes con infertilidad idiopática, asociadas a alteraciones severas en diferentes parámetros seminales2-4.
Las técnicas de reproducción asistida (TRA), tanto de baja como de alta complejidad, han permitido subsanar parcialmente alteraciones anatómicas, hormonales y genéticas de las parejas infértiles. Sin embargo, existe un grupo específico de parejas con un factor masculino severo que no podrán obtener un embarazo exitoso sin importar la técnica utilizada.
El desarrollo vertiginoso de diferentes TRA no solo ha permitido que millones de parejas logren alcanzar embarazos exitosos, sino que además ha develado conflictos bioéticos concernientes a la transmisión vertical de defectos genéticos, tales como deleciones génicas en el cromosomaY, asociadas a alteraciones de fertilidad en la descendencia masculina5.
Entre las diversas alteraciones genéticas observadas en hombres infértiles destacan las microdeleciones del cromosomaY por su frecuencia, y sobre todo, por los efectos que tienen en el potencial de fertilidad de los pacientes y de su descendencia. Las microdeleciones del cromosomaY corresponden a la ausencia de secuencias génicas o genes de la región funcionalmente activa del cromosomaY2-6. Estas mutaciones representan la anomalía cromosómica estructural más frecuente en hombres con infertilidad idiopática, observándose en el 15-20% de hombres con azoospermia idiopática, en el 7-10% de los hombres con oligozoospermia idiopática y en el 2-3% de los pacientes candidatos para inyección intracitoplasmática de espermatozoides (ICSI, por sus siglas en inglés)7.
La región ubicada en la zona distal del brazo largo del cromosomaY (Yq11) contiene los genes involucrados en el control de la espermatogénesis8-10. Esta zona del cromosomaY se ha denominado factor de azoospermia (AZF). Análisis moleculares han dividido esta región en 3 subregiones: AZFa, AZFb y AZFc11,12.
La deleción parcial o completa de las regiones AZF altera la espermatogénesis. Existen por lo menos 14 proteínas codificadas en el locus de AZF. Las deleciones descritas actualmente ocurren en alguno de los 6 siguientes patrones: AZFa, AZFb, AZFc, AZFbc, AZFabc y la deleción parcial de AZFc13. Estas mutaciones son en su mayoría de novo, afectando a 1/1.000 a 1/5.000 recién nacidos14,15. Existen importantes diferencias en la frecuencia de estas mutaciones en diferentes estudios. Una de las causas de ello es la variación étnica descrita para estas anomalías cromosómicas2-15.
El objetivo principal de este artículo es presentar por primera vez la prevalencia de esta alteración genética en hombres chilenos infértiles, con alteraciones severas del seminograma, sometidos a TRA de alta complejidad.
Material y métodosSelección de pacientesEstudio descriptivo transversal con aprobación de comité de ética institucional. Del universo de pacientes que consultaron por infertilidad masculina a la unidad de reproducción de un hospital universitario y una clínica privada entre noviembre de 2012 y diciembre de 2013 se seleccionaron los que presentaban alteraciones cuantitativas severas en el seminograma durante la evaluación andrológica inicial (mínimo 2 muestras separadas). Dichas alteraciones fueron definidas como azoospermia (ausencia de espermatozoides en muestra seminal) u oligozoospermia severa (menos de 5×106/ml espermatozoides en muestra seminal). Todos los pacientes firmaron, antes de ser incluidos en el estudio, un consentimiento informado ad hoc.
Análisis de semenEl análisis se semen se realizó siguiendo las recomendaciones de la Organización Mundial de la Salud (OMS). Los parámetros de normalidad utilizados son los publicados por la OMS el año 2010. El diagnóstico de azoospermia se basó en la ausencia de espermatozoides en al menos 2 muestras diferentes, después de la centrifugación a 1.000g durante 5min16.
Estudio andrológicoTodos los pacientes seleccionados fueron sometidos a una evaluación andrológica completa que incluyó anamnesis médica y sexual, examen físico, medición de hormona foliculoestimulante (FSH), ecografía testicular, cariotipo y análisis de microdeleciones del cromosomaY. Las concentraciones séricas de FSH fueron determinadas por ensayo inmunorradiométrico (Siemens Medical Solutions Diagnostics, LA, CA, EE.UU.); los resultados se expresan en mIU/ml, con valores normales en los rangos de 1-15mIU/ml.
Detección de microdeleciones del cromosoma YLas microdeleciones de AZF fueron detectadas utilizando la reacción en cadena de la polimerasa (PCR) asociada a sequence tagged sites (STS) específicos para el cromosomaY.
De los pacientes se extrajo ADN genómico de leucocitos de sangre periférica con el kit Wizard (Promega, EE.UU.) de acuerdo a las instrucciones del fabricante. Posteriormente se realizó la amplificación a través de PCR multiplex de 8 STSs de la región AZF de acuerdo a protocolos de la EAA descritos en la literatura17. Se amplificaron 2STS de cada una de las regiones de interés: AZFa, AZFb y AZFc. Los genes ZFY/ZFX y SRY(Yp) se utilizaron como controles internos. Se amplificaron STS complementarios para confirmar las microdeleciones de regiones específicas. Las mutaciones fueron expresadas como positivas para alguno de los 6 patrones de deleciones descritos.
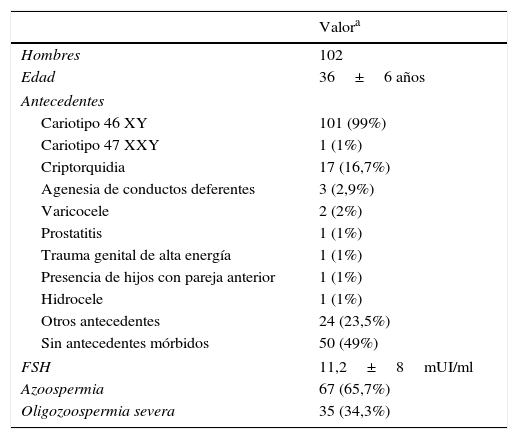
ResultadosLas características de los pacientes se muestran en la tabla 1. Ciento dos pacientes cumplieron los criterios de inclusión durante el período señalado, con una edad promedio de 35años. Todos los pacientes fueron sometidos a una evaluación andrológica completa. Al analizar los parámetros seminales de los sujetos, 67 y 35 pacientes presentaban azoospermia y oligozoospermia, respectivamente.
Características de los pacientes estudiados
| Valora | |
|---|---|
| Hombres | 102 |
| Edad | 36±6 años |
| Antecedentes | |
| Cariotipo 46 XY | 101 (99%) |
| Cariotipo 47 XXY | 1 (1%) |
| Criptorquidia | 17 (16,7%) |
| Agenesia de conductos deferentes | 3 (2,9%) |
| Varicocele | 2 (2%) |
| Prostatitis | 1 (1%) |
| Trauma genital de alta energía | 1 (1%) |
| Presencia de hijos con pareja anterior | 1 (1%) |
| Hidrocele | 1 (1%) |
| Otros antecedentes | 24 (23,5%) |
| Sin antecedentes mórbidos | 50 (49%) |
| FSH | 11,2±8mUI/ml |
| Azoospermia | 67 (65,7%) |
| Oligozoospermia severa | 35 (34,3%) |
DE: desviación estándar; FSH: hormona foliculoestimulante.
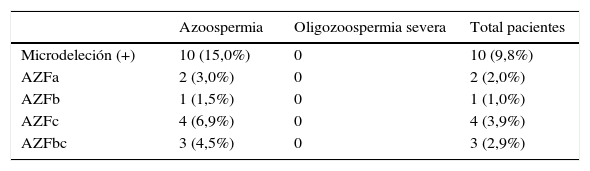
Al realizar la búsqueda de microdeleciones del cromosomaY se determinó que el 9,8% de estos pacientes con infertilidad idiopática asociada a alteraciones severas del seminograma presentaban una mutación AZF. Del total de pacientes con azoospermia, el 15% poseían estudio positivo para microdeleciones del cromosomaY.
La mutación más prevalente fue AZFc, afectando al 3,9% de los pacientes, seguida por AZFbc, con el 2,9%; AZFa, con el 2,0%, y AZFb, con el 1,0%. Todas las mutaciones se presentaron en pacientes con azoospermia. Es decir, en este estudio los pacientes oligozoospérmicos fueron negativos para microdeleciones del cromosomaY. La distribución de los diferentes patrones de microdeleciones se presenta en la tabla 2.
Prevalencia de microdeleciones del cromosoma Y en grupos de pacientes según alteración seminal
| Azoospermia | Oligozoospermia severa | Total pacientes | |
|---|---|---|---|
| Microdeleción (+) | 10 (15,0%) | 0 | 10 (9,8%) |
| AZFa | 2 (3,0%) | 0 | 2 (2,0%) |
| AZFb | 1 (1,5%) | 0 | 1 (1,0%) |
| AZFc | 4 (6,9%) | 0 | 4 (3,9%) |
| AZFbc | 3 (4,5%) | 0 | 3 (2,9%) |
Resultados presentados en número de pacientes afectados (%).
El 53% de los pacientes no presentaban antecedentes relevantes en la anamnesis. Cabe destacar que un paciente con mutación AZFbc tenía el antecedente de criptorquidia en la infancia (33,3% del total de pacientes con mutación AZFbc). Solo un paciente presentó un cariotipo alterado (47XXY), realizándose el diagnóstico de síndrome de Klinefelter. Los pacientes que presentaron microdeleciones no eran portadores de aneuploidías.
DiscusiónLa prevalencia de microdeleciones encontrada es similar a la presentada en estudios internacionales1,2. Un estudio de prevalencia de un haplotipo amerindio en población chilena, publicado en 2013 por Lardone et al.18, describe una prevalencia discretamente mayor (11,1%) de microdeleciones del cromosomaY en sujetos con azoospermia y oligozoospermia severa. La distribución del tipo de mutación también se asemeja a la que se encuentra en la literatura internacional, siendo AZFc la deleción más frecuente en pacientes con infertilidad idiopática2.
Esta prevalencia es semejante a la publicada en otros grupos19-21. Por ejemplo, en un grupo de pacientes candidatos a ICSI, Oliva et al.19 describieron una prevalencia del 16% de microdeleciones del cromosomaY en pacientes azoospérmicos y del 1,5% en oligozoospérmicos. En el estudio de Martínez et al.20 la proporción de pacientes azoospérmicos con mutaciones fue del 14%. En un estudio de 94 pacientes infértiles originarios de Brasil no se observaron microdelecionesYq en los pacientes con oligozoospermia severa22.
Parece que la frecuencia de mutaciones puede depender del pool génico y del linaje de una población determinada18. Diversos trabajos que estudian haplotipos específicos de distintas poblaciones han tratado de determinar esta relación. Lo Giacco et al.21 compararon la frecuencia de mutaciones de AZF en población infértil española y no española. En pacientes con infertilidad idiopática portadores del haplotipo hgr (específico para población originaria de España) se observó una frecuencia de deleciones significativamente menor, comparado con hombres infértiles de origen no español (2,7% vs 7,9%; p<0,05). Así mismo, Lardone et al.18 compararon la prevalencia de mutaciones en AZF y la frecuencia del haplotipo amerindio Q1a3a en pacientes chilenos fértiles e infértiles. Se observó una proporción significativamente mayor del haplogrupo amerindio Q1a3a en pacientes infértiles con microdeleciones comparado con pacientes con falla en la espermatogénesis sin microdeleciones y pacientes control (p<0,01 y p<0,05, respectivamente).
Estos resultados apoyan las recomendaciones de diferentes sociedades científicas en relación a solicitar el estudio con cariotipo y microdeleción del cromosomaY a todo paciente que consulta por infertilidad idiopática con alteraciones cuantitativas severas en los parámetros seminales1,23. Conocer el status genético del paciente tendrá consecuencias importantes en la selección del tipo de terapia posterior y la necesidad de consejo genético a la pareja.
El locus AZF del brazo largo del cromosomaY contiene, según los estudios disponibles hasta la fecha, 14 genes codificadores para proteínas y 2 pseudogenes. Los patrones de deleción existentes —AZFa, P5-proximal P1 (AZFb), P5-distalP1 (AZFbc), P4-distal P1 (AZFbc), b2/b4 (AZFc) y AZFc parcial— son producto de la recombinación intra-cromosomal entre secuencias homólogas2,24.
El locus AZFa se ubica la región proximal de Yq11. Contiene 2 genes funcionales: USP9Y y DBY. El primero tiene un rol fundamental en la eficiencia de la espermatogénesis, el segundo está involucrado en las fases premeióticas de las espermatogonias25. Las mutaciones de AZFa son de baja frecuencia. La deleción completa remueve aproximadamente 792kilobases (kb), que incluyen los 2 genes candidatos antes mencionados2,26. La deleción de este segmento genético bloquea la producción y la maduración de las células germinales en los túbulos seminíferos. El fenotipo que se evidencia en la biopsia testicular es el síndrome de Sertoli solo (ausencia de células germinales). Es imposible rescatar gametos viables para su utilización en fertilización in vitro (FIV) e ICSI27.
AZFb se localiza en la región media de Yq11. Se superpone con la región AZFc en 1,5megabases28. Se han identificado diversos genes candidatos en esta región, tanto de copia única (EIF1AY, RPS4Y2, CYORF15A, CYORF15B y SMCY) como de copias múltiples (XKRY, HSFY, RBMY1A1, PRY, CDY, BPY2 y DAZ). Todas estas familias génicas poseen un patrón de expresión específico para el tejido testicular29,30. La detección de esta mutación tiene un valor diagnóstico y pronóstico. El fenotipo observado en las biopsias testiculares de estos pacientes es la detención de la maduración en fases premeióticas. Los pacientes se presentan con azoospermia no obstructiva y, al igual que con AZFa, es imposible rescatar gametos viables con las técnicas de extracción de espermatozoides desde testículo (TESE)2,31.
El locus AZFc se ha mapeado en la zona distal del brazo largo del cromosomaY. Su secuencia comprende aproximadamente 4,5mb. Contiene 21 genes candidatos32. Los genes más importantes en esta secuencia son: 4 copias de DAZ, 3 copias de BPY2 y 2 copias de CDY1. Todos los miembros de la familia de genes DAZ codifican para proteínas involucradas en la translocación de ARN mensajero, siendo vitales para la espermatogénesis32-34. Se han descrito, además, deleciones parciales de AZFc producto de la recombinación de los sub-amplicones dentro de la región. Dentro de ellas tienen relevancia clínica para infertilidad: gr/gr, b1/b3 y b2/b3; la correlación genotipo-fenotipo de estas alteraciones no es muy clara hasta la fecha2-35.
La correlación entre genotipo gr/gr y fenotipo pudiera depender en parte del pool génico de una población determinada. Los efectos en la espermatogénesis parecen ser diferentes según los antecedentes genéticos de la población36. En un estudio español se comparó la frecuencia de la deleción parcial de AZFc gr/gr entre pacientes infértiles candidatos a ICSI y pacientes control. Las deleciones gr/gr fueron observadas en 11 (5,07%) de 217 pacientes oligozoospérmicos y en 1 (1,52%) de 66 pacientes azoospérmicos; no se observó la mutación en ninguno de los 232 controles (p=0,02)36. Sin embargo, en un estudio que comparó 218 hombres con falla en la espermatogénesis con 182 controles, todos pacientes de origen chileno (confirmados por la presencia del haplotipo amerindio Q1a3a), se observó la presencia de la deleción en 6 y 4 pacientes, respectivamente. Estas diferencias no fueron significativas18.
Las mutaciones en esta región representan el tipo más frecuente de deleción observado en pacientes azoospérmicos y oligozoospérmicos severos. El fenotipo resultante es diverso, desde azoospermia hasta oligozoospermia moderada a severa2,37,38.
Las variaciones dependen de 4 elementos:
- 1.
Pool genético del paciente.
- 2.
Exposición a factores ambientales.
- 3.
Tamaño de la deleción.
- 4.
Progresión del daño de la espermatogénesis en el tiempo.
En estos pacientes es posible rescatar gametos viables a través de TESE, teniendo en cuenta que la mutación será transmitida y la descendencia masculina poseerá la anomalía genética con la alteración de la fertilidad asociada a esta2,38.
Por último, las deleciones que ocurren en la zona de traslape entre AZFb y AZFc se denominan deleciones AZFbc. Se consideran una clase significativa de deleciones recurrentes del cromosomaY, representando la deleción más larga del genoma humano2,28. El fenotipo resultante provoca falla en la espermatogénesis e imposibilidad de extraer espermatozoides viables para su utilización en FIV/ICSI27. En este estudio se observa que un tercio de los pacientes con esta mutación eran portadores de criptorquidia, pudiéndose inferir que tanto las alteraciones del desarrollo y migración testicular, como la falla en la espermatogénesis, pueden tener un origen común y encontrarse dentro del espectro de fenotipos secundarios a la deleción de la región AZFbc.
En el presente trabajo, ningún paciente con oligozoospermia severa era portador de microdelecionesYq. Esto se explica porque la mutación es poco frecuente en pacientes no azoospérmicos, sobre todo en aquellos con una concentración >2millones/ml, y porque nuestra muestra tiene un número limitado de participantes21. Al aumentar el número de pacientes es probable que la prevalencia de esta mutación se acerque al 1-2% publicado en otras series19.
En este estudio se confirma que la frecuencia de microdeleciones del cromosomaY en población chilena es semejante a la descrita en población caucásica europea y norteamericana presentada por diferentes grupos. Esta alta prevalencia en individuos con alteraciones severas de los parámetros seminales hace necesario incluir este examen dentro de la evaluación estándar de pacientes con azoospermia y oligozoospermia severa. Solo de esta forma se podrá eximir a los pacientes de eventuales procedimientos largos y costosos que no lograrán obtener un embarazo exitoso, en el caso de AZFa y AZFb, y se podrá realizar consejería genética antes de continuar con TRA de alta complejidad que transmitirán las alteraciones de la fertilidad a la descendencia, en el caso de AZFc.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.