El síndrome de los cilios inmóviles es una enfermedad autosómica recesiva que se caracteriza por un defecto en la ultraestructura de los cilios: los brazos de dineína son anómalos o están ausentes. Los varones que presentan además situs inversus y bronquiestasia padecen el llamado síndrome de Kartagener.
En este trabajo se presenta el caso de un varón con síndrome de Kartagener que se realizó 4 ciclos de ICSI (inyección intracitoplasmática de espermatozoides) con baja tasa de fecundación y sin conseguir gestación, utilizando espermatozoides de eyaculado y HOS test, espermatozoides de eyaculado sin HOS test y espermatozoides de testículo.
Tras la realización de la biopsia de testículo, se llevó a cabo el estudio anatomopatológico y se analizaron los espermatozoides por microscopia electrónica, confirmándose la patología y la severidad del defecto espermático.
Tras los 4 ciclos de ICSI la pareja decidió utilizar semen de donante, quedando gestante tras el primer ciclo de inseminación con semen de banco.
Este estudio demuestra la utilidad y necesidad de realizar un estudio ultraestructural de los espermatozoides en este tipo de pacientes, lo que nos puede ayudar a conocer la severidad del defecto y la probabilidad de conseguir una gestación.
Repeated ICSI cycles without achieving pregnancy in a patient with Kartagener syndrome
The immotile cilia syndrome is an autosomal recessive disease characterized by defective cilial ultraustructure in ciliated cells. Men with simultaneous presence of situs inversus and bronchiectasis are referred to as having Kartagener´s syndrome.
The objective of this report is to describe a case of a male with Kartagener´s syndrome with four failures of pregnancy and reduced fertilization rates using intracytoplasmic sperm injection (ICSI) with ejaculated immotile spermatozoa using hypo-osmotic swelling test (HOS) test, without HOS test and with testicular sperm.
Transmission electron microscopy revealed the severity of defects in sperm tail ultra structure. After four ICSI cycles the couple decided to use donor spermatozoa, and will get pregnant after one donor insemination cycle.
Detailed electron microscopy of the spermatozoa should be done to know the type of ultrastructural defect, and could be useful to know the success probability.
El síndrome de los cilios inmóviles es una enfermedad autosómica recesiva que se caracteriza por un defecto en la ultraestructura de los cilios: los brazos de dineína son anómalos o están ausentes. La dineína es el motor proteico, fijada a los microtúbulos, que puede transformar la energía química (ATP) en energía mecánica para conseguir la movilidad espermática. Se estima una incidencia de esta anomalía en 1 de cada 20.000 recién nacidos1.
Los varones que presentan además situs inversus y bronquiestasia padecen el llamado síndrome de Kartagener2. El situs inversus está presente en el 50% de los pacientes con síndrome de cilios inmóviles. Ya que los cilios están formados por 100 polipéptidos diferentes, hay un amplio espectro de heterogeneidad genética3. Se conoce que los genes DNAH5 y DNA11 en los cromosomas 5 y 9, respectivamente, causan la discinesia ciliar. Ambos genes codifican para la dineína4 y su mutación provoca la ausencia completa de brazos de dineína.
Ya que los pacientes que presentan el síndrome de Kartagener poseen todos los espermatozoides inmóviles, no tienen posibilidad de conseguir una gestación de forma espontánea, por lo que el único tratamiento posible es la microinyección espermática, aunque las tasas de fecundación publicadas hasta el momento han sido bajas5,6. Sin embargo, se han publicado casos en los que se han conseguido gestaciones con espermatozoides de estos varones, bien del eyaculado7 o del testículo8.
Este estudio describe el caso de un paciente con síndrome de Kartagener, que después de 4 ciclos de ICSI (inyección intracitoplasmática de espermatozoides), 2 de ellos con espermatozoides de testículo, no consiguió gestación y, como posteriormente se comprobó, la imposibilidad de conseguirla.
CASO CLÍNICOVarón de 30 años de edad, que acude en el año 2003 a la Unidad de Reproducción de la Clínica Tambre con el diagnóstico previo de síndrome de Kartagener, basado en los estudios médicos que incluyen infecciones recurrentes del oído medio, sinusitis, bronquiectasias y situs inversus.
Su mujer, de 27 años de edad, no había estado nunca previamente embarazada.
La pareja acudió con la información previa revisada de la literatura científica en la cual se había descrito el embarazo y nacimiento de un niño sano de un varón con el mismo síndrome.
Se realizaron 3 análisis de semen al varón que mostraron repetidamente un 100% de astenozoospermia, con un volumen medio de 3 ml de eyaculado, una concentración de 1,2 × 106 espermatozoides/ml y un 2% de espermatozoides morfológicamente normales.
También se realizó un test de integridad nuclear con naranja de acridina, que reveló un 43% de espermatozoides vivos (con el ADN intacto, o con fluorescencia verde).
El estudio hormonal realizado al varón mostró que la hormona foliculostimulante (FSH), la hormona luteinizante (LH) y la testosterona eran normales, así como la exploración física y el cariotipo (46 XY).
Se decidió entonces realizar un ciclo de ICSI tras el estudio ginecológico de la mujer, que demostró estar dentro de la normalidad.
Primer ciclo de ICSI (septiembre de 2003)Después de estimulación ovárica utilizando para la frenación hipofisaria antagonistas de la GnRH (Cetrotide, Serono), en asociación con FSH recombinante (FSHr) (Gonal, Serono), se recuperaron 9 ovocitos, todos ellos metafase II.
El estudio del semen en este ciclo confirmó la astenozoospermia total, y se utilizó el HOS test para identificar espermatozoides viables para ICSI. Para ello, el medio de lavado del semen (Sperm Prep, MediCult, Dinamarca) se diluía con igual volumen de agua destilada (Sigma), para identificar espermatozoides con el flagelo enrollado (HOS test positivo).
En la placa de ICSI se colocó una gota con el medio del test HOS al lado de la gota de polivinil pirrolidona, y las gotas con los ovocitos. Se colocó un volumen de 3 µl de la muestra de semen lavada en la gota de la solución hipoosmótica para seleccionar los espermatozoides con el flagelo enrollado (total o parcialmente) y que considerábamos viables.
Este procedimiento fue muy costoso y poco útil, porque la mayoría de los espermatozoides, como se había demostrado en los análisis de semen previos, presentaba múltiples anomalías, muchas de ellas de flagelo, lo que dificultó enormemente la selección de espermatozoides con el flagelo enrollado.
Tras la selección de los espermatozoides para ICSI, se colocaron los ovocitos en las gotas correspondientes y se microinyectaron. Después de 18 h se comprobó una fecundación normal en 2 de los ovocitos. A las 24 h no se observó división embrionaria, por lo que no se realizó transferencia.
Segundo ciclo (febrero de 2004)Después de utilizar un protocolo de estimulación ovárica similar al del primer ciclo, se obtuvieron 8 ovocitos, todos ellos metafase II. En esta ocasión se recuperaron espermatozoides del testículo para realizar el ICSI. La recuperación espermática del testículo (TESA) se realizó el día de la punción folicular, en ambos testículos, obteniéndose muestra de tejido testicular con espermatozoides inmóviles en todos los fragmentos analizados.
Tras procesamiento de las muestras de biopsia de testículo, se microinyectaron los 8 ovocitos con espermatozoides inmóviles, sin realizar el HOS test.
A las 18 h se observó fecundación normal en 3 ovocitos que se dividieron a las 24 h. Se realizó la transferencia de 2 embriones en D+2 (2 células grado 1 y 4 células grado 1), y se congeló 1 embrión.
Se realizó un test de beta hCG a los 14 días de realizarse la transferencia, siendo positivo (140 UI/ml), pero fue descendiendo progresivamente hasta hacerse indetectable.
Un par de meses después se transfirió el embrión congelado, que sobrevivió, pero tampoco se consiguió embarazo.
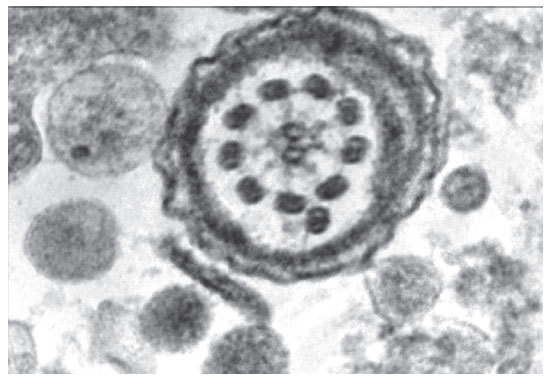
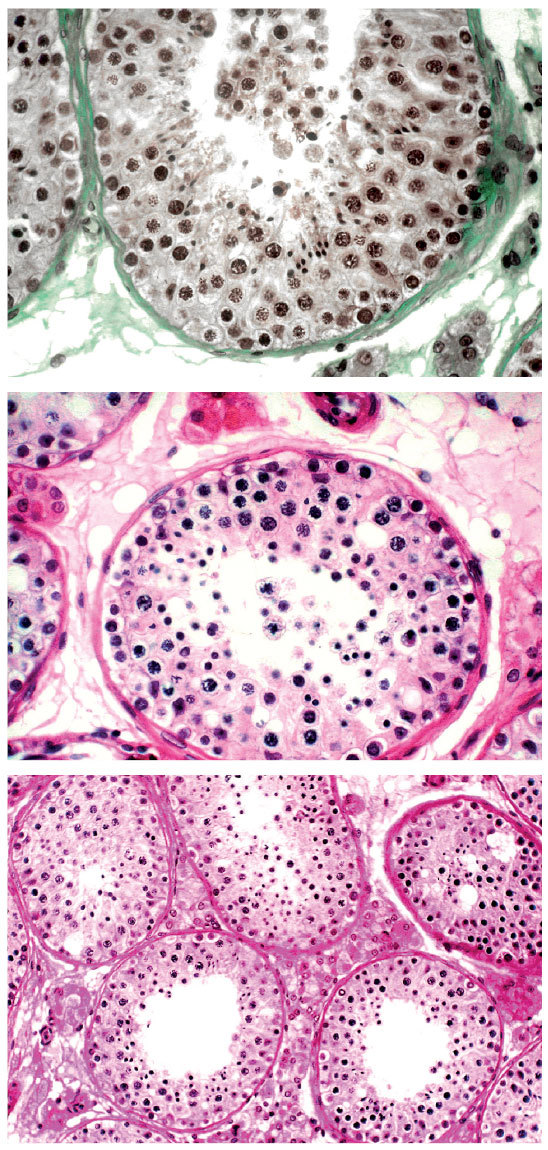
Tras la realización de la biopsia de testículo se envió muestra de tejido espermático para su estudio anatomopatológico y realización de microscopia electrónica del flagelo espermático. El estudio confirmó la ausencia de brazos de dineína (figs. 1 y 2), así como la presencia de un par supernumerario de microtúbulos.
Figura 1. Microscopia electrónica del flagelo de un espermatozoide procedente de biopsia de testículo, donde se observa la ausencia de brazos de dineína y un par de microtúbulos supernumerarios.
Figura 2. Diversos cortes histológicos de la muestra de parénquima testicular donde se confirma la ausencia de brazos de dineína y se comprueba un diámetro tubular de 206 µ; espermatogonias 20,1; espermatocitos de primer orden 29,3; espermátidas jóvenes 24 (n > 30); espermátidas adultas 28; ectasia tubular ligera, y células de Leydig sin alteraciones.Tercer ciclo (abril de 2004)
Se realizó un ciclo de estimulación ovárica similar a los anteriores, recuperándose 9 ovocitos metafase II. Se microinyectaron 5 ovocitos con espermatozoides de eyaculado y 4 con espermatozoides de biopsia de testículo, y se observó fecundación en 1 de ellos (microinyectado con espermatozoides de eyaculado), que se dividió y transfirió al día siguiente (4 células grado 3), sin conseguirse gestación.
Se aconsejó a la pareja la no realización de más intentos de ICSI, pero decidieron realizar un último ciclo con espermatozoides de testículo, en junio de 2004. En este ciclo, con estimulación ovárica similar a los anteriores, se obtuvieron 4 ovocitos metafase II, que se microinyectaron con espermatozoides de biopsia de testículo, no consiguiéndose la fecundación en ninguno de ellos.
Posteriormente, la pareja resolvió utilizar espermatozoides de banco de semen, efectuándose un ciclo de inseminación con semen de donante (IAD). Tras un primer ciclo, la mujer quedó gestante, dando a luz a las 40 semanas un varón sano.
Dos años más tarde volvieron a realizar otro ciclo de IAD consiguiéndose asimismo una gestación tras 3 intentos, que actualmente está en curso.
DISCUSIÓNEn 1976, Afzelius2 describió el síndrome de los cilios inmóviles como una alteración genética que se caracteriza por la presencia de espermatozoides inmóviles con buena morfología y viabilidad. Al principio se consideró esta anomalía como una forma de infertilidad masculina intratable, ya que los espermatozoides inmóviles eran incapaces de fecundar un ovocito, pero más adelante, la aparición del ICSI hizo posible que estos pacientes pudieran tener hijos genéticamente propios.
La primera publicación de un embarazo en un paciente con síndrome de Kartagener data del año 1993, obteniéndose tras inyección de un espermatozoide subzona9.
Olmedo et al10, en 1997, fueron los primeros en publicar una gestación con ICSI utilizando espermatozoides de eyaculado de un varón con una variante mosaico del síndrome de cilios inmóviles. Sin embargo, en 1999, Abu-Musa et al11 informaron de un caso de ausencia total de fecundación después de ICSI en un paciente con el síndrome de Kartagener.
Desde entonces se han publicado varios trabajos, la mayoría casos clínicos, en los que se describen gestaciones conseguidas en pacientes con esta patología, introduciendo cambios o mejoras en las técnicas empleadas.
Una de las estrategias más comentada es la utilización del HOS test, empleado inicialmente en pacientes con ausencia total de espermatozoides móviles, independientemente de su origen (eyaculado, epidídimo o testículo)5.
El HOS test es un método simple, barato y eficaz, sin que conlleve ningún tipo de toxicidad, ya que emplea sustancias fisiológicas. Este test identifica espermatozoides con la funcionalidad de la membrana plasmática intacta, sin dañar esos mismos espermatozoides que se utilizarán para ICSI en los casos en que no hayan espermatozoides móviles.
En 2003, Buckett12 demostró que el HOS test podría identificar de forma fiable espermatozoides inmóviles viables con un valor predictivo positivo de cerca del 80% en muestras con astenozoospermia total.
Un año después, en el 2004, Peeraer7 publicó un caso clínico de un paciente con síndrome de cilios inmóviles que consiguió una gestación y un niño sano utilizando el HOS test.
En nuestro caso, la utilización del HOS test no ha sido de ninguna utilidad, dado que muchos de los espermatozoides encontrados en el eyaculado, tras procesar la muestra, presentaban el flagelo enrollado antes de someter la muestra a la solución hiposmóstica. Por lo tanto, la selección espermática tras el HOS test no resultó fiable, como lo demostró el hecho del resultado final del ciclo.
Posteriormente, se emplearon espermatozoides de testículo, ya que también hay publicaciones previas de gestaciones en este tipo de casos. La más reciente es la de Kaushal y Baxi8, que data de 2007, y con la que se consiguió una gestación gemelar y parto de 2 niños sanos que fueron seguidos hasta los 2 años y no presentaron el síndrome.
Hay autores que justifican la utilización de espermatozoides de testículo con una mayor capacidad de fecundación, debido a que el tránsito de los espermatozoides por el epidídimo aumenta el riesgo de su degeneración5.
En el presente caso, el primer ciclo de ICSI realizado con HOS test resultó en una baja tasa de fecundación sin división embrionaria. En un primer momento, se pensó que la causa de tales resultados se debía a una incorrecta selección de espermatozoides viables, a pesar de la utilización del test de endósmosis.
Sin embargo, al efectuar la biopsia de testículo y realizar el estudio anatomopatológico, se comprobó no solamente la ausencia de brazos de dineína sino la pesencia de un par suplementario de microtúbulos, lo que podría explicar los bajos resultados, incluso utilizando espermatozoides de testículo.
En conclusión, a pesar de que el ICSI con espermatozoides de testículo puede ser una técnica prometedora para varones con espermatozoides inmóviles, un estudio detallado de microscopia electrónica de los espermatozoides al comienzo del tratamiento puede ser revelador para conocer defectos ultraestructurales que nos orientes sobre las posibilidades de gestación en este tipo de alteraciones.
Correspondencia:
Dra. R. Núñez Calonge.
Unidad de Reproducción. Clínica Tambre.
Tambre, 8. 28002 Madrid. España.
Correo electrónico: rocio@clinicatambre.com