A azoospermia representa cerca de 10% dos casos de infertilidade masculina1. A azoospermia obstrutiva (AO) é caracterizada pela oclusão ou ausência de partes do tracto reprodutivo, impedindo que as células espermáticas entrem no plasma seminal antes da ejaculação. A azoospermia não obstrutiva (ANO) é causada por uma falha na produção de espermatozóides, de tal modo que o ejaculado não contém espermatozóides.
Inicialmente, nos casos de AO irreparável ou ausência bilateral congénita dos canais deferentes (ABCD) realizava-se a fecundação in vitro com espermatozóides aspirados do epidídimo2-4, mas os resultados eram desanimadores e imprevisíveis. Desde a introdução da microinjecção intracitoplasmática (ICSI) com espermatozóides do epidídimo5 ou do testículo6-8, esta técnica tornou-se um procedimento de rotina na AO. Tem sido reportada taxas de fecundação, implantação e gravidez elevadas1,9-16, assim como uma taxa de obtenção de espermatozóides em quase 100% dos casos de AO17.
A realização de ciclos ICSI com espermatozóides colhidos do testículo é igualmente o método de eleição para o tratamento de infertilidade masculina por ANO18, remontando os primeiros nascimentos à década de 9019. Na população de pacientes com ANO a probabilidade de se encontrarem espermatozóides é de 48-68% num grupo de pacientes não selecciona-17,20-22, sugerindo focos de espermatogénese.Pode ser antecipado que nos casos de ANO, tanto a quantidade como a qualidade dos espermatozóides recolhidos seja inferior à dos casos de AO. Os dados da literatura não são concordantes e há estudos que mostraram uma redução significativa nas taxas de fecundação e gravidez na ANO15,16,23; estudos que mostraram uma diminuição na taxa de fecundação, mas não na taxa de gravidez1,14; e outros que obtiveram taxas de fecundação e gravidez aceitáveis 9,10,13,21,24-29.
A criopreservação de amostras de tecido testicular oferece a possibilidade de se evitar a repetição de colheitas cirúrgicas, contornando as alterações da vascularização, calcificações e outros danos possivelmente permanentes no testículo30,31, e torna-se particularmente importante nos casos de testículos reduzidos, onde biopsias múltiplas podem representar uma perda significativa de massa testicular.
Foram reportados resultados comparáveis em termos de fecundação, qualidade embrionária, taxas de implantação e de gravidez usando espermatozóides do testículo frescos e descongelados para pacientes comAO 25,29,32-38. Os primeiros casos de relatos de uso de espermatozóides testiculares congelados e posteriormente descongelados em homens com ANO eram casos clínicos39,40 ou estavam incluídos em grupos mistos de uma maioria de AO e alguns ANO25,28,41-43. Um problema adicional destes primeiros relatos era a definição de falha testicular, que não estava muitas vezes claramente definida e/ou nem sempre baseada na histologia testicular. Mesmo assim, têm sido descritos resultados aceitáveis de ICSI com espermatozóides testiculares descongelados em pacientes com ANO27,33,44-47.
Ao contrário da AO onde podem ser facilmente usados espermatozóides viáveis das amostras descongeladas, a pior qualidade do tecido testicular na ANO não permite a criopreservação e posterior ICSI em todos os casos. Como tem sido demostrado para os espermatozóides do ejaculado, também ocorre uma diminuição significativa na mobilidade e vitalidade dos espermatozóides do testículo, após descongelação48. Isto implica que casos com um número extremamente baixo de espermatozóides recolhidos possam não ser candidatos à criopreservação. A biópsia diagnóstica prévia com criopreservação pode ser considerada uma opção controversa para estes casos. Há de facto uma elevada probabilidade de não se encontrarem espermatozóides na biópsia diagnóstica devido à sua ausência total ou à recolha limitada de tecido e/ou esforços de procura. De modo a contornar o risco do material descongelado ser inadequado para a ICSI após descongelação, alguns centros definem limites de qualidade para a criopreservação de espermatozóides testiculares e noutros os casais apenas entram em-ciclo se tiverem qualidade (motilidade) suficiente numa fracção testicular previamente descongelada. Neste sentido, a população de ANO pode diferir grandemente entre centros, o que pode justificar os diferentes resultados publicados.
Na nossa unidade, historicamente, a opção de eleição para os casais com ANO era o uso de espermatozóides do testículo colhidos a fresco, mas actualmente também é oferecida a possibilidade de se realizar biópsia diagnóstica seguida de criopreservação. Os casais são cuidadosamente esclarecidos sobre os prós e contras de ambas as estratégias.
O objectivo deste estudo retrospectivo foi analisar a eficiência do uso de espermatozóides testiculares mediante a etiologia da azoospermia e o efeito da criopreservação.
MATERIAL E MÉTODOSPopulação em estudoEste estudo retrospectivo incluiu 136 ciclos de ICSI realizados em 81 casais com factor masculino isolado (azoospermia) com espermatozóides colhidos do testículo por biópsia extractiva (TESE). A azoospermia foi confirmada em pelo menos duas amostras de esperma após centrifugação a 1800g e exploração de todo o pellet.
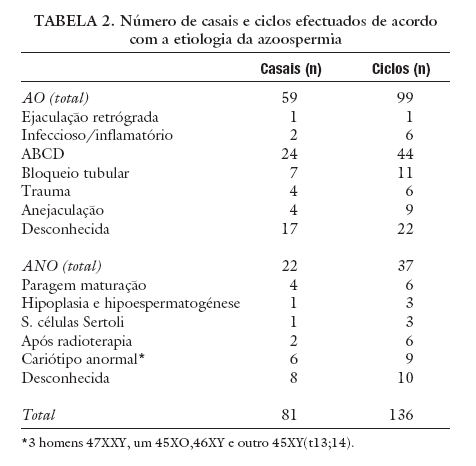
A etiologia da azoospermia foi classificada pela equipa de Andrologia como AO em 99 ciclos (59 casais) e ANO em 37 ciclos (22 casais) (tabela 1), com base na história clínica, exame físico, doseamento hormonal (FSH, LH e testosterona), análises histológicas, ultra-sonografia, análises repetidas ao sémen e dados cirúrgicos. Sempre que indicado foi realizada ecografia transrectal, análise do cariótipo, pesquisa de microdelecções no braço longo do cromossoma Y e análise das mutações mais frequentes do gene da fibrose cística.
TABELA 1. Características da população em estudo
A etiologia da AO incluiu 1 ciclo de ejaculação retrógrada, 6 de processo inflamatório/infeccioso, 44 de ausência bilateral de canais deferentes, 11 de bloqueio tubular, 6 após trauma, 9 de anejaculação e 22 de causa desconhecida, enquanto que a etiologia da ANO incluiu 6 casos de paragem de maturação completa, 3 de hipoplasia e/ou hipoespermatogénese, 3 de síndroma células de Sertoli, 6 após radioterapia, 9 de cariótipo anormal e 10 de causa desconhecida (tabela 2).
TABELA 2. Número de casais e ciclos efectuados de acordo com a etiologia da azoospermia
Oitenta e seis ciclos foram realizados com espermatozóides frescos (58 ciclos de AO e 28 ciclos de ANO), enquanto que os restantes 50 ciclos foram realizados com espermatozóides previamente criopreservados (41 ciclos de AO e 9 ciclos de ANO).
Sempre que houve necessidade de repetir a biópsia no mesmo testículo, houve pelo menos um tempo mínimo de espera de seis meses, conforme defendido por Amer et al49, de modo a evitar danos intratesticulares permanentes e obter colheita positiva.
Todos os casais foram aconselhados sobre os procedimentos e deram consentimento informado para os seus tratamentos.
Estimulação ovárica e punção folicular (PF)A colheita dos ovócitos foi realizada após dessensibilização pituitária através de protocolo longo (n = 104) com agonistas da GnRH (Suprefact®, Hoeport) ou protocolo curto (n = 32) com antagonistas da GnRH (Cetrotide®, Serono ou Orgalutran®, Organon), seguida de estimulação ovárica com gonadotrofinas (Gonal F®, Serono ou Puregon®, Organon). Quando o folículo dominante atingiu um diâmetro igual ou superior a 18mm, com uma concentração de estradiol de 200-300pg/ml por folículo maduro, foi administrada uma dose de 10.000 IU/L de hCG (Pregnyl®, Organon) para induzir a maturação final do folícu-lo/ovócito. A PF foi realizada sob controlo ecográfico vaginal 34-36h após a administração da hCG.
Biópsia testicular e ICSIA polpa testicular foi colhida por TESE sob anestesia local conseguida com 5-6ml de mistura de 1:1 1% lidocaína (xilocaína 2% sem adrenalina, Braun) e 0,5% bupivacaína (marcaína 0,5% sem adrenalina, Braun) em regime de ambulatório.
Após imobilização do testículo, efectuou-se uma incisão de cerca de 1cm numa região avascularizada do escroto, atravessando a túnica vaginalis e túnica albugínea. Uma porção da polpa extrudida foi lavada em meio Sperm Preparation Medium® (SPM) (Medicult) e colocada numa placa de Petri contendo 1-3 ml de SPM, onde foi fragmentada e macerada com lâminas de bisturi. Pequenos fragmentos de polpa foram sendo colhidos em diferentes áreas do mesmo testículo e/ou no contralateral até se encontrarem espermatozóides. No máximo foram colhidos 6 fragmentos do mesmo testículo.
A pesquisa de espermatozóides foi efectuada em microscópio invertido (Diaphot 330, Nikon) equipado com ópticas de Hooffman e platina aquecida na ampliação de 200µ. Em todos os casos foram encontrados espermatozóides móveis. A suspensão foi lavada com 1-2 ml de SPM® e incubada em tubo cónico a 37 °C e 5% CO2. Imediatamente antes da ICSI, o pellet foi centrifugado a 200 g durante 10 min, após o que foi ressuspendido em 50-100 µl de SPM® e incubado a 37 °C e 5% CO2, durante pelo menos 30 min. A identificação e imobilização dos espermatozóides foi realizada em microgotas sobre parafina líquida (Medicult).
A ICSI foi realizada mediante protocolo convencional50. Após a remoção das células do cumulus e corona, foi efectuada uma avaliação dos ovócitos de modo a serem apenas injectados os ovócitos em metafase II. A fecundação foi avaliada 16-18h após a ICSI e confirmada pela presença de dois pro-núcleos (PN) distintos.
Criopreservação e descongelação da polpa testicularPara a realização da criopreservação a suspensão testicular foi diluída em igual volume de Sperm Freezing Medium (Medicult), colocada em tubos/palhetas durante 10 min e em vapores de azoto líquido (N2L) durante 30 min, antes de ser submergida e armazenada em N2L. A descongelação foi efectuada colocando o tubo/palheta sobre água corrente durante 5 min e o sedimento foi preparado como acima descrito.
Cultura de embriões, transferência (TE) e detecção da gravidezA qualidade embrionária foi avaliada diariamente até ao dia da TE, mediante a morfologia dos PN, tamanho, número e forma dos blastómeros, grau de fragmentação, aspecto da zona pelúcida e espaço perivitelino. Foram transferidos 2-3 embriões entre os dias 2-5 após PF, consoante o número/qualidade dos embriões, ida-de da mulher e o número de ciclos anteriores. Foi administrada progesterona intravaginal para suporte luteínico (3 µ200 mg/dia; Utrogestan®, Jaba) a partir do dia da PF até à 12.a semana de gestação, se gravidez positiva.
A detecção da gravidez foi efectuada por doseamento de µ-hCG plasmática ao 16.o dia após PF. A gravidez clínica foi confirmada pela observação de saco gestacional à 6.a semana por ultra-sonografia. A taxa de implantação foi calculada pela razão entre o número de sacos observados e o número de embriões transferidos.
Análise de resultadosFoi efectuada análise estatística usando o teste de t-Student e µ2, sempre que apropriado. As diferenças foram consideradas significativas para p < 0,05.
RESULTADOSEm todos os ciclos foi encontrado um número suficiente de espermatozóides móveis para injectar todos os ovócitos maduros.
Etiologia da azoospermiaNo total foram realizados 99 ciclos de ICSI-TESE de AO e 37 ciclos de ANO (tabela 3). A dose de gonadotrofinas e dias de estimulação não foi significativa-mente diferente entre os dois grupos (tabela 3). Ape-sar de ter sido colhido um número semelhante de ovócitos (9,6 ± 5,0 versus 9,4 ± 6,6), o número de ovócitos inseminados e fecundados foi significativa-mente superior na AO (7,5 ± 4,1 versus 5,9 ± 4,2 e 3,9 ± 2,6 versus 2,8 ± 2,3) do que na ANO (p < 0,001). A taxa de fecundação normal (51,5% versus 43,4%), foi significativamente superior na AO (p < 0,05). O número de ovócitos transferidos foi semelhante (1,7 ± 1,0 versus 1,7 ± 0,9) entre os dois grupos, mas as taxas de implantação (18,7% versus 10,0%) e gravidez clínica por transferência (29,9% versus 16,1%) foram superiores na AO, embora sem significado estatístico.
TABELA 3. Resultados dos ciclos ICSI-TESE mediante a etiologia da azoospermia
Efeito da criopreservaçãoO sucesso da ICSI usando espermatozóides testiculares colhidos a fresco ou previamente criopreservados nos casos de AO foi comparado e é apresentado na tabela 4. O número de ovócitos colhidos e inseminados foi significativamente inferior no grupo dos ciclos realizados com espermatozóides colhidos a fresco (p < 0,001 e p < 0,01, respectivamente). No entanto, a taxa de fecundação foi semelhante nos ciclos realizados com espermatozóides colhidos a fresco e descongelados (52,3% e 50,6%, respectivamente). A taxa de implantação e gravidez clínica foi superior com espermatozóides descongelados, embora sem significado estatístico.
TABELA 4. Resultados dos ciclos ICSI-TESE mediante efeito da criopreservação na AO
No grupo da ANO o efeito da criopreservação dos espermatozóides testiculares não se fez sentir na taxa de fecundação, implantação ou gravidez clínica (tabela 5), uma vez que apesar dos resultados terem sido melhores no grupo dos espermatozóides colhidos a fresco, tal diferença não se traduziu em significado estatístico.
TABELA 5. Resultados dos ciclos ICSI-TESE mediante efeito da criopreservação na ANO
DISCUSSÃOVários factores influenciam o sucesso da ICSI em pacientes com azoospermia, tais como a idade dos parceiros, a histologia testicular, origem dos espermatozóides, etiologia da azoospermia, assim como o facto dos espermatozóides serem frescos ou descongelados. Parâmetros associados à mulher também têm um contributo significativo, tais como a idade e reserva ovárica.
A etiologia da azoospermia subjacente pode influenciar a viabilidade dos espermatozóides testiculares colhidos tal como, na maioria dos casos é determinante, a sua fonte, (epidídimo ou testículo), uma vez que se correlaciona com o seu status de maturação. A viabilidade dos espermatozóides, avaliada pela motilidade, pode ser influenciada pela sua fonte. Uma comparação do sucesso de ciclos ICSI realizados num mesmo laboratório pode contribuir para esclarecer este tópico. No nosso estudo as taxas de fecundação, implantação e gravidez clínica por ciclo, foram superiores no grupo de pacientes com AO.
Uma razão plausível para a pior taxa de fecundação após ICSI nos casos de ANO pode ser a baixa concentração de espermatozóide que normalmente é possível recuperar nestas situações e que reduz a possibilidade de escolha de espermatozóides “normais e maduros” para microinjectar. Lewin et al51 estabeleceu uma correlação clara entre o número de espermatozóides colhidos e a taxa de fecundação em casos de ANO. Por outro lado, a taxa de fecundação é afectada pelo grau de comprometimento da espermatogénese no grupo da ANO. Nos casos de defeitos graves na espermatogénese (síndroma de só células de Sertoli, hipoespermatogénese ou paragem da maturação), por vezes estão disponíveis para a ICSI espermatozóides não completamente maduros, o que pode explicar a taxa de fecundação inferior nestes casos. No nosso estudo, devido ao reduzido número de casos de ANO, não se efectuou a análise pelas diferentes categorias de ANO.
O Task Force ESHRE da ICSI reporta a sua experiência no ano de 199552 e refere a tendência para uma redução na taxa fecundação após ICSI em pacientes com ANO relativamente a pacientes com AO.
Não foram encontradas diferenças significativas na taxa de gravidez, taxa de nascimento e dados perinatais entre os dois grupos.
Nos casos de AO é possível colher espermatozóides na maioria dos casos, no entanto, nos casos de ANO não é possível predizer com certeza o sucesso da colheita de espermatozóides maduros, uma vez que não há bons indicadores disponíveis, incluindo a idade, nível de FSH ou histopatologia testicular prévia17,53. O nível plasmático da inibina B, como indicador da função das células de Sertoli pode correlacionar-se com a hipótese de encontrar espermatozóides nos casos de ANO, sendo esta significativamente superior nos casos de sucesso54,55. No entanto, um estudo de Von Eckardstein et al56 não encontrou esta correlação e outro de Vernaeve et al57 conclui que a inibina B falhou a predição da presença de espermatozóides no testículo em 185 casos de ANO. Friedler et al36 concluíram que a idade do paciente ou o nível de FSH plasmático falharam como indicadores da presença ou falha de espermatozóides no testículo após TESE. O indicador mais forte foi a histologia, e era mais forte nos casos de hipoespermatogénese severa, tal como noutro estudos17,22,58,59.
Friedler et al36 sugerem que na ausência de parâmetros não invasivos que predigam a possibilidade de colheita de espermatozóides, a biopsia deve ser efectuada anteriormente à estimulação ovárica das mulheres, especialmente se o uso de espermatozóides dador não for uma opção de alternativa. De Croo et al1 partilham a mesma opinião, pelo menos para os casos de ANO. Efectuar a biopsia previamente à PF evita a realização da estimulação ovárica nos casos onde não se encontrem espermatozóides. Simultaneamente quando a biópsia é realizada aquando da PF, é possível efectuar uma procura mais exaustiva do tecido testicular. Por outro lado, ao efectuar a biópsia previamente os poucos espermatozóides encontrados podem perder-se na criopreservação. Infelizmente não há indicadores seguros do sucesso da recolha de espermatozóides, excepto a histopatologia testicular17.
A criopreservação de espermatozóides após extracção testicular permite a realização de ciclos de ICSI adicionais, sem a repetição da biopsia e sem a necessidade de sincronização com a estimulação ovárica e PF. A maioria dos estudos que comparam resultados usando espermatozóides provenientes do testículo a fresco e descongelados não faz distinção entre AO e ANO, ou seja, não comparam o efeito da criopreservação mediante a etiologia da azoospermia. Isto deve-se predominantemente ao baixo número de casos que seria analisado em cada grupo.
Apesar de nos casos de AO ser normalmente recolhido um maior número de espermatozóides móveis do que nos casos de ANO, tanto nuns casos como noutros, normalmente a quantidade recolhida permite que se realize a criopreservação. Nos casos de ANO a criopreservação bem sucedida permite que se possa realizar biopsias dirigidas e não apenas diagnósticas.
São poucos os artigos que comparam os resultados de ANO usando espermatozóides a fresco e congelados27,36,44 e estes não mostram diferença significativa nem na taxa de fecundação, nem na taxa de gravidez. Uma meta-análise dos resultados publicados poderia ajudar a tomar decisões clínicas mais eficazes29.
No nosso estudo, apesar de no grupo da AO, a taxa de fecundação obtida com espermatozóides descongelados ter sido inferior, a taxa de implantação e taxa de gravidez foram superiores, embora sem tradução estatística. Já na ANO foi possível obter melhores resultados utilizando espermatozóides colhidos a fresco.
Pode-se concluir que na perspectiva de obter melhores taxas de fecundação com espermatozóides colhidos a fresco nos casos de AO, a ICSI deve ser planeada em conjunto com a biopsia testicular diagnóstica. Pelo contrário, nos casos de ANO, como a taxa de recolha de espermatozóides é baixa, mas como os resultados usando espermatozóides colhidos a fresco ou previamente criopreservados não são significativamente diferentes, pode ser oferecida a biopsia electiva prévia à estimulação ovárica, especialmente quando a opção de recurso a gâmetas de dador não se pões na unidade. A principal vantagem desta política é evitar a estimulação ovárica nos casos onde não se encontrem espermatozóides para a ICSI. No entanto, em alguns homens apenas podem ser encontrados muito poucos espermatozóides para a criopreservação, e noutros os riscos de repetição da cirurgia (no caso de não sobreviverem espermatozóides após a descongelação) é inaceitável. Nestes casos a criopreservação selectiva do tecido testicular não se coaduna com os melhores interesses do paciente.
Correspondência: Dra. I. Pires. Unidade de Medicina da Reprodução. Centro Hospitalar de Vila Nova de Gaia/Espinho, EPE. Unidade II. Rua Dr. Francisco Sá Carneiro. 4400-129 Vila Nova de Gaia. Portugal. Correio electrónico: imspires@hotmail.com