INTRODUCCIÓN
Son varias las hormonas que pueden influir, por diversas vías y mecanismos, en varios aspectos de la función sexual. Las que parecen tener un papel más importante en la respuesta sexual (RS) femenina son 2 clases de esteroides gonadales: los estrógenos y los andrógenos, que suelen denominarse conjuntamente hormonas sexuales. La siguiente discusión se enfoca exclusivamente en ellas, con consideración también de sus precursores de origen adrenal y ovárico. Descripciones de las relaciones de estas y otras hormonas, como la prolactina y la oxitocina (cuyos cambios asociados en la RS se han señalado en un artículo precedente1), la progesterona, etc., con la sexualidad femenina y masculina, así como en otras especies animales pueden encontrarse en trabajos de Mas2-4.
SECRECIÓN, TRANSPORTE Y METABOLISMO DE LOS ESTEROIDES SEXUALES
Se resumen, brevemente, los datos fisiológicos más relevantes para la comprensión del papel de estas hormonas en la función sexual de la mujer.
Producción
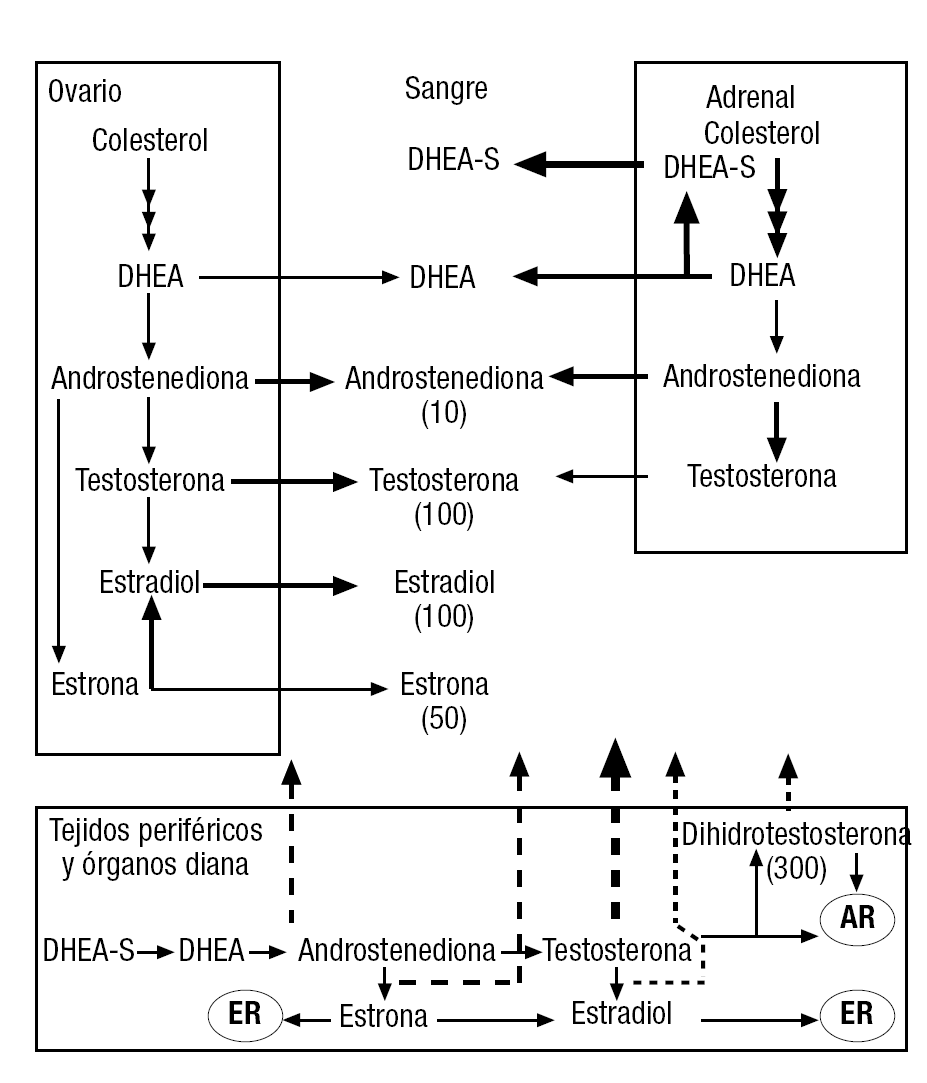
En la mujer en edad reproductiva, la fuente más importante de los estrógenos y los andrógenos presentes en su sangre es el ovario, y se complementa con la aportación de precursores adrenales, que pueden transformarse en andrógenos bioactivos, en órganos periféricos y en tejidos diana (fig. 1). Se estima que en la mujer fértil el ovario contribuye en un 50% a los valores plasmáticos de testosterona (el 25% por secreción directa y el 25% por transformación periférica de los precursores que secreta, fundamentalmente androstenediona). La corteza adrenal aportaría la otra mitad, fundamentalmente por la transformación periférica de los precursores dehidroepiandrosterona (DHEA) sulfato (DHEA-S), DHEA y androstendiona. La producción total de testosterona en la mujer joven se estima en unos 200-300 μg/día, lo que contrasta con los 5.000-7.000 μg/día producidos por los testículos. La testosterona, además de ejercer sus efectos específicos en el receptor androgénico, sirve como precursor para la formación de la dihidrotestosterona (DHT), de mayor potencia androgénica (de 3 a 5 veces, según el tipo de ensayo), por unirse con más afinidad al receptor, por la actividad de la 5-a reductasa, presente en varias células diana. La testosterona y la androstenediona sirven, además, como precursores para la formación de los estrógenos estradiol y estrona, respectivamente, por acción de la enzima aromatasa. Ello ocurre en el propio ovario, así como en tejidos diana, como el cerebro, el hueso, los vasos sanguíneos, etc., y en órganos periféricos, como el tejido adiposo, el músculo y el hígado, que pueden devolver los estrógenos así formados a la circulación.
Figura 1. Producción de esteroides sexuales en la mujer joven. Las líneas hacia la sangre de trazo continuo indican las fuentes glandulares de los esteroides circulantes, y las líneas de puntos, las extraglandulares (que pueden alcanzar gran relevancia, como en el caso de la testosterona o el de la formación de estrona, especialmente tras la menopausia). El grosor de las flechas indica la aportación relativa de cada fuente a los valores de hormona circulante. La potencia relativa de las distintas hormonas se expresa paréntesis. La potencia androgénica (por su afinidad por el AR) de la dihidrotestosterona y la androstenediona se expresan como porcentaje de la correspondiente a la testosterona. Igualmente, la potencia estrogénica de la estrona (afinidad por los ER) se expresa como porcentaje de la del estradiol. AR: receptor androgénico; ER: receptores estrogénicos; 5αR: 5-alfa reductasa.
En la tabla 1 se resumen los valores representativos de la concentración de estas hormonas en el plasma sanguíneo de mujeres en distintas etapas de la vida5-11, así como de varones jóvenes, para su comparación. Pueden apreciarse importantes diferencias entre las diversas situaciones mostradas. Cabe destacar el importante descenso sostenido con la edad de los valores plasmáticos de DHEA-S (aproximadamente, un 2% anual desde los 20 años), fenómeno que se da también en los varones. Véase que la testosterona plasmática de las mujeres en la etapa fértil varía con la edad, con valores en la cuarta década que decaen hasta la mitad de los que se tienen en la veintena. Sin embargo, el paso a la posmenopausia no conlleva un descenso adicional importante de los valores séricos de testosterona, ya que el ovario posmenopáusico continúa produciéndola, aunque al ritmo reducido de los años precedentes. Obsérvese que las concentraciones molares de testosterona plasmática de las mujeres son habitualmente superiores a las de estrógenos, salvo durante el breve tiempo del pico ovulatorio del estradiol, en que su nivel se acerca al de aquélla. Se puede apreciar que la androstenediona, un esteroide con actividad androgénica (bien que débil, por lo que se suele considerar más apropiadamente como un preandrógeno), se encuentra en la sangre de las mujeres jóvenes en una concentración similar o mayor que en los varones.
En la menopausia, se produce una caída drástica de los valores del estradiol circulante, reflejo del virtual cese de su producción por su principal fuente, el ovario, y llegan a hacerse inferiores a los encontrados en los varones. Sin embargo, los valores plasmáticos de estrona se mantienen parecidos a los de edades anteriores, debido fundamentalmente al aumento de su formación periférica por aromatización por el tejido adiposo y otros de la androstenediona de origen adrenal y ovárico. Así, la estrona, aunque con menor potencia que el estradiol (fig. 1), se convierte en el principal estrógeno circulante en la posmenopausia.
Transporte en la sangre y biodisponibilidad
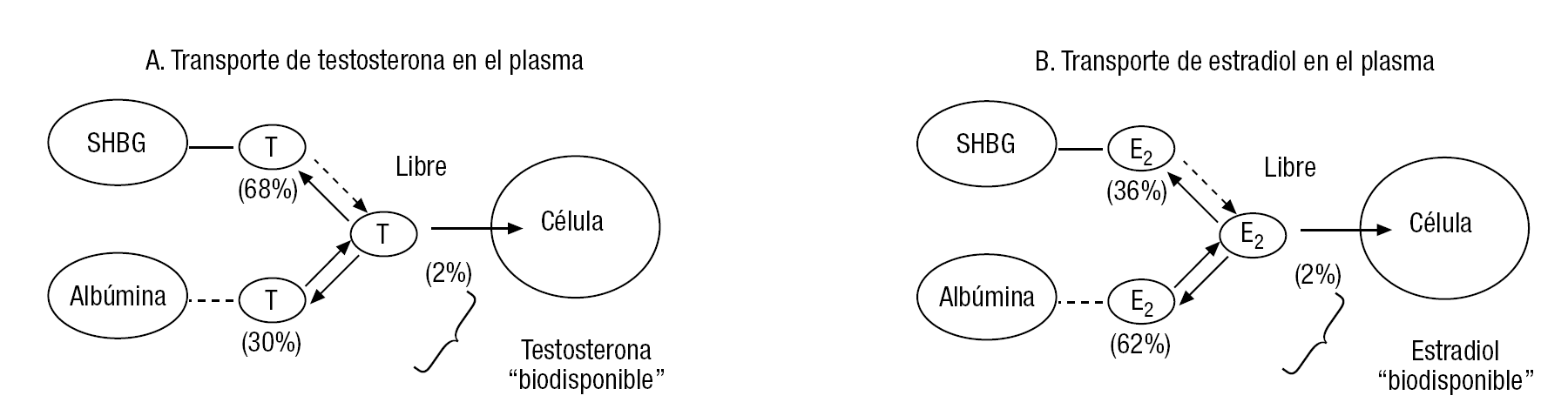
Los andrógenos y los estrógenos, como las demás hormonas esteroides, son muy poco solubles en el agua, de modo que sólo un 1-2% del total presente en el plasma sanguíneo se encuentra en forma libre, que es la que puede atravesar las membranas de las células para actuar sobre sus receptores intracelulares. La mayor parte del estradiol y la testosterona circulantes se unen a 2 proteínas transportadoras, que actúan a modo de reservorio, liberando los esteroides a medida que se van utilizando por las células (fig. 2). Dichas proteínas son la albúmina plasmática (que transporta muchas otras hormonas y vitaminas) y una β-globulina específica (la SHBG), para el transporte de estas hormonas sexuales (los demás esteroides, como DHEA-S, DHEA, androstenediona, estrona o progesterona no se unen de modo significativo a ella). El estradiol y la testosterona se unen a estas proteínas con distinta afinidad. Es pequeña para la albúmina, que los libera con rapidez, y muy fuerte para la SHBG (el tiempo de disociación de la testosterona de la SHBG es unas 20 veces mayor que el de la albúmina). Por ello, se suele considerar la suma de la fracción libre y la fracción unida a la albúmina como "testosterona biodisponible". Hay, también, diferencias entre la afinidad por la unión a la SHBG, que es mayor para la testosterona. Por este motivo, sumado a que la concentración plasmática de testosterona es mayor, la ley de acción de masas que rige los intercambios de una a otra forma del esteroide en el plasma determina que la SHBG transporte una mayor proporción del andrógeno (fig. 2A) y el estradiol se una en mayor medida a la albúmina (fig. 2B). A su vez, la producción hepática de SHBG y, por ende, su concentración plasmática están influidas por varios factores hormonales; así, los estrógenos la aumentan mientras que los andrógenos la disminuyen, de modo que en las mujeres premenopáusicas sus valores son superiores a los de los varones.
Figura 2. Transporte de testosterona (A) y estradiol (B), en el plasma de mujeres jóvenes. Los porcentajes indicados describen su distribución aproximada de las fracciones unidas a la SHBG, la albúmina y presentes en forma libre.
Estos hechos fisiológicos pueden tener importantes implicaciones clínicas. Por ejemplo, el descenso de los estrógenos en las mujeres posmenopáusicas se acompaña de una disminución de los valores de SHBG, lo que facilita que la testosterona circulante se desplace más hacia la forma "biodisponible", con lo que aumentaría la eficacia de la que se halla presente en la circulación. Del mismo modo, los tratamientos con andrógenos reducen los valores de SHBG y potencian su propio efecto por el referido mecanismo. A la inversa, los tratamientos con estrógenos, en especial por vía oral, como en las píldoras anticonceptivas o en varias formulaciones para la menopausia, elevan los valores plasmáticos de SHBG, con la consecuencia de que la testosterona circulante se desplaza hacia la forma unida a ésta y, por tanto, "no biodisponible". Esto puede tener consecuencias importantes en la sexualidad, al crear una especie de "hipoandrogenismo funcional inducido".
Transformaciones en las células diana
Aunque la medida de las concentraciones plasmáticas de las hormonas y sus proteínas transportadoras representa la información sobre el estado hormonal más directamente accesible al clínico, dista de reflejar toda su complejidad. Así, como se ha apuntado anteriormente y se señala en la figura 1, estas hormonas presentan importantes transformaciones en el interior de las células diana que las usan y en otros órganos, que pueden reenviarlas a la circulación. Por ejemplo, en ellas se pueden formar testosterona y androstenediona a partir de precursores adrenales (DHEA-S y DHEA) y, a su vez, servir para la formación de estradiol y estrona, respectivamente; se ha acuñado el término intracrinología para referirse a estos procesos12. Esto es particularmente relevante en la menopausia, cuando la desaparición de los estrógenos ováricos convierte la aromatización periférica de los andrógenos en la única fuente endógena de estas importantes hormonas, cuya disponibilidad a su vez depende en su totalidad (en la menopausia quirúrgica) o parcialmente (en la menopausia natural) del aporte que de éstos o de sus precursores haga la corteza adrenal. En la menopausia natural, la producción androgénica del ovario también contribuye al aporte de precursores para la producción de estrógenos. El organismo parece adaptarse a esta situación; así, en biopsias de tejido adiposo, se ha encontrado que la actividad de aromatasa (enzima que forma estrógenos a partir de los andrógenos) aumenta con la edad, de modo que en la posmenopausia llega a ser sustancialmente mayor que en mujeres jóvenes13,14. Esto explica la correlación positiva entre el grado de adiposidad y los valores de estrógenos plasmáticos que se suelen encontrar en las mujeres menopáusicas y la observación clínica frecuente de que las mujeres muy delgadas suelen presentar síntomas menopáusicos (de deprivación estrogénica) más acentuados.
RECEPTORES A LOS ESTEROIDES SEXUALES Y SU EXPRESIÓN EN LOS ÓRGANOS DE LA RESPUESTA SEXUAL
Características de los receptores a esteroides sexuales
Para que una hormona pueda actuar sobre sus células diana, es necesario que éstas expresen receptores específicos para aquélla. Las hormonas esteroides actúan en sus órganos diana fundamentalmente mediante su unión específica a receptores intracelulares (aunque se les están describiendo también nuevos mecanismos de acción en la membrana celular). En el caso de las hormonas aquí consideradas, serían los receptores estrogénicos (ER) de los que existen 2 tipos: ERα (el clásico, sobre el que se han realizado la mayoría de los estudios) y ERβ, codificados en los cromosomas 6 y 14, respectivamente, y el receptor androgénico (AR), codificado en el cromosoma X. Estos receptores son factores de trascripción que, tras la unión de su ligando específico (la hormona) y subsiguiente dimerización, se transfieren al núcleo, donde se fijan a secuencias específicas del ADN (elementos de respuesta hormonal) situadas en la región reguladora de cada uno de los genes diana, cuya expresión modificada producirá los principales efectos de este tipo de hormonas.
Estos receptores deben ser funcionalmente operativos, es decir, capaces de ligarse a su hormona específica y en respuesta a ello producir los efectos en el metabolismo celular que constituyen la acción hormonal. Alteraciones genéticas, como las que llevan a la falta de expresión de un determinado receptor hormonal o mutaciones de su gen, que afecten de modo importante su funcionalidad, se han relacionado desde hace tiempo con trastornos del desarrollo y la diferenciación sexual. Un caso extremo es el síndrome de insensibilidad completa a los andrógenos (CAIS), en el que por ausencia del gen del receptor androgénico o por mutaciones puntuales en zonas críticas para su función, los sujetos afectados, con cariotipo XY y testículos, presentan un fenotipo externo e identidad sexual perfectamente femeninos15. Además de estas grandes disfunciones genéticas infrecuentes, ahora se está aprendiendo que alteraciones más sutiles (polimorfismos y mutaciones menos deletéreas) en la estructura de los genes de los receptores de los esteroides sexuales se asocian a una amplia gama de enfermedades cuya relación con dichas hormonas es conocida. Entre ellas, están los cánceres de mama, de endometrio o de próstata, el ovario poliquístico, la infertilidad femenina y masculina, etc. Todo parece indicar que hay una variabilidad en la población en cuanto a la sensibilidad a estas hormonas. Por ello, es muy probable que distintos individuos con valores similares de una hormona en su sangre respondan con distinta intensidad debido a pequeñas diferencias en la funcionalidad de sus receptores. Este fenómeno podría contribuir a explicar parte de la generalmente amplia variabilidad observada en la relación entre los valores plasmáticos de una determinada hormona, producida endógenamente o suministrada desde fuera, y sus efectos en la función sexual. Sin duda, el rápido desarrollo actual de las aplicaciones diagnósticas de las técnicas de biología molecular permitirá incorporar en un futuro próximo este tipo de información a los estudios de las relaciones entre las hormonas y la sexualidad humana.
La presencia de las referidas proteínas receptoras, o de su correspondiente ARN mensajero (ARNm), se puede identificar y cuantificar en los diversos tejidos diana por técnicas de inmunohistoquímica (con anticuerpos a cada proteína receptora) y de biología molecular (como la hibridación in situ del ARNm, que permite su visualización dentro de las células), respectivamente. Estas técnicas han proporcionado una información muy útil para discernir cuáles son las células diana de estas hormonas en los distintos órganos implicados en los diversos aspectos de la función sexual.
Vagina y vulva
Está bien caracterizada la abundante presencia de receptores estrogénicos en la pared vaginal, especialmente en el epitelio (en varios estratos celulares) y en menor cantidad en fibroblastos y músculo liso de la estroma16. Se ha documentado la expresión de los 2 tipos de ER en la vagina: el ERαse localiza en el epitelio, el estroma y las fibras musculares y el ERβ, en el epitelio y, como en otros tejidos, en los vasos sanguíneos17.
En la vulva se encuentran ER en el epitelio de transición (paraqueratótico) de los labios menores, así como en su dermis, aunque en cantidad bastante inferior a la hallada en la vagina, y son muy escasos en el epitelio queratinizado (piel verdadera) de los labios mayores, donde están confinados a algunas células de la capa basal. Parece haber un gradiente en la distribución de los ER: vagina > labios menores > labios mayores; si bien se encuentran en relativa abundancia en las células ductales de las glándulas sudoríparas apocrinas de los labios mayores y el periné16.
El receptor androgénico también se expresa en la vagina humana, más en la submucosa y la estroma que en el epitelio16,18. Sin embargo, el AR se ha encontrado en bastante mayor cantidad en la vulva, en el epitelio y en la dermis de los labios mayores (similar a la encontrada en el prepucio masculino) y sus glándulas sudoríporas ecrinas y apocrinas, y en proporción algo menor en los labios menores16. De este modo, el AR mostraría un gradiente de distribución vulva > vagina recíproco del apuntado antes para el ER. Esto sugiere que las estructuras vulvares pueden ser más sensibles a los andrógenos y la vagina a los estrógenos, lo que es relevante al considerar posibles tratamientos tópicos con hormonas sexuales.
Tracto urinario inferior
La uretra de la mujer está tapizada en toda su extensión por un grueso epitelio escamoso no queratinizado similar al de la vagina19,20, lo que contrasta con la delgada mucosa urotelial presente en casi toda la uretra masculina. También, al igual que el de la vagina, el epitelio de la uretra femenina, aunque no la capa subepitelial, expresa abundantes receptores estrogénicos, que faltan por completo en el contiguo urotelio de la vejiga20. Esto se refleja en el frecuente deterioro concurrente de las funciones vaginal y uretral tras la deprivación estrogénica de la menopausia (atrofia urogenital). También podría explicar que el reemplazo con estrógenos a las mujeres posmenopáusicas suele tener mayor eficacia en los síntomas urinarios irritativos y las infecciones recurrentes, relacionados con la atrofia del epitelio uretral, que en la incontinencia urinaria (más relacionada con la dinámica vesical).
Cerebro
En el cerebro humano se han localizado receptores estrogénicos, el más estudiado de los cuales es el ERα21-23. Se encuentra especialmente en regiones como la amígdala, el hipocampo, y la corteza temporal y frontal. También se ha documentado una importante expresión del ERα en diversos núcleos hipotalámicos en proporciones diversas (tabla 2). Se han detectado diferencias sexuales (dimorfismo) en cuanto su expresión en diversas estructuras hipotalámicas, y en las mujeres se encuentra en mayor cantidad en la banda diagonal y el núcleo mamilar medial y, en menor medida, en los núcleos supraquiasmático y ventromedianos. En los varones, la expresión del ERαparece ser mayor en el área preóptica medial, el núcleo paraventricular y el área hipotalámica lateral23.
Aunque con menor frecuencia, se ha estudiado también la expresión del ERβ. Parece tener una distribución en parte común, pero también con grandes diferencias con el ERα así, el primero se ha encontrado en más abundancia en el hipocampo, el claustro, el núcleo subtalámico y el núcleo ventrolateral del tálamo, áreas, salvo la primera, que no expresan el ERα mientras que éste se transcribe en mayor cantidad en el hipotálamo y la amigdala22; igualmente, hay diferencias en cuanto a su patrón de distribución en los distintos núcleos hipotalámicos24. También hay dimorfismo sexual en la expresión del ERβ., que en las mujeres es mayor en los núcleos supraquiasmático, supraóptico, paraventricular, infundíbulo y mamilar medial24,25. El estado hormonal afecta, asimismo, a la expresión de estos receptores en algunos núcleos cerebrales, como el supraóptico del hipotálamo, donde en las mujeres jóvenes hay bastante más ERβ.que las posmenopáusicas, mientras que éstas expresan ERαen una mayor proporción de neuronas25.
El receptor androgénico también se expresa en cantidades importantes en el cerebro de varones y mujeres. Se han medido valores elevados de su ARNm en el hipocampo, con valores similares a los de la próstata (paradigma de alta expresión del AR), sin encontrarse diferencias sexuales26. Varios núcleos hipotalámicos presentan valores apreciables de AR en ambos sexos, si bien son generalmente superiores en los varones (tabla 2). Las mayores concentraciones del AR (y también su diferencia sexual) se han encontrado en la banda diagonal de Broca (rama horizontal) y en los núcleos del complejo mamilar. Otros núcleos hipotalámicos que expresan el AR son el supraquiasmático, basal de la estría terminal, el preóptico medial, el paraventricular (solamente en varones), el ventromediano y el arqueado27.
Los datos resumidos anteriormente demuestran que el cerebro humano es un importante órgano diana de las hormonas sexuales. La localización de sus receptores en áreas cerebrales especializadas en determinadas funciones es congruente con lo que se conoce acerca de la influencia de los esteroides gonadales en diversos aspectos, fisiológicos y clínicos, de la función cerebral (cognición, afecto, diversos trastornos neurológicos y psiquiátricos, etc.). Se debe destacar, aquí, la expresión en el cerebro de la mujer y del varón de receptores estrogénicos y/o androgénicos en áreas cerebrales, especialmente del hipotálamo (tabla 2), cuya importante participación en la regulación de la secreción de gonadotropinas (área preóptica medial, infundíbulo), así como de la motivación sexual (amígdala, núcleo basal de la estría terminal, área preóptica medial, núcleos de los cuerpos mamilares) y la RS (núcleos paraventricular y ventromediano del hipotálamo), están bien documentadas por la investigación experimental en animales3,28 y se está corroborando en estudios de neuroimagen funcional en humanos29-32. Otro caso relevante es el de la expresión sustancial, sobre todo en la mujer, de ambos tipos de receptores estrogénicos en el núcleo supraquiasmático del hipotálamo, al que se atribuye un papel crucial en la regulación del ciclo vigila-sueño; esto podría estar en la base de los trastornos de sueño que suele producir la deprivación estrogénica característica de la menopausia. El núcleo supraóptico, que expresa especialmente el ERβ. en las mujeres jóvenes, está especializado en la producción de las hormonas vasopresina y oxitocina; como se describe en un artículo anterior, la segunda se secreta durante el orgasmo1.
EFECTOS DE LOS ESTRÓGENOS Y LOS ANDRÓGENOS EN LA FUNCIÓN SEXUAL
El procedimiento clásico de la endocrinología experimental para discernir posibles efectos fisiológicos de una hormona incluye examinar, primero, las consecuencias funcionales de la supresión de la glándula que la produce y estudiar si el tratamiento de sustitución de la hormona eliminada restaura las funciones alteradas. La práctica clínica proporciona modelos útiles para obtener tal información acerca del papel de las hormonas sexuales en la función sexual femenina.
Cambios sexuales en la menopausia inducida y en la menopausia natural
La extirpación de ovarios normales a mujeres en edad fértil se practica, de modo electivo (en prevención de su posible malignización en el futuro) a una importante proporción de las muchas que son histerectomizadas, generalmente por causas no malignas, como miomas, endometriosis, hemorragia uterina disfuncional, prolapso, etc. En la mayoría de los casos, la extirpación de un útero que estaba ocasionando problemas no suele afectar negativamente a la función sexual, sino más bien mejorarla, al suprimir molestos síntomas ginecológicos que, en muchos casos, interferían con ella33. Sin embargo, varios estudios han documentado diferencias entre los efectos sexuales de la histerectomía simple (preservando los ovarios) y la combinada con ovariectomía. La segunda se sigue con mayor frecuencia de un deterioro de la vida sexual, reflejado en índices como la frecuencia de deseo y de coito, molestias y dificultades durante éste y grado de satisfacción obtenida34-36. En concordancia con ello, estudios poblacionales han encontrado una mayor prevalencia de disminución importante del deseo sexual en las mujeres en edad reproductiva con menopausia quirúrgica respecto a las de la misma edad con ovarios funcionantes37.
La menopausia natural proporciona otro modelo de estudio; si bien diferente en algunos aspectos a la quirúrgica. En la menopausia natural, los cambios hormonales se producen progresivamente a lo largo de varios años antes de la desaparición definitiva de la regla (transición menopáusica)38, un patrón de cambio hormonal bien distinto al de la instantánea caída de las hormonas ováricas de la menopausia quirúrgica. Además, en la segunda se produce un descenso más acusado de los andrógenos plasmáticos, aunque matizado en su magnitud y duración por el aporte remanente de los precursores adrenales, que depende de la edad de la mujer. Por el contrario, en la transición a la menopausia natural y durante varios años tras la última regla, los valores plasmáticos de los andrógenos suelen mantenerse relativamente estables en valores del 50-60% de los correspondientes a la tercera década (tabla 1), que ya se habían alcanzado unos 8-10 años antes9-11.
La menopausia natural y su transición a ella, al igual que la menopausia inducida (aunque en ésta suelen ser más acentuados), se acompañan con frecuencia de síntomas de diverso tipo, como sofocos, sudoración nocturna, dificultad para dormir, alteraciones del humor, fatiga, irritabilidad, dolores articulares, problemas urinarios, etc.39. Todos ellos pueden interferir indirecta pero significativamente con la vida sexual. También suelen darse síntomas específicamente sexuales, como sequedad vaginal, molestias coitales y disminución del deseo sexual. En gran medida, son consecuencia de alteraciones en la estructura y la funcionalidad de los genitales internos y externos40,41; entre ellas: pérdida de vello pubiano, aplanamiento del monte de Venus (por pérdida de grasa subcutánea), disminución de tamaño de los labios menores y mayores, e involución de los corpora del clítoris. Es de especial importancia la atrofia vaginal, con pérdida de elasticidad de sus paredes, disminución de la vascularización, aplanamiento de las rugae y adelgazamiento de la mucosa. Tales cambios se traducen en pérdida de la capacidad de acidificación de la luz vaginal42,43, con mayor propensión a infecciones, de vasodilatación de su plexo submucoso42 y de transferencia de líquido a través de su epitelio44, lo que reduce la reacción de lubricación y produce molestias o dolor en la penetración. La uretra experimenta cambios atróficos parecidos, con adelgazamiento de su epitelio, pérdida de tejido de sostén y vascularización. Esto lleva a que falle su función de oclusión de la vía urinaria, lo que favorece la incidencia de infecciones e incontinencia, mientras que la pérdida de su almohadillado vascular (que normalmente se ingurgita en la excitación sexual) puede provocar dolor uretral durante la penetración vaginal45.
Muchos de estos cambios están relacionados con la disminución de los valores de esteroides sexuales. Sin embargo, no se debe perder de vista que, en los problemas sexuales que acompañan a la menopausia, especialmente a la natural, en que se combinan los efectos del envejecimiento, influyen multitud de factores contextuales, como los relacionados con la pareja (como su pérdida, permanencia o cambio de ésta, su estado de salud y función sexual, la calidad de la relación, etc.), así como de la propia mujer, como su experiencia sexual previa, su estilo de vida, los factores de personalidad y el estado de salud físico y mental. Muchos de ellos pueden tener tanto o más peso en la expresión de la sexualidad de la mujer que los cambios hormonales40,46,47. No obstante, también es un hecho bien establecido que el tratamiento con esteroides sexuales contribuye a aliviar muchos de los síntomas sexuales de la menopausia.
Efectos sexuales del reemplazo con estrógenos
Los estrógenos, administrados solos (en la menopausia quirúrgica) o acompañados de gestágenos, como es preceptivo hacerlo si hay útero para evitar la hiperplasia endometrial, han mostrado ser el tratamiento más eficaz para aliviar las secuelas y los síntomas urogenitales de la menopausia comentados anteriormente; para ello, se administran por vía sistémica, en aplicación tópica en la vagina o combinando ambas41,45,48. Esto es congruente con la abundante expresión de receptores estrogénicos documentada en la vagina16,17 y la uretra20 humanas.
Los datos sobre los efectos de los tratamientos con estrógenos, con o sin gestágenos acompañantes, en el deseo sexual son más conflictivos. Hay estudios en los que parecen producir un aumento del deseo sexual y otros en que se muestran totalmente inefectivos en este aspecto, o bien la mejoría es sólo transitoria49. A estas discrepancias pueden contribuir diferencias en los instrumentos (cuestionarios) usados al evaluar los cambios en el deseo, en los preparados hormonales y en las dosis empleadas. Lo último es relevante porque el deseo sexual y la atrofia urogenital parecen responder a diferentes valores plasmáticos de estrógenos. Así, en un reciente estudio prospectivo en una amplia cohorte de mujeres en la transición menopáusica que tomaban o no diversos preparados con estrógenos se estimó que el valor mínimo de estradiol en sangre necesario para aumentar con alguna significación clínica el índice de RS empleado (un constructo que combinaba preguntas acerca del interés, la excitación, el placer y el orgasmo) era el doble del necesario para mejorar la sequedad vaginal y corregir la dispareunia (unos 700 y 350 pmol/l, respectivamente)47. Que los estrógenos estimulen el deseo sexual de la mujer es coherente con la importante presencia de sus receptores en áreas cerebrales a las que la investigación experimental ha reconocido su participación en la regulación de diversos componentes de la conducta sexual21,23,24; sin embargo, que se requieran para ello valores relativamente elevados de estradiol en sangre, que en el ciclo menstrual sólo se encuentran, y por poco tiempo, al final de la fase folicular, como indica el estudio reseñado anteriormente, sugiere que no es la única hormona implicada. A diferencia de la mayoría de los mamíferos, en que las hembras sólo aceptan, y buscan, la cópula en estrecha coincidencia con la ovulación (fase de estro o celo), la mujer puede, y suele, tener deseo y actividad sexual durante todo el ciclo.
Efectos sexuales del reemplazo con andrógenos
El empleo de andrógenos para tratar síntomas menopáusicos es tan antiguo como el de los estrógenos. La testosterona se aisló en 1935 y pronto se empezó a probar en varones y también en mujeres, de modo que el primer estudio controlado sobre efectos del tratamiento con testosterona en la función sexual femenina se publicó en 1950 (describiendo que aumentaba la libido50). Sin embargo, el tratamiento con andrógenos a las mujeres ha sido tradicionalmente visto con recelo por una mayoría de la comunidad médica, debido en parte al desconocimiento acerca de su papel fisiológico en la mujer. En el varón, por el contrario, el importante efecto de los andrógenos de facilitación del deseo y la respuesta sexual se ha reconocido desde hace tiempo, lo que ha llevado a su actual uso aceptado para tratar dificultades sexuales y otros problemas del hipogonadismo, así como el envejecimiento masculino, que se suele acompañar también de un descenso de los valores de testosterona biodisponible.
Una de las pruebas más convincentes de que los andrógenos estimulan el deseo sexual femenino la proporcionó el estudio controlado, prospectivo y cruzado de Sherwin et al34, que merece comentarse con detalle. Distintos grupos de mujeres sometidas a histerectomía con extirpación de los ovarios fueron tratadas tras la intervención con inyecciones mensuales de estrógenos, andrógenos, la combinación de ambos o placebo. Hubo un grupo control a quienes se había practicado una histerectomía simple (sin extirpación de los ovarios). Desde un mes antes de la operación y durante un total de 8 meses tras ésta (cruzándose los tratamientos a la mitad de este tiempo), registraron diariamente su función sexual mediante un cuestionario validado. Los resultados mostraron un mantenimiento de los valores preoperatorios del deseo sexual en el grupo control (histerectomía simple) y en los de ovariectomizadas que recibieron andrógenos solos o combinados con estrógenos (de hecho, en los datos comunicados se aprecia un cierto aumento con respecto al valor preoperatorio de las mujeres que recibieron estos tratamientos). Por el contrario, el deseo disminuyó en las que recibieron estrógenos solos o placebo. En cambio, el tratamiento con estrógenos, solos o con andrógenos, sí se mostró muy eficaz para prevenir los sofocos, lo que no logró el tratamiento con andrógenos ni el placebo. La interpretación de estos datos es que los andrógenos tienen un importante efecto en el mantenimiento del deseo sexual, mientras que los estrógenos son necesarios para la prevención de los trastornos vasomotores. Una limitación importante de este estudio es que los valores medidos de hormonas en el plasma subsiguientes a los distintos tratamientos fueron marcadamente suprafisiológicos. Ésta ha sido una característica común en la mayoría de los trabajos en este campo hasta fechas recientes.
Desde entonces, han sido numerosos los estudios publicados en que se ha administrado testosterona a mujeres con menopausia quirúrgica como adición al tratamiento que estaban recibiendo con estrógenos, con el que no se sentían satisfechas en cuanto a la recuperación del deseo sexual. Éstos han mostrado consistentemente que el tratamiento con testosterona mejora el deseo sexual y otros parámetros relacionados con éste en las mujeres estrogenizadas. La testosterona se ha suministrado en una variedad de formas: oral (como metiltestosterona), inyecciones intramusculares, implantes subcutáneos, etc. Todas ellas tienen en común, como se ha apuntado anteriormente, que producen valores de testosterona en sangre no fisiológicos, con grandes elevaciones en el tiempo de la aplicación de las dosis y descensos al final del intervalo entre las dosis. Para referencias de los estudios controlados de estas características véanse los trabajos de Bachmann y Leiblum49 y Alexander et al51.
Recientemente, se ha introducido la forma transdérmica de administración de testosterona, fundamentalmente en forma de parches cutáneos o en gel. Ésta combina las ventajas, junto con la mayor comodidad que las inyecciones o los implantes, de evitar el primer paso por el hígado (de consecuencias metabólicas negativas) que supone la administración oral, así como proporcionar unos valores estables del esteroide en el plasma y, con la dosis adecuada, parecidos a los propios de mujeres jóvenes normales. Se han publicado varios estudios controlados que muestran consistentemente que este tipo de tratamiento aumenta el deseo y la satisfacción sexual, además de otros indicadores relevantes de calidad de vida, junto con pocos efectos adversos significativos52-56. Prácticamente todos ellos se han basado en el modelo descrito anteriormente, es decir, mujeres con menopausia quirúrgica a las que el tratamiento de sustitución con estrógenos no ha bastaba para restituir su función sexual hasta grados satisfactorios. También se ha comenzado a estudiar, con resultados positivos similares, el efecto de los parches de testosterona en mujeres con menopausia natural tratadas con estrógenos y, si tienen útero, con gestágenos adicionales57.
RECAPITULACIÓN: PAPEL DE LOS ESTRÓGENOS Y LOS ANDRÓGENOS EN LA SEXUALIDAD FEMENINA Y SUS MECANISMOS
Cuanto se ha expuesto anteriormente acerca de los efectos sexuales de estas hormonas pone de manifiesto que los estrógenos tienen un papel fundamental en el mantenimiento del buen estado trófico y funcional del tracto urogenital, aunque está menos clara su influencia directa en el deseo sexual de la mujer. Es un hecho que muchas mujeres con menopausia inducida o natural mejoran muchos, si no todos, los aspectos de su sexualidad tras recibir tratamiento con estrógenos solos o asociados a progestinas. Esto puede deberse a una acción directa de los estrógenos en los circuitos cerebrales del deseo y/o a que, si la función adrenal y, en su caso, la secreción androgénica del ovario posmenopáusico están conservadas, aún se mantiene un valor suficiente de andrógenos endógenos que, por su efecto promotor del deseo, complementen el del tratamiento estrogénico que reciben en cuanto al sostenimiento del conjunto de la función sexual. También, el eficaz alivio de molestos síntomas urogenitales, trastornos vasomotores y alteraciones del sueño y del ánimo que produce el tratamiento estrogénico puede mejorar indirectamente el deseo sexual.
El tratamiento con andrógenos, a dosis que producen valores plasmáticos fisiológicos o ligeramente superiores a éstos, ha demostrado un efecto positivo en la función sexual, especialmente en los aspectos relacionados con el deseo. Sin embargo, el hecho de que los andrógenos sirvan también como precursores de los estrógenos en varios órganos diana, incluido el cerebro (fig. 1) ha llevado a sugerir que su acción promotora del apetito sexual requiere su transformación en estrógenos (aromatización) por las estructuras cerebrales que regulan la motivación sexual. A esta conclusión ha llevado el estudio de la conducta sexual masculina de roedores, pero su extrapolación al cerebro de la mujer parece bastante discutible.
En la especie humana, varios hechos refutan la hipótesis de la exigencia de la aromatización para la acción de los andrógenos en el deseo sexual. Así, en un experimento en varones jóvenes a los que se indujo un hipoandrogenismo transitorio mediante un análogo de la hormona liberadora de gonadotropinas (Gn-RH), que se acompañaba de una disminución del apetito sexual, el tratamiento concomitante con dosis fisiológicas de testosterona preservó su descenso, y la adición a éste de un bloqueador de la aromatasa no alteró este efecto protector del deseo de la testosterona58. Igualmente, la administración de un inhibidor de la aromatasa a mujeres ovariectomizadas, estrogenizadas y tratadas con testosterona transdérmica no atenuó los efectos estimulantes de la testosterona en el deseo sexual59. Por otra parte, en los tratamientos con antiándrogenos, que bloquean la unión de la testosterona o la DHT al receptor androgénico, se han encontrado efectos deletéreos en el deseo y la excitabilidad sexual en varones (por lo que se utilizan en el tratamiento de las parafilias en el varón60); efecto también observado en mujeres con hirsutismo que reciben dosis altas de antiándrógenos61. Por último, como se ha descrito anteriormente, en los núcleos hipotalámicos a los que se atribuye un papel importante en la regulación de la motivación y la conducta sexual, se ha encontrado, en varones y mujeres, una expresión sustancial (aunque en proporciones diversas) tanto del AR como de los ER (tabla 2). Parece, por tanto, que en varones y mujeres los andrógenos actúan como tales en su propio receptor, para facilitar los mecanismos del deseo. Esto no excluye que, además, en determinadas áreas o núcleos cerebrales, lo hagan mediante su aromatización local y ulterior unión a los ER. Un dato sugerente de esta posibilidad es la alta expresión de ER, sobre todo en el varón, en los núcleos basal de la stria terminalis y preóptico medial (tabla 2), que han demostrado tener un importante papel en la motivación sexual masculina en varias especies animales3,28.
El conjunto de estas consideraciones lleva a la propuesta de que, tanto en la mujer como en el varón, los andrógenos y los estrógenos, de producción endógena (sistémica o local) o administrados desde el exterior, tienen un efecto aditivo en los mecanismos cerebrales del deseo y la excitación sexual. Con esto concuerdan también recientes observaciones realizadas con técnicas de neuroimagen funcional en respuesta a estímulos eróticos en relación con la menopausia62,63 y el reemplazo hormonal en ésta63.
La comparación entre mujeres premenopáusicas (edad media, 37 años) y menopáusicas sin tratamiento hormonal (edad media, 52 años) de sus respuestas de activación de áreas cerebrales medidas por resonancia magnética funcional (RMf) a estímulos visuales eróticos mostró diferencias entre ellas. Si bien ambos grupos informaron de un grado similar de excitación subjetiva, en las menopáusicas hubo una menor intensidad general de activación cerebral, en la que se detectaron diferencias regionales. Así, en las menopáusicas se activaron en menor medida regiones como el putamen, la cabeza del núcleo caudado, la circunvolución cingular y la rodilla del cuerpo calloso, mientras que presentaban una mayor activación relativa en otras áreas como la ínsula, el cuerpo del núcleo caudado y el esplenio del cuerpo calloso62. Queda por dilucidar, sin embargo, en qué medida el distinto procesamiento de la información erótica que sugieren estos datos se debe a las diferencias de edad o de valores hormonales.
En otro estudio (preliminar) se han examinado los efectos sobre la respuesta cerebral, medida también por RMf, a estímulos eróticos en mujeres con menopausia quirúrgica (edad media, 50 años) sin tratamiento hormonal y tras ser tratadas en sucesivos períodos de 6 semanas primero con estradiol seguido de estradiol y testosterona, ambos por vía transdérmica. Se compararon con un grupo de premenopáusicas (edad media, 43 años). De modo congruente con el estudio comentado anteriormente, las menopáusicas sin tratamiento mostraron una menor activación global que el grupo control, particularmente en varias áreas relevantes para la función sexual como el tálamo, la amígdala y las circunvoluciones frontal medial y parahipocámpica. El tratamiento con estradiol incrementó, aunque en pequeña medida, la respuesta de estas áreas. Sólo el tratamiento combinado con estradiol y testosterona se tradujo en pautas de activación hasta valores parecidos a los de las premenopáusicas63. En los próximos años se verá, sin duda, un aumento considerable de la información acerca de los correlatos cerebrales de la función sexual femenina, incluida su modulación hormonal.
En síntesis, los estudios del sustrato hormonal de la función sexual femenina permiten asignar a los estrógenos un papel esencial, en el mantenimiento de la estructura y la funcionalidad del tracto genital femenino y del urinario inferior, fundamentales para el desarrollo de una RS satisfactoria. A los andrógenos se les reconoce un importante papel en el fomento del deseo sexual, ya que actúan en las áreas cerebrales que lo regulan, posiblemente en cooperación con los estrógenos. Todo ello apoya la validez del tratamiento combinado con estrógenos y testosterona a las mujeres deprivadas del aporte hormonal de los ovarios, para lograr una restauración completa de su función sexual.
Correspondencia:
Dr. M. Mas.
Facultad de Medicina. Campus Ciencias de la Salud.
38071 La Laguna. Tenerife. España.
Correo electrónico: mmas@ull.es