FUNÇÃO E DISFUNÇÃO ENDOTELIAL
O endotélio, considerado antigamente como uma simples barreira anatómica passiva, é actualmente reconhecido como sendo um orgão metabolicamente activo, que desempenha importantes funções autócrinas, parácrinas e endócrinas1,2. A monocamada endotelial desempenha um papel importante na modulação do tónus vascular e muscular, na regulação do processo inflamatório, activação de plaquetas, trombose e na proliferação da camada muscular lisa subadjacente3,4. De forma a a manter a homeostase vascular, o endotélio possui a capacidade de responder a estímulos humorais, neuronais e mecânicos (pressão e shear stress) através da síntese e libertação de vários factores com funções agonista e antagonista5. Para tal, as CEs produzem de forma regulada moléculas vasodilatadoras e vasoconstritoras, pró-coagulantes e anti-coagulantes, inflamatórias e anti-inflamatórias, fibrinolíticas e anti-fibrinolíticas, oxidantes e anti-oxidantes6-8. O equilíbrio entre a libertação de mediadores vasoactivos, como o óxido nítrico (ON), a prostaciclina I2 (PGI2) e vários factores hiperpolarizadores derivados do endotélio (EDHF), e vasoconstritores como a endotelina-1 (ET-1), angiotensina II (Ang II), prostaglandina H2 (PGH2) e tromboxano A2 (TXA2), revelaram-se de extrema importância na regulação da permeabilidade e do tónus vascular4,9. Para além das importantes funções vasoactivas, o ON apresenta também propriedades anti-inflamatórias (regulação da adesão de leucócitos ao endotélio), anti-trombóticas e anti-proliferativas, enquanto que a PGI2 é um potente inibidor da agregação plaquetária4,10,11. Similarmente, as moléculas ET-1 e Ang II, para além de poderosos vasoconstritores exercem também efeitos pró-trombóticos e mitogénicos, enquanto que o TXA2 promove agregação de plaquetas4,12. Dada a sua impotância para a funcionalidade do endotélio intacto, quaisquer alterações que condicionem as actividades biológicas destas moléculas, originam alterações generalizadas nas funções das CEs, levando à perda da sua integridade funcional, condição designada por disfunção endotelial. Como consequência o endotélio vascular perde capacidade de resposta a mudanças hemodinâmicas, autócrinas e parácrinas3,13,14. A disfunção endotelial é caracterizada essencialmente por uma redução na biodisponibilidade e bioactividade de ON, e por um aumento da produção de factores vasoconstritores. Como consequência, o potencial vasodilatador é reduzido sendo o tónus vascular severamente afectado. A redução da biodisponibilidade do ON leva também a que ocorram importantes alterações na expressão endotelial de moléculas de adesão, que levam a uma desregulação dos processos inflamatórios9,11,12. Desta forma, a disfunção endotelial, para além da inibição de vasodilatação, é também caracterizada por alterações pró-inflamatórias, pró-coagulantes e proliferativas, que podem levar à ocorrência de morte celular programada ou apoptose endotelial. Estas condições resultantes de disfunção endotelial encontram-se intimamente associadas com o desenvolvimento de aterosclerose e patologias cardiovasculares11,15-18. Estudos recentes demonstraram também, que a disfunção endotelial é a etiologia predominante na patofisiologia da disfunção eréctil (DE) masculina, e que esta condição se encontra associada ao desenvolvimento de doença cardiovascular (DCV)19-21. De facto, surgem evidências de que a DE não representa somente um sinal precoce de DCV, mas pode também ser considerada como um importante marcador de doença vascular.
EFEITOS PATOFISIOLÓGICOS DA DISFUNÇÃO ENDOTELIAL
A perda da integridade funcional do entotélio, caracterizada por alterações generalizadas nas funções das CEs, conduzem a uma redução na vasodilatação e a um estadio pró-inflamatório e pró-trombótico, sendo observado como evidência de doença vascular. A disfunção endotelial encontra-se associada à patofisiologia da aterosclerose, doença arterial periférica, diabetes e de várias doenças cardiovasculares, como doença coronária e insuficiência cardíaca congestiva9. A função das CEs é extremamente afectada pela diabetes e por diversos factores de risco cardiovasculares como a hipertensão, a obesidade abdominal, a dislipidemia e a hiperglicemia, conjunto de factores designados actualmente por síndrome metabólico22. Estes factores podem actuar directamente no endotélio vascular, danificando-o e favorendo o aparecimento de várias lesões iniciais que contribuem para o desenvolvimento das patologias supracitadas. Entre as acções nocivas que provocam nas CEs, inclui-se a formação e acumulação de espécies de oxigénio reactivas (ROS) e de produtos avançados de glicação, que levam a alterações nos processos essenciais para a manutenção da função endotelial23-25. As ROS actuam em parte pela da inibição da actividade e biodisponibilidade de ON, estando também envolvidas directamente na indução da apoptose endotelial, através do aumento da expressão de genes envolvidos na morte celular programada23,24,26. Como previamente mencionado, níveis reduzidos de ON promovem por sua vez a ocorrência de inflamação vascular, pela indução tanto da expressão de moléculas de adesão endotelial, como da produção de proteínas quimiotácticas envolvidas no tráfego leucocitário27,28. A formação de produtos avançados de glicação nas CEs associa-se a alterações que conduzem a um decréscimo na produção de factores de crescimento vascular, essenciais para a manutenção da homeostase endotelial24. Devido à localização e importantes funções das CEs presentes nas estruturas vasculares cavernosas, estas alterações moleculares endoteliais provocadas por factores de risco cardiovascular, vão afectar profundamente o endotélio peniano e consequentemente a fisiologia eréctil. De facto, a DE vasculogénica conduz a uma insuficiência vascular que provoca desordens do fluxo arterial, e consequente inibição do relaxamento do músculo liso cavernoso, orinando fibrose e disfunção veno-oclusiva29,30. Existem várias evidências que revelam uma forte associação entre factores de risco cardiovascular e DE, considerando-se mesmo que a DE pode ser um factor preditivo para a ocorrência de DCV19,20,31,32. A ocorrência prévia de DE deve-se ao facto de o diâmetro da artéria peniana ser substancialmente mais reduzido do que o da artéria coronária e da carótida, e desta forma alterações vaculares que condicionem o fluxo sanguíneo cavernoso, afectarão inicialmente a função erétil, podendo ser um indício para desenvolvimento de DCV. Foi mesmo reportado que a DE se manisfesta aproximadamente 39 meses antes da ocorrência de um evento cardíaco33,34. Contudo, a DE é cada vez mais considerada como um importante marcador não apenas de DCV, mas de doença vascular sistémica, manifestando-se previamente ao aparecimento de sintomas característicos de cada patologia vascular35.
MECANISMOS DE REPARAÇÃO VASCULAR LOCAL E SISTÉMICO: ANGIOGÉNESE E VASCULOGÉNESE ADULTA
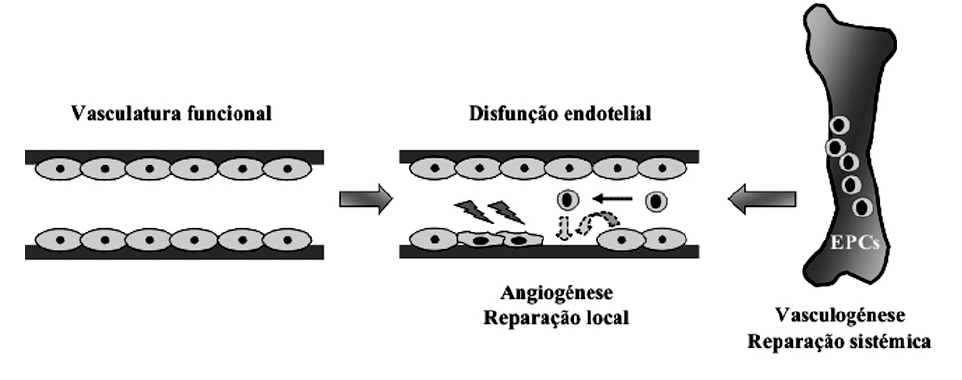
Como resposta a danos infringidos nas CEs, levando à perda da sua integridade funcional, o endotélio vascular acciona mecanismos de reparação e regeneração endotelial, designados por angiogénese e vasculogénese adulta. O processo angiogénico é um processo de reparação local, que envolve a proliferação e migração de CEs adjacentes até ao local vascular danificado, reparando-o36-38. Por outro lado, o processo de vasculogénese adulta é considerado um processo de reparação sistémico, em que células progenitoras endoteliais (EPCs) residentes na medula óssea, são mobilizadas para a circulação periférica até locais de neoangiogénese onde se diferenciam em CEs maturas, regenerando o endotélio37,39-41 (fig. 1). A angiogénese é um processo essencial no crescimento e remodelação da árvore vascular, que se processa a partir de CEs de estruturas vasculares pré-existentes42. Durante o desenvolvimento embrionário, a vasculatura é inicialmente originada a partir de um conjunto de vasos sanguíneos previamente formados no embrião por vasculogénese, um processo através do qual estruturas vasculares iniciais são formadas de novo a partir de progenitores endoteliais ou angioblastos43. Após a formação do plexo vascular inicial, ocorre a sua remodelação e crescimento através da proliferação e migração coordenadas das CEs do endotélio primordial, por angiogénese, dando origem a novas estruturas vasculares necessárias ao desenvolvimento dos vários orgãos38. No indivíduo adulto a vasculatura encontra-se maioritariamente quiescente, podendo o processo angiogénico ser activado em condições fisiológicas, como processos de cicatrização, manutenção da homeostasia vascular e durante o ciclo menstrual feminino. Contudo, uma desregulação nos mecanismos angiogénicos contribui para o desenvolvimento de várias patologias como, isquemia, artrite reumatoíde, retinopatia diabética, desenvolvimento tumoral, entre muitos outros36-38,42,44. Durante muitos anos considerou-se que no adulto todos os processos neovasculares ocorriam somente por angiogénese. Contudo, descobertas efectuadas na última década demonstraram que EPCs derivadas da medula óssea adulta possuem funções análogas aos angioblastos embrionários, podendo ser mobilizadas para a circulação periférica até locais neovasculares, participando neles activamente através da sua diferenciação em CEs funcionais39-41. Vários estudos demonstraram que as EPCs desempenham um papel crucial em mecanismos fisiológicos, de reparação vascular reparação endógena e na cicatrização, e no crescimento endotelial em condições patológicas, como na isquemia do miocárdio e no desenvolvimento tumoral39-41,45-49. Embora o processo de angiogénese seja o principal mecanismo de neovascularização, a vasculogénese adulta contribui com ele de forma sinergística, célere e eficiente na formação de novas estruturas vasculares.
Figura 1. Regeneração endotelial mediada pelos processos de angiogénese e vasculogénese adulta. Após a ocorrência de danos endoteliais endógenos que originam disfunção endotelial, a camada vascular afectada é regenerada por células endoteliais adjacentes, por angiogénese, e através do recrutamento de células progenitoras endoteliais (EPCs), por vasculogénese.
O processo angiogénico. Step by step
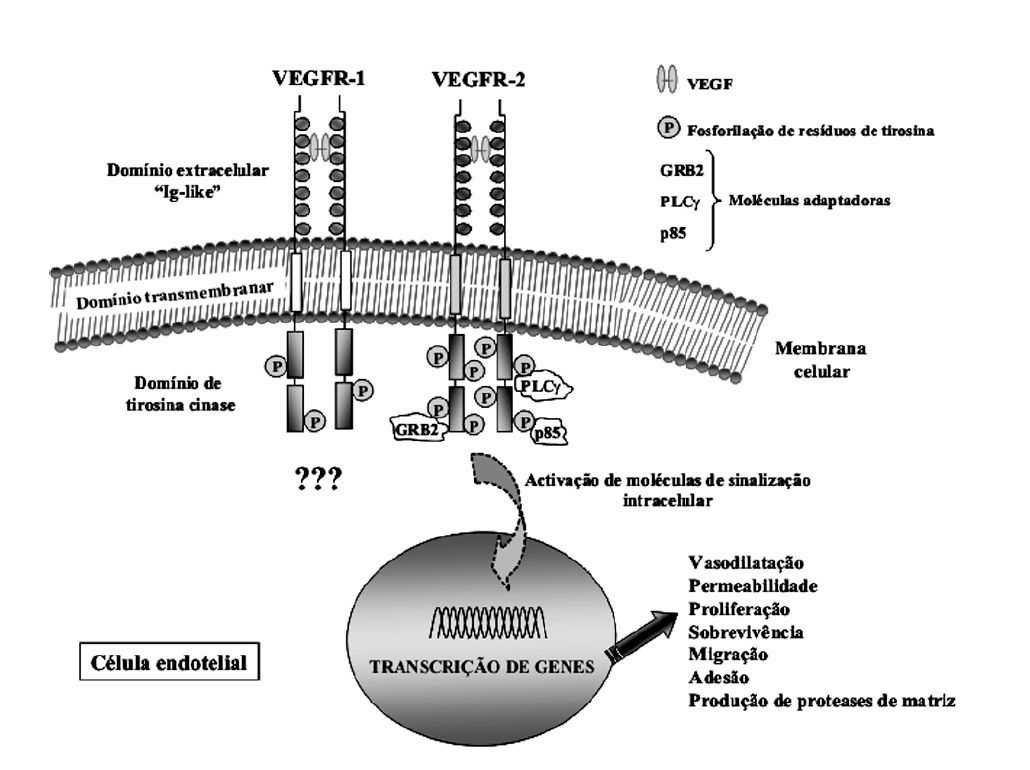
A angiogénese refere-se ao processo complexo pelo qual novos vasos sanguíneos se formam a partir da vasculatura pré-existente, com a coordenada intervenção de múltiplos factores angiogénicos e anti-angiogénicos, a interacção de variados tipos celulares e componentes da matriz extracelular42. A angiogénese processa-se em várias fases a partir de endotélio vascular quiescente, que quando estimulado inicia o processo através do aumento da vasodilatação, da permeabilidade, seguido pela degradação da matriz extracelular, permitindo às CEs activadas proliferarem, sobreviverem, migrarem, diferenciarem-se e formarem novos lumens vasculares. As estruturas resultantes são posteriormente remodeladas, com a deposição de nova matriz extracelular e de células peri-vasculares diferenciadas50,51. Sabe-se actualmente que o processo angiogénico é sequencialmente orquestrado por uma dinâmica interacção entre vários factores, que actuam de forma coordenada controlando a série de eventos envolvida na formação de novas estruturas vasculares. Moléculas angiogénicas como as Angiopoietinas-1 e -2 (Ang-1 e -2), o Factor de Crescimento de Fibroblastos (FGF) e o Factor de Crescimento Derivado das Plaquetas (PDGF), entre muitos outros, ligam-se aos seus receptores membranares nas CEs contribuindo directa ou indirectamente para o processo neovascular52. Contudo, o Factor de Crescimento Endotelial Vascular ou VEGF, uma potente citocina mitogénica, é reconhecido como sendo a molécula chave em todo o processo, dado que se encontra presente espacial e temporalmente em todas as fases do crescimento vascular, participando nelas activamente53,54. O VEGF medeia as suas accções biológicas através da ligação a dois receptores de tirosina cinase transmembranares presentes nas CEs, designados por VEGFR-1 e VEGFR-2. Os receptores do VEGF são constituídos por um domínio extracelular semelhante às imunoglobulinas ("Ig-like domain"), seguido por uma região transmembranar e por um domínio de tirosina cinase localizado na parte citoplasmática (fig. 2). O VEGF após a sua interacção com ambos receptores induz autofosforilação dos resíduos de tirosina cinase citoplasmáticos, activando posteriormente várias moléculas intermediárias por fosforilação, que iniciam variadas cascatas de sinalização intracelular. Como consequência o endotélio activado é estimulado a proliferar, sobreviver e migrar, ocorrendo também vasodilatação, permeabilidade vascular e produção de proteases de matriz (MMPs)55-59. Embora os VEGFRs sejam estruturalmente homólogos, após a ligação do VEGF os efeitos biológicos por eles mediados são bastante distintos. Encontra-se actualmente estabelecido que todas as respostas endoteliais são mediadas pela ligação do VEGF ao VEGFR-2 originando uma potente fosforilação e activação de sinais intracelular. O papel desempenhado pelo VEGFR-1 nas CEs no decorrer da angiogénese permanece ainda controverso e discutível (Figura 2)60,61. Desta forma, após a interacção VEGF/VEGFR-2 no endotélio o processo angiogénico é iniciado, com o aumento de produção de ON e consequentemente de vasodilatação vascular62. A mesma via angiogénica, induz o aumento da permeabilidade vascular, originando o extravasamento de proteínas plasmáticas que formam uma estrutura temporária, que vai servir de suporte às CEs activadas aquando da sua migração. Simultaneamente vai ocorrendo degradação da matriz extracelular através do aumento da produção de MMPs, induzidas por acção do VEGF63,64. As MMPs desempenham um papel central na degradação de barreiras físicas celulares, nomeadamente de membranas extracelulares e da membrana basal, permitindo que as CEs estimuladas a proliferar por acção do VEGF, migrem para locais distantes50. Desta forma, as CEs migram através da matriz extracelular formando cordões sólidos que subsequentemente adquirem lumen, sendo o processo angiogénico fisiológico posteriormente terminado com a produção de factores anti-angiogénicos, como a trombospondina-1, a re-estruturação da matriz extracelular e deposição de células peri-vasculares65. Quando não ocorre de forma coordenada e temporal um equilíbrio entre a produção de moléculas pró e anti-angiogénicas, o processo de neovascularização vai processar-se de forma desregulada. Estudos revelaram uma associação entre a presença de factores de risco cardiovascular e alterações na expressão de proteínas angiogénicas, facto que poderá condicionar a reparação e reversão de danos endoteliais presentes nessas condições66.
Figura 2. Estrutura e funções desempenhadas pelo VEGF e seus receptores no endotélio vascular. O VEGF liga-se aos seus receptores de tirosina cinase VEGFR-1 e VEGFR-2 nas células endoteliais, induzindo uma potente fosforilação dos resíduos de tirosina cinase no VEGFR-2, que por sua vez recrutam várias moléculas adaptadoras (GRB2, PLC?, p85), iniciando cascatas de sinalização intracelular que culminam com a activação nuclear da expressão de vários genes angiogénicos. Embora o VEGFR-1 apresente uma homologia estrutural com o VEGFR-2, as suas funções no endotélio são ainda controversas.
Vasculogénese adulta. A queda de um dogma
O processo de vasculogénese adulta prevaleceu durante muitos anos como um dogma, dado que se pressupunha que no adulto novas estruturas vasculares seriam apenas originadas pela proliferação e migração de CEs pré-existentes, por angiogénese, e que o processo de vasculogénese se encontraria confinado à vida embrionária. Contudo, este dogma caiu quando estudos demonstraram a existência de uma escassa população de células progenitoras endoteliais (EPCs) na medula óssea adulta, que poderia ser recrutada para a circulação periférica, extravasando em locais de desenvolvimento vascular onde se diferenciariam em CEs funcionais e integrando estruturas vasculares. De facto, inúmeras linhas de investigação demonstraram que o processo de vasculogénese presente no embrião, foi adaptado na vida adulta, contribuindo para processos vasculares em várias condições patofisiológicas que dependem de um suporte vascular eficiente39,46-49. Estas descobertas alteraram o conceito de neovascularização pós-natal, de angiogénese para angio/vasculogénese46. Contudo, esta população celular foi somente identificada no final da década de 90 a partir de células mononucleares de sangue periférico de indivíduos adultos, sendo a sua descoberta tardia devida fundamentalmente à ausência de marcadores celulares específicos exclusivos das EPCs46,67. De facto, tanto CEs diferenciadas como um sub-grupo de células hematopoiéticas, partilham com as EPCs um padrão de expressão de receptores de superficie, tornando a sua identificação, isolamento e caracterização fenotípica complicada e controversa. Actualmente estabeleceu-se algum consenso nesta matéria e encontra-se definido que são consideradas EPCs, a população de células que expressa concomitantemente VEGFR-2, CD34 e CD133 (um antigénio de superfície de expressão restrita a EPCs e células estaminais hematopoiéticas)46,67,68. Contudo, à medida que estas células são mobilizadas, proliferam e se diferenciam em CEs os seus marcadores de superfície vão variando69. Apesar de fenotípicamente idênticas, funcionalmente EPCs e CEs são bastante distintas, sendo que as primeiras possuem um potencial proliferativo extremamente elevado, característica ausente em CEs diferenciadas70. As EPCs, de forma a participarem em processos de neovascularização ou de reparação vascular, respondem a estímulos específicos que induzem a sua saída da medula e recutamento para locais neovasculares. Embora não se encontre totalmente esclarecido o mecanismo exacto pelo qual ocorre mobilização de EPCs, o Factor de Estimulação de Colónias de Granulócitos e Macrófagos (GM-CSF), o Factor Derivado do Estroma-1 (SDF-1) e o VEGF foram foram já sugeridos como moléculas implicadas, sendo este último considerado como o mediador mais importante71-73. O VEGF funciona como potente quimioatractor actuando no seu receptor, VEGFR-2, presente nas EPCs activando vias de transdução de sinal que induzem uma resposta migratória. Vários estudos demonstraram que a administração exógena de VEGF promove uma rápida mobilização de EPCs para a circulação periférica, sendo que a cinética de recrutamento celular se encontra directamente associada com os níveis de VEGF presentes na corrente sanguínea71,74. Tais factos foram observados em doentes queimados, em que o número de EPCs aumentou aproximadamente 50 vezes, num período de 12 horas após a ocorrência do trauma vascular. Este acréscimo de EPCs foi acompanhado pelo aumento sérico de VEGF74. A importância funcional destas células na formação de novas estruturas vasculares tem sido extensivamente avaliada, sendo que a sua contribuição tenha sido considerada essencial para o crescimento vascular em condições patofisiológicas e para reparação endotelial endógena39,46-49. Contudo, para além do seu potencial regenerador, existem evidências de que o número de EPCs circulantes poderão também ser usadas como factor de diagnóstico. Estudos demonstraram que uma diminuição nos níveis de EPCs em circulação poderão ser reveladores de disfunção endotelial, e foram observados em doentes que acumulam vários factores de risco para o desenvolvimento de doença cardiovascular75. De facto, a redução no número de EPCs vai condicionar a sua acção vasculoprotectora, impedindo-as de eficientemente repararem e regenerarem áreas vasculares que apresentem danos endoteliais.
ALTERAÇÕES LOCAIS E SISTÉMICAS DOS MECANISMOS DE REPARAÇÃO VASCULAR NA DISFUNÇÃO ERÉCTIL
Os mecanismos de reparação endotelial, locais e sistémicos, são de vital importância para a manutenção da homeostasia vascular, reparando a vasculatura afectada devido à ocorrência de danos endógenos que levam à disfunção endotelial. Após a deterioração da integridade da monocamada endotelial, esta pode então ser regenerada através da proliferação e migração de CEs adjacentes, por angiogénese, ou através do recrutamento de EPCs para locais de vascularização onde se diferenciam em CEs funcionais. Contudo, se os danos endoteliais causados não forem reparados eficientemente, podem tornar-se demasiado extensos e mesmo irreversíveis, ficando a capacidade de restauração e a integridade do endotélio comprometida. Estudos recentes revelaram que em condições de DE, disrupções no endotélio cavernoso causadas por disfunção endotelial, não são devidamente regeneradas devido a alterações funcionais nos processos de angiogénese e vasculogénese adulta76. Desta forma não é possível reparar a vasculatura de modo a que a homeostase endotelial peniana seja reconstituída e as condições de DE revertidas. Vários estudos demonstraram que proteínas angiogénicas e seus receptores, nomeadamente o sistema VEGF/VEGFRs, se encontram alterados na vasculatura cavernosa o que poderá condicionar a sua função de regeneração angiogénica77-79. Analogamente foi também sugerido que o sistema de reparação sistémico se encontra desregulado, dado que o número de EPCs circulantes se encontra significativamente reduzido em indivíduos com DE, inibindo a eficiente reparação vasculoprotectora80.
Angiogénese. Alteração do sistema VEGF/VEGFR no tecido cavernoso
Dada a importância deste mecanismo na manutenção da integridade endotelial, vários estudos centraram-se na avaliação local das funções de factores angiogénicos na manutenção da homeostase da vasculatura peniana. Várias experiências efectuadas em modelos animais com factores de risco cardiovascular, investigaram as vias angiogénicas moleculares envolvidas na regulação da vascularização cavernosa. Foi demonstrada uma diminuição na expressão de proteínas angiogénicas como o VEGF, Ang-1 e -2, com a consequente inibição da activação de importantes vias de transdução de sinal intracelular76,77,79. A redução da sinalização mediada pelo VEGF, levou a uma inibição da produção endotelial de ON e a um aumento de apoptose no tecido eréctil, reinforçando o importante papel desempenhado pelo VEGF no corpo cavernoso77. Similarmente, foi também observado que a expressão dos receptores do VEGF se encontra diminuída no tecido eréctil, restringindo os locais de ligação do VEGF e condicionando as suas funções angiogénicas78. Tornou-se evidente que alterações no sistema de sinalização VEGF/VEGFR poderiam estar envolvidas na patofisiologia da DE, e pressupondo-se que terapias moleculares com VEGF poderiam reverter esta disfuncionalidade, reabilitar esta via de sinalização endotelial e melhorar a função eréctil. De facto, foi demonstrado que várias terapias moleculares envolvendo a expressão transiente de VEGF restauraram a função eréctil, induziram a produção de ON e aumentaram a viabilidade celular cavernosa através da indução da expressão de genes anti-apoptóticos81-83. Terapias combinadas utilizando dois importantes factores angiogénicos, o VEGF e a Ang-1, aumentaram sinergísticamente a angiogénese cavernosa, reinforçando a funcionalidade e estrutura do endotélio84. Contudo, permanece por clarificar qual o método de terapia molecular para expressão de mediadores angiogénicos mais eficiente, quais as combinações de moléculas angiogénicas que confereram melhores resultados e quais os efeitos a longo prazo destas terapias na manutenção da funcionalidade e integridade endotelial.
Vasculogénese. EPCs e disfunção eréctil
Após a descoberta das funções mediadas pelas EPCs na regeneração vascular, vários estudos investigaram a potencialidade destas células na reparação de danos endógenos e na manutenção da homeostase vascular. Dada a importância desta população celular, várias publicações sugeriram que alterações na sua mobilização da medula óssea para a circulação periférica, inibiriam o seu potencial regenerador, contribuindo para a disfunção endotelial. Foi demonstrado que o número de EPCs em circulação é afectado por factores de risco cardiovascular, que potencialmente actuam aumentando a apoptose ou interferindo com várias vias de transdução de sinal que regulam o potencial migratório das EPCs85. De facto, foram observadas diminuições significativas no número de EPCs circulantes em indivíduos com DE75,80,86. Esta diminuição de EPCs em circulação foi associada com uma ineficiente capacidade de reparação endotelial que pode afectar a integridade vascular peniana, permitindo a progressão da condição de DE, e consequentemente de DCV80,87. Interessantemente, estudos revelaram que tratamentos com inibidores da fosfodiesterase tipo 5 (PDE5), como o vardenafil (administrado "on demand") e o tadalafil (administrado crónicamente), induzem o recrutamento de EPCs aumentando o seu número em circulação e revelando uma melhoria na função eréctil, indicativa de um aumento da função endotelial88,89. Embora o mecanismo específico de actuação destes fármacos na mobilização e/ou produção de EPCs permaneça por definir, descobertas recentes demonstraram que existe expressão de PDE5 na medula óssea, podendo inibidores desta enzima actuar ao nível da medula, activando mecanismos que promovam a mobilização das EPCs para a circulação89. Outra potencial explicação para estas acções mobilizadoras, reside no facto de inibidores da PDE5 poderem aumentar a expressão do VEGF e do seu receptor VEGFR-2, levando através da activação deste mecanismo molecular ao recrutamento de EPCs90. Contudo, é necessário verificar se uma inibição na mobilização das EPCs em indivíduos com DE se deve ao facto da expressão do VEGF ou do VEGFR-2 se encontrarem reduzidas, e se de facto inibidores da PDE5 aumentam o número de EPCs em circulação através da regulação deste sistema de sinalização, promovendo e restaurando desta forma o potencial vasculoprotector das EPCs.
CONCLUSÕES
A perda generalizada das funções vasculares, designada por disfunção endotelial é a etiologia predominante para a ocorrência de DE. Danos endógenos causados no endotélio são normalmente reparados através de mecanismos locais e sistémicos, de angiogénese e vasculogénese adulta, respectivamente. Contudo, disrupções nas funções do endotélio cavernoso não são devidamente reparadas devido a alterações nos processos de angiogénese e vasculogénese. Algumas das alterações angiogénicas envolvidas nesta desregulação foram já identificadas, e potencialmente revertidas recorrendo-se a terapias moleculares específicas. Na vasculogénese adulta, a redução no número de EPCs circulantes presentes em indivíduos com DE condiciona a sua função vasculoprotectora, sendo que esta alteração pode ser revertida através de tratamentos com inibidores da fosfosdiesterase tipo 5. Embora permaneçam ainda muitas questões por responder, torna-se cada vez mais evidente a importância de uma melhor compreensão dos mecanismos moleculares angiogénicos e vasculogénicos que governam a função endotelial cavernosa, de forma a se perspectivarem terapias direccionadas mais específicas.
Correspondência:
Carla Costa.
Laboratório de Biologia Celular e Molecular Molecular.
Faculdade de Medicina da Universidade do Porto.
Al. Prof. Hernâni Monteiro. 4200-319 Porto. Portugal.
Correio electrónico: carcosta@med.up.pt