INTRODUCCIÓN
En las últimas décadas, la demanda para cirugía de reasignación de sexo en pacientes transexuales se ha incrementado de manera importante1. Este incremento ha sorprendido a muchos profesionales de la salud de diversas disciplinas que no han querido o no han sabido abordar este problema prácticamente ausente todavía de los textos médicos, y que más bien se considera un hecho marginal de aberración sexual, no distinguiendo a los transexuales de otros colectivos. Esta actitud, no sólo de los profesionales sanitarios sino también de la sociedad española en general, ha hecho que los transexuales tropiecen con multitud de problemas para tratarse en los hospitales públicos españoles y busquen refugio y soluciones precisamente en la marginalidad.
Los transexuales buscan adaptar su cuerpo al sexo biológico opuesto al que ellos se sienten pertenecer. El tratamiento hormonal juega un papel importante en este proceso2. Idealmente, el tratamiento hormonal debe suprimir los caracteres sexuales secundarios del sexo original e inducir los del sexo opuesto lo más completa y rápidamente posible. Por ello hay una inclinación a maximizar la dosis hormonal y usar muy diversas pautas de tratamiento aprendidas de la experiencia de otros transexuales. Así, la autoterapia con esteroides sexuales incrementa el riesgo de efectos adversos3. Estos efectos han sido ampliamente publicados en tratamientos con esteroides sexuales para afecciones más convencionales, como contraceptivos orales en mujeres de edad fértil4,5, sustitución estrogénica en mujeres posmenopáusicas6, tratamiento estrogénico del carcinoma de próstata7 o sustitución androgénica en varones8; sin embargo, en transexuales las publicaciones acerca de efectos indeseables del tratamiento hormonal para el cambio de sexo han sido pocas.
El objetivo de nuestro trabajo fue analizar los efectos adversos de la autoterapia con esteroides sexuales para cambio de sexo en una población de transexuales.
PACIENTES Y MÉTODOS
Pacientes
Se revisaron las historias clínicas de pacientes transexuales atendidos por un equipo multidisciplinar formado por psicólogo, psiquiatra, endocrinólogo, ginecólogo, urólogo y cirujano plástico durante 8 años, entre enero de 1997 y diciembre de 2004. El diagnóstico de transexualismo se hizo basándose en los Standards of Care of the Harry Benjamin Gender Dysphoria Association9. Nosotros hemos atendido a 236 pacientes transexuales, con una edad media de 34 años, entre 19 y 54 años, con diferente nivel de estudios (23% primarios, 41% medios y 36% superiores); 129 de hombre a mujer (H-a-M) y 107 de mujer a hombre (M-a-H).
Intervenciones diagnósticas y terapéuticas
Todos los pacientes fueron evaluados por psicólogo o psiquiatra para diagnosticar el trastorno de identidad, descartar otro proceso psicológico concomitante y procurarle ayuda psicológica a quien lo necesitase.
Después se remitieron a la consulta de endocrinología. Después de una anamnesis y exploración clínica detalladas, y con medidas del peso corporal, talla e índice de masa corporal (IMC = peso corporal en kg/ talla en m2), se determinó en suero: glucosa; urea; creatinina; colesterol total (CT); triglicéridos (TG); colesterol unido a lipoproteínas de alta densidad (cHDL); colesterol unido a lioproteínas de baja densidad (cLDL); enzimas hepáticas, y concentraciones séricas de prolactina (PRL), testosterona (T), Δ-4-androstenediona (A), sulfato de dehidroepiandrosterona (DHEA-S), 17-β-estradiol (E2), progesterona (PG), 17OH-progesterona (17OH-PG), hormona folículo estimulante (FSH), hormona luteinizante (LH) y hormona tirotropa (TSH).
Una vez descartadas contraindicaciones y confirmada la normalidad de las pruebas bioquímicas se inició tratamiento hormonal cruzado. En transexuales H-a-M se prescribió etinil estradiol a dosis de 100 μg/día por vía oral y acetato de ciproterona a dosis de 100 mg/día por vía oral. En transexuales M-a-H se prescribió cipionato de testosterona a dosis de 250 mg cada 15-21 días por vía intramuscular. En los últimos años, con la salida al mercado español de los parches dérmicos de 5 mg por día hemos preferido esta pauta, más fisiológica, pero los frecuentes problemas de alergia en el sitio de contacto con la piel nos ha hecho preferir de nuevo la vía intramuscular.
Métodos de laboratorio
Todas las determinaciones de laboratorio se realizaron en condiciones basales, a las 8 h del día y tras al menos 8 h de ayunas, en una sola muestra sanguínea. Todas las determinaciones bioquímicas, excepto las hormonales, se realizaron automáticamente en un autoanalizador BM/Hitachi 717, mediante técnicas enzimáticas a punto final. La concentración en suero de glucosa, CT y TG se determinó mediante un método enzimático colorimétrico. Se consideraron diabéticos los pacientes con valores de glucemia > 126 mg/dl, y dislipémicos, aquéllos con CT o TG > 200 mg/dl. La separación de las partículas HDL del CT se hizo por precipitación con polietilenglicol. Se consideraron dislipémicos los pacientes con valores < 35 mg/dl. La determinación de cLDL se calculó usando la fórmula de Friedewald et al10, donde cLDL = CT ([TG/5] + cHDL). Se consideraron dislipémicos los pacientes con concentraciones de cLDL >150 mg/dl. Los cocientes CT/cHDL y cLDL/cHDL11 se calcularon a partir de los parámetros lipídicos y lipoproteicos obtenidos, y se consideraron pacientes con riesgo cardiovascular los que tenían valores > 4 y > 3, respectivamente. La urea se determinó por el test UV cinético, y se consideró como rango de normalidad 10-50 mg/dl; y la creatinina, por el método de Jaffé, cinético, sin desproteinización, y como valores de normalidad hasta 1,2 mg/dl. La GOT se determinó mediante el test UV aspartato-aminotransferasa, y se consideraron valores de normalidad hasta 35 U/l; la GPT con el test UV alanina-aminotransferasa, y valores normales hasta 35 U/l, y la GGT mediante el test L-g-glutamil transferasa, y como valores normales hasta 30 U/l. Las determinaciones hormonales se realizaron por métodos de quimioluminiscencia (IMMULITE, DPC, LA, CA), excepto la TSH, que se determinó por IRMA (Auto Delfia, Wallac, Gaithersburg, MD). Los coeficientes de variación interensayo e intraensayo para PRL fueron 6,6 y 10,5%, respectivamente. En los pacientes con valores de PRL > 100 mU/l se efectuó resonancia magnética hipofisaria.
Análisis estadístico
Se realizó un análisis de tipo descriptivo de ambos grupos estudiando cada una de las variables, expresándolas como media ± desviación estándar. Se estudiaron las diferencias entre ambos grupos mediante análisis de la varianza para 2 vías. Para transformar las variables cuantitativas en cualitativas y poder comparar ambos grupos mediante el test de la χ2, se realizó un estudio de prevalencia de anormalidades de las distintas variables. También se estudiaron las posibles asociaciones entre todas las variables utilizando el coeficiente de correlación de Pearson o Spearman, según el tipo y la distribución de las variables. Como nivel de significación se consideró válido una p < 0,05.
RESULTADOS
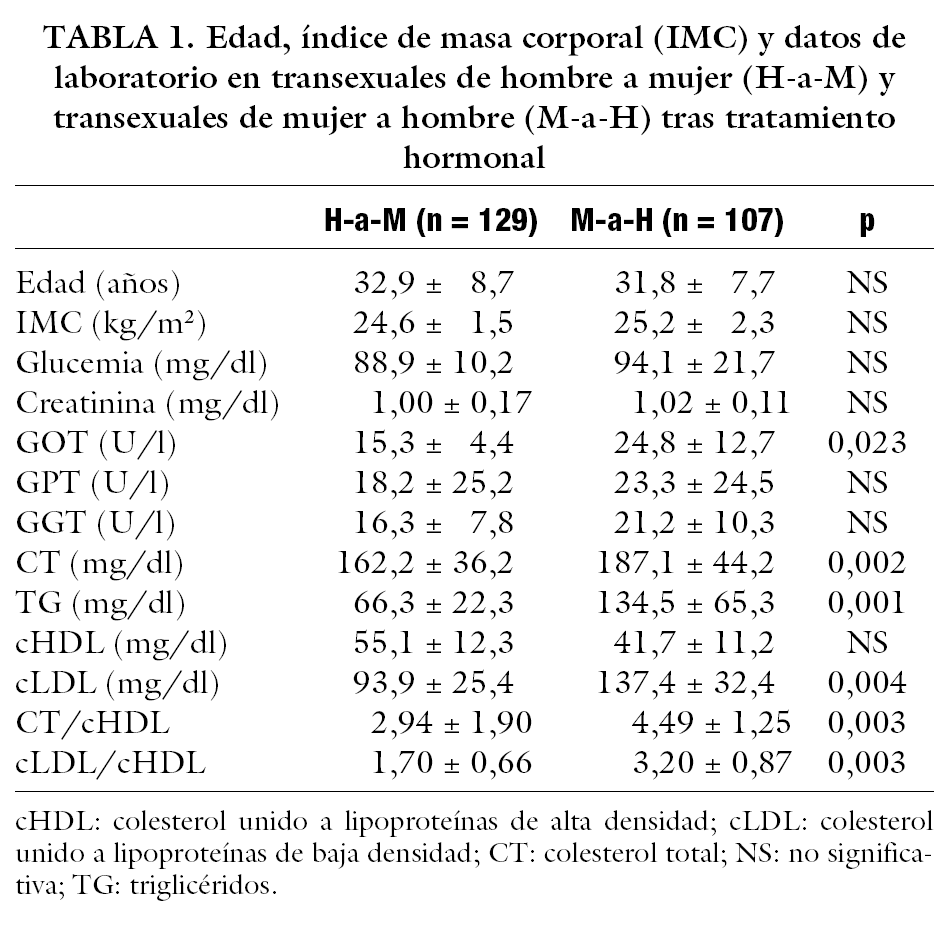
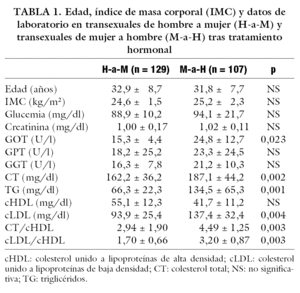
En la tabla 1 se muestran los niveles medios de edad, IMC y datos de laboratorio. En ella se observa que los transexuales M-a-H presentan valores de GOT significativamente mayores que los transexuales H-a-M. Lo mismo ocurre en cuanto a los valores de CT, TG, cLDL y cocientes CT/cHDL y cLDL/cHDL.
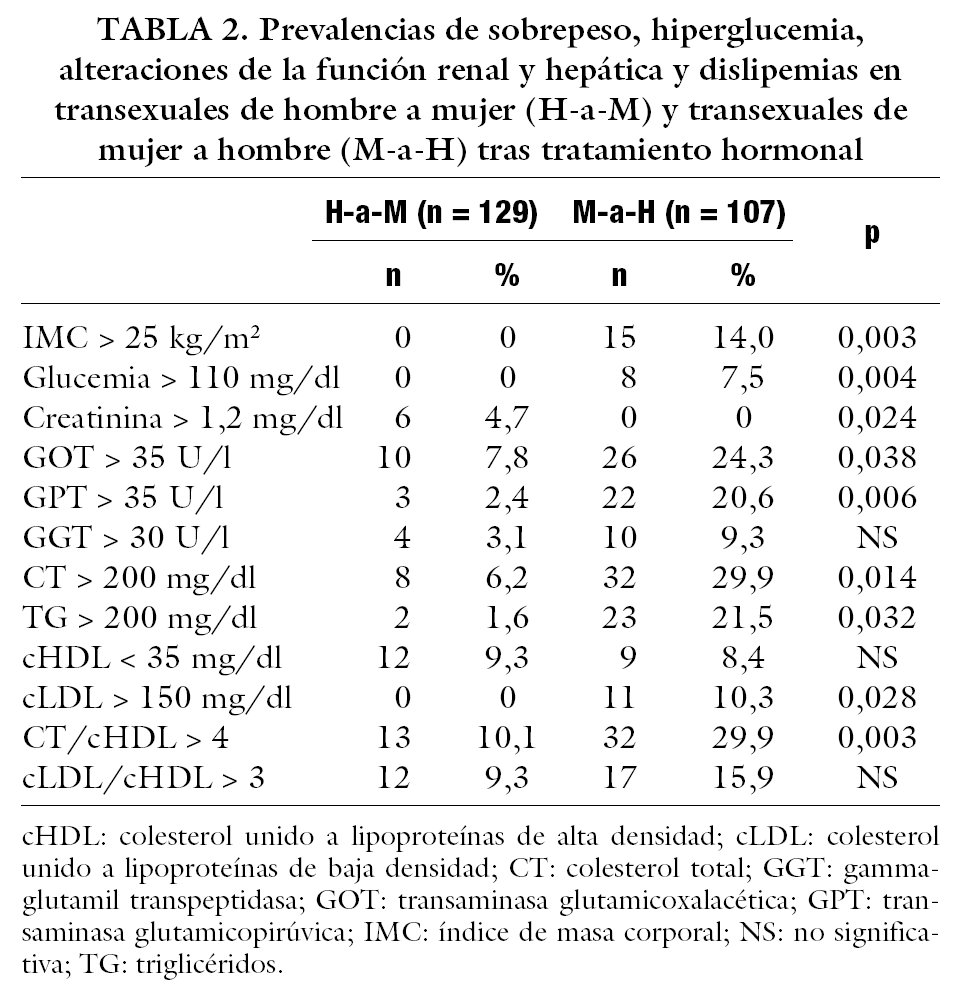
En la tabla 2 se recogen las prevalencias de alteraciones de las mismas variables, observándose que en general éstas son más comunes en transexuales M-a-H, excepto en las de creatinina (más frecuentes en transexuales H-a-M). La comparación de estas prevalencias entre ambos grupos alcanzan nivel de significación estadística en el IMC, glucemia, enzimas hepáticas (GOT y GPT), CT, TG, cLDL y cociente CT/cHDL.
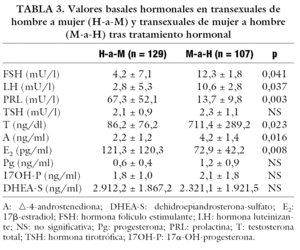
En la tabla 3 se muestran los valores medios basales hormonales, donde se observan valores significativamente mayores de PRL y E2 en transexuales H-a-M que en transexuales M-a-H. Por el contrario, los valores de FSH, LH, T y A eran mayores en transexuales M-a-H. No hubo diferencias significativas en el resto de las hormonas estudiadas.
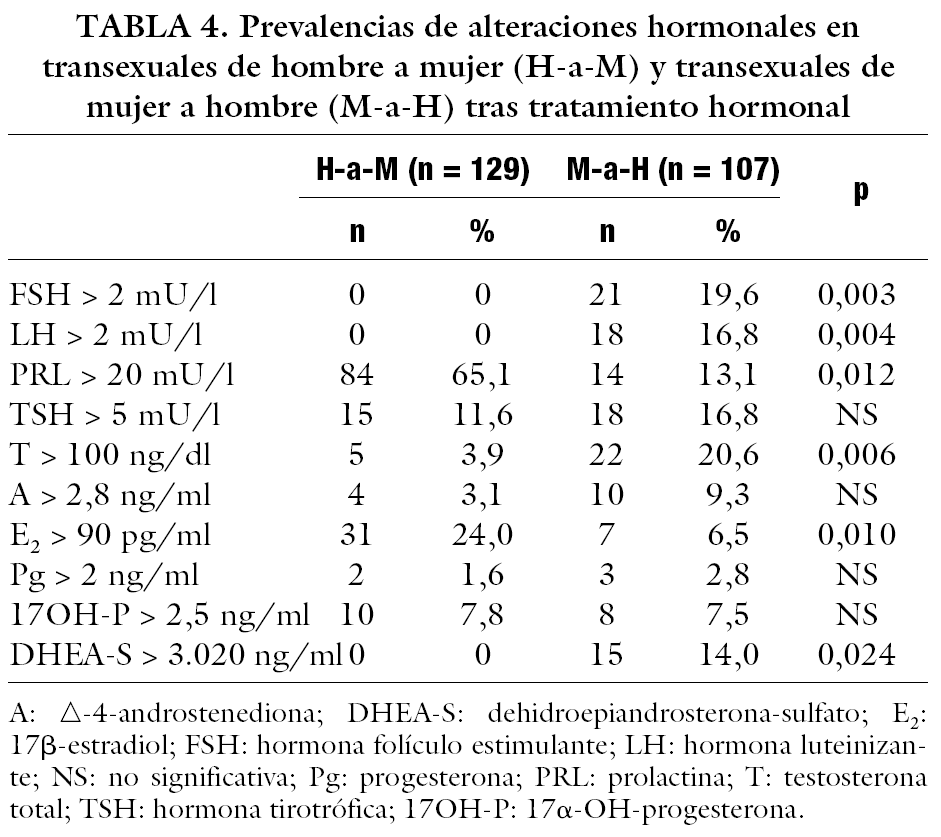
La tabla 4 muestra las prevalencias de las distintas alteraciones hormonales. En cuanto a las hormonas hipofisarias, las alteraciones de PRL y E2 fueron significativamente más prevalentes en transexuales H-a-M. Por el contrario, las alteraciones de FSH, LH, T y DHEA-S fueron significativamente más frecuentes en transexuales M-a-H; sin diferencias significativas en las del resto de las hormonas.
Del total de pacientes transexuales atendidos en nuestro equipo, 43 (18,2%) cumplimentaron con la cirugía el proceso de reasignación de sexo, sin grandes problemas relacionados con el acto quirúrgico inmediato y con diversos grados de satisfacción sexual. La calidad de vida después de varios años de cirugía había mejorado significativamente en todos. La actividad sexual era satisfactoria en 38 (88,4%) de los transexuales operados, 5 de ellos no encontraron satisfacción alguna.
DISCUSIÓN
La baja incidencia de episodios cardiovasculares en mujeres premenopáusicas, y el rápido incremento tras la menopausia, hace sospechar acerca del papel protector de los estrógenos en la enfermedad cardiovascular. Los beneficios de los estrógenos se deben a la mejoría del perfil lipoproteico, a la prevención de la oxidación de las partículas cLDL y a la acción directa sobre el endotelio vascular inhibiendo la adhesión celular y promoviendo la vasodilatación, al mismo tiempo que el tratamiento estrogénico en mujeres menopáusicas ha demostrado reducir el riesgo de infarto de miocardio un 35%12. Así, el tratamiento con estrógenos en transexuales H-a-M los coloca en la categoría de riesgo de las mujeres premenopáusicas y, por el contrario, la terapia androgénica en transexuales M-a-H los sitúa en la categoría de riesgo del varón3. Nuestro estudio confirma este hecho. En los transexuales M-a-H, tanto los valores de CT, TG y cLDL, como el riesgo cardiovascular medido por los cocientes CT/cHDL y cLDL/cHDL, fueron significativamente mayores que en transexuales H-a-M. También las prevalencias de hipercolesterolemia, hipertrigliceridemia y de cLDL y cociente CT/cHDL elevados fueron significativamente mayores en los primeros. Moffatt et al13 demuestran que en mujeres levantadoras de pesos el uso de andrógenos produce un descenso de los valores de cHDL, comparado con las que no los utilizan, y con cociente CT/cHDL menos favorables. Sin embargo, recientemente se ha señalado el efecto favorable del tratamiento con andrógenos al reducir la acumulación de grasa visceral, factor de riesgo central del síndrome X, y mejorar la sensibilidad a la insulina14. Además, se sugiere que la aromatización de estosterona a estradiol podría evitar los afectos desfavorables de los andrógenos sobre los factores de riesgo cardiovascular15. En nuestro estudio, aunque las alteraciones del perfil lipídico en transexuales no se puedan comparar ajustadas para la edad con un grupo control, parecen suficientes para sugerir que el tratamiento con andrógenos eleva el riesgo cardiovascular. No se puede asegurar si el tratamiento estrogénico por su parte produjo descenso de este riesgo, porque en un porcentaje nada despreciable se encontraron estas alteraciones.
La conexión entre valores sanguíneos hormonales y lipídicos es compleja. Estudios epidemiológicos16 sugieren que cambios en los valores sanguíneos de lípidos, similares a los ocurridos durante el tratamiento estrogénico, reducen el riesgo cardiovascular. Pero los estrógenos no previenen episodios recurrentes de enfermedad coronaria en varones hiperlipidémicos con infarto de miocardio previo. Además, en pacientes con cáncer de próstata, el tratamiento con estrógenos se ha asociado a un incremento en la incidencia de episodios cardiovasculares y mortalidad7. El efecto de los andrógenos sobre los lípidos sanguíneos (incremento de CT y descenso de cHDL) se ha encontrado en mujeres tratadas con testosterona (100 a 800 mg/mes intramuscular) por transexualismo17. Este estudio demuestra un incremento de los valores de CT a dosis bajas (100 a 300 mg/mes) y a dosis altas (800 mg/mes). La primera dosis es comparable a la que usaron los pacientes de nuestro estudio, donde sí se encontraron mayores valores de CT y mayor prevalencia de hipercolesterolemia que en transexuales H-a-M tratados con estrógenos, pero sin diferencias entre ambos grupos en cuanto a valores de cHDL o en prevalencias de cHDL disminuido.
Las alteraciones de las enzimas hepáticas que se encontraron en nuestro estudio no se pueden achacar a hepatitis viral puesto que ninguno de los pacientes incluidos presentó serología positiva, aunque no se puede descartar su origen tóxico (alcohol). Anormalidades transitorias de las enzimas hepáticas sin producir daño hepático también se han descrito en estudios en varones tratados con estrógenos por transexualismo16 o en pacientes con cáncer de próstata tratados con estrógenos7. Se han reportado 3 casos de carcinoma hepatocelular en pacientes tratados con acetato de ciproterona16. Altas dosis de este producto (150 a 300 mg/día) se han asociado con hepatotoxicidad durante los 3-6 meses del inicio del tratamiento en algunos pacientes con cáncer de próstata7. No se ha encontrado ningún signo de tumor hepático en nuestra población, pero el uso de este fármaco podría
ser la causa de la elevación de las enzimas hepáticas en los sujetos de nuestra población de transexuales H-a-M.
El tratamiento estrogénico en varones también se ha asociado con un incremento en la incidencia de complicaciones tromboembólicas3. No se han objetivado estos procesos en ninguno de nuestros pacientes.
La exposición a estrógenos endógenos (gestación) o exógenos (contraceptivos orales) se asocia a incremento en la síntesis, almacén y secreción de prolactina, y a proliferación de células lactotrofas pituitarias18, y puede producir adenomas; éstos no son más frecuentes ni de mayor tamaño que en mujeres no gestantes y que no consumen contraceptivos orales19. El mecanismo de acción permanece controvertido, aunque cualquier medicación con propiedades antagonistas dopaminérgicas puede disminuir la inhibición de la secreción de PRL, dando lugar a hiperprolactinemia20. En ratas, los prolactinomas pueden ser inducidos por grandes dosis de estrógenos18. En humanos, la inducción de un prolactinoma por el uso de estrógenos no se ha establecido bien, aunque se ha sugerido que algunas mujeres son más sensibles a los efectos lactogénicos de los estrógenos exógenos21, y lo mismo podría aplicarse a los hombres22. La administración de estrógenos en transexuales H-a-M da lugar a grados variables de hiperprolactinemia, que puede asociarse con agrandamiento pituitario23, aunque sólo se han descrito 2 casos, uno con valores de 6,2 U/l (normal 0,05-0,30 U/l)24, y otro con 114 μg/l (normal < 20 μg/l)25. La magnitud del incremento de los valores de PRL se ha asociado con la dosis de estrógenos23, y todos los pacientes de nuestro estudio utilizaron dosis ligeramente altas de estrógenos. En los únicos 10 casos (todos H-a-M tratados con estrógenos) que superaron los valores de 100 mU/l se realizó una resonancia magnética hipofisaria, que fue negativa. Pero un factor que puede confundir en nuestros pacientes es el uso concomitante de acetato de ciproterona, que también incrementa la secreción de PRL26, aunque en menor grado. No se ha encontrado referencias acerca de la asociación del tratamiento androgénico con hiperprolactinemias, aunque podrían actuar mecanismos similares al de los estrógenos. El grupo de transexuales H-a-M de nuestro estudio no sólo presentó valores de PRL significativamente más elevados que los de los transexuales M-a-H, sino también una prevalencia de hiperprolactinemia 5 veces mayor, que sugiere el mayor efecto de los estrógenos (y/o acetato de ciproterona) que de los andrógenos, y por mecanismos diferentes.
CONCLUSIONES
Los trastornos de identidad de género son cada vez más frecuentes en España y en sociedades culturalmente avanzadas. A pesar de las limitaciones de nuestro trabajo, al ser un estudio retrospectivo y descriptivo, se puede comprobar cómo en los pacientes transexuales el tratamiento hormonal produce una inversión del riesgo cardiovascular innato a nuestro sexo biológico, así como la presencia de una hiperprolactinemia farmacológica y alteraciones de la función hepática; por ello, hay que tener en cuenta este tipo de situaciones en nuestra práctica clínica. Para prevenir los efectos adversos y la morbilidad del tratamiento hormonal sustitutivo, es necesario incluir este cuadro en las prestaciones de la sanidad pública y crear unidades específicas multidisciplinarias.
Correspondencia: Dr. A. Becerra Fernández.
Las Panzas, 46. 28860 Paracuellos de Jarama. Madrid. España.
Correo electrónico: abecerra@telefonica.net