Introducción
En estudios recientes se ha puesto de manifiesto que la mayor parte del daño de membrana y del ácido desoxirribonucleico (ADN) que se observa en espermatozoides eyaculados se produce sobre todo en el ámbito del epidídimo1,2. De ahí que en un 90% de los casos los niveles de daño de ADN que se observan en espermatozoides eyaculados sean muy superiores a los observados en espermatozoides testiculares1-5.
Este daño de ADN puede ser inducido directamente por el impacto de radicales libres sobre las cadenas de ADN, o indirectamente a través de la activación de caspasas y endonucleasas espermáticas2. El daño directo inducido por radicales libres puede producirse por tres mecanismos principales:
a)Daño de ADN en espermatozoides maduros inducido por radicales libres generados por espermatozoides inmaduros. Se ha demostrado que espermatozoides inmaduros, sobre todo los que retienen restos citoplasmáticos en la pieza intermedia, producen niveles altos de radicales libres6-8. Dado que los radicales libres exportados al medio extracelular tienen una vida media del orden de nano-a microsegundos, para que se produzca este daño intercelular, los espermatozoides inmaduros han de estar en íntimo contacto con los espermatozoides maduros. Y esto es precisamente lo que ocurre en el epidídimo, donde los espermatozoides están altamente empaquetados. A través de este mecanismo, los espermatozoides inmaduros productores de radicales libres podrían dañar tanto las membranas como el ADN de espermatozoides maduros resultando en la inducción de necrozoospermia y fragmentación del ADN espermático.
b)Daño inducido por radicales libres utilizados en la oxidación de puentes disulfuro a nivel de la cabeza del epidídimo. A nivel del tramo final de la cabeza del epidídimo existe un mecanismo de reciclaje de radicales libres que se utilizan en la oxidación de los puentes disulfuro de protaminas nucleares y proteínas flagelares espermáticas9. Las alteraciones en la regulación de este reciclaje que conllevan un escape de radicales libres pueden resultar en daño oxidativo de los espermatozoides.
c)Daño inducido por radicales libres producidos por las células epiteliales del epidídimo. Otro mecanismo que podría resultar en daño de membrana y de ADN en los espermatozoides sería el resultante de la producción de radicales libres por parte de las células epiteliales del epidídimo, acoplado a niveles bajos de enzimas antioxidantes, tanto a nivel del epitelio como de la luz del túbulo epididimario9. Enzimas antioxidantes como las diferentes isoenzimas de la glutatión peroxidasa (GPX) desempeñan un papel central en la protección tanto del epitelio epididimario, como de los espermatozoides a su paso por el epidídimo9. Se ha demostrado que el riesgo de este tipo de daño aumenta de forma progresiva de la cabeza a la cola del epidídimo, y que está relacionado con una disminución en los niveles de GPX y, en particular, de la isoenzima GPX-59.
En un estudio llevado a cabo en pacientes de infertilidad, se encontró que la coincubación de suspensiones espermáticas con leucocitos polimorfonucleares activados o con factores proinflamatorios in vitro produjo un aumento de una a dos órdenes de magnitud en la producción de radicales libres por parte de espermatozoides inmaduros presentes en estas suspensiones10. Los autores de este estudio concluyen que factores proinflamatorios producidos por leucocitos activados amplifican de forma significativa la producción de radicales libres por parte de espermatozoides inmaduros, aumentando así el daño potencial de membrana y ADN en espermatozoides maduros. Por lo tanto, en pacientes donde se produzca un aumento en los niveles de factores proinflamatorios a nivel del epidídimo, ya sea por procesos inflamatorios o infecciosos11, podría producirse un aumento significativo en el daño de membrana y de ADN. Dado que se ha postulado que el epidídimo se encuentra en un estado seudoinflamatorio crónico subclínico9, los factores proinflamatorios desempeñan un papel importante en la fisiopatología del daño de membrana y ADN en los espermatozoides a su paso por el epidídimo. De ahí las aplicaciones clínicas que tanto los agentes antiinflamatorios como los antibióticos11 podrían tener en la prevención del daño de membrana y del ADN espermático.
El ácido docosahexaenoico (DHA) es un ácido graso poliinsaturado que contiene 22 carbonos y 6 dobles enlaces a lo largo de la cadena alifática, de los cuales el último doble enlace está a 3 carbonos del terminal metilo. De ahí su designación numérica de 22:6n-3 o también de omega 3. Dada la presencia de estos seis dobles enlaces no conjugados con grupos metileno bis-alílicos interpuestos, la molécula de DHA adopta una configuración circular. Esto explica en gran parte su gran entropía y movilidad molecular a nivel celular, tanto esterificado a fosfolípidos de membrana, como en forma de ácido graso libre. La gran movilidad del DHA y su carácter altamente hidrofóbico, que le permite atravesar todo tipo de membranas celulares, explica en gran medida sus efectos terapéuticos y su función reguladora de la fluidez de membrana.
A nivel espermático, el DHA desempeña un papel muy importante en la regulación de la maduración y la función espermática12, así como en la regulación de la fluidez de membrana asociada a la motilidad espermática y a las reacciones de fusión de membranas que tienen lugar durante el proceso de fecundación.
Dado que el DHA, al igual que el ácido araquidónico (AA) y el ácido eicosapentaenoico (EPA), se encuentra esterificado a fosfolípidos de membrana, regula también el contenido celular de AA y EPA, ya que compite con estos ácidos grasos por el lugar de esterificación en la posición sn-2 de los fosfolípidos de membrana. Esto, de por sí, le confiere al DHA un efecto antiinflamatorio, ya que el AA esterificado en la posición sn-2 de los fosfolípidos es el sustrato para la biosíntesis de factores proinflamatorios como las prostaglandinas y los leucotrienos. Además de este efecto antiinflamatorio indirecto, el DHA, en forma de ácido graso libre, ejerce un efecto antiinflamatorio directo a través de los peroxisome proliferator-activator receptors (PPAR), bloqueando la biosíntesis de otros factores proinflamatorios como las citocinas13. Otros efectos celulares del DHA incluyen el aumento en la expresión de genes que codifican proteínas transportadoras de la familia ATP-Binding Cassette (ABC), que participan en el transporte intracelular de ácidos grasos14.
Estudios previos han demostrado el potente efecto antiinflamatorio del DHA en modelos experimentales animales de enfermedades inflamatorias crónicas15,16. Se han obtenido resultados similares en otros modelos experimentales17-27.
Como se había indicado anteriormente, la mayor parte del daño de membrana y ADN que se produce en espermatozoides es inducido por radicales libres; puede ser amplificado por factores proinflamatorios, y se produce sobre todo a nivel del epidídimo. Por lo tanto, dadas sus propiedades como agente antioxidante y antiinflamatorio, el DHA podría tener aplicaciones clínicas en la prevención del daño espermático que se puede producir a nivel postesticular.
Además de su efecto beneficioso potencial a nivel del epidídimo como agente antioxidante y antiinflamatorio, el DHA también podría tener efectos beneficiosos a nivel testicular. Dada su acción antiinflamatoria en los PPAR, el DHA podría aumentar la producción espermática parcialmente inhibida por factores proinflamatorios como la interleucina 8 y el factor de necrosis turmoral alfa, que actúan en la célula de Sertoli bloqueando la espermatogénesis.
Otro efecto beneficioso potencial del DHA a nivel testicular sería el de bloquear el efecto oxidativo de los radicales libres sobre los telómeros de los bivalentes durante el proceso de meiosis. Se sabe que durante la meiosis, la sinapsis de los bivalentes durante la recombinación genética se lleva a cabo a través de los telómeros. Estudios previos realizados en fibroblastos demuestran que los radicales libres pueden inducir daño telomérico y defectos de sinapsis28. Este daño telomérico y los defectos de sinapsis derivados del mismo podrían producirse también en células germinales, dando lugar a anomalías cromosómicas en los espermatozoides. Una vez que se produce la fecundación, estas anomalías podrían dar lugar a alteraciones en la segregación cromosómica durante la división embrionaria, a aneuploidías embrionarias y a una reducción en las tasas de embarazo y un aumento en la tasa de aborto espontáneo. Por lo tanto, el DHA también podría tener un efecto beneficioso a la hora de prevenir el daño telomérico inducido por radicales libres en los bivalentes y prevenir, al menos en parte, las aneuplodias embrionarias derivadas de alteraciones sinápticas. Esta hipótesis es consistente con el aumento en alteraciones sinápticas que se observa en pacientes con un varicocele clínico, una condición clínica caracterizada por un aumento en los niveles de estrés oxidativo a nivel testicular.
Dado que contiene 6 dobles enlaces bis-alílicos, el DHA es susceptible de reaccionar con radicales libres. De ahí que el DHA pueda considerarse como una "esponja absorbente" de radicales libres u oxygen radical sink, actuando, además de como un agente antiinflamatorio, como un potente antioxidante. Si bien en condiciones termodinámicas favorables esto podría suponer un riesgo debido a la formación de lipoperóxidos, en condiciones termodinámicas desfavorables, principalmente a temperaturas por debajo de los 37 °C, el riesgo de peroxidación sería mínimo, prevaleciendo su efecto antioxidante29. Estas condiciones termodinámicas desfavorables de bajas tasas de peroxidación son precisamente las que se dan en el testículo donde la temperatura media intratesticular es de 35,7 °C.
Basado en lo expuesto anteriormente, dado que: a) el daño de membrana y ADN que se observa en espermatozoides eyaculados se produce sobre todo a nivel del epidídimo; b) que este daño está mediado directa o indirectamente por radicales libres; c) que los factores proinflamatorios amplifican la producción de radicales libres por parte de espermatozoides inmaduros, y d) que el DHA actúa como un agente antiinflamatorio y antioxidante, se formula la hipótesis siguiente: el DHA debería prevenir, al menos en parte, el daño de membrana y ADN que se observa en espermatozoides eyaculados. Esto vendría condicionado no solo por sus propiedades antioxidantes y antiinflamatorias, sino también por la facilidad con la que el DHA cruza la barrera hematotesticular dada su alta hidrofobicidad y movilidad molecular.
Material y métodos
Reactivos
El DHA utilizado en este estudio se obtuvo de Gynea Laboratorios (GestaDha®). El GestaDha® contiene aceite de la microalga Schizochytrium sp., con un porcentaje de DHA superior al 38% y un alto nivel de pureza, sin presencia de contaminantes ambientales, ya que su procedimiento de obtención se lleva a cabo en cultivos aislados del entorno marino. Una de las características más importantes del GestaDha®, al igual que otros DHA procedentes de microalgas marinas, es que no contiene ácido linoleico (que es el sustrato para la biosíntesis del ácido araquidónico), ni tampoco EPA. Como su origen es vegetal, no posee el olor característico a pescado que tienen otras formulaciones de DHA derivadas de aceite de pescado y, además, puede utilizarse en pacientes con alergias al pescado.
Diseño del estudio
Para este estudio se seleccionó a pacientes diagnosticados de necrozoospermia (viabilidad < 75%), de acuerdo a los criterios de la Organización Mundial de la Salud30, o con un DFI > 20% durante la primera visita a nuestro centro. En el grupo de necrozoospermia, se incluyó a 20 pacientes en el grupo experimental (tratados con GestaDha®) y 20 pacientes en el grupo control (no tratados con GestaDha®). En el grupo de pacientes con un DFI > 20%, se incluyó también a 20 pacientes en el grupo experimental (tratados con GestaDha®) y a 20 pacientes en el grupo control (no tratados con GestaDha®). El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica del centro.
Tratamiento con GestaDha®
Los pacientes incluidos en el grupo experimental fueron tratados con 200 mg de GestaDha® cada 12 horas durante 8 semanas. Se recogieron muestras de semen para su análisis a las 0, 1, 2, 4 y 8 semanas tanto en el grupo control (no tratado con GestaDha®), como en el grupo experimental (tratado con GestaDha®). No se utilizó tratamiento con placebo en el grupo control.
Análisis del semen
Las muestras de semen se obtuvieron por masturbación tras 2 o 3 días de abstinencia sin eyacular, se recogieron en un recipiente estándar de polipropileno y se entregaron en el centro en menos de 1 hora después de su eyaculación en el recipiente. Una vez licuadas las muestras, se analizó la viabilidad espermática utilizando el método estándar de tinción supravital con eosina/nigrosina30 y el índice de fragmentación de ADN mediante el test TUNEL.
Test TUNEL
El análisis de la fragmentación del ADN espermático se llevó a cabo utilizando el test TUNEL, siguiendo las instrucciones del kit (Cell Death Detection Kit with Fluorescein-labelled dUTP, Roche, Monza [Italia]). El test TUNEL está diseñado para detectar roturas del ADN de cadena sencilla y cadena doble marcadas en grupos 3'-OH terminales con modificación de nucleótidos a través de TdT (del inglés terminal deoxynucleotidyl transferase), una enzima que cataliza la polimerización de forma independiente.
Después de su centrifugación, los espermatozoides se fijaron en 4% paraformaldehído en PBS durante 1 hora y permeabilizados con 0,1% Triton X-100 en 0,1% citrato sódico a 4 °C durante 2 minutos. Después de la centrifugación de lavado utilizando el medio tampón fosfato salino (PBS, del inglés phosphate-based saline), los espermatozoides permeabilizados y fijados se resuspendieron en 50 μl de la mezcla de nucleótidos marcados con TdT-labelled e incubados en la oscuridad en una atmósfera humidificada durante 1 hora a 37 °C. Después de otra centrifugación de lavado con PBS, se aspiró el sobrenadante y se añadieron 500 μl de PBS. En cada experimento se incluyó un control negativo omitiendo el TdT. Se consideró anormal un índice de fragmentación (DFI) por TUNEL > 20%31.
Análisis estadístico
Para comparar el porcentaje de viabilidad y el índice de fragmentación del ADN espermático a las 0, 1, 2, 4 y 8 semanas, se utilizó el Wilcoxon signed-rank test y el Mann-Whitney U test. Para comparar las diferencias en los valores de viabilidad espermática y el índice de fragmentación del ADN espermático entre el grupo control y el grupo experimental, se utilizó el test de la t de Student. Los resultados se expresaron como la media ± desviación estándar. Todos los análisis estadísticos se realizaron utilizando el software package SPSS 15.0. Se consideraron significativas diferencias con un valor de p < 0,05.
Resultados
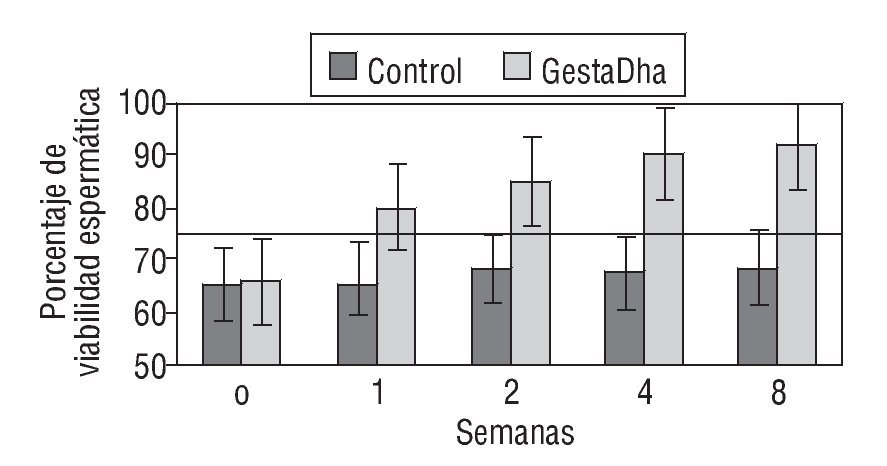
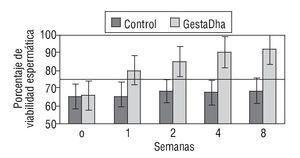
En la figura 1 se muestran los resultados de los valores de viabilidad espermática en pacientes con necrozoospermia tratados con GestaDha® comparados con los valores obtenidos en el grupo control no tratado. Las diferencias observadas entre el grupo experimental y el grupo control fueron estadísticamente significativas a partir de la primera semana de tratamiento con GestaDha® (p < 0,01). Las diferencias en la viabilidad espermática al inicio del estudio no fueron estadísticamente significativas entre ambos grupos (p = 0,66).
Figura 1 Efecto del GestaDha® en la viabilidad espermática. Los valores representan la media ± desviación estándar del porcentaje de viabilidad espermática correspondiente a muestras de semen obtenidas a las 0, 1, 2, 4 y 8 semanas de 20 pacientes del grupo control y de 20 pacientes del grupo tratado con GestaDha®. La línea discontinua representa el valor normal de viabilidad espermática. Tomada de World Health Organization30.
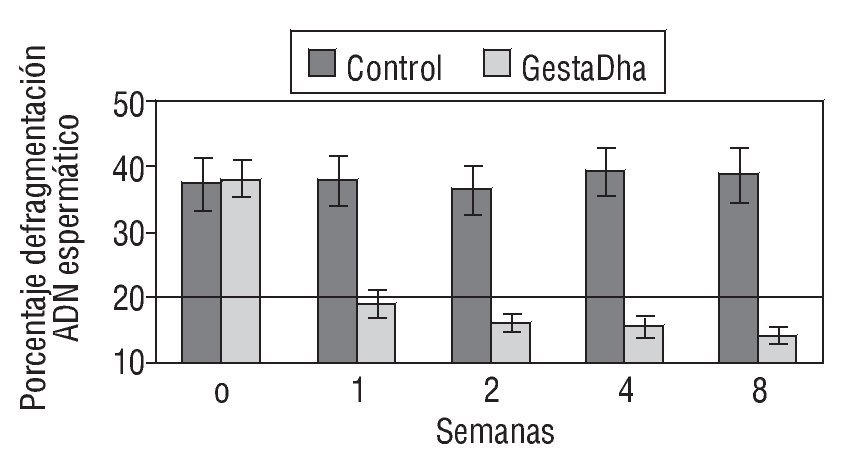
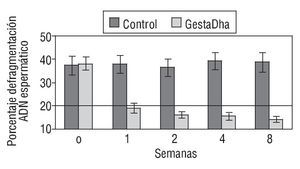
En la figura 2 se muestran los valores del DFI en pacientes tratados con GestaDha® comparados con el grupo control no tratado. Al igual que en el grupo de necrozoospermia, las diferencias entre el grupo experimental y el grupo control fueron estadísticamente significativas a partir de la primera semana de tratamiento con GestaDha® (p < 0,001). No se observaron diferencias estadísticamente significativas en el DFI entre ambos grupos al inicio del estudio (p = 0,55).
Figura 2 Efecto del GestaDha® en el índice de fragmentación del ácido desoxirribonucleico espermático. Los valores indicados representan la media ± desviación estándar del índice de fragmentación del ADN espermático (DFI, en sus siglas en inglés) correspondiente a muestras de semen obtenidas a las 0, 1, 2, 4 y 8 semanas de 20 pacientes del grupo control y de 20 pacientes del grupo tratado con GestaDha®. La línea discontinua representa el valor normal del DFI. Tomada de Sergerie et al31.
No se observaron efectos adversos en ninguno de los pacientes tratados con GestaDha®.
Discusión
El hallazgo más importante que emerge de este estudio es la eficacia del DHA en la prevención del daño de membrana, expresada como viabilidad espermática y del daño del ADN espermático, expresado como el índice de fragmentación de ADN o DFI, en pacientes de infertilidad con necrozoospermia y/o un aumento en los niveles de fragmentación del ADN espermático en semen. Si bien dadas las propiedades antiinflamatorias y antioxidantes del DHA el efecto beneficioso del DHA observado en pacientes con necrozoospermia y fragmentación ADN patológica podría considerarse previsible, esta es la primera vez que se demuestra en un estudio observacional la utilidad del DHA en el tratamiento de la infertilidad masculina asociada a daño de membrana y del ADN espermático.
Dado que el tránsito de los espermatozoides por el epidídimo se estima que es de 4-7 días, y que el daño de membrana y de ADN que se observa en espermatozoides eyaculados se produce sobre todo a nivel del epidídimo, esto explicaría por qué ya se observan diferencias significativas en los niveles de necrozoospermia y fragmentación de ADN entre el grupo experimental tratado con GestaDha® y el grupo control no tratado al cabo de una semana de tratamiento. Es decir, tras una semana de tratamiento con GestaDha®, los niveles de DHA, tanto en las células epiteliales del epidídimo como en la luz del túbulo, podrían contribuir a prevenir el daño de membrana y de ADN en espermatozoides que ya han sido liberados a los túbulos seminíferos y que inician su tránsito por el epidídimo.
Otro aspecto importante a destacar en los resultados de este estudio es el hecho de que no se produjeron efectos adversos en los pacientes tratados con GestaDha® durante la duración del tratamiento a las dosis utilizadas, como cabía esperar de los estudios realizados hasta ahora con el aceite de la microalga Schizochytrium sp. Como ya se había mencionado anteriormente, GestaDha® contiene DHA procedente de aceite de microalgas, caracterizado por un alto nivel de pureza y por no contener ácidos grasos que puedan interferir con el efecto antiinflamatorio del DHA, ni contener contaminantes ambientales, ya que la microalga Schizochytrium procede de cultivos aislados del entorno marino. Precisamente por ello, no se recomienda el uso de formulaciones de DHA que contengan EPA (como las derivadas de aceites de pescado) o ácido linoleico, ya que podrían interferir con el efecto antiinflamatorio del DHA. Además, el DHA procedente de aceite de pescado podría contener trazas de metales pesados que actúan como catalizadores de reacciones mediadas por radicales libres. De ahí que se recomiende el uso de formulaciones de DHA derivadas de microalgas que no contienen EPA, ácido linoleico, ni metales pesados.
Si bien otros agentes antiinflamatorios con propiedades antioxidantes, como, por ejemplo, el diclofenaco, podrían también utilizarse en la prevención del daño de membrana y ADN que pudiera producirse durante el paso de los espermatozoides por el epidídimo, los efectos adversos potenciales de este tipo de antiinflamatorios, unido al hecho de que el GestaDha® carece de efectos adversos a dosis relativamente altas, lo convierte en la mejor opción en el tratamiento de la infertilidad masculina ligada a daño de membrana y del ADN espermático.
Dado que: a) los niveles de factores proinflamatorios o de radicales libres a nivel del epidídimo en pacientes con necrozoospermia y/o aumento en los niveles de fragmentación del ADN espermático en semen no pueden ser evaluados, y b) el GestaDha® carece de efectos adversos, de confirmarse estos resultados en otros estudios (preferiblemente aleatorizados con placebo control), debería recomendarse la prescripción de GestaDha® como tratamiento preventivo de daño postesticular, tanto en parejas que vayan a realizar ciclos de coito dirigido, como en parejas que vayan a realizar tratamientos de reproducción asistida. Dado que la presencia de factores proinflamatorios en el epidídimo pudiera estar asociada a un proceso infeccioso, generalmente producido por bacterias como Chlamydia trachomatis o Ureaplasma, debería recomendarse el uso combinado de GestaDha® con antibióticos tipo doxiciclina durante al menos 2 semanas.
Conclusiones
Los resultados de este estudio ponen de manifiesto la eficacia y la seguridad del DHA derivado la microalga Schizochytrium (GestaDha®) en el tratamiento de la infertilidad masculina asociada a daño de membrana y del ADN espermático.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Correo electrónico:jalvarez@androgen.es
Recibido el 1 de agosto de 2011;
aceptado el 30 de agosto de 2011