INTRODUCCIÓN
La mitad del material genético del embrión proviene del espermatozoide, por lo que seleccionar el mejor espermatozoide es vital para el éxito de las técnicas de reproducción asistida.
Desde que en 1992 Palermo et al1 publicaron sus primeros embarazos mediante la inyección intracitoplasmática de espermatozoides (ICSI), ésta ha resultado ser una técnica muy útil y ampliamente extendida en los laboratorios de fecundación in vitro (FIV) para parejas con un factor masculino, ya que únicamente es necesario un espermatozoide para cada óvulo. La ICSI se realiza en microscopios invertidos dotados generalmente de un sistema óptico con contraste de Hoffman, que permite aumentar los espermatozoides hasta 400 veces, escogiendo aquellos con mejor morfología y movilidad.
El espermatozoide maduro ideal, según la Organización Mundial de la Salud2, corresponde a una célula de cabeza ovalada de contorno regular, con una parte anterior correspondiente al 40-70% del área de la cabeza, el acrosoma, y una región posterior más oscura. La base de la cabeza debe ser amplia, con sólo una cola. La cola debería estar insertada simétricamente en la fosa de la base de la cabeza e inmediatamente detrás de la cabeza aparece la pieza intermedia, que debe ser algo más gruesa que la cola.
Incluso pequeñas diferencias geométricas en la morfología de la cabeza pueden provocar modificaciones hidrodinámicas del espermatozoide afectando a su funcionalidad, de lo cual se desprende la necesidad de realizar una selección lo más cuidadosa posible.
A pesar de todo, los 400 aumentos que se consiguen mediante los sistemas basados en la óptica Hoffman no permiten visualizar las vacuolas presentes en la cabeza de la mayoría de los espermatozoides. La presencia de vacuolas es básica para poder valorar la correcta formación del espermatozoide, dado que una incorrecta espermatogénesis o condensación del genoma en el epidídimo se traduce en un núcleo espermático vacuolado o defectos en la morfología externa3.
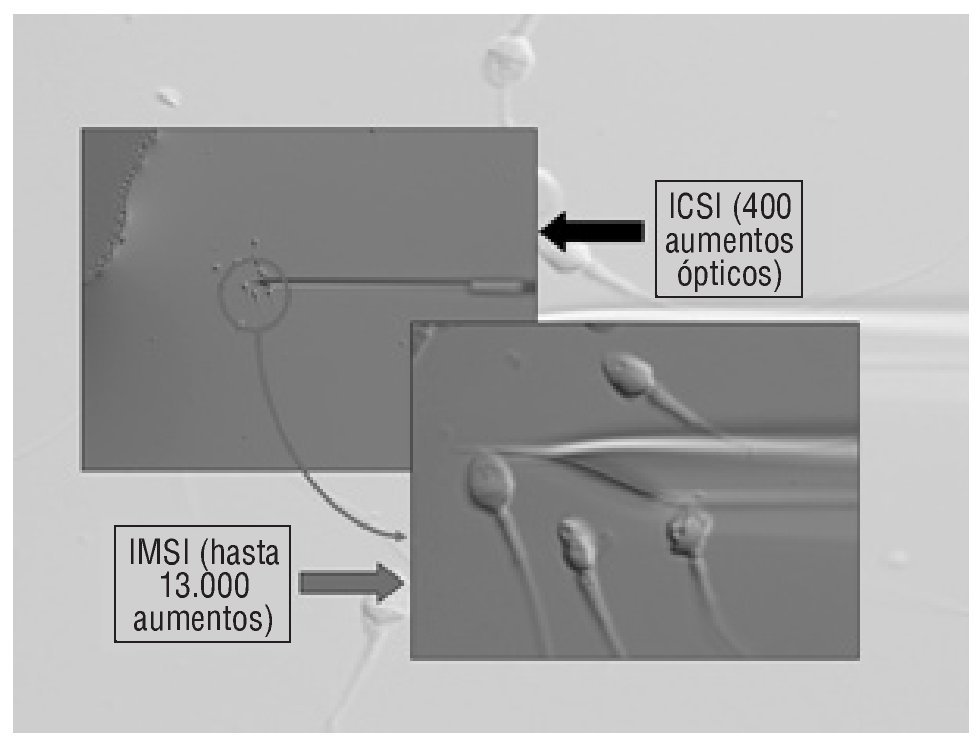
La morfología espermática se puede evaluar de una forma mucho más precisa mediante un microscopio invertido equipado con óptica Nomarski o contraste interdiferencial (magnificación a 1.000× bajo aceite mineral) con un sistema digital que puede alcanzar una magnificación de más de 13.000×. De esta forma, siguiendo los criterios de estudio de la morfología de orgánulos en espermatozoides móviles (MSOME)4,5, los núcleos espermáticos de forma normal serían los que tienen una configuración oval, simétricos, homogéneos, sin desórdenes regionales y conteniendo no más de 1 vacuola (de un diámetro de 0,78 ± 0,18 μm) (fig. 1).
Figura 1. Apariencia de los espermatozoides observados a 400 aumentos en condiciones de ICSI (izquierda) y a 13.000 aumentos en condiciones de IMSI (derecha).
Así, en el año 2005 se presentaron los primeros embarazos mediante inyección intracitoplasmática de espermatozoides morfológicamente seleccionados (IMSI)6, técnica resultante de realizar una MSOME y posterior inyección de esos espermatozoides morfológicamente seleccionados en un ovocito (MSOME + ICSI = IMSI).
La presencia vacuolar se relaciona directamente con un posible daño en el ADN espermático, ya sea produciendo su desnaturalización y/o fragmentación, o provocando un efecto negativo en el desarrollo embrionario7-10. La estabilidad de la cromatina parece que influye en el desarrollo embrionario. Se ha demostrado en bovinos que la utilización de esperma con vacuolas afecta la viabilidad de los embriones.
Vista la importancia diagnóstica de las vacuolas nucleares de los espermatozoides, hay que plantearse si los sistemas actuales de selección son todavía válidos, o si, por el contrario, una selección a 400× es insuficiente para seleccionar los espermatozoides con mejor morfología y, en consecuencia, menos vacuolados.
El objetivo de este estudio es validar la selección de espermatozoides realizada a 400 aumentos ópticos con un microscopio convencional de ICSI dotado con óptica Hoffman, utilizando para ello un microscopio de IMSI de contraste interdiferencial (DIC), capaz de realizar la selección a 1.600 aumentos ópticos y a más de 13.000 aumentos gracias a un VarioZoom digital de alta sensibilidad.
MATERIAL Y MÉTODOS
Se analizaron muestras de semen de 20 pacientes no seleccionados sometidos a tratamiento de FIV, las cuales tenían como mínimo una concentración de 106 espermatozoides grado A/ml. Se escogieron 10 espermatozoides de cada muestra (de morfología y movilidad normales) utilizando un microscopio Olympus IX50, en condiciones estándar de ICSI (objetivo de 40×, contraste de Hoffman).
Posteriormente, esos 10 espermatozoides se evaluaron de nuevo utilizando un microscopio invertido LEICA AM6000 en condiciones estándar de IMSI (objetivo de inmersión de aceite 100×, lente multiplicadora 1,6×, DIC). Los espermatozoides se evaluaron, además de por su morfología, por su patrón de vacuolación5. Así, espermatozoides sin vacuolas se consideraron de grado I, si tenían 2 o menos vacuolas de grado II, con una vacuola grande de grado III y si tenían una vacuola grande y otras anormalidades de grado IV. Los grados I y II se consideraron espermatozoides de buena calidad, y los grados III y IV se consideraron espermatozoides anormales (fig. 2).
Figura 2. Diferentes espermatozoides separados por su grado de vacuolización, según la clasificación propuesta por Vanderzwalmen et al5.
Tanto la selección en condiciones de ICSI como la posterior validación en condiciones de IMSI fueron realizadas a temperatura ambiente, a fin de ralentizar el metabolismo de los espermatozoides y evitar que se vacuolasen.
RESULTADOS
De los 100 espermatozoides considerados inicialmente de buena calidad al seleccionarlos en condiciones de ICSI, sólo el 27% (n = 54) resultaron ser de grado I o II. El 73% (n = 146) restante fue considerado espermatozoide de mala calidad al evaluar su patrón de vacuolación.
DISCUSIÓN
Se ha obtenido un 73% de falsos positivos, es decir, espermatozoides considerados normales a 400× con contraste de Hoffman que se revelaron anormales por su patrón de vacuolación al reestudiarlos a 1.600 aumentos ópticos con DIC. Este porcentaje tan elevado es consecuencia de la limitación óptica del contraste de Hoffman.
A 400 aumentos se puede descartar la gran mayoría de malformaciones de los espermatozoides, aunque las vacuolas son indetectables. El hecho de que se haya relacionado la presencia de vacuolas de gran tamaño con el daño en el ADN espermático11 debe hacernos reflexionar acerca de la conveniencia de realizar IMSI en vez de ICSI siempre que sea posible, a fin de evitar la transmisión a la descendencia de posibles alteraciones genéticas presentes en el genoma paterno.
A pesar de todo, todavía hay controversia acerca de si la realización de la IMSI es una técnica igualmente útil para cualquier paciente. La utilidad de la alta magnificación está relacionada con grupos muy concretos de pacientes, con determinadas patologías como ADN espermático fragmentado, fallos repetidos de implantación y abortos de repetición. Además, no siempre es posible realizar esta técnica en el laboratorio de reproducción asistida, ya que es necesario una concentración umbral por debajo de la cual la dificultad de encontrar espermatozoides móviles y normales hace inviable la aplicación de la técnica.
Correspondencia: Dr. S. Rovira.
Plaza Eguilaz, 14, bajos. 08017 Barcelona. España.
Correo electrónico: srovira@cirh.es