Introduction: High levels of oxidative stress can explain the presence of high levels of damage in the DNA molecule. The impact of high levels of oxidative stress in 2 clinical circumstances affecting the male germ line has been well established: leukocytospermia and varicocele.
Objective: To assess sperm DNA fragmentation in patients diagnosed with leukocytospermic and varicocele.
Material and methods: Leukocytospermic and varicocele patients and external controls (donors with proven fertility and patients with undetermined male factor). Unlike in other studies of sperm DNA fragmentation, in this study both the proportion of damaged sperm after using the sperm chromatin dispersion test (Halosperm), and the proportion of degraded sperm in total fragmented (degradation index [DI]) were taken into consideration.
Results: A highly significant increase in sperm DNA fragmentation has been observed in semen samples of patients with varicocele and leukocytospermia. Varicocele patients showed a DI twice as high as that observed in patients with undetermined male factor or in patients with leukocytospermia, and 6 times as high as that observed in the donors. Discussion: The presence of high levels of oxidative stress could be an acceptable explanation for the high levels of damage observed in the spermatozoa of varicocele patients or with leukocytospermia; the level of sperm degradation is higher in the case of varicocele than those observed in leukocytospermia.
Conclusions: SDF levels in patients with leukocytospermia and varicocele are significantly higher than those observed in donors or men with undetermined male factor. The DI in sperm samples from patients with varicocele is the highest of all the samples studied in this analysis. The routine determination of the DI may have a practical value, by guiding the patient towards the potential diagnosis of varicocele, even when this is subclinical.
Introducción: El estrés oxidativo en una de las causas que puede explicar la presencia de unos niveles elevados de daño en la molécula de ADN. En 2 cuadros clínicos que afectan a la línea germinal del varón, la leucocitospermia y el varicocele, se reconoce la incidencia de niveles elevados de estrés oxidativo.
Objetivos: En el presente trabajo se compararon 2 cuadros clínicos, varicocele y leucocitospermia, con objeto de comprobar si existe una intensidad diferencial de la fragmentación del ADN espermático.
Material y métodos: Se incluyeron como controles externos donantes de espermatozoides con fertilidad probada y pacientes con factor masculino no determinado. A diferencia de otros estudios de fragmentación del ADN espermático, en este caso, se consideraron tanto los niveles de fragmentación absolutos (SDF), como la proporción de espermatozoides degradados en el total de fragmentados (índice de degradación [ID]) de acuerdo con la información obtenida tras la aplicación del test Halosperm.
Resultados: Se demostró un aumento muy significativo de la fragmentación del ADN espermático en las muestras seminales de pacientes con varicocele y con leucocitospermia. Los pacientes con varicocele mostraron un ID 2 veces mayor que el observado en pacientes con factor masculino no determinado o en pacientes con leucocitospermia, y 6 veces mayor que en los donantes.
Discusión: La presencia de unos niveles de estrés oxidativo elevados podría ser una explicación asumible para justificar los altos niveles de daño observado en los espermatozoides de los pacientes tanto con varicocele como con leucocitospermia, pero probablemente estos niveles sean más elevados en el caso del varicocele ya que los niveles de degradación del ADN espermático son superiores a los observados en cuadros de leucocitospermia.
Conclusiones: Los niveles SDF en los pacientes con leucocitospermia y varicocele son significativamente mayores que los observados en donantes o en varones con factor masculino no determinado. El ID en muestras de esperma de pacientes con varicocele es el más elevado de toda la muestra incluida en el análisis. La determinación rutinaria del ID podría tener valor práctico, al orientar hacia el diagnóstico potencial de varicocele, incluso cuando este sea subclínico.
Introducción
El material genético del espermatozoide puede ser dañado por múltiples causas, abarcando desde enfermedades de base genética hasta daños externos derivados del manejo ex vivo de las muestras seminales. En particular, el daño iatrogénico que es inherente al empleo de las nuevas técnicas de reproducción asistida debiera ser controlado y valorado de forma rutinaria en cualquier acto de reproducción asistida. El estrés oxidativo es considerado uno de los mecanismos más activos en la generación de daño celular y su ámbito de actuación implica tanto los procesos de desarrollo del espermatozoide como su manipulación in vitro. El estrés oxidativo tiene lugar cuando la producción de especies reactivas de oxígeno (ERO) excede la capacidad antioxidante; la consecuencia inmediata es la generación de daño celular1,2. En el semen hay 2 fuentes básicas de producción de radicales libres: los propios espermatozoides, especialmente los inmaduros, y los leucocitos polimorfonucleares2,3. Estos últimos poseen la capacidad de generar ERO para combatir ciertos agentes patógenos4. Las ERO pueden alterar la funcionalidad de los espermatozoides, principalmente por 2 mecanismos: el primero es un efecto de peroxidación de los ácidos grasos insaturados, que dañan la membrana, lo que reduce su movilidad y su habilidad para fusionarse con el oocito5. En cuanto al segundo mecanismo, las ERO modifican la estructura química tanto de las bases púricas y pirimidínicas como también de la desoxiribosa, inestabilizándolas y degenerando en roturas del ácido desoxirribonucleico (ADN) espermático6. Dentro de los cuadros clínicos donde el espermatozoide se puede ver afectado por estrés oxidativo, destacan por su etiología las muestras procedentes de pacientes con varicocele o leucocitospermia.
La fisiopatología del varicocele es compleja y comprende multitud de factores, entre los cuales destaca la presencia de una dilatación de las venas del cordón espermático que drenan el testículo. Los vasos sanguíneos que descienden por el canal inguinal para nutrir el testículo ejercen una compresión no fisiológica de estas venas y provocan la dilatación de las mismas, cuyo grado depende de la intensidad de la compresión7. El plexo pampiniforme se sitúa alrededor de la arteria espermática y funciona como un regulador de temperatura. Dado que la sangre arterial pierde calor a medida que pasa por el cordón espermático y la sangre venosa gana calor en su retorno, si este mecanismo se encuentra alterado, produce un aumento de la temperatura testicular de entre 0,6-0,8 °C por encima de lo normal. Este aumento de la temperatura tiene un impacto en la maduración del núcleo espermático que conlleva una mayor retención de histonas no reemplazadas por protaminas con el consiguiente déficit de compactación y vulnerabilidad de las ERO8,9. Además, los pacientes con varicocele tienen una mayor presión sanguínea en la vena espermática en comparación con otros individuos sin varicocele y, en consecuencia, se produce un paso acelerado de los espermatozoides por el epidídimo, lo que dificulta el proceso natural de la expulsión de la gota citoplasmática y genera espermatozoides inmaduros. A su vez, estos espermatozoides contienen orgánulos intracelulares no procesados que facilitan la formación de ERO con el consiguiente incremento del estrés oxidativo10.
La leucocitospermia es el término que se utiliza para definir las muestras seminales que contienen un número anormalmente alto de leucocitos. Según la Organización Mundial de la Salud, se considera que una muestra de semen es leucocitospérmica si contiene una concentración ≥ 1x106 leucocitos/ml eyaculado. La leucocitospermia suele estar asociada a infecciones en el tracto genital de diferente etiología y su prevalencia entre los varones infértiles es muy variable, oscilando desde un 2-40%8. En función del estado de activación del leucocito, éste puede liberar citoquinas o ERO, provocando estrés oxidativo. Así pues, los macrófagos y los granulocitos activos pueden liberar peróxido de hidrógeno, radicales libres de oxígeno, así como reactivos derivados de agentes nitrogenados4,6. El grado de daño que pueden producir los productos de los leucocitos sobre los espermatozoides es variable y depende del lugar anatómico donde tenga lugar, del tiempo de exposición a esos productos y de la capacidad de activación de los sistemas de defensa de los espermatozoides9.
El efecto del daño oxidativo del ADN en el espermatozoide no es fácil de analizar. Las técnicas al uso para su caracterización, TUNEL, SCSA, SCD-Halosperm u otro tipo de estrategias, determinan la presencia de roturas de las cadenas del ADN, pero no identifican las posibles modificaciones que sufren las bases nitrogenadas, tales como la presencia de 8-OHdG, 8-OHdA, timina-glicol, uracil-glicol, residuos de urea, 5-OHdU, 5-OHdC o hidantoína6,11. Sin embargo, la técnica de SCD-Halosperm, a diferencia de otras técnicas para medir el daño en el ADN del espermatozoide, identifica un tipo peculiar de espermatozoides altamente fragmentados y considerados como degradados tanto en su componente de ADN como en el de sus proteínas nucleares y cuya frecuencia puede ser relativamente alta en los pacientes con varicocele12-14.
El objetivo esencial de este trabajo es comparar estos 2 cuadros clínicos en los que se ha reconocido la incidencia de altos niveles de estrés oxidativo para comprobar si esta situación da lugar a un incremento significativo en la frecuencia de espermatozoides con ADN fragmentado y si existen diferencias o no entre ambos grupos en la distribución de los niveles de daño, especialmente en la proporción relativa de espermatozoides de tipo "degradado".
Material y métodos
Muestras seminales
Se utilizaron un total de 268 muestras de donantes (D) y pacientes con distintas patologías. Los grupos se establecieron en función de la determinación clínica del paciente: muestras de donantes con fertilidad probada (D; n = 50), muestras de pacientes infértiles que lograron un embarazo con ayuda de técnicas de reproducción asistida (pacientes infértiles; n = 55); muestras de pacientes con presencia de leucocitos y/o macrófagos (L/M; n = 72); muestras de pacientes con varicocele subclínico (Vsub; n = 34); pacientes con varicocele clínico (Vcl; n = 43) y, finalmente, pacientes con varicocele indeterminado (Vin; n = 14). Los pacientes con varicocele clínico fueron diagnosticados mediante palpación o examen visual según los criterios de Dubin16, mientras que el diagnóstico de varicocele subclínico fue realizado mediante ecografía Doppler17. Finalmente, debido a la variabilidad que existe y según el nivel de experiencia entre los diferentes especialistas a la hora de determinar el grado y tipo de varicocele, en el grupo de pacientes con varicocele indeterminado se incluyeron aquellos pacientes en los que el tipo o la severidad del varicocele no pudieron ser claramente determinados. Los valores de normalidad para la leucocitosperia se establecieron en < 1x106 leucocitos/ml.
Análisis de la fragmentación del ácido desoxirribonucleico
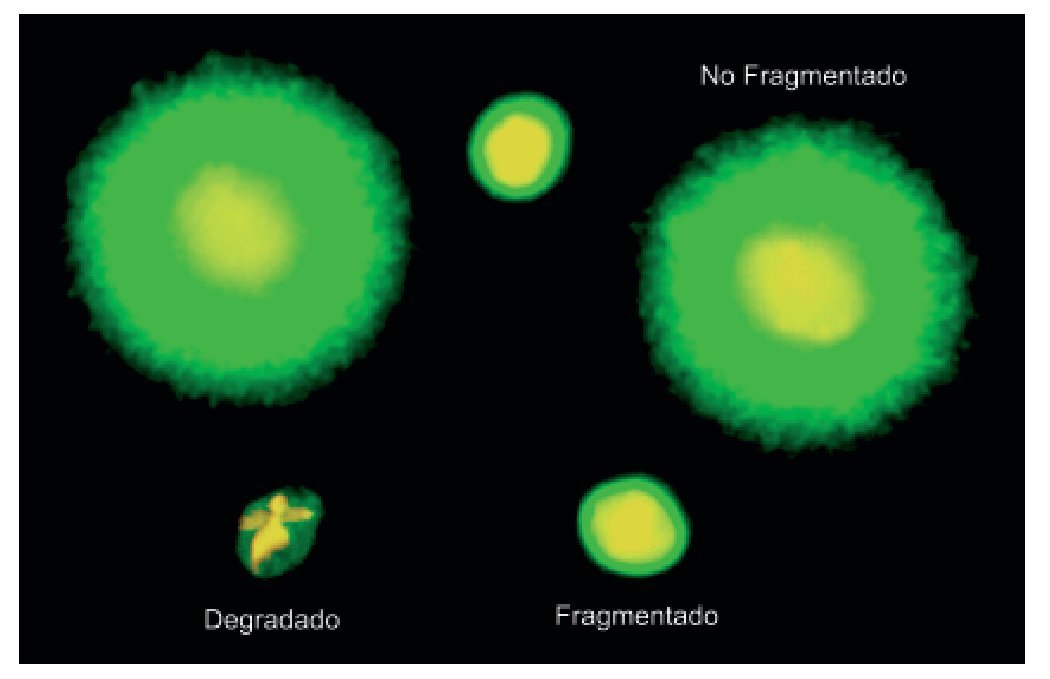
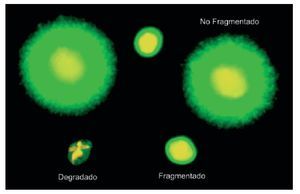
Existen diversas técnicas para detectar el daño del ADN espermático. En nuestro caso se utilizó el test Sperm Chromatin Dispersion (SCD) en su versión comercial Halosperm-GII (Halotech SL, Madrid, España) dado que esta metodología nos permite identificar los espermatozoides con el núcleo degradado. Básicamente, el método consiste en someter una muestra de semen a un tratamiento ácido inicial que desnaturaliza el ADN en caso de estar fragmentado y, posteriormente, a una desproteinización controlada que extrae la mayor parte de las proteínas nucleares. En los espermatozoides sin fragmentación del ADN se producen nucleoides con grandes halos de bucles de ADN emergiendo de un core central (fig. 1), mientras que los nucleoides de espermatozoides con ADN fragmentado no muestran halo de dispersión o es mínimo (fig. 1). Para ello, en un primer paso, la muestra de semen se diluye en buffer fosfato salino hasta alcanzar una concentración de 5-10 millones de espermatozoides por ml. Un Eppendorf con 50 μl de agarosa solidificada dispensada en el kit se introduce con ayuda de un flotador en agua y se incuba durante 2 minutos en el microondas a 750 W. Una vez que la agarosa está líquida, el Eppendorf con el flotador se introduce en un baño con agua a 37 °C y se mantiene 5 minutos hasta que la agarosa se atempere. Se añaden 25 μl de la muestra de semen al Eppendorf con 50 μl de agarosa líquida. Se mezcla bien y se coloca aproximadamente una gota de 15-20 μl sobre un portaobjetos pretratado y se cubre utilizando un cubreobjetos de 18 x 18 mm o 20 x 20 mm, respectivamente. Se coloca el portaobjetos sobre una superficie preenfriada (de metal o cristal) y se deja en el frigorífico a 4 °C durante 5 minutos para que la muestra gelifique.
Figura 1 Visualización de la integridad del ADN espermático utilizando Halosperm. Nótese que los espermatozoides degradados muestran no sólo una fluorescencia para ADN más reducida que en el caso de los fragmentados, sino también que el core residual de cromatina se encuentra notablemente alterado.
De forma paralela, se preparan tanto la solución desnaturalizante como la solución de lisis. Una vez retirado el portaobjetos de la muestra gelificada, se incuba el portaobjetos en posición horizontal durante 7 minutos en la solución desnaturalizante para, a continuación, realizar la desproteinización. Para ello, el portaobjetos se incuba en una bandeja que contiene 10 ml de solución de lisis durante 25 minutos. Trascurrido ese tiempo, se deshidratan los portaobjetos durante 2 minutos en una serie de alcoholes (70-100%). Finalmente, las preparaciones se secan a temperatura ambiente y se almacenan en oscuridad hasta su estudio.
Si bien las preparaciones se pueden teñir para ser evaluadas en microscopía de campo claro, en nuestro caso no se utilizó la tinción recomendada por el fabricante y las muestras se analizaron con microscopía de fluorescencia utilizando EvaGreen (Biotium, Hayward, CA, EE. UU.) como fluorocromo para teñir ADN. Éste se preparó a una concentración final 10X en buffer fosfato salino. El fluorocromo se diluyó para su utilización con un agente retardador de la caída de la intensidad de la fluorescencia (Vectashield®: Vector Laboratories, Inc. Burlingame, CA EE.UU.) en una proporción 1:1. Las preparaciones se analizaron utilizando un microscopio de epifluorescencia Leica DMLA motorizado con software automático para rastreo y digitalización de las imágenes (Leica Microsystems, Barcelona, España). El equipo va dotado de una fuente de fluorescencia metal hialide Leica EL6000 y se utilizó un objetivo Leica plan-Fluotar 40x para la obtención de las imágenes sobre una CCD Leica DFC350 FX, (Leica Microsystems, Barcelona, España).
Análisis estadísticos
El análisis estadístico de los datos se realizó con el programa IBM® SPSS® Statistics (Chicago, IL, EE.UU.) para entorno Windows. Las comparaciones de los datos obtenidos entre los diferentes grupos se llevaron a cabo mediante test no parámetricos (Kruskal-Wallis para comparar valores entre varios grupos y Mann-Whitney para comparar valores entre 2 grupos). La dependencia entre variables se estudió mediante el test de correlación de Pearson aplicando ajustes de la relación lineal.
Resultados
Halosperm y morfología nuclear espermática
Tras la aplicación del test SCD, la cabeza del espermatozoide sin ADN fragmentado muestra un halo periférico de difusión de bucles de ADN alrededor de un core central compacto correspondiente a la cabeza residual (fig. 1). El tamaño del halo puede ser grande o mediano, tomando como referencia el diámetro menor del core. En el caso de presentar ADN fragmentado, el core puede aparecer sin halo o tenerlo muy reducido o bien puede no presentar halo y mostrarse como "degradado". Estos espermatozoides son muy característicos ya que presentan un core muy afectado (fig. 1). Esto no ocurre en los espermatozoides con halo pequeño o sin halo, los cuales también presentan fragmentación del ADN pero con un core perfectamente definido.
Análisis de la fragmentación del ácido desoxirribonucleico espermático en los distintos grupos
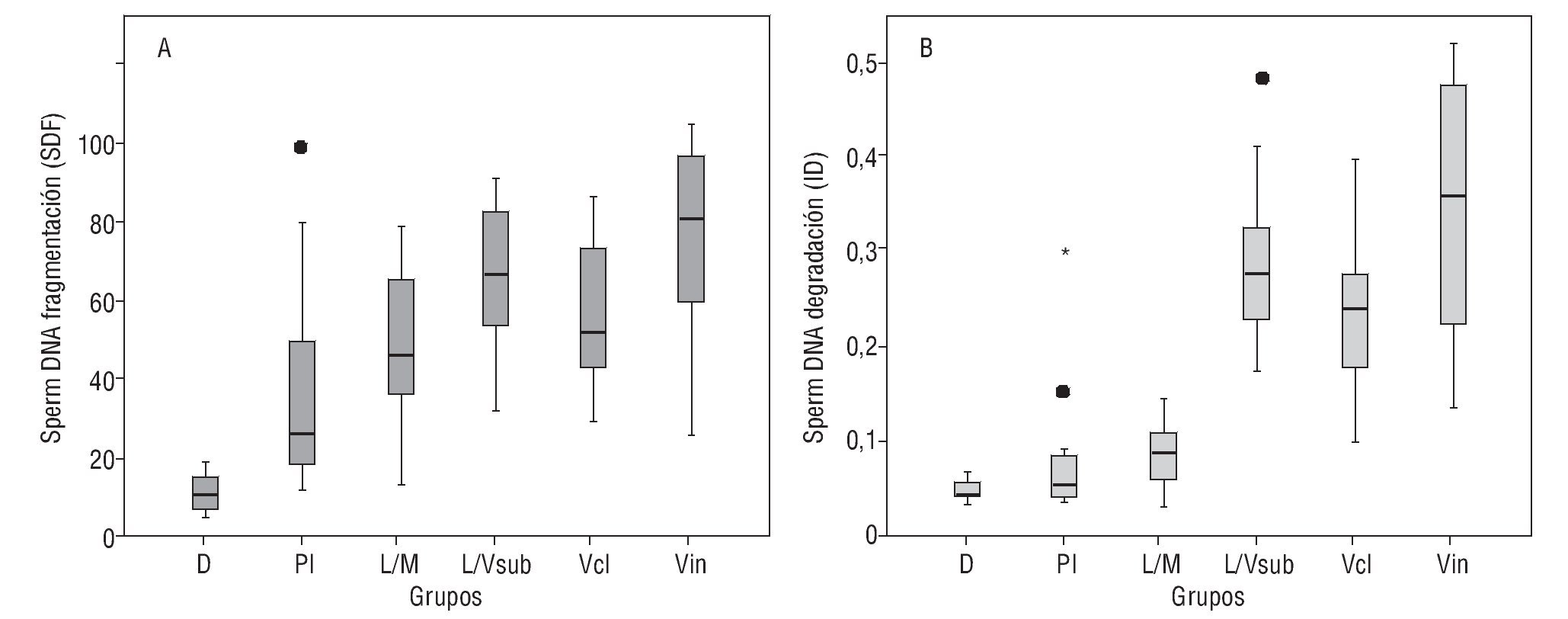
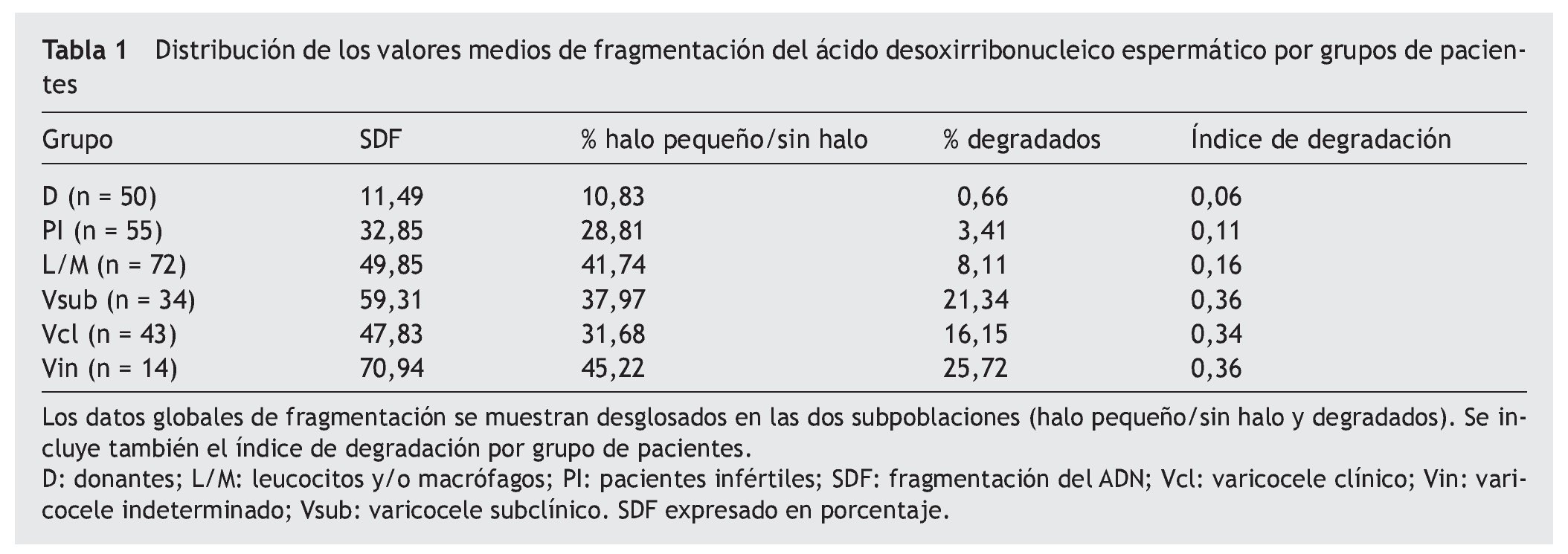
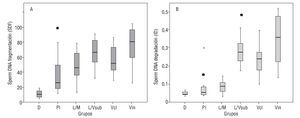
Se analizaron un total de 268 muestras seminales, obtenidas tras la eyaculación y licuación, para determinar la frecuencia de espermatozoides con ADN fragmentado (SDF) mediante el test Halosperm. De cada una de las muestras, se calculó el índice de fragmentación: SDF = % de espermatozoides con halo pequeño + sin halo + degradados, así como el índice de degradación: ID = % de espermatozoides degradados / % SDF. Los resultados de la estadística descriptiva para los valores obtenidos de SDF e ID para cada uno de los grupos se muestran en la figura 2. En la tabla 1 se muestran los valores medios de SDF desglosada en 2 componentes (halo pequeño/sin halo y degradados) junto con el ID.
Figura 2 Gráfico box-plot múltiple en que se muestran los niveles de SDF por grupo de pacientes (A) y los índices de degradación estimados por grupo (B).
Con objeto de analizar si existen diferencias significativas en el daño basal del ADN espermático entre los distintos grupos, se compararon el SDF (fig. 2A) e ID (fig. 2B) entre los distintos grupos utilizando la prueba de Kruskal-Wallis. Se asumió como hipótesis nula (H0) que la distribución de los datos de SDF y el ID es igual para todos los grupos, mientras que la hipótesis alternativa (H1) asume que sí existen diferencias en las distribuciones. Rechazamos la H0 tanto para el caso de los valores estimados de SDF (χ2: 144,9; gl 5; p < 0,05) como de ID (χ2: 192,2; gl 5; p < 0,05).
De igual forma, se apreciaron diferencias significativas entre los 3 grupos de varicocele para los niveles de SDF (χ2: 14,5; gl 2; p < 0,0007) y del ID (χ2: 14,0; gl 2; p < 0,0008). Sin embargo, tomadas en conjunto, las muestras de varicocele mostraron SDF más altos que las de leucocitospermia, y éstas, a su vez más altas que en las de individuos infértiles que lograron embarazo mediante técnicas de reproducción asistida. Habría que resaltar que el ID fue particularmente elevado en el caso de los pacientes con varicocele (ID = 0,35 de media en los diferentes casos), siendo el doble del observado en los pacientes con leucocitospermia (ID = 0,16) y 6 veces mayor que el observado en los donantes (ID = 0,06).
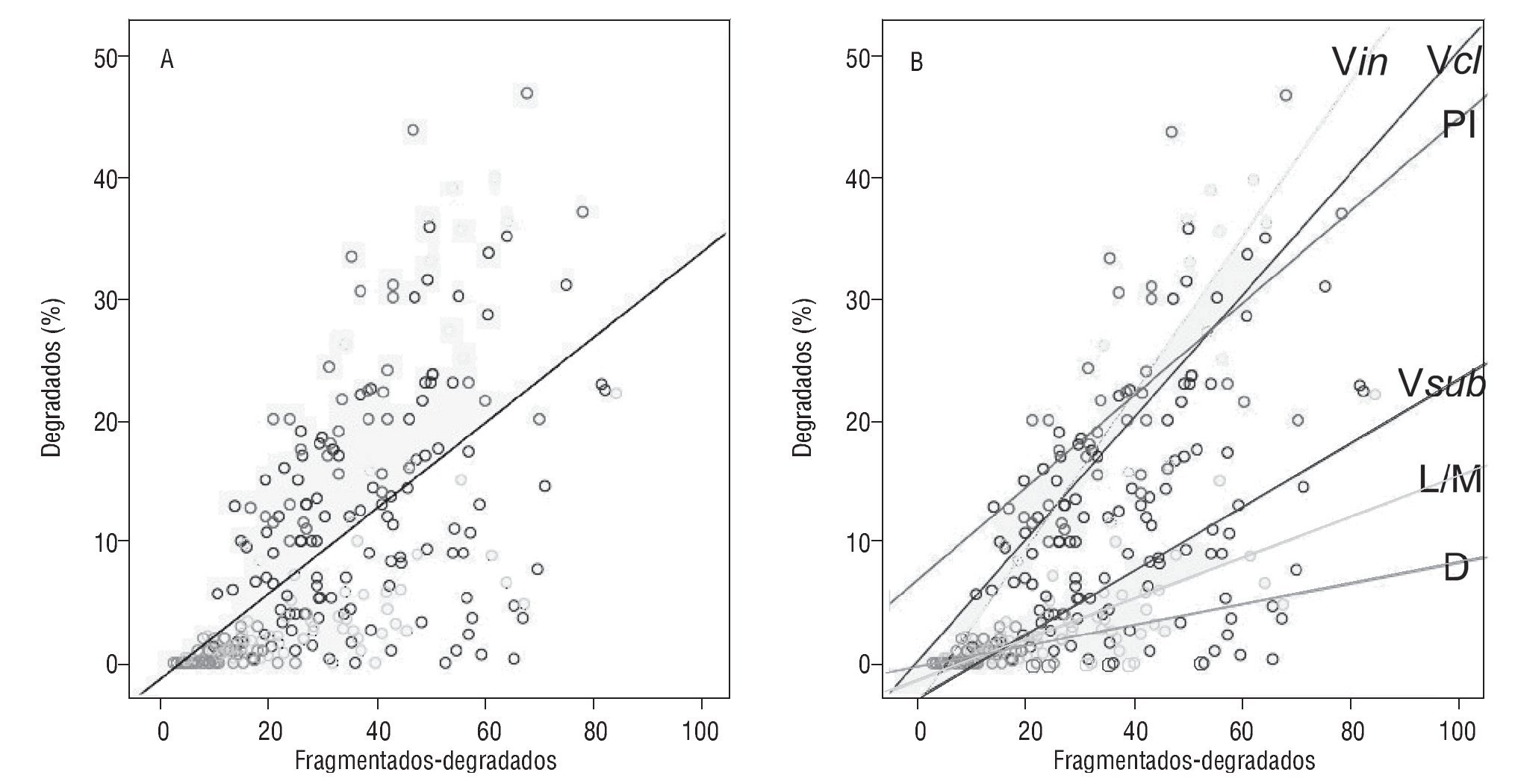
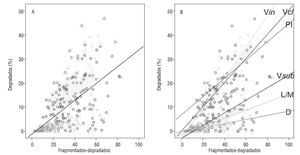
Finalmente, se aplicó el test de correlación de Pearson para comprobar si existía relación de dependencia lineal entre el porcentaje de espermatozoides degradados y el porcentaje de espermatozoides con ADN fragmentado (excluidos los degradados) presentes en cada muestra. Se demostró una correlación positiva (fig. 3) (R2 0,619; p < 0,000), por lo que en general los índices de degradación espermática eran más elevados a medida que aumentaban los valores de la fragmentación basal. Sin embargo, cuando se analizaron los grupos de individuos por separado, los coeficientes de ajuste cambiaron para cada cuadro clínico. El orden de los grupos en función de la correlación lineal ordenada desde valores de R menores a mayores fue: donantes (R2 = 0,21), muestras con leucocitos y macrófagos (R2 = 0,33), pacientes con varicocele subclínico (R2= 0,38), pacientes infértiles que dan embarazo (R2 = 0,54), pacientes con varicocele clínico (R2 = 0,70) y pacientes con varicocele indeterminado (R2 = 0,70). Los 3 últimos grupos mostraban una correlación lineal fuerte.
Figura 3 A) Representación gráfica de la relación lineal entre el porcentaje de espermatozoides degradados y el porcentaje de espermatozoides con ADN fragmentado (excluyendo los degradados) para todas las muestras (n = 268). B) Representación gráfica de la relación lineal entre el porcentaje de espermatozoides degradados y el porcentaje de espermatozoides con ADN fragmentado (excluyendo los degradados) con líneas de ajuste por cada grupo de pacientes. D: donantes; L/M: leucocitos y/o macrófagos; PI: pacientes infértiles; SDF: fragmentación del ADN; Vcl: varicocele clínico; Vin: varicocele indeterminado; Vsub: varicocele subclínico.
Discusión
Los resultados que se presentan en este trabajo nos permiten establecer, al menos, 2 hechos que debiéramos tener en cuenta en el momento de valorar las muestras seminales de los pacientes: 1) los índices de fragmentación espermática basal son más elevados, con respecto a individuos con un seminograma normal, en determinadas patologías tales como el varicocele o la leucocitospermia. En la misma dirección se comporta el grupo de pacientes en los que el factor masculino se ve afectado por causas de etiología no determinada, y 2) los espermatozoides degradados, considerados como una subpoblación de los espermatozoides con ADN fragmentado, se ven representados de forma distinta dependiendo del cuadro clínico al que nos enfrentemos. En particular, los pacientes que presentan varicocele muestran índices de degradación muy elevados, de tal modo que 1 de cada 2 espermatozoides con ADN fragmentado es de tipo degradado, de promedio. Este índice es del orden de dos veces mayor que el observado en los otros cuadros clínicos. Es decir, los espermatozoides degradados constituyen una proporción relativamente alta dentro de los que contienen el ADN fragmentado. Este índice de degradación en el caso de los pacientes con varicocele puede llegar a ser 6 veces mayor que en los donantes donde se encontraría un espermatozoide degradado por cada 17 con ADN fragmentado, de promedio.
Se considera que las muestras seminales que presentan algún factor masculino asociado muestran índices de fragmentación alterados y que estos suelen ser superiores al valor de normalidad establecido, que se encuentra en torno a valores no mayores de un 20% de espermatozoides afectados17,18. En el caso particular del varicocele, los pacientes no eluden esta regla y los índices de fragmentación son más elevados que los de los varones fértiles, hecho que se confirma en este estudio. Sin embargo, el porcentaje promedio de espermatozoides con ADN fragmentado determinado con técnicas tales como el SCSA genera valores medios de fragmentación para los casos de varicocele de aproximadamente un 25%19, mientras que si la técnica aplicada es el TUNEL, estos valores se sitúan en torno al 23%20. Nuestros resultados utilizando el kit de Halosperm, si bien concuerdan con la observación de ese incremento, no lo hacen en los valores registrados ya que los sitúa en valores medios de SDF más elevados, del 50%. Esta situación puede reflejar una sensibilidad diferencial para detectar daño del ADN dependiendo de la técnica aplicada y que es mayor en el caso de Halosperm. De hecho, el test Halosperm permite diferenciar el daño en 3 niveles diferentes de espermatozoides con ADN fragmentado: halos muy reducidos, ausencia de halo (estos 2 tipos con un core compacto) y "espermatozoides degradados" (sin halo y con un core muy afectado). Con otro tipo de técnicas del tipo TUNEL o SCSA no se pueden distinguir, por ejemplo, los espermatozoides considerados como degradados y no podemos calibrar su contribución final al índice de fragmentación total. Los elevados niveles de daño observados en el presente estudio y asociados al varicocele concuerdan con los publicados recientemente por otros autores utilizando también Halosperm14. Los 3 subgrupos establecidos en los pacientes con varicocele tienen los ID más altos que el resto de los grupos. Las medias de SDF de pacientes con varicocele subclínico, varicocele clínico o de varicocele indeterminado son SDF = 58,8%, SDF = 47,8% y SDF = 70,9%, respectivamente. De igual forma, los ID (ID = 0,36; 0,34; 0,36, respectivamente) son relatores explícitos del daño masivo que está ocurriendo en el núcleo celular. De hecho, el varicocele es el único cuadro clínico en el que se sabe con certeza que el estrés oxidativo está exacerbado y tiene su reflejo directo en la calidad del ADN espermático21. De hecho, se ha demostrado que los pacientes con varicocele tienen un aumento significativo del anión superóxido y de la actividad de las ERO, además de otros productos tóxicos para el espermatozoide22. La relación entre unos niveles elevados de estrés oxidativo y la SDF espermática es un hecho bien documentado en la literatura y se ha constatado que los varones infértiles suelen presentar niveles significativamente mayores de ERO que los fértiles23,24. Asimismo, estos pacientes tienen niveles menores de antioxidantes25. De forma paralela, se ha comprobado que existe una correlación positiva entre la generación de estrés oxidativo en los espermatozoides y el incremento del daño en el ADN espermático26,27. Si bien, en el presente estudio se muestran diferencias significativas, particularmente en la proporción de espermatozoides degradados en cada grupo de pacientes con varicocele. Este aspecto, que pudiera tener cierta lógica, tendría que ser analizado con un número mayor de pacientes para poder establecer rangos más claros de separación si los hubiere. De hecho, en otros estudios, la distribución del daño en las muestras de varicocele no permite asociar un determinado rango de frecuencia de espermatozoides con SDF tal que pueda orientar sobre la gravedad de la enfermedad20. Esto ocurre, en cierta medida, al considerar la fragmentación total en nuestro modelo experimental, pero no cuando separamos y comparamos las subpoblaciones de espermatozoides degradados.
Es interesante resaltar el hecho de que los cuadros clínicos asociados con leucocitospermia no resultan tan agresivos sobre el espermatozoide como lo son los cuadros de varicocele. Los valores medios del daño total producido en los pacientes L/M (SDF = 49%) son ligeramente inferiores a los obtenidos en los cuadros de varicocele, pero no existen diferencias significativas claras (Mann-Whitney; Wilcoxon: W = 3.757, P = 0,107). Sin embargo, cuando se comparan los ID, los 2 grupos difieren significativamente (Mann-Whitney; Wilcoxon: W = 5.559, P = 0,000). Estos resultados nos obligan a reconsiderar parcialmente una de nuestras hipótesis de partida en la que planteábamos que en los pacientes con leucocitospermia, los índices de daño en el ADN espermático podrían ser elevados y equiparables a los encontrados en varicocele. Sin embargo, la comparación del daño sufrido por el ADN en los pacientes con varicocele y con leucocitospermia no deja dudas sobre que si bien en ambos tipos de cuadro clínicos la presencia de ERO parece estar implicada, en el valor total del daño producido no es equiparable. Al igual que ocurre en el varicocele, existen múltiples trabajos en los que se ha establecido una relación entre la presencia de leucocitos activos y la generación de ERO a través de un aumento del estrés oxidativo4,23,28. Sin embargo, la incidencia efectiva de ERO asociada a presencia de leucocitos es un tema polémico dado que algunos autores no están de acuerdo con la idea de una correlación perfecta entre presencia de leucocitos e incremento en los niveles de estrés oxidativo y, consecuentemente, daño en el espermatozoide, ya que los leucocitos pueden no estar activados29-32. No existe un consenso respecto a la influencia negativa de los leucocitos en el semen e incluso hay estudios que sugieren que los leucocitos juegan un papel positivo al fagocitar espermatozoides defectuosos33. En este sentido, la fuerte dispersión de los valores del daño, tanto en los parámetros de SDF como de ID en el grupo de pacientes L/M (fig. 2), pueden estar reflejando esta circunstancia, de forma tal que las células extra presentes en el eyaculado pueden generar niveles de ERO muy variables que se traducen en diferentes niveles de daño. Recientemente, se ha constatado que existe una clara asociación entre la cantidad de leucocitos presentes en la muestra seminal y la calidad espermática32, lo cual refuerza la posibilidad de una dispersión del daño registrado como consecuencia de esta variabilidad. En el caso del varicocele, la situación puede ser un poco diferente dado que la dilatación permanente de las venas espermáticas da lugar a una hiperproducción crónica de óxido nítrico, que reacciona con el anión superóxido produciendo peroxinitrito, el cual es un agente oxidante muy potente34-36. Además, los espermatozoides de las muestras de individuos con varicocele suelen retener la gota citoplasmática como consecuencia de un proceso de inmadurez y esto supone una fuente de ERO muy activa37,38. Así pues, mientras que el estrés oxidativo que afecta al varicocele puede tener un origen intratesticular, intenso y continuo, el daño por una actividad elevada de ERO vía leucocitos, podría ser más transitorio en el espacio y el tiempo.
En cualquiera de los casos, el ID observado en las muestras analizadas tiene una relevancia singular en el marco de este tipo de estudios, dado que ofrece unas diferencias muy significativas entre los grupos de pacientes que no se observan de forma tan nítida con los valores obtenidos al estimar la SDF total, es decir, sin establecer la discriminación de los espermatozoides degradados dentro de los espermatozoides con ADN fragmentado. Por lo tanto, y de acuerdo con los resultados aquí obtenidos, pensamos que valores de ID del ADN espermático superiores a 0,30 no sólo nos indican un grado alto de afectación de la molécula de ADN, sino también que este valor se podría utilizar como marcador potencial de presencia de varicocele. Actualmente, las determinaciones del ID se están extendiendo a múltiples patologías andrológicas con mayor número de individuos y esperamos poder confirmar los resultados aquí presentados. En cualquiera de los casos, si en un estudio de fragmentación de ADN espermático se detecta la presencia de una proporción elevada de espermatozoides degradados en el conjunto de espermatozoides con ADN fragmentado, independiente de la cifra global de fragmentación, se debería confirmar con los métodos diagnósticos clásicos la posible presencia de varicocele, incluso si éste es subclínico.
Agradecimientos
Los autores quieren agradecer a Altea Gosálbez y a Francisca Arroyo su inestimable colaboración en el procesado de muchas de las muestras utilizadas en el presente trabajo, realizado con fondos del Ministerio de Ciencia y Tecnología: BFU2010-16738/BFI.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
* Autor para correspondencia
Correo electrónico:jaime.gosalvez@uam.es (J. Gosálvez).
Recibido el 4 de noviembre de 2011;
aceptado el 25 de enero de 2012