Los avances en tecno-ciencia nos han permitido cambiar el clásico concepto de enfermedad desde el evidente estado de disminución física y debilitamiento, por conceptos más complejos y dinámicos, entre los cuales destacan las enfermedades asintomáticas o “silenciosas”, los marcadores tumorales y recientemente la incorporación de anomalías en los genes como predictores de enfermedades. Tales marcadores y genes de predisposición genética aumentan día a día y muchos de ellos ya se utilizan en la práctica clínica. Los profesionales sanitarios debemos conocer a cabalidad sus indicaciones, comprender sus beneficios así como también debemos saber reconocer sus limitaciones y aspectos controversiales como herramientas de diagnóstico y como elementos predictivos. Los datos genéticos pueden llegar a ser extremadamente delicados por cuanto su difusión inapropiada puede vulnerar la dignidad y los derechos de las personas. Su divulgación puede significar discriminación y estigmatización para quien es portador de defectos del código genético, por lo que los médicos debemos ser los primeros garantes de la privacidad y confidencialidad de esta información. En general se recomienda su utilización en la identificación de grupos de riesgo sólo cuando se pueden ofrecer terapias o estrategias que mejoren el curso natural de la enfermedad pues de lo contrario, sólo contribuirán a generar ansiedad y angustia sin ningún beneficio evidente para el paciente.
Advances in techno-science have allowed us to change the classical concept of disease from the spectrum of signs of physical decline and weakness, for more complex and dynamic concepts, such as asymptomatic or “silent” diseases and recently the incorporation of abnormal genes as predictors of disease. Among these predictors, tumor markers are growing continuously and many of them are already used in clinical practice. Healthcare professionals must understand their benefits as well as should be able to recognize its controversial aspects such as diagnostic tools and predictors. Genetic data can be extremely sensitive because its disclosure could undermine the dignity and rights of individuals. Its information can result in risk of discrimination and stigmatization and for these reasons doctors should be the first guarantee of privacy and confidentiality of this information. Its use in the identification of risk groups is acceptable only when they can provide therapies or strategies to improve the natural course of the disease.
La salud ocupa actualmente un importante lugar en nuestras vidas. La promoción y adhesión a estilos de vida saludable constituyen hoy estrategias de políticas públicas, estrategias comerciales de la industria farmacéutica, alimentaria y de cosméticos, de las empresas de vestuario y calzado deportivo, de los gimnasios y muchas otras actividades sanitarias, productivas y empresariales. Esto se debe a que la sociedad moderna asigna a la salud una gran importancia y anhela un estado de salud individual y colectivo que le permita la libertad de crecer y desarrollarse en forma óptima, de acuerdo a las propias potencialidades y sin el freno que imponen las enfermedades humanas a este crecimiento y desarrollo. Sin embargo, el estar sano depende de múltiples factores, pero sobre todo está directamente relacionada con nuestra constitución genética individual y con la exposición a diversos agentes ambientales nocivos, como también lo está con el estado emocional, mental y estructura sicológica de cada sujeto, es decir, con nuestra forma de ser y de enfrentar la vida. También está íntimamente relacionada con el modo en que como sociedad, nos relacionamos con el medio ambiente, nos prodigamos crecimiento económico y cómo éste se distribuye con equidad en la población. Los Estados han comenzado a invertir mucho más de su presupuesto en promoción de la salud para que la población adquiriera hábitos de vida saludables, mediante una correcta educación a edad temprana y además, muestran cada vez más preocupación por mantener o recuperar una buena calidad del medio ambiente (1).
Sumado a lo anterior, nuestra sociedad occidental muestra un creciente interés en la medicina preventiva, especialmente en la prevención primaria y secundaria. En este último tipo de estrategia, Chile tiene múltiples normativas y guías que tienen como objetivo homologar, estandarizar y aplicar a todo nivel (público y privado), acciones de salud que permitan la detección precoz de una amplia gama de alteraciones y enfermedades, con el fin de prevenir las conocidas y graves complicaciones que se derivan de su evolución natural. Con estas estrategias espera lograrse un impacto significativo en la mejoría de indicadores como el pronóstico vital, la calidad de vida, carga de enfermedad y años de vida ganada, entre otros. Ejemplo de estas políticas son las normas de pesquisa de hipotiroidismo congénito y fenilquetonuria del recién nacido, detección de displasia de caderas en el primer trimestre de vida del niño, pesquisa de diabetes/ VIH/ sífilis y otras enfermedades en la embarazada, papanicolau y mamografía periódica en las mujeres adultas y muchos otros ejemplos
Esta misma estrategia se ha ido consolidando en el área de los tumores malignos, debido a que en la mayoría de los países desarrollados, así como en el nuestro, el cáncer representa la segunda causa de muerte y este problema se hace más dramático a medida que aumenta el envejecimiento poblacional. En general, los pacientes con cáncer se diagnostican en una etapa muy avanzada y por lo tanto, tardía para ser curados; las terapias más modernas muestran una elevada relación costo-efectividad y sólo son eficaces para una minoría. Además las respuestas a la terapia suelen ser poco predecibles y con múltiples efectos colaterales. Por otra parte, los pacientes con diagnóstico oportuno en etapa precoz tienen mayores probabilidades de curación con las terapias modernas con una mayor chance de sobrevida a 5 años y sin recurrencias de la neoplasia en su futuro.
En consecuencia, es un imperativo desarrollar métodos de diagnóstico precoz que permitan reconocer estos cánceres en sus primeras etapas, así como elementos que permitan predecir la mejor, más costo-efectiva y específica terapia para cada individuo.
Estar sano y estar enfermo en el siglo XXIAunque el concepto de salud resulta familiar y muy obvio, se ha intentado definir “la salud” y “el estar sano o estar enfermo” desde distintas perspectivas incluyendo desde luego, la visión médica, y otras como la antropológica, histórica, filosófica y sociológica. Para muchos, el modo más simple de definir la salud es la ausencia de enfermedad. Tal es así, que lógicamente se ha asumido, desde nuestro más remoto pasado, que si una persona está asintomática, entonces está sana.
Sin embargo, el concepto de salud tiene características que dificultan una definición única y universal del término: es una palabra que se usa en variados contextos, se utiliza a partir de diversos supuestos básicos referentes al estado psico-biológico del ser humano y traduce anhelos idealizados respecto a la calidad (y a veces cantidad) de vida que quisiéramos tener.
En el contexto filosófico/antropológico, Pedro Laín Entralgo, gran médico, historiador y eticista español definió la salud como “hábito psico-orgánico al servicio de la vida y de la libertad de la persona; y consiste en la posesión de esa normalidad y en la capacidad física para realizar proyectos vitales de la persona en cuestión” (2).
La definición de salud propuesta por la Organización Mundial de la Salud (OMS) es “el estado de completo bienestar físico, mental y social y no solamente la ausencia de afecciones o enfermedades, que a su vez son definidas como aquellas alteraciones estructurales o funcionales que afectan negativamente al estado de bienestar” (3). Se critica esta definición como utópica, que suscita expectativas desmedidas, y que por ser demasiado vaga, carece de aplicabilidad y hasta de significado concreto.
Sin embargo, la salud y la enfermedad son vividas por las personas bajo su propia percepción y conceptualmente no corresponden a categorías discretas, sino que más bien se pueden considerar como un continuo, en que el estado de salud ideal (cualquiera que éste sea y como quiera que se defina) está en un extremo pocas veces alcanzado por cualquier ser humano, seguido por el estado de enfermedad con infinitos estados intermedios (se puede sentir un poco enfermo o muy enfermo) y en el otro extremo se encuentra la enfermedad terminal. En las partes intermedias de este continuo se encontraría la mayoría de la población, donde el límite de separación entre salud y enfermedad se hace más confuso.
Se puede advertir, entonces que la definición de salud no es fácil, como tampoco lo es su límite con la enfermedad. Esta palabra proviene del latín “infirmitas” y significa “poca firmeza o sin firmeza” o debilidad. La concepción más ancestral de enfermedad se basaba en las anormalidades que se percibían respecto del ideal de salud en cada momento, lugar y cultura de nuestra historia. La enfermedad se manifestaba por los síntomas y signos que permitían su diagnóstico, y se debía al alejamiento del órgano de su función normal y a todo el cuerpo de lo “fisiológico”. En último término, todo aquello que causaba una obvia y categórica percepción de disminución física del individuo, que lo hacía percibir una “dolencia” y que lo diferenciaba sin lugar a dudas de “estar sano”.
Desde nuestros comienzos humanos, la enfermedad como concepto ha sido la conjunción más o menos coherente entre el debilitamiento que ocasionaba el mal, las manifestaciones que la acompañaban y las anormalidades que podían encontrarse al examen físico. Sus causas estuvieron primero relacionadas con las voluntades divinas, ya sea como castigo a pecados o faltas a las deidades. Posteriormente se las atribuyó a desequilibrios entre los elementos que se suponía, eran componentes básicos de nuestro cuerpo (sangre, bilis, flemas, entre otros).
Sólo en los últimos tres o cuatro siglos, se comenzó a entender la biología y la fisiología, la bacteriología y todas las otras disciplinas que han permitido develar las causas de las enfermedades humanas. Esto nos llevó a comprender mejor la relación entre las manifestaciones físicas y cada enfermedad o grupo de enfermedades. Conocidos los sustratos morfofuncionales y consolidada la semiología médica, se entendió la enfermedad como un proceso vital, caracterizado por una desviación del estado normal o ideal de salud, por una alteración del estado fisiológico en uno o más órganos o sistemas del cuerpo, manifestada por síntomas y signos característicos, y cuya evolución era más o menos previsible. En otras palabras, como una alteración que provoca una amenaza para la salud, de causas diversas, cuyo sustento está avalado por las ciencias biomédicas y que tiene impacto en el desempeño normal del individuo, o que afecta su calidad de vida, o disminuye sus expectativas de vida o representa una amenaza inmediata con riesgo de muerte.
Un importante cambio conceptual de la definición de enfermedad apareció a mediados del siglo XX, cuando los métodos auxiliares de apoyo al diagnóstico comenzaron a consolidarse en la práctica clínica. Especialmente con la irrupción de la medicina preventiva, de los exámenes de laboratorio, de diagnóstico por imágenes y endoscópicos, se comenzó a percibir el conflicto que generan los hallazgos inesperados. Esto ha ocurrido con el hallazgo de cánceres precoces en el estómago, en las mamas, el tiroides, en el cuello uterino, en la próstata o en la piel, por citar algunos ejemplos frecuentes. Estos nuevos escenarios obligaron a evolucionar el concepto de enfermedad, que ya no es solamente aquello que quita firmeza, que hace sentir disminuidos, que hace sentir “dolencias” o que quita la sensación de bienestar, sino que ahora se debe incluir circunstancias asintomáticas, pero objetivamente riesgosas para la salud y pronóstico vital. Este primer y revolucionario cambio en el modo de definir las enfermedades se resume en que al sujeto enfermo ya no se le exige percibir una “dolencia” para ser considerado como tal. En suma, se ha introducido y validado plenamente el concepto de “enfermo asintomático”. El “estado de bienestar” al cual hace referencia la OMS (3) ya no depende exclusivamente de la auto-percepción del individuo sino que ahora se sustenta en la calidad, cantidad y profundidad con que nuestras herramientas de diagnóstico escudriñan el interior del cuerpo humano.
Recientemente se han agregado nuevos elementos que aportan más complejidad a este escenario. El descubrimiento del código genético y de sus alteraciones en enfermedad, la comprensión de los fenómenos intracelulares ligados a la aparición de neoplasias, el hallazgo de marcadores biológicos y moleculares de anormalidad, han cambiado aún más radicalmente nuestra definición de enfermedad, desde la clásica auto-percepción de anormalidad y minusvalía, hasta una perspectiva desligada de la vivencia individual e independiente de la presencia de síntomas y signos, que no necesita alteraciones anatómicas gruesas y ni siquiera alteraciones a nivel microscópico para ser caracterizada: ahora, la anormalidad también se encuentra y define a nivel molecular, en la presencia de indicadores en sangre, en orina u otros fluidos o en secuencias anormales del código genético. Esto genera un conflicto pues no se tiene certeza si se debe llamar “enfermo” a una persona asintomática, sin alteraciones evidentes en su cuerpo ni en su desempeño orgánico y sistémico, equilibrada emocionalmente, solamente por el hecho de encontrar una alteración bioquímica que sólo traduce una probabilidad de riesgo futuro. Más aún, ¿se llamará enfermo a un voluntario asintomático, aparentemente sano, en quien el estudio del grupo control, demuestra que tiene una alteración en su genoma? ¿Qué consecuencias traerá este nuevo escenario? ¿Esta información tendrá impacto en la esfera social, laboral, financiera, de contratación de seguros u otras esferas de la vida de relación del individuo?
Todos estos adelantos han ocurrido en muy poco tiempo, han cambiado el modo de hacer medicina, han agregado tópicos inéditos a la práctica clínica y han planteado nuevos desafíos para el mundo civil y el mundo sanitario.
En nuestro país, los exámenes de medicina preventiva consideran un mínimo definido por normas del Ministerio de Salud (Minsal) en la Guía Clínica para Examen de Medicina Preventiva del año 2008, en que se describen los procedimientos básicos para detectar algunos de los muchos problemas prevalentes en nuestra población (4).
Sin embargo, esta realidad sólo establece una plataforma elemental y consensuada, que puede ser insuficiente, pero que apunta a la detección de enfermedades con un costo razonable para el individuo, para su seguro de salud y finalmente para los fondos fiscales. Pues es bien sabido que mientras más exámenes se hagan en un sujeto adulto asintomático, más probabilidades habrá de encontrar alteraciones a cualquier nivel, debido a la teoría de las probabilidades y el azar (5-7).
Derivado de lo anterior, surgen otros cuestionamientos: ¿hasta dónde buscar en un programa de Medicina Preventiva? ¿Debemos considerar un escáner total del cuerpo? En un país cuya primera causa de muerte por cáncer es el carcinoma gástrico: ¿Se debe hacer endoscopía digestiva alta anual o cada dos años, a todos los sujetos sintomáticos mayores de 40 años? En Chile, dado que la primera causa de muerte por cáncer en la mujer es el carcinoma de vesícula biliar: ¿Se debe hacer ecotomografía abdominal a todas las mujeres mayores de 35 años, para buscar colelitiasis? ¿Existen los recursos financieros y la capacidad humana y técnica para hacer esto?
Son preguntas trascendentales que tienen varios ribetes de análisis, entre ellos de costo-efectividad, de presupuestos económicos y de planificación, de disponibilidad de recursos para atender a una nueva cohorte de personas con anomalías que se descubrirán a través de estos programas de detección temprana, considerando que el sistema sanitario seguirá teniendo además, la misma carga asistencial determinada por las enfermedades sintomáticas, crónicas y avanzadas que actualmente lo agobian. En lo que asiste certeza es que los estudios “preventivos” tienen un techo infinito y cuyo impacto en nuestros sistemas de salud públicos y privados puede ser asistencial y económicamente catastrófico, al generar una nueva y mayor demanda de acciones sanitarias en sistemas que no tienen la posibilidad de crecer proporcionalmente en su oferta de servicios. De ahí que cada vez que surge un nuevo examen para detección precoz de cualquier entidad mórbida, los médicos debemos ser extraordinariamente cuidadosos, debemos estar bien informados de sus ventajas y desventajas, debemos actuar siempre en el mejor beneficio del paciente y sobre todo, debemos siempre informar adecuadamente a éste acerca de los beneficios reales y de los aspectos negativos de estos nuevos adelantos.
El objetivo de este artículo, es revisar algunos de los escenarios que enfrentarán los pacientes, el equipo de salud y los agentes sociales en relación a los nuevos métodos de prevención secundaria, de diagnóstico precoz y de predicción de enfermedades neoplásicas, que pueden significar decisiones complejas en lo médico y especialmente en lo ético.
El problema del cáncer y su prevención: estudios de diagnóstico genético y marcadores tumoralesActualmente, existe una gran variedad de exámenes genéticos que permiten diagnósticos prenatales, comparar la identidad genética entre muestras de un mismo individuo o entre padres e hijos, identificar mutaciones específicas de algunos padecimientos y técnicas que permitirían “predecir” con mayor o menor exactitud, la ocurrencia de ciertas enfermedades.
Antes de 1950, la genética humana estaba en pañales en su aplicación clínica. De las pocas enfermedades genéticas conocidas, en la mayoría sólo se llegaba a la etapa de diagnóstico y eventualmente de consejería respecto a decidir sobre futura descendencia, pues era muy raro poder ofrecer terapias o curación para estas enfermedades. A fines de la década de 1950, la situación cambió dramáticamente con la descripción de la anomalía cromosómica característica del Síndrome de Down, y sobre todo, después que se descubrió que tal anomalía puede detectarse en el líquido amniótico de la mujer embarazada mediante una simple amniocentesis. Este suceso abrió inmediatamente una de las áreas de reflexión ética más profundas en la medicina contemporánea, cual es el diagnóstico prenatal de anormalidades embrionarias o fetales y del derecho de los padres a decidir acerca del destino de tal embarazo y del controversial tema del aborto.
A comienzos de 1990, se inició el proyecto para descifrar el genoma humano y mapear la información genética, responsable de nuestra herencia biológica, almacenada en los 23 pares de cromosomas humanos. En los últimos veinte años, producto de tales avances, se ha podido estudiar cada vez con más precisión, la predisposición genética a algunos tipos de cáncer y se han descrito varios síndromes de tumores hereditarios. El primer ejemplo de ellos surgió durante la década de 1990, cuando se demostró la existencia de una forma de cáncer mamario con un fuerte componente hereditario, en el cual se identificaron los genes BRCA-1 y BRCA-2 responsables del alto riesgo de desarrollar esta neoplasia maligna. Actualmente se conocen algunos síndromes de cánceres hereditarios que están asociados a mutaciones monogénicas raras pero con alta penetrancia, aunque los factores genéticos también juegan algún rol en los cánceres esporádicos, como se ha reportado en numerosos estudios de familias. La contribución de factores ligados a la herencia en la aparición de neoplasias, han sido estudiados en grandes poblaciones de gemelos verdaderos, donde se ha visto que para algunos tumores, la herencia ejerce una considerable influencia como es el caso de los cánceres de mama, colon y próstata (8).
Los recientes avances tecnológicos en genómica, proteómica y metabolómica (las “ómicas”) están abriendo luces para conocer la huella digital de cánceres específicos y redefinir su nomenclatura, clasificación y significado de acuerdo a las alteraciones moleculares que albergan. Esta aproximación desde las “ómicas” ha permitido caracterizar indicadores de respuesta a drogas, el desarrollo de nuevas terapias, innovadoras estrategias de monitorización de respuestas y vigilancia específica en individuos susceptibles al cáncer (9) Además, el desarrollo de nuevos marcadores tumorales ha contribuido a ampliar las oportunidades de hacer tamizaje, diagnóstico precoz, evaluación de terapias y definir con más exactitud el pronóstico de ciertos tumores. El descubrimiento de genes que predisponen al cáncer y de marcadores tumorales que, como su nombre lo indica, “marcan” la presencia de un tumor, han ayudado a médicos y pacientes en el proceso de toma de decisiones, a veces de un modo trascendental para el manejo de la enfermedad. Sin embargo, han abierto nuevos escenarios de discusión ética, pues pueden significar acciones médicas incorrectas producto de una inadecuada interpretación de los hallazgos, pueden acarrear la vulneración de ciertos derechos individuales o pueden promover actos discriminatorios contra las personas afectadas.
Los marcadores tumoralesSe denominan así a sustancias biológicas que se encuentran en una persona con cáncer, en su sangre, orina u otros fluidos corporales y aún en el tejido tumoral. Clásicamente son proteínas producidas por las mismas células cancerosas, pero también pueden ser producidos por el metabolismo corporal en respuesta al cáncer, entre otras afecciones. La mayoría de los marcadores tumorales son proteínas, pero algunos más recientes consisten de genes u otras sustancias. Existen muchos diferentes marcadores tumorales. Algunos se encuentran presentes en un solo tipo de cáncer, mientras que otros pueden encontrarse en muchos tipos de neoplasias y aún en enfermedades no neoplásicas.
Clásicamente, el marcador es identificado al combinar la sangre u orina o tejido tumoral, con anticuerpos que reaccionan con la proteína (antígeno) del marcador tumoral. Por si solos, estos marcadores pocas veces son suficiente evidencia de la presencia de cáncer. Se sabe que la mayoría de los marcadores tumorales pueden ser producidos también por células no cancerosas en enfermedades inflamatorias benignas que pueden causar que los niveles de ciertos marcadores tumorales se incrementen más de lo normal. Además, se debe tener presente que no todos los sujetos con cáncer presentan niveles elevados del marcador tumoral particular. Es por eso que sólo unos pocos marcadores tumorales se han validado en la práctica clínica: cuando están elevados, permiten al médico junto con la historia clínica del paciente, los hallazgos del examen físico, así como con los otros análisis de laboratorio y estudios de imágenes, seguir un protocolo de estudio que permita maximizar las probabilidades de demostrar la presencia y localización exacta de tal neoplasia y que minimice los errores de diagnóstico (porcentaje de falsos positivos y falsos negativos tendientes a cero). Debe recordarse que en la medicina moderna, el diagnóstico de certeza de un cáncer lo constituye el estudio histopatológico de una muestra tisular de tal tejido.
Un marcador resulta útil si se puede medir en forma exacta, confiable y reproducible con un método ampliamente accesible, pero debe recordarse que puede existir variabilidad intra e inter-observadores y laboratorios, lo que resta exactitud y credibilidad al método y que obliga a estrictos y permanentes controles de calidad. El determinante más importante de su utilidad es si el diagnóstico permite realizar acciones de salud que puedan evitar o reducir la morbi-mortalidad de tal enfermedad tumoral; ejemplo de ello son los marcadores que permiten predecir la presencia del cáncer, la sobrevida del sujeto o la recidiva del tumor, mediante protocolos de vigilancia (10).
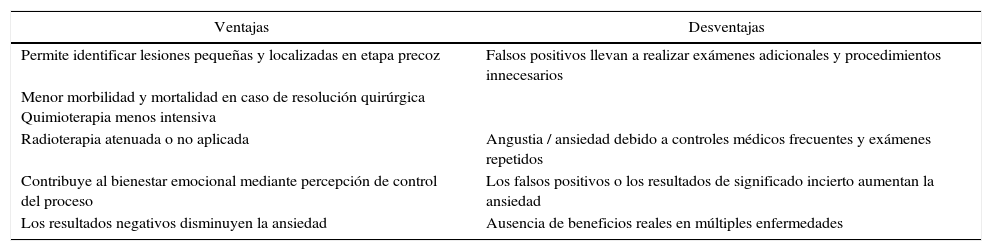
Los marcadores tumorales se han utilizado para un tipo de prevención llamado cribado (se usa también e indistintamente el término tamizaje y en inglés “screening”) que consiste en la detección de una enfermedad en su etapa asintomática (sub-clínica) o en la detección de sus factores de riesgo. Idealmente un buen sistema de cribado debe tener alta sensibilidad y especificidad, un valor predictivo positivo muy elevado, debe ser simple y de bajo costo, debe ser seguro, aceptado por médicos y pacientes, y finalmente debe ser certero en su clasificación para resguardar apropiadamente a los pacientes de un “etiquetado” o “rotulado” equivocado. Esto último es relevante pues tiene que ver con la capacidad de no causar entre otros, daños físicos, económicos y psicológicos al ser falso positivo, ni daño de oportunidad (retraso en la terapia) al ser falso negativo (5-7). Al igual que muchas materias en Medicina, esta acción de tamizaje o cribado tiene ventajas y desventajas que se resumen en la tabla 1.
Ventajas y desventajas del tamizaje o cribado para cáncer.
| Ventajas | Desventajas |
|---|---|
| Permite identificar lesiones pequeñas y localizadas en etapa precoz | Falsos positivos llevan a realizar exámenes adicionales y procedimientos innecesarios |
| Menor morbilidad y mortalidad en caso de resolución quirúrgica Quimioterapia menos intensiva | |
| Radioterapia atenuada o no aplicada | Angustia / ansiedad debido a controles médicos frecuentes y exámenes repetidos |
| Contribuye al bienestar emocional mediante percepción de control del proceso | Los falsos positivos o los resultados de significado incierto aumentan la ansiedad |
| Los resultados negativos disminuyen la ansiedad | Ausencia de beneficios reales en múltiples enfermedades |
Modificado de Teplick A. y cols (11).
Cuando se diseñan protocolos de vigilancia en base a estos marcadores tumorales, se debe tener en cuenta los factores deseables a considerar en tales programas (11):
- •
Estos exámenes deben tener la más alta sensibilidad y especificidad.
- •
En caso de predisposición genética, la enfermedad en pesquisa debe tener una alta penetrancia (% de sujetos con la predisposición, que manifestarán la enfermedad).
- •
Deben conocerse los grupos etarios de riesgo, para aplicar en ellos estos protocolos.
- •
Las modalidades de vigilancia por screening a utilizar deben ser seguras, efectivas y ampliamente disponibles.
- •
Deben conocerse los intervalos para realizar el examen en virtud de la más sólida información epidemiológica.
- •
Debe estar definido el periodo durante el cual, los sujetos estarán sometidos a tal protocolo (¿de por vida?, ¿hasta los 75 años?, ¿sólo en la edad fértil?).
- •
Debe existir terapias efectivas para la enfermedad en pesquisa.
En la actualidad, el Antígeno Prostático Específico (APE o PSA por sus siglas en inglés) es el más reconocido marcador tumoral utilizado para estudios de detección precoz en cáncer de próstata. Pero hay que recordar que hay pacientes con cáncer prostático y PSA normal y pacientes con PSA elevado que no tienen cáncer, por lo que su utilización debe ser siempre acompañada de otras modalidades de estudio y en manos de especialistas.
Otros marcadores tumorales usados en clínica, fundamentalmente en el seguimiento y detección de recurrencia cancerosa son:
- -
la Gonadotrofina coriónica humana para los tumores trofoblásticos del embarazo como el Coriocarcinoma y algunos tumores de células germinales en testículo y ovario.
- -
Alfa-feto proteína (AFP) para cáncer de hígado.
- -
CA 125 para el cáncer ovárico.
- -
Antígeno carcino-embrionario para cánceres colo-rectales.
- -
CA 19-9 para cáncer de páncreas.
- -
Existen algunos aspectos desfavorables de los marcadores tumorales que debemos conocer:
- •
Casi todas las personas tienen una pequeña cantidad de estos marcadores en la sangre, por lo tanto es muy difícil detectar tumores cancerosos en etapa inicial mediante el uso de estas pruebas.
- •
Los niveles de estos marcadores tienden a aumentar a más de lo normal sólo cuando hay una gran cantidad de cáncer presente.
- •
Algunas personas con cáncer no presentan niveles elevados anormales de estos marcadores.
- •
Incluso cuando los niveles de estos marcadores son elevados, no siempre significa que haya cáncer. Por ejemplo, el nivel del marcador CA 125 puede estar elevado en mujeres con afecciones ginecológicas distintas al cáncer ovárico.
Debido a estas razones, los marcadores en la actualidad son principalmente usados en pacientes que ya hayan sido diagnosticados con cáncer y sometidos a terapia, para seguir su respuesta al tratamiento o para detectar la recurrencia del cáncer después del tratamiento. Últimamente se han encontrado muchos otros marcadores tumorales y esta área continúa siendo muy atractiva y prolífica en la investigación sobre el cáncer (12).
Estas materias han abierto un nuevo espacio de debate en el campo de la bioética clínica, a la vez que han planteado numerosas interrogantes de carácter ético y legal, tales como la exactitud y credibilidad de las predicciones, la información sobre riesgo, la protección contra la discriminación y la dignidad humana, el derecho a la privacidad de los datos y la obligación de guardar la confidencialidad de éstos, el valor y alcances del consentimiento informado y la propiedad del material y de la información genética. Pocas veces en Medicina, las autoridades sanitarias y legislativas se han visto enfrentadas a desafíos tan complejos como en la regulación y normativa de los avances científicos en genética humana y marcadores tumorales y en sus aplicaciones diagnósticas y terapéuticas.
La prevención secundaria en oncología: reflexiones desde una perspectiva bioética1Los genes de predisposición al cáncerComo se mencionó anteriormente, nuestro concepto de enfermedad ha evolucionado y aceptamos que a una persona se la podría catalogar como enferma aunque esté asintomática, si tiene tumores internos, órganos con disfunciones parciales o alteraciones en sus genes. En el campo de la oncología, se han identificado múltiples anormalidades genéticas ligadas a tumores específicos, entre los más frecuentes figuran los cánceres de próstata, mama, colo-rectal, pulmón, tiroides, testículo y otros (13), pero el riesgo que muestran estos marcadores a la ocurrencia de cáncer, se observa en general una razón de disparidad (Odds Ratio) en promedio menor de 1.3. Esto es explicable pues, para que tales anomalías lleguen a expresarse, deben concurrir una serie de factores multi-causales individuales, tales como otros errores genéticos y la interacción con factores ambientales, que produzcan la aparición de un cáncer (modelo de Rothman).
Se ha observado que muchos de los individuos con presencia de genes de predisposición genética al cáncer presentes, nunca desarrollaron tales neoplasias, como es el caso de mujeres con los marcadores BRCA de cáncer de mama. Esto se conoce como la ecuación fundamental de la Genética, en la cual la expresión final de un gen (fenotipo) se alcanza sólo si interactúan del modo preciso, el genotipo y ciertas características ambientales. Además es importante tener presente que existen alteraciones epigenéticas, que corresponden a cambios que sufre el material genético sin que se altere la secuencia de sus genes (por ejemplo, la metilación de algunas bases nitrogenadas) y que pueden dar origen a cambios que impacten en la expresión del fenotipo.
Las personas con historia familiar de cáncer tienen al menos el doble de riesgo de desarrollar cáncer en comparación con la población general y aquellas personas que son portadoras de mutaciones en genes específicos de líneas germinales, pueden tener hasta 80% de riesgo de desarrollar cáncer. Sin embargo, para la mayoría de las personas con historia familiar de cáncer pero sin aberraciones genéticas identificables, aún no es posible evaluar su riesgo específico de desarrollar neoplasias y proponer estrategias de prevención apropiadas. Las mutaciones de líneas germinales en genes supresores o de reparación, de tumores específicos de alta penetrancia han sido consistentemente asociadas a varios síndromes de cáncer hereditario, como algunos tipos de cáncer de mama y ovario, en el Síndrome de Lynch, en poliposis adenomatosa familiar, en neoplasias endocrinas múltiples y en cáncer gástrico difuso familiar. En algunas de ellas, pueden ofrecerse cirugías de carácter “profiláctico”, como en el caso de tumores de mama, ovario, colon y estómago, sin embargo no se debe olvidar los riesgos vitales que representan algunas de estas intervenciones y las secuelas físicas y funcionales que provocan. Complementariamente, son recomendables los programas de vigilancia, sea por imágenes o endoscópica, por equipos multi-disciplinarios y en pacientes muy bien informados (14).
Una situación preocupante está ocurriendo en Estados Unidos de Norteamérica, donde el impacto público que ha causado el tema de la genética de cánceres familiares, ha llevado a un creciente mercado de test genéticos que se venden directamente a los compradores por internet, generando situaciones preocupantes para las autoridades sanitarias, para el mundo médico y para las agencias reguladoras, dado el escaso conocimiento que tiene la civilidad respecto al significado de tales exámenes y a las impensables consecuencias a nivel individual y de sobrecarga asistencial para resolver dudas, que esta situación está generando (15).
La predicción mediante estos estudios del genoma, ofrecen la posibilidad de conocer un riesgo incrementado de desarrollar un cáncer específico que tiene una base genética. Sin embargo es importante recalcar que estas alteraciones en el genoma sólo expresan una susceptibilidad a desarrollar tal enfermedad, pero no la certeza de tenerla. Los medios y recursos para identificar tales susceptibilidades se han desarrollado aceleradamente en el último tiempo, pero no así el avance de técnicas genéticas de prevención y terapia, que están bastante más atrasadas que las primeras. El conocimiento de la susceptibilidad a desarrollar una enfermedad sin una verdadera posibilidad de intervención, puede conducir a inaceptables consecuencias del uso de tal información como la discriminación, además del impacto en la vida psico-emocional en el individuo y aún en sus planes reproductivos.
Nuestra sociedad occidental ha asumido y aceptado ciertas prácticas médicas que permiten conocer por anticipado ciertas anormalidades o predicciones en salud: la punción de líquido amniótico para estudio de la trisomía 21 y la ecografía fetal son ejemplos de ello, pero es sabido que para la mayoría de ellos, aún no se descubre el modo de prevenirlos o curarlos. Del mismo modo, es esperable que una vez que estén ampliamente disponibles, los estudios de predisposición genéticas serán exigidos por la sociedad tal como ha ocurrido con los exámenes ya mencionados (15). Bajo este escenario, es válido preguntarse ¿Cómo se ponderan los beneficios de saber la susceptibilidad de enfermar de cáncer, a los riesgos y aspectos negativos que ello significa? ¿Está preparada la sociedad y sus individuos para tomar decisiones que signifiquen tanto un conocimiento de susceptibilidad como una carga importante de angustia? ¿Podrá tal conocimiento afectar la calidad de vida y otros aspectos de la existencia de las personas?
Los problemas son diversos e involucran dilemas médicos, psicológicos, sociales y éticos. Estos dilemas comunes a toda la medicina predictiva, son más evidentes en los exámenes predictivos de ADN para los cánceres.
Algunos de los conceptos que se deben tener siempre presentes son:
- •
La predicción no constituye certeza de enfermedad.
- •
El concepto de alteración genética no es sinónimo de enfermedad genética.
- •
La dificultad de comprender los riesgos y las probabilidades en genética.
- •
La expresión del gen en el fenotipo es multi-factorial.
- •
La información genética también traduce información sobre nuestros antecesores.
La presencia de anomalías en una parte de la información genética, obliga a efectuar consejería personalizada y seguimientos específicos de por vida. En este sentido debe respetarse el derecho del sujeto en evaluación, para conocer todos los aspectos relacionados con el tema y para recibir información del significado de tales pruebas de ayuda al diagnóstico, antes de su realización. La autonomía para decidir la aceptación de tales estudios estará sustentada en la calidad de la información provista por los especialistas y en la explicitación de las materias que aún no se conocen o en los problemas que aún no tienen posibilidades de curación. Todavía es controversial si se debe estudiar genéticamente a un individuo con ciertos antecedentes familiares específicos, cuando no hay posibilidades de ofrecer prevención o cura de la enfermedad que se quiere confirmar, pues en este caso, no se percibe un claro beneficio para el individuo y son evidentes los efectos negativos en su vivencia diaria, en su auto-percepción de salud y en la carga emocional de incertidumbre que deberá soportar (16).
2Detección de cáncer precoz: indicaciones, interpretaciones, probabilidades y sus implicancias éticasLa irrupción de marcadores tumorales representa por una parte, un claro beneficio al identificar sujetos con riesgo elevado, para incorporarlos a programas de seguimiento protocolizado, que pretende diagnosticar neoplasias en estadios precoces y así, aumentar las probabilidades de curación. Sin embargo, como se ha mencionado anteriormente, a veces los resultados positivos no están relacionados con cáncer y en otras ocasiones, los resultados negativos no descartan el cáncer.
Desde un punto de vista ético, el análisis se hace complejo al enfrentar conceptos como el mejor interés del paciente, los fines de la medicina moderna, la auto-percepción de salud y el derecho de los pacientes a una información completa e inteligible, a saber la verdad y a tomar sus propias decisiones. También es relevante la utilidad que brindan tales indicadores y marcadores: si a la vez de hacer el diagnóstico, no aportan información útil en términos de terapia, no reducen la morbi-mortalidad de la enfermedad ni permiten cambiar su curso natural en forma significativa, entonces no tienen una clara indicación clínica y sólo son aceptables en el contexto de investigación científica.
Esto es especialmente importante en el caso de los niños de familias con predisposición genética a ciertas neoplasias, pues tales diagnósticos pueden impactar fuertemente en los padres y en los estilos de enseñanza y formación de los menores, así como para su desarrollo futuro en términos de planificación de largo plazo. En este caso sólo se deben realizar estudios cuando hay medidas útiles que ofrecer, pues en caso contrario, se deben diferir hasta que el sujeto tenga las capacidades para tomar sus propias decisiones.
Para promover una reflexión útil que ayude a la mejor toma de decisiones, los profesionales sanitarios debemos recordar los fundamentos científicos de nuestra disciplina y tener claros los fines que deben orientar nuestra profesión.
En primer lugar, debemos recordar que todas las pruebas de diagnóstico tienen márgenes de error por diversas causas y que tal error puede manifestarse en la omisión de un diagnóstico verdadero (falso negativo, subdiagnóstico o seudo-normalidad) o en el falso diagnóstico de una enfermedad no presente (falso positivo, sobre-diagnóstico o seudo-enfermedad).
Cuando una nueva prueba de diagnóstico aparece disponible, es necesario conocer su sensibilidad y especificidad para discriminar a los enfermos, de los sujetos sin la enfermedad en estudio. Interesa entonces saber en cuántos de 100 pacientes con la enfermedad, el test en prueba resultará positivo (sensibilidad) y en cuantos sin la enfermedad, el test resultará negativo (especificidad). Sin embargo en estos dos conceptos, se parte de un escenario poco real, pues ya se conocen los pacientes enfermos y los sujetos sanos, y lo que se está estudiando es la capacidad del test de discriminar individuos enfermos de sujetos sanos, siendo el ideal 100% en ambos casos, aunque esta instancia es excepcional en Medicina. Es sabido que esta aproximación a un diagnóstico específico a través de marcadores, puede estar influenciada por el azar, por sesgos de varios tipos y por el tipo o espectro de los pacientes estudiados, en que habitualmente al probar un nuevo método de estudio (por ejemplo, un marcador bio-químico, inmunológico o genético), se utilizan sujetos muy enfermos, con estados mórbidos avanzados y en que la cronicidad y secuelas de su mal no dejan lugar a dudas de la presencia de tal enfermedad. La sensibilidad y especificidad de un test en estos casos, puede resultar muy alta, pero no es suficiente para confiar en su capacidad de discriminar sanos de enfermos, pues en la práctica clínica diaria, los grados de severidad de una enfermedad son amplios y lo mismo ocurre en los cánceres en que hay desde neoplasias in situ hasta la ominosa enfermedad metastásica.
Respecto a la sensibilidad y especificidad de una prueba, debe recordarse que son propiedades del test que deben tenerse en cuenta al momento de decidir si se utiliza dicha prueba o no. Sin embargo, una vez que ya se ha utilizado y están disponibles los resultados de una prueba diagnóstica, sean positivos o negativos, la sensibilidad y especificidad de la prueba dejan de ser relevantes, ya que estos valores han sido obtenidos en sujetos en los que se conoce de antemano, la presencia o ausencia de enfermedad (habitualmente estas pruebas se hacen en sujetos muy enfermos o de lo contrario, en personas muy sanas).
El escenario real de la práctica clínica, suele ser de incertidumbre en el cual el médico no tiene certeza si el paciente está enfermo de la entidad sospechosa o no lo está. Por lo tanto, a una prueba diagnóstica se le exige que su resultado sea concordante con el estado real del sujeto y que aporte a una correcta clasificación. Lo ideal es que una prueba de diagnóstico, clasifique correctamente al 100% de los sujetos. Si el resultado es (+) para la enfermedad “X”, que sea 100% verdadero positivo y si el resultado es (-) para esa condición, que sea 100% verdadero negativo.
Se describirá de un modo resumido los errores de sub-diagnóstico y de sobre-diagnóstico y se analizarán sus posibles consecuencias (5-7).
- a)
Sub-diagnóstico. En este sentido, lo que verdaderamente importa de una prueba es el Valor Predictivo Negativo (VPN), es decir, la probabilidad de no sufrir la enfermedad cuando el examen ha salido negativo; en otras palabras, en 100 exámenes negativos cuantos sujetos están sin la enfermedad. La circunstancia del sub-diagnóstico se produce cuando un examen resulta falsamente negativo y puede deberse a un bajo VPN. Las consecuencias son muy obvias y comprenden la tipificación del paciente como no enfermo para el diagnóstico que se quería confirmar o descartar, es decir quedará erróneamente rotulado como normal aunque tiene la enfermedad. Esta seudo-normalidad retrasará el diagnóstico y en el caso de una enfermedad neoplásica, eventualmente podría privar al paciente de la oportunidad de tratamiento curativo.
- b)
Sobre-diagnóstico. La instancia de sobre-diagnóstico se produce por un examen falsamente positivo. Nuevamente, lo que más importa de la prueba es su valor predictivo positivo (VPP), que es la probabilidad que una persona con un test positivo, tenga la enfermedad o condición anómala que se supone detectaría dicho test (6) y que está en directa relación con la prevalencia de la enfermedad. Es decir, cuando la prevalencia de una enfermedad o condición de interés es baja, un resultado negativo permitirá descartar la enfermedad con mayor seguridad, siendo así mayor el VPN.
Por el contrario, un resultado positivo no permitirá confirmar el diagnóstico, resultando en un bajo VPP. Por otro lado, se ha observado que a medida que aumenta el número de exámenes que solicitan los médicos para un “chequeo de salud”, también aumenta la posibilidad de obtener más pruebas con resultados falsos positivos (7).
Es indudable que el sobre-diagnóstico tiene una connotación negativa para el paciente. El impacto emocional de portar un cáncer es muy fuerte para toda persona, más aún si se siente sana. Además, la presunción de enfermedad neoplásica obligará a efectuar una serie de nuevos estudios, tales como exámenes bioquímicos de sangre, endoscopías, diagnóstico por imágenes (habitualmente escáner) y otros, para confirmar la sospecha inducida por este marcador tumoral y para etapificar el supuesto cáncer, sin mencionar que habitualmente, el costo económico de tales estudios deberá ser asumido por el paciente, aseguradoras o el Estado. Además puede impactar fuertemente en la relación clínica paciente-médico, quebrando la confianza del primero en su equipo tratante y despertando suspicacias respecto a los intereses del médico (¿solicita exámenes por conveniencia personal al ser dueño del laboratorio o recibe incentivos por tales solicitudes?).
Por estas razones, los médicos deben conocer a fondo el valor de estas pruebas en el momento de indicarlas y los fundamentos para su adecuada interpretación. La información brindada a los pacientes debe tener en cuenta que estos predictores o marcadores son sólo probabilísticos, cuyo significado puede ser relativo como valor pronóstico único y que es necesario complementar dichas pruebas con otros métodos.
3Manejo de la información genéticaDebido a que el manejo de los datos genéticos humanos puede vulnerar derechos y la dignidad de las personas, la UNESCO emitió el año 2003, la “Declaración Internacional sobre los Datos Genéticos Humanos” (17). En ella se resume una serie de recomendaciones respecto a los cuidados que deben tenerse en la recolección, utilización, tratamiento y conservación de estos datos. Destaca el derecho de las personas a decidir si quieren o no ser informados de los resultados de un estudio de investigación genética y que dicha información debe ser entregada por personas especialmente entrenadas en consejería genética. Además obliga a proteger la privacidad y confidencialidad de los datos genéticos. Estos datos identificables, no deben ser dados a conocer a empleadores, compañías de seguros, establecimientos educacionales, ni a familiares, salvo que haya razones de salud pública en juego.
Los estudios de tamizaje genético para evaluar la susceptibilidad individual a ciertas enfermedades y en particular en grupos de riesgo para desarrollar neoplasias malignas, son cada vez más disponibles en la práctica clínica y serán rutinarios en un breve plazo. Los mejores efectos de los estudios genéticos predictivos incluyen la adherencia a estrategias preventivas y de reducción de riesgo, comunicación apropiada al paciente y a sus familiares en riesgo, promover el bienestar psico-emocional, y finalmente reducir la morbi-mortalidad derivada de cánceres hereditarios o con una fuerte herencia familiar.
La comunicación de estas delicadas materias exige herramientas profesionalizadas, que han llegado a consolidar en países desarrollados la carrera de Consejería Genética, y que en nuestro país lo realizan los genetistas clínicos. Esta es una especialidad médica que brinda la Facultad de Medicina de la Universidad de Chile que comprende, entre otros, contenidos de genética básica, genética molecular, dismorfología, citogenética y consejería genética. Tal consejería debe velar no sólo por los contenidos, la formalidad y el escenario sino también por la edad a la que se debe informar al portador de la anomalía.
Otro tema importante es que los pacientes portadores de alteraciones genéticas, a veces pueden por su cuenta, transmitir información a menores de edad relacionados consanguíneamente, y esto puede ser particularmente grave y dañino, cuando se hace a menores, de un modo no profesional. Se aconseja tal información cuando el conocimiento de tal condición generará un beneficio en términos de perspectiva vital y cuando los enfoques se concentran en la toma de conciencia de actividades de riesgo (por ejemplo tabaco, alcohol, vida sexual) y en la prevención de hábitos riesgosos y en la promoción de hábitos de vida saludables (18).
La obtención de un consentimiento informado en estos casos cobra capital importancia, debe ser previo a la realización de los test genéticos, debido a la complejidad de la información genética, a la naturaleza controversial de la alternativas clínicas, opciones “terapéuticas o profilácticas” tales como algunas cirugías profilácticas u otros procedimientos de eficacia aún incierta, y al potencial daño por estrés emocional que se puede causar al sujeto. Los pacientes deben ser estimulados a reflexionar sobre la conveniencia de participar en tales estudios, en términos que los beneficios sean categóricamente superiores a los potenciales daños (19). Cuando tales test genéticos forman parte de una investigación científica, se deben tomar todos los resguardos para que el sujeto voluntario pueda entender perfectamente tal circunstancia y aceptar su participación, aun cuando no haya certeza de resultados y que la información recopilada puede dar origen a nuevas investigaciones.
La propiedad de las muestras es materia de discusión y la controversia no ha sido respondida de un modo consensuado, por cuanto hay diferentes miradas organizacionales. Lo importante es no perder de vista que el primer objetivo de la Medicina y de la investigación bio-médica es el bienestar del ser humano, cuidar y proteger al individuo sano o enfermo como sujeto en estudio. La información a brindar debe estar supeditada a proteger su mejor interés, a resguardar siempre el anonimato de los probandos humanos, a reguardar su identidad, y a solicitar su aprobación para cada nuevo test que se quiera hacer en tal muestra.
En el caso de la información contenida en fichas de registro clínico, debe ponerse especial atención al modo en que se resguardará la información desde el punto de vista de los datos genéticos predictivos: puede considerarse sólo información general en la ficha médica universal e información específica en la ficha genética. Su acceso debe estar encriptado de modo de estar resguardado adecuadamente de la intrusión de terceros no relacionados con el cuidado sanitario del paciente y en particular, en los casos de ficha clínica electrónica, tal acceso debe ser restringido a especialidades con privilegios previamente definidos. No obstante lo anterior, debe buscarse el modo que dicha información pueda estar al alcance de otros especialistas, cuando sea relevante para la salud del paciente.
La comunicación de información genética delicada, por el médico tratante a familiares del enfermo, sólo puede hacerse bajo la aceptación explícita del paciente. La naturaleza familiar consanguínea de la información genética puede exponer al médico tratante a una situación de conflicto, en que tiene por un lado, la obligación de resguardar a ultranza la confidencialidad de estos datos, y por otra parte puede verse enfrentado a la circunstancia de advertir a los familiares de posibles riesgos a la salud de éstos, evitándoles así, el sufrir daños consecuentes. El apoyo del departamento legal hospitalario y del comité de ética ayudarán a ponderar los riesgos y beneficios de tal información (20). Se recomienda que en caso de riesgo de salud para los familiares consanguíneos, y siempre y cuando haya posibilidad de terapia o paliación para el mal diagnosticado, se podrá informar a los familiares adultos. Esto debe realizarse idealmente con la anuencia del paciente para mantener una buena relación clínica, pero si éste no lo consiente y se juzga que hay riesgo para sus familiares si no se les informa, entonces se debe informar aun sin el consentimiento del paciente.
4Discriminación y estigmatización por estudios genéticosLa discriminación es una de las materias más delicadas en esta área de la “medicina predictiva”. La discriminación para contratar seguros de salud, obtener crédito bancario, ser objetado en concursos laborales y otras, son materias controversiales de nuestra sociedad actual. Justamente la confidencialidad de la información genética, es una obligación profesional de nuestro gremio en aras de proteger los mejores intereses del paciente.
Lamentablemente, en nuestra sociedad contemporánea, abundan los ejemplos de discriminación social, racial, por edad, de género y otras. Claro ejemplo de ello es que las personas mayores y las mujeres en edad fértil, tienen muchos más obstáculos para afiliarse a las Isapres y a un mayor costo de la prima, sin olvidar que pueden ser desafiliados unilateralmente cuando su perfil de riesgo no conviene al negocio de tales empresas. Este claro ejemplo de discriminación también puede hacerse extensivo a personas portadoras de alteraciones genéticas que los predispongan a ciertos tumores, en la medida que se perciba que su condición de sujetos sanos es “engañosa” y que tienen mayores probabilidades de enfermar que los sujetos normales, pudiendo ser discriminados en muchas esferas de la vida.
Este escenario aún está en ciernes en nuestro país, pero debemos estar preparados para defender los intereses de nuestros pacientes a toda costa.
Otro modo de discriminación negativa puede darse en el eventual estudio genético de niños que podrían ser entregados en adopción: una selección de los infantes por futuros padres, en base a información genética nos violenta en nuestra esencia humana y es una materia que ha enfrentado en un intenso debate a diversas sociedades desde perspectivas pragmáticas o deontológicas (21).
En síntesis, el concepto de enfermedad ha cambiado radicalmente en el último siglo. Actualmente se corre el riesgo de definir como enfermo, a quien posee alteraciones en sus genes, aún cuando esté asintomático y puede que nunca haga la neoplasia correspondiente a tal anomalía genética. Los test de tamizaje por marcadores tumorales para neoplasias deben ser efectivos en la detección, deben ser costo-efectivos en la utilización de los recursos y deben poseer un alto nivel de confiabilidad y exactitud (ej: elevados valores predictivos positivos y negativos). Los procesos involucrados en la detección de una neoplasia, deben incluir siempre una adecuada información y consejería a quienes resulten positivos, con oportuno estudio complementario necesario para confirmar tal sospecha diagnóstica, que abarcará desde el examen físico, de imágenes y de endoscopia hasta la obtención del tejido tumoral para su confirmación histopatológica. Además se debe disponer de los procesos de rápida información escrita a las personas en quienes el examen salió negativo.
Por último, debemos estar siempre informados de los resultados alejados del uso de tales marcadores; la reciente publicación de resultados del uso de antígeno prostático en poblaciones de Europa del norte en que no se encuentra diferencia significativa en la mortalidad por cáncer prostático a 20 años de seguimiento, entre grupos sometidos a vigilancia por este marcador y un grupo sin vigilancia, nos obliga a tener una mirada siempre abierta, crítica y basada en las mejores evidencias para tomar decisiones apropiadas (22). Este sorprendente reporte obliga al mundo médico a plantearse con mucha modestia y humildad cada vez que se sugiere un “chequeo preventivo”, interrogantes que con mucho sentido común, plantean los pacientes: ¿Qué diferencia hay entre realizar controles anualmente o consultar al médico sólo cuando aparecen los síntomas iniciales? ¿Vale la pena las molestias y el costo de los exámenes preventivos anuales? ¿Se vive más y mejor cuando se hacen controles preventivos periódicos?
Este nuevo escenario para la práctica clínica-asistencial de la Medicina, nos obliga a tener fundamentos científicos sólidos y convincentes para los pacientes, conocer estas nuevas materias con una mirada constructiva pero a la vez crítica, que nos permita ejercer nuestra profesión con apego estricto a nuestras mejores tradiciones humanistas, protegiendo en primer término el mejor interés de la persona enferma (o potencialmente enferma), cuidando la calidad de vida del individuo sano y cumpliendo los fines de la Medicina moderna.
El autor declara no tener conflictos de interés, en relación a este artículo.