Resaltar la importancia durante el periodo neonatal de las alteraciones del sodio que pueden llevar a situaciones extremas que pongan en compromiso la vida del paciente y supongan un desafío terapéutico.
Casos clínicosPresentamos 2 casos con alteraciones extremas del sodio.
1°: Recién nacido a término de 17 días con deshidratación hipernatrémica: pérdida de peso del 32% respecto al nacimiento. Cifra máxima de sodio 195 mmol/L. Fallo multiorgánico con necesidad de soporte en oxigenación por membrana extracorpórea (ECMO) y hemodiafiltración.
2°: Recién nacido prematuro de 31 semanas con cifra de sodio de 95mmol/L a los 15 días de vida sin otra sintomatología acompañante. Precisa reposición hidroelectrolítica lenta intravenosa.
ResultadoBuena evolución clínica. El caso 1 presenta un desarrollo psicomotor adecuado (actualmente 18 meses). El caso 2 presenta a los 7 años parálisis cerebral con diplejía espástica. Desde nacimiento presentaba lesiones compatibles con leucomalacia periventricular.
ConclusionesEl periodo neonatal es probablemente el periodo de la vida con mayor riesgo de presentar alteraciones hidroelectrolíticas. Es importante realizar un seguimiento estrecho de la pérdida ponderal en los recién nacidos en los primeros días de vida para prevenir la deshidratación hipernatrémica, así como monitorizar los niveles de sodio en los recién nacidos prematuros. Las alteraciones severas de la natremia son una urgencia vital que puede requerir tratamientos avanzados para conseguir una supervivencia con mínimas secuelas.
To highlight the importance of sodium changes during the neonatal period, which can lead to extreme situations that pose therapeutic challenges and compromise patient lives.
Case reportWe present 2 cases with extreme sodium alterations.
1st: A 17 day old full term newborn with hypernatremic dehydration: 32% of weight loss compared to birth weight and maximum sodium of 195mmol/L. He suffered multiorgan failure requiring ECMO support and haemodiafiltration.
2nd: A 31 week premature newborn with a sodium level of 95 mmol/L at 15 days of life without other accompanying symptoms. He required slow intravenous hydroelectrolytic replacement.
ResultsGood clinical evolution. Case one presents adequate psychomotor development (currently 18 months). Case two presents cerebral palsy with spastic diplegia at 7 years of age. From birth she presented cerebral injuries compatible with periventricular leukomalacia.
ConclusionsThe neonatal period is probably the period of life with the highest risk for hydroelectrolytic alterations. It is important to perform a strict weight control in newborns during their first days of life to prevent hypernatremic dehydration. It is also important to monitor sodium levels in preterm infants. Severe changes in natremia are a vital emergency that may require advanced treatments in order to achieve survival with minimal sequelae.
El periodo neonatal, especialmente en el caso de los prematuros extremos, es una de las etapas de la vida de mayor riesgo de alteraciones en los niveles de sodio. Esto se debe a que el recién nacido (RN), dada su inmadurez, es extremadamente sensible a las graves alteraciones hidroelectrolíticas que pueden producir tanto la falta como el exceso de líquidos. Asimismo, de debe tener en cuenta que las variaciones del sodio a menudo son iatrogénicas y, por tanto, pueden evitarse1.
La hiper o hiponatremia no suelen producir síntomas notables, aunque en ocasiones, sobre todo en los casos extremos, se asocian a apneas, bradicardias, letargia, irritabilidad y convulsiones, incluso pudiendo llegar a ser letal2.
Las tres causas fundamentales de hipernatremia durante el periodo neonatal son una mayor pérdida de agua, una ingesta inadecuada de líquido o un aporte excesiva de sodio3, siendo la principal causa la pérdida excesiva de peso en RN alimentados exclusivamente con lactancia materna (LM)4. Los síntomas secundarios a la depleción de volumen intravascular son la disminución de la presión arterial y la diuresis, siendo en ocasiones difícil de valorar el volumen de diuresis en domicilio. En estos casos, la deshidratación puede asociar complicaciones trombóticas graves (seno dural, trombosis periférica y renovascular)5.
Por otro lado, la hiponatremia leve es común en los recién nacidos prematuros (RNPT), pero la hiponatremia severa es rara y se ha asociado a alteraciones en el neurodesarrollo6. La que se desarrolla en el período inicial suele deberse al exceso de agua libre, mientras que la causa de la tardía suele ser un balance de sodio negativo5. Los hallazgos clínicos de la hiponatremia dependerán del grado y la rapidez de su instauración, pudiendo producir edema cerebral con aumento de la presión intracraneal5 y fallecimiento.
A continuación, presentamos dos casos clínicos con alteraciones extremas del sodio en sangre. Es importante destacar que sólo se han descrito casos tan extremos de manera esporádica en la literatura7.
Casos clínicosPrimer casoRN a término de peso adecuado para la edad gestacional (40+3 semanas/3780g). Primera gestación. Periodo perinatal sin incidencias. Dado de alta a las 48 horas de vida con una pérdida de peso del 11,5% precisando suplementar la LM con fórmula de inicio. A los 17 días de vida es valorado por su pediatra de atención primaria por rechazo parcial de tomas en las últimas 24 horas sin ninguna otra sintomatología asociada. Se objetiva una pérdida de peso del 32% respecto el peso al nacimiento (2690g), siendo derivado de forma urgente al hospital. Alimentación con LM exclusiva sin recibir suplementos, manteniendo un tránsito y diuresis aparentemente adecuado.
A su llegada al centro hospitalario presenta regular estado general, con signos clínicos de deshidratación grave e irritabilidad. Temperatura: 34,9°C; Tensión arterial: 72/59 (64) mmHg; SatO2: 98%; Frecuencia cardíaca: 150 lpm. Analítica de sangre: sodio de 195 mmol/L, osmolaridad plasmática 460 mOsm/kg, creatinina 4.89mg/dl, urea 409mg/dl, potasio 6,3 mmol/L, cloro 157mmol/L, EB −10,7mmol/L, láctico 2,2mmol/L, proteína C reactiva (PCR) 0,3mg/dl. Hemograma: 14.300 leucocitos/mm3 (4.900 neutrófilos/mm3, 8.600 linfocitos/mm3), 37.000 plaquetas/mm3. Coagulación: razón de TTPa (TTPa/control TTPa): 2,93 segundos; INR 1,74. Se realiza extracción para hemocultivo y toma de muestras para urocultivo.
Dada su inestabilidad se procede a su intubación y canalización de vía central para reposición hídrica. Se realiza ecografía transfontanelar en la que se objetiva trombosis de senos venosos durales y ecografía abdominal con posible necrosis papilar renal bilateral y trombosis parcial de la vena renal derecha. Precisa transfusión de hemoderivados (plasma, plaquetas y fibrinógeno). Se inicia terapia trombolítica con r-tPA durante 36 horas, sustituyéndose posteriormente por heparina sódica y heparina no fraccionada. Desde el ingreso presenta fallo multisistémico con anuria, edema pulmonar severo e hipotensión arterial, precisando soporte inotrópico con dopamina y noradrenalina y ventilación de alta frecuencia con índices de oxigenación mantenidos de 34, iniciándose asistencia con el sistema de oxigenación por membrana extracorpórea (ECMO) a las 24 horas del ingreso y hemodiafiltración venovenosa continua. Hubo crecimiento en el hemocultivo tomado al ingreso de E. coli, recibiendo tratamiento antibiótico con cefotaxima (cifra máxima de PCR durante el ingreso de 16,7mg/dl a los 4 días). A los 5 días del ingreso presenta crisis convulsivas clínicas iniciándose tratamiento con levetiracetam y fenobarbital. Se descarta afectación meníngea.
El paciente presenta mejoría progresiva permitiendo retirada de la hemodiafiltración a los 4 días y salida de ECMO a los 6 días de ingreso. Extubación 24 horas más tarde y retirada definitiva del soporte respiratorio a los 15 días del ingreso. Normalización progresiva de las alteraciones iónicas y la función renal (Tabla 1).
Evolución de las alteraciones iónicas y función renal en caso clínico 1
| PARÁMETROS | Normal | Día 1 | Día 2 | Día 3 | Día 4 | Día 5 | Día 6 |
|---|---|---|---|---|---|---|---|
| Sodio (mEq/L) | 135–145 | 195 | 175 | 168 | 165 | 149 | 138 |
| Cloro (mEq/L) | 95–105 | 157 | 147 | 138 | 132 | 118 | 111 |
| Urea (mg/dl) | 8–28 | 409 | 249 | 214 | 142 | 51 | 22 |
| Creatinina (mg/dl) | 0,12–1,06 | 4,89 | 2,59 | 2,54 | 1,48 | 0,63 | 0,29 |
A los 15 días se realiza resonancia magnética (RM) donde se confirma la trombosis de senos venosos sin otros hallazgos y con una ecografía renal ya sin alteraciones. Buena evolución a nivel neurológico con exploración acorde a su edad, actualmente tiene 18 meses. Paciente actualmente en seguimiento por el departamento de Neurología y Nefrología.
Segundo casoRNPT con peso adecuado para la edad gestacional (31+2 semanas/1800g). Embarazo sin incidencias. Cesárea urgente por sangrado placentario. Maduración previa con corticoides. Al nacimiento precisa ventilación con presión positiva intermitente, pH de cordón de 7,37. Empeoramiento progresivo en las primeras horas precisando administración de surfactante e intubación endotraqueal con signos de hipertensión pulmonar. Soporte inotrópico con dopamina y noradrenalina y asistencia en ventilación de alta frecuencia. A los 10 días de vida presenta mejoría progresiva del cuadro respiratorio y hemodinámico permitiendo su extubación. En las ecografías iniciales presenta hiperecogenicidad periventricular persistente compatible con leucomalacia periventricular (LPV).
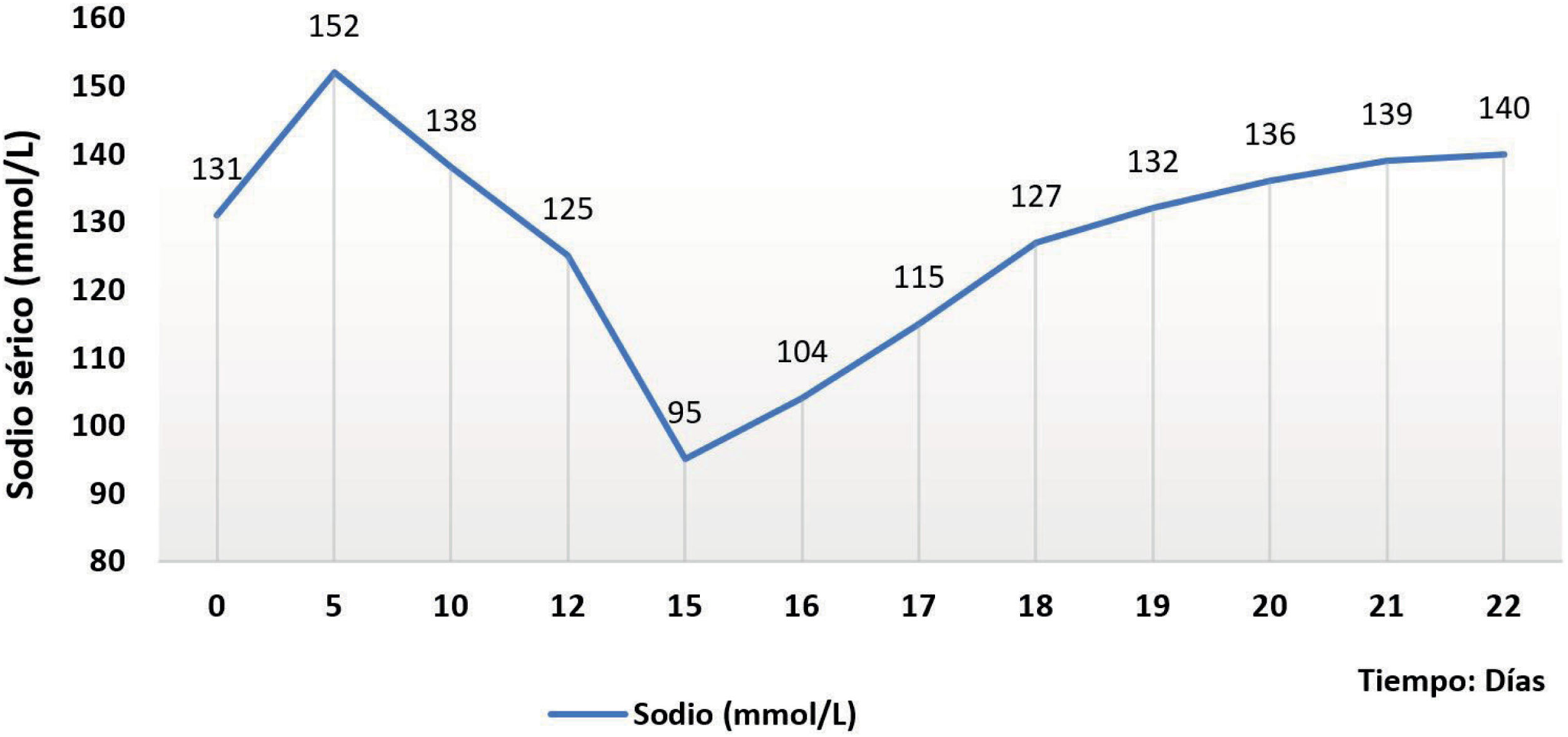
A los 15 días de vida, coincidiendo con un pico febril, se extrae analítica sanguínea donde se objetiva un sodio de 95 mmol/L, cloro de 68 mmol/L con una osmolaridad plasmática de 203 mOsm/kg. El resto de la analítica no presenta alteraciones, con una función renal dentro de la normalidad (creatinina <0,20mg/dl, urea 30mg/dl). En este contexto presenta diuresis conservada y nutrición enteral exclusiva bien tolerada desde hacía 24 horas. Se recoge muestra de orina (osmolaridad 492 mOsm/kg, sodio 20 mmol/L, excreción fraccional de sodio de 0,23%). La paciente ingresa en la Unidad de Cuidados Intensivos Neonatales y se canaliza vía central para reposición intravenosa de sodio (aportes máximos de 15 mEq/kg/día). En todo momento se mantiene asintomática con exploración neurológica acorde a su edad y constantes estables. Se descarta infección nosocomial. Cortisol, 17-hidroxiprogesterona y hormonas tiroideas dentro de la normalidad.
Presenta normalización progresiva de las cifras de natremia con suspensión de los aportes intravenosos a los 7 días (Figura 1). En los controles de ecografía transfontanelar persisten las imágenes previas de LPV que se mantienen hasta el alta. A los 6 meses se realiza una resonancia magnética donde se confirma el diagnóstico. Actualmente tiene 7 años y presenta una parálisis cerebral con diplejía espástica secundaria y buen nivel cognitivo.
DiscusiónAunque los trastornos del sodio pueden ser habituales en el periodo neonatal, las alteraciones severas son muy poco frecuentes y están asociadas a una alta morbimortalidad. En este estudio presentamos dos casos con alteraciones extremas que supusieron un desafío terapéutico.
En los RN ingresados, especialmente en los pretérmino, la causa puede ser iatrogénica y por tanto evitable. Sin embargo, en otras ocasiones, como en el caso de la diabetes insípida, el síndrome de secreción inadecuada de hormona anti-diurética o el síndrome pierde sal, pueden aparecer secundariamente a una patología del sistema nervioso central: infecciones, hemorragias, malformaciones o encefalopatía hipóxico-isquémica.
En el RN sano, una de las causas principales de hipernatremia es la ingesta insuficiente de líquidos. Hay muchos casos descritos en la literatura de hipernatremia en RN alimentados exclusivamente con LM8, como el primer caso descrito. Debido a un aporte insuficiente o una hipogalactia se produce una deshidratación hipernatrémica que si no es diagnosticada precozmente puede conllevar graves secuelas. Nuestro paciente fue un caso de deshidratación extrema, con una cifra inicial de sodio de 195 mmol/L, solo descrita en la literatura en casos esporádicos. Cifras>160 mmol/L son consideradas hipernatremia severa. La etiología más probable fue una ingesta insuficiente que suponemos pudo estar agravada o causada por una infección por E.coli. Clínicamente, se presentó con deshidratación severa, regular estado general, letargia y fallo renal, presentando trombosis de senos venosos y renal, precisando asistencia en ECMO por un fallo multiorgánico sin respuesta a los tratamientos habituales. Según nuestro conocimiento, no hemos encontrado ningún caso en la literatura de hipernatremia tan severa que haya precisado asistencia en ECMO.
Un punto importante es evaluar la diuresis del RN, puesto que nos puede poner en alerta y poder iniciar un tratamiento adecuado lo más precoz posible. Podría ser patológico tanto la oliguria (<1ml/kg/hora) como sucede en las deshidrataciones, como la poliuria (>3-6ml/kg/hora) como sucede en la diabetes insípida9.
La hiponatremia tardía (<132 mEq/L) aparece en algunas series hasta en el 30% de RNPT. La fisiopatología asociada a esta disminución sería un aporte insuficiente unido a un aumento de la natriuresis. Existen diferentes factores de riesgo asociados: el bajo peso para la edad gestacional, la alimentación con LM, el uso de diuréticos como la furosemida, la presencia de distrés respiratorio o la corta duración de la nutrición parenteral. En nuestro caso, no se estableció una etiología clara. Desde el punto de vista neurológico, la paciente desarrolló evolutivamente una diplejia espástica secundaria a LPV. En la literatura se ha descrito la hiponatremia como factor de riesgo para el desarrollo de parálisis cerebral en prematuros extremos, así como alteraciones en las funciones cognitivas10. En nuestro paciente, no podemos establecer una relación causal entre la hiponatremia y la LPV puesto que la leucomalacia se había constatado ya desde las primeras ecografías tras el nacimiento. A su vez, también se ha asociado la hiponatremia tardía en prematuros con un mayor riesgo de desarrollar displasia broncopulmonar moderada-severa11, retinopatía de la prematuridad y a un retraso en el crecimiento extrauterino, morbilidades que no presentó nuestra paciente.
Tanto en la hipernatremia como la hiponatremia, hay que realizar una corrección mediante una restauración cuidadosa de líquidos, destacando la importancia de no realizar correcciones de sodio a una velocidad superior a 0,5-1 mmol/L, exceptuando casos extremos de hiponatremia severa con convulsiones o coma donde la corrección debe ser más rápida hasta alcanzar niveles de sodio de seguridad5. Un tratamiento rápido de la deshidratación hipernatrémica puede producir un descenso súbito de la osmolaridad extracelular con el desarrollo de edema cerebral por lo que hay que administrar una cantidad adecuada de agua libre para corregir el sodio sérico de una manera progresiva y lenta. Por otro lado, la corrección rápida de la hiponatremia puede dar lugar a una desmielinización cerebral. Adicionalmente, los pacientes más graves pueden presentar una importante inestabilidad clínica, así como complicaciones severas, requiriendo ingreso en la unidad de cuidados intensivos y en algunos casos soporte terapéutico avanzado para poder sobrevivir.
ConclusionesEl periodo neonatal es probablemente el periodo de la vida con mayor riesgo de presentar alteraciones hidroelectrolíticas, en algunos casos graves. Por ello es importante realizar un seguimiento estrecho de la pérdida ponderal en los RN en los primeros días de vida para prevenir la deshidratación hipernatrémica, así como monitorizar los niveles de sodio en los RNPT. Por último, resaltar que las alteraciones severas de la natremia son una urgencia vital que puede requerir tratamientos avanzados para conseguir una supervivencia con mínimas secuelas.
Consideraciones éticasEl estudio ha sido aprobado por el Comité Ético del Centro Hospitalario.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.