La ecotomografía Doppler color en dermatología es un nuevo campo del ultrasonido que ha venido creciendo exponencialmente en las últimas décadas. Tiene múltiples aplicaciones tales como la detección de la morfología y extensión de los tumores cutáneos benignos y del cáncer de piel, el estudio de anomalías vasculares y lesiones ungueales, el diagnóstico de condiciones inflamatorias de la piel, la discriminación de los rellenos cosméticos más frecuentes y el diagnóstico de complicaciones de procedimientos estéticos, entre otras.
Esta aplicación de la ecografía requiere de equipamiento especial con transductores de alta frecuencia, protocolos estandarizados y de un operador entrenado en este tipo de examen.
Hoy por hoy, la ecotomografía Doppler color en dermatología es una herramienta indispensable en el arsenal dermatológico aportando información anatómica crítica que ayuda al manejo clínico.
The use of color Doppler ultrasound in dermatology is a new field of ultrasound that has been exponentially growing in the last decades. It has multiple applications, such as the detection of the morphology and extent of benign cutaneous tumors and skin cancer, the study of vascular anomalies, the diagnosis of inflammatory conditions of the skin, the discrimination of the most common cosmetic fillers, as well as the diagnosis of aesthetic complications, among other uses.
This utilization of ultrasound requires special devices that work with high-frequency probes, standardized protocols, as well as an operator trained in these pathologies.
Nowadays, color Doppler ultrasound in dermatology has become an essential part of the dermatologic toolkit, providing critical anatomical information that helps patient management.
La ecotomografía es una técnica de diagnóstico por imágenes no invasiva basada en la emisión de ondas de sonido no audibles. Como es una técnica que no utiliza radiación ionizante, es segura y se puede utilizar en todas las edades. La ecotomografía no requiere inyección de medio de contraste por lo que está exenta de reacciones adversas tales como nefropatías u otras1.
En dermatología su uso ha ido aumentando exponencialmente en los últimos 15 años. Esto se debe al desarrollo de equipamiento especializado que incluye los equipos con Doppler color que trabajan con transductores multifrecuencias de rango alto que actualmente varían entre los 15 y los 70MHz. Al mismo tiempo, hay mayor presencia de médicos entrenados en la operación de estos equipos como también en patología dermatológica2–4.
Un punto importante en el desarrollo de la ecotomografía Doppler color dermatológica ha sido el desarrollo de guías para realizar estos exámenes, lo que ha permitido estandarizar los procedimientos. Estas guías han sido publicadas en las revistas oficiales de la Sociedad Americana de Ultrasonido (www.aium.org) y de la Federación Europea de Sociedades de Ultrasonido en Medicina y Biología (www.efsumb.org)2,5.
Las guías para practicas exámenes dermatológicos recomiendan el uso de equipamiento con frecuencias ≥15MHz, la utilización de Doppler color y del análisis espectral de curvas del flujo vascular (Doppler pulsado) en todos los exámenes. También sugieren que el examen sea realizado preferentemente por un médico con un mínimo anual de 300 exámenes para establecer mínimas competencias en este campo.
La forma de solicitar estos estudios es ecotomografía Doppler color de la región o las regiones potencialmente afectadas. Al igual que el resto de exámenes de imágenes de partes blandas la solicitud debe señalar, además de la región corporal, el lado o los lados comprometidos2,5.
No se recomienda realizar ecotomografía de partes blandas sin Doppler ya que no se pueden evaluar adecuadamente los patrones vasculares que nos ayudan a diferenciar lesiones vasculares versus no vasculares, tumorales benignas versus malignas o inflamatorias activas versus inactivas 1,2,4,5.
Existen protocolos de estudios ya reportados para algunas patologías o regiones que incluyen más de un segmento corporal. Esto se debe a la necesidad de etapificación de los pacientes como por ejemplo en hidradenitis supurativa, la detección de actividad subclínica en morfea o el escurrimiento o inflamaciones de estructuras glandulares en pacientes con rellenos cosméticos6. Es así como la literatura sugiere que los exámenes de hidradenitis supurativa se realicen bilaterales (por ejemplo; axilo-braquiales o inguino-perineales), que en las morfeas se estudien los segmentos corporales adyacentes (por ejemplo: región frontal facial y el cuero cabelludo en morfea en golpe de sable siguiendo el mismo eje) y la región facial junto con las regiones submandibulares (en pacientes con antecedentes de procedimientos estéticos faciales)6. En el caso de las regiones ungueales se recomienda la realización de un estudio bilateral ya que se compara la posición de la placa ungueal y los patrones de flujo del lecho ungueal para discriminar lesiones tumorales o inflamatorias7.
En comparación a otras técnicas por imágenes, tales como la resonancia nuclear magnética (RM), la tomografía axial computada (TAC) o la Tomografía por Emisión de Positrones (PET, por sus siglas en inglés), la ecotomografía Doppler color presenta una mucho mayor resolución espacial. Esto quiere decir que realizando las ecografías Doppler color a las frecuencias antes comentadas, la discriminación de las estructuras es mucho más alta con ultrasonido. Por ejemplo, con ecotomografía esta discriminación alcanza estructuras que miden un mínimo de 0,1mm a 15MHz y de 0,03mm a 70MHz. En cambio, la RM necesita estructuras que midan más de 3mm, la TAC de 5mm y el PET-CT entre 5 y 8mm para poder discriminar sus características internas6,8–10.
Las aplicaciones de esta técnica por imágenes incluyen, entre otras, el estudio de tumores cutáneos benignos y malignos, anomalías vasculares, enfermedades inflamatorias dermatológicas, lesiones ungueales y el área estética2–7,9,11–30.
En esta revisión comentaremos las patologías más frecuentes y sus principales características ecográficas con énfasis en el rol de la ecotomografía en el campo dermatológico ylas razones por la cuales esta técnica por imágenes puede permitir cambiar el manejo de los pacientes.
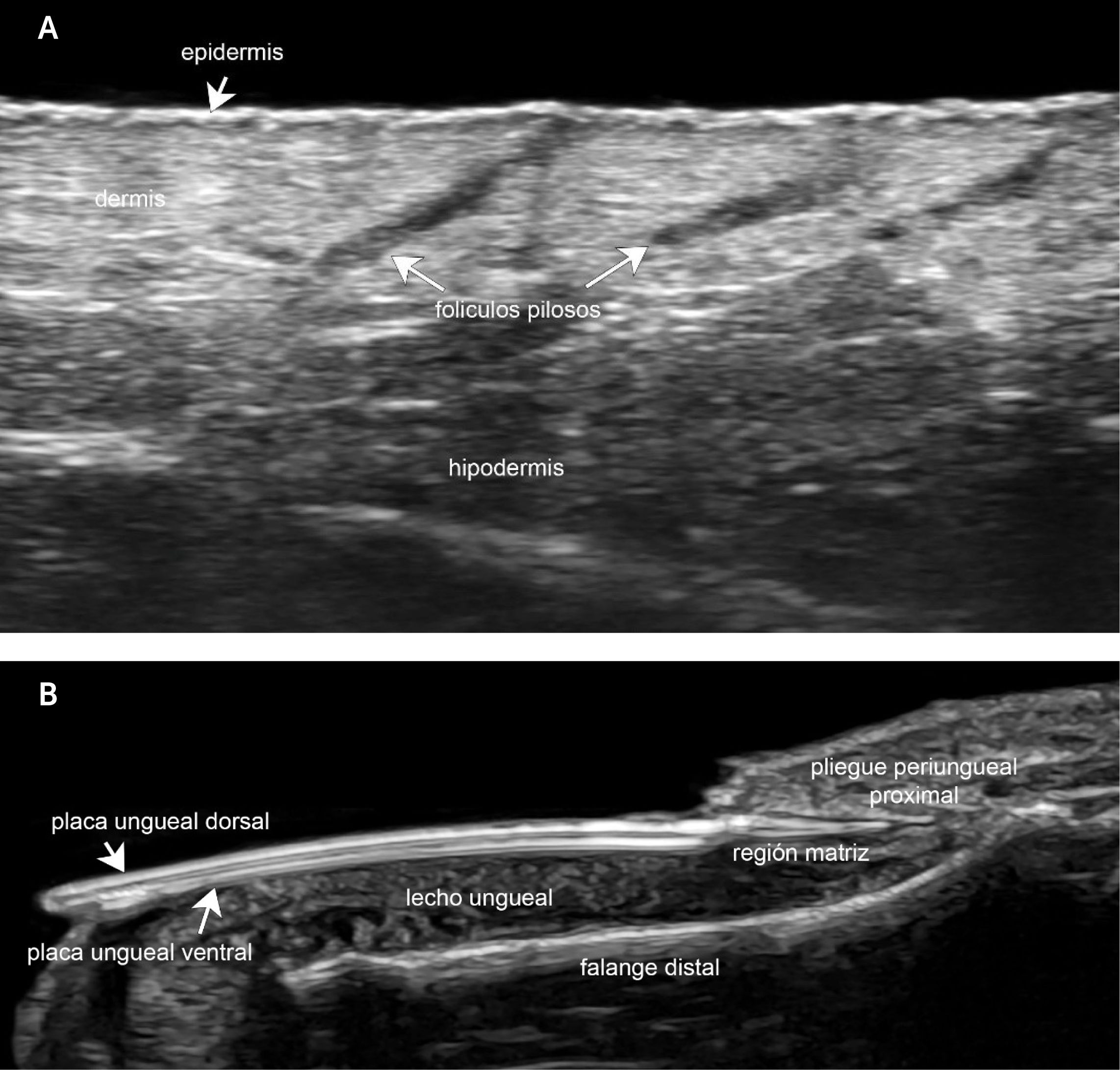
2Conceptos de anatomía ecográficaLa ecografía permite distinguir las capas de la piel que son la epidermis (línea hiperecogénica), la dermis (banda hiperecogénica, menos brillante que la epidermis) y la hipodermis o tejido celular subcutáneo (hipoecogénica). La ecogenicidad o tonos de representación de la piel están dada por sus componentes estructurales. En el caso de la epidermis, la ecogenicidad está dada por la queratina del estrato corneo, en la dermis, por el colágeno y en la hipodermis, por el tejido adiposo (Fig. 1A).1,4,6,7,28
Con equipos que trabajan en ultra-alta frecuencia (70MHz) es posible detectar estructuras tan pequeñas como los tractos pilosos dentro de los folículos, las glándulas sebáceas, las glándulas de Montgomery y los músculos erectores de pelo30.
La uña se presenta como una estructura compuesta por la placa ungueal (bilaminar hiperecogénica), el lecho (hipoecogénico), la región periungueal proximal y lateral (con similar estructura de epidermis y dermis). En el segmento proximal del lecho ungueal se localiza el área de la matriz ungueal. Subyacente al lecho ungueal se observa la línea hiperecogénica de la cortical ósea de la falange distal (Fig. 1B)1,4,6,27,31,32.
Con Doppler color se detecta la vascularización cutánea y ungueal que habitualmente predomina en la hipodermis en el caso de piel y en los dos tercios profundos del lecho ungueal y presenta vasos de baja velocidad (≥15cm/seg)1,4,6,27,31,32.
El pelo tiene dos partes, una de ellas es el folículo piloso que se encuentra en la dermis y otra es el tracto piloso que está en el centro del folículo y emerge a la superficie. Ambas partes son detectables por ecotomografía. Los folículos pilosos se observan como bandas hipoecogénicas dérmicas habitualmente de disposición ligeramente oblicua y los tractos pilosos como bandas bilaminares o trilaminares hiperecogénicas. Los tractos trilaminares se localizan mayormente en el cuero cabelludo y los tractos bilaminares se encuentran principalmente en el resto del cuerpo. Para observarlos tractos pilosos en el interior de los folículos se necesitan equipos de ultra-alta frecuencia (70MHz)1,4,6,28,33,34.
3Consideraciones técnicasEn este tipo de examen se utiliza una capa de gel de mayor espesor en comparación con otros tipos de exámenes de ecografía. Esto permite observar bien todas las capas cutáneas incluyendo la epidermis, no comprimir los vasos superficiales que usualmente tienen baja velocidad y ajustar mejor el foco de la imagen.
Se recomienda comenzar con una fase en escala de grises en ejes perpendiculares, luego se agrega el Doppler color para observar la vascularización y en una tercera fase se realiza un Doppler pulsado de los vasos (análisis espectral de curvas) que permite confirmar el tipo de vaso (arteria o vena) y la velocidad de los vasos (cm/seg). Este tipo de protocolo permite tener una idea detallada de la estructura y su patrón de vascularización4,6.
En las figuras presentadas en esta revisión se utilizaron dos equipos de ecotomografía: Logic E10 (General Electric Health Systems, Waukesha, Wisconsin, USA) con transductor compacto lineal multifrecuencia con rango de 6 a 24MHz y el equipo Vevo MD(Visualsonics Fujifilm, Toronto, Canada) con transductor lineal multifrecuencia con rango de 20 a 70MHz. En las figuras mostradas en el artículo se describe la frecuencia mayor de los respectivos transductores.
4Principales aplicaciones de la ecotomografía Doppler color en dermatologíaExisten en la actualidad múltiples aplicaciones de la ecotomografía Doppler color en dermatología. Para este artículo revisaremos las más frecuentes y las clasificaremos de la siguiente manera:
4.1Tumores cutáneos benignos4.1.1Quiste epidérmicoEs una lesión quística dérmica y/o subcutánea que está conformada por un epitelio estratificado con granulosa y que contiene queratina. El mayor problema es que tiende a inflamarse, romperse y liberar la queratina que posee en el interior con el consiguiente aumento de la inflamación regional. Si el quiste se rompe y quedan fragmentos de cápsula en los tejidos, es altamente probable que se reproduzca28,35–37.
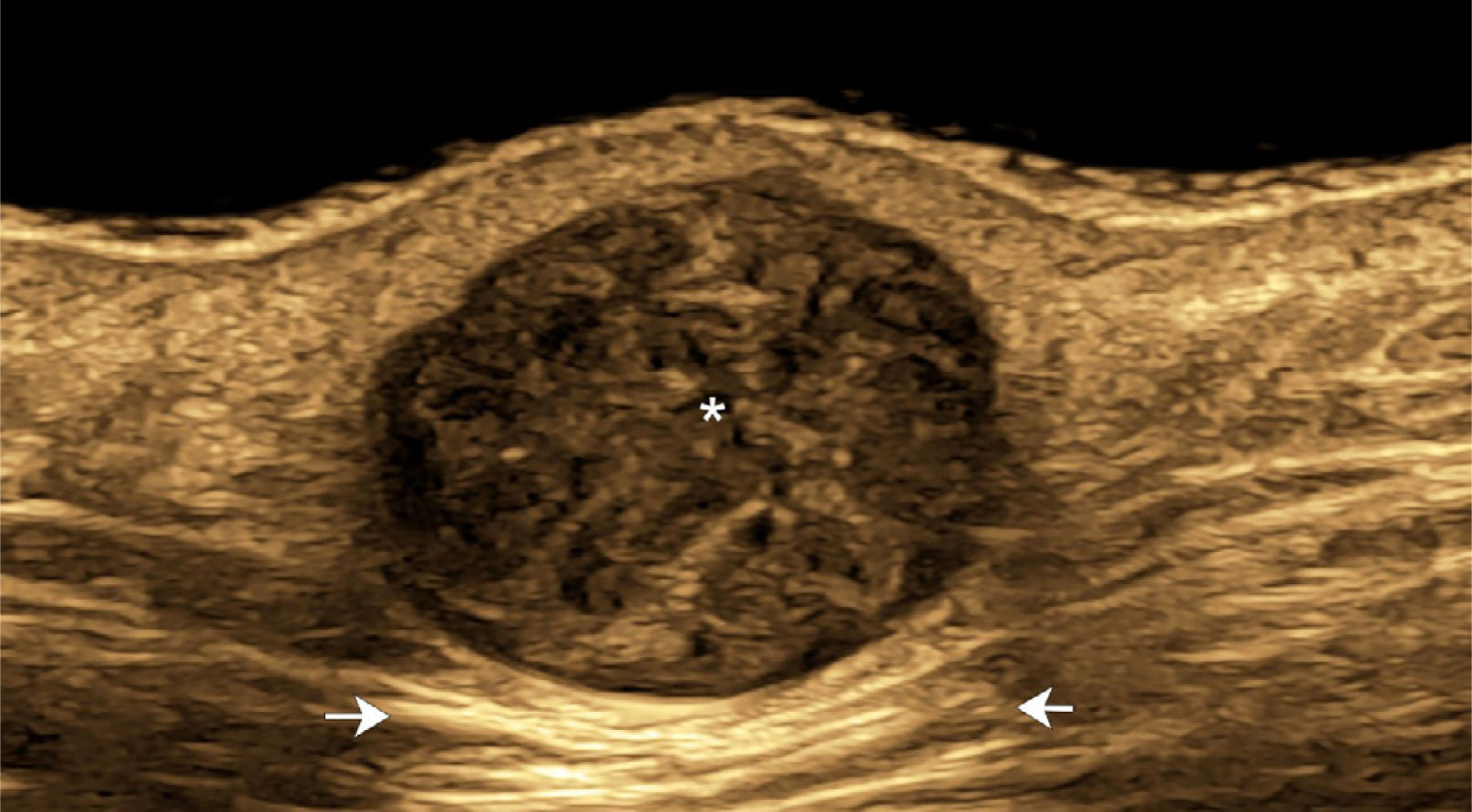
Con ecotomografía Doppler color los quistes epidérmicos intactos demuestran un aspecto distinto en comparación con los quistes parcial o totalmente rotos. En general, los quistes intactos son bien delimitados, ovalados o redondeados, hipoecogénicos, demuestran un reforzamiento posterior del sonido e hipovascularización en su periferia (Fig. 2). Los quistes rotos presentan grados variables de irregularidad en sus paredes y de signos inflamatorios en los planos dermo-hipodérmicos adyacentes con vasos arteriales y/o venosos de baja velocidad. Los fragmentos de cápsula remanentes se pueden detectar ecográficamente aun cuando para esto generalmente se necesitan equipos especiales de ultra-alta frecuencia que tienen transductores que llegan a los 70 MHz1,4,6,28,35–38.
Quiste epidérmico intacto. Quiste epidérmico intacto (ecografía en escala de grises con filtro de color; 24MHz; mejilla izquierda; eje longitudinal) muestra estructura dérmica redondeada e hipoecogénica (*) que solevanta la epidermis y genera reforzamiento acústico hacia posterior (flechas).
Es un tumor benigno derivado de la vaina del pelo y que afecta frecuentemente a la población pediátrica aun cuando puede aparecer en otras etapas de la vida. En este tumor está reportado una alta tasa de error en el diagnóstico clínico que llega al 56%. En ecotomografía Doppler color, el pilomatrixoma tiene una gran variedad de presentaciones, siendo la más frecuente el tipo target que presenta un borde hipoecogénico y un centro heterogéneo o hiperecogénico. Una de las características principales es que posee calcio y esto puede ser detectado por ecotomografía. Los focos cálcicos se observan como focos hiperecogénicos que de acuerdo a su tamaño pueden producir grados variables de sombra acústica hacia posterior. En cuanto a su vascularización, estos tumores demuestran una presentación variable que va desde tumores hipovasculares hasta algunas variantes hipervasculares que se pueden confundir clínicamente con lesiones vasculares (Fig. 3)1,4,6,7,23,28,39–46.
Pilomatrixoma. A. Ecografía en escala de grises y B. Doppler color (24MHz, eje transverso; región ciliar izquierda) presenta formación nodular (*) redondeada dérmica y subcutánea con borde hipoecogénico (flecha) y centro heterogéneo que muestra pequeños focos hiperecogénicos de aspecto cálcico (cabezas de flechas). Note que con Doppler color se observa vascularización en el interior y periferia de la formación.
El cáncer de piel incluye múltiples tipos de tumores, pero comentaremos los más frecuentes. El objetivo de una ecotomografía Doppler color en cáncer de piel es ayudar en la detección de la extensión en todos sus ejes, principalmente la profundidad del tumor que es lo que no se puede diagnosticar clínicamente5,7,9,12,18,28,46–64.
Los tipos de cáncer no melanoma más importantes son el carcinoma basocelular y el carcinoma escamoso. Por ahora, la ecotomografía Doppler color es el único método por imágenes que permite detectar el tumor primario y su profundidad57.
Estas lesiones tumorales son hipoecogénicas y pueden presentar alteraciones de grado variable en el grosor y regularidad de los planos epidérmicos. Los carcinomas basocelulares tienen una característica ecográfica distintiva que es la presencia de puntos hiperecogénicos los que están dados por presencia de calcificaciones, quistes córneos y probablemente nidos de células atípicas compactas. La cantidad de estos puntos hiperecogénicos se han relacionado con el grado de agresividad del tumor, por ende los tumores con más puntos hiperecogénicos corresponden a subtipos más agresivos. Esto puede servir para elegir el mejor sitio de biopsia o decidir el tipo de cirugía (por ejemplo, Mohs o standard), especialmente en los tumores que poseen subtipos mixtos (Fig. 4)12,28,49,59,64.
Carcinoma basocelular. Carcinoma basocelular (ecografía en escala de grises; 70MHz; dorso nasal, eje longitudinal). Se observa zona focal (*) dérmica hipoecogénica que demuestra una depresión epidérmica y contornos profundos irregulares. En su interior se distinguen múltiples puntos hiperecogénicos (flechas).
Aparte, de eso, la ecotomografía Doppler color detecta el grado de vascularización y las características de flujo tumoral y peritumoral, permitiendo al clínico establecer la presencia de vasos importantes en la vecindad del tumor1,4,6,12,28,49,53,54,57,58,60,62–64.
No menos importante es la posibilidad de realizar un estadiaje locoregional ecográfico. Si bien las metástasis locoregionales en carcinomas no melanomas son poco frecuentes, están reportadas principalmente en carcinoma escamoso. Es por eso que la literatura sugiere realizar un estadiaje ecográfico locoregional en estos tumores1,4,6,7,9,28,51,52. En un estudio, los pacientes con cáncer no melanoma expuestos a estadiaje locoregional por imágenes tuvieron mejor sobrevida que los no expuestos65.
En cuanto al melanoma, la detección de la profundidad tumoral es clave para el pronóstico de vida del paciente. Hoy existe la posibilidad de determinar la profundidad de los melanomas por ecotomografía y realizar un Breslow ecográfico66,67.
Habitualmente, la vascularización tumoral va aumentando de grado si se comparan estos tipos de cáncer de piel, siendo los más hipervasculares los melanomas debido a su capacidad de neoangiogénesis60.
El estadiaje locoregional en melanomas incluye el estudio del tumor primario o su cicatriz y las áreas de drenaje linfático con el objetivo de detectar lesiones satélites (a <2cm del tumor primario), en tránsito (≥2cm del tumor primario) o nodales (ganglionares)50–52.
Los linfonodos metastásicos o metástasis cutáneas se pueden diagnosticar ecotomográficamente. Los linfonodos infiltrativos demuestran pérdida de su forma ovalada y diferenciación córtico-medular, irregularidad y engrosamiento cortical, áreas nodulares o pseudonodulares intranodales y vascularización caótica de localización predominantemente cortical1,4,6,51,52,68.
4.3Anomalías vascularesEstas son causas frecuentes de solicitudes de exámenes ecográficos. Una de las principales utilidades de la ecotomografía Doppler color es poder discriminar entre los hemangiomas infantiles y las malformaciones vasculares porque estas dos entidades pueden asemejarse clínicamente en algunos casos. Como sabemos, estas patologías tienen distintos tratamientos y pronósticos1,4,6,23,28,69.
Un hemangioma infantil es un tumor benigno con componente endotelial que frecuentemente va a crecer desproporcionadamente después de nacer y duranteel primer año de vida para ir luego lentamente involucionando70,71.
La ecotomografía Doppler color permite reconocer morfológicamente un hemangioma en las distintas fases (hipoecogénico y altamente vascular en la fase proliferativa e hiperecogénico e hipovascular en la fase de involución total).
No menos importante es que a través del examen ecográfico se pueda determinar la profundidad del hemangioma ya que los hemangiomas superficiales (dérmicos) y los profundos, también llamados mixtos (que afectan la hipodermis u otros planos profundos) presentan distintas opciones de tratamiento que pueden ser tópicas en el caso de los superficiales y sistémicas como es el caso del uso de propanolol en los hemangiomas mixtos.
Con ecotomografía Doppler color se puede monitorear un hemangioma e ir ajustando las dosis de medicamento, por ejemplo, de propanolol. También se puede detectar la presencia de vasos arteriales anómalos adyacentes al hemangioma que pueden enlentecer o dificultar la involución1,4,6,7,14,20,22,28,69–75.
En cambio, las malformaciones vasculares no son tumores, son errores de morfogénesis vascular y tienden a crecer proporcionadamente en el tiempo. Se clasifican de acuerdo al tipo de vaso en arteriales, venosas, arteriovenosas, linfáticas o capilares. A veces, estas malformaciones vasculares pueden ser mixtas y contener dos o más tipos de vasos. Otras veces son parte de síndromes congénitos1,4,6,28,73,74,76,77.
Con ecotomografía Doppler se detectan en el interior de las malformaciones vasculares redes de túbulos o áreas lacunares vasculares con flujos arteriales o venosos, shunts arteriovenosos oausencia de flujo en el caso de las malformaciones vasculares linfáticas.
Las malformaciones vasculares capilares se caracterizan por alteraciones de la ecogenicidad dermo-hipodérmica y ausencia de flujo al Doppler color1,4,6,23,28,77.
Adicionalmente, con ultrasonido se puede determinar la extensión, los planos comprometidos y se pueden guiar o controlar los resultados de procedimientos percutáneos como la escleroterapia1,4,6,23,28,77.
4.4Lesiones unguealesLa ecotomografía Doppler color permite estudiar tumores benignos y malignos, lesiones inflamatorias como por ejemplo la psoriasis ungueal, alteraciones de posición o crecimiento como la onicocriptosis y la retroniquia, entre muchas otras patologías.
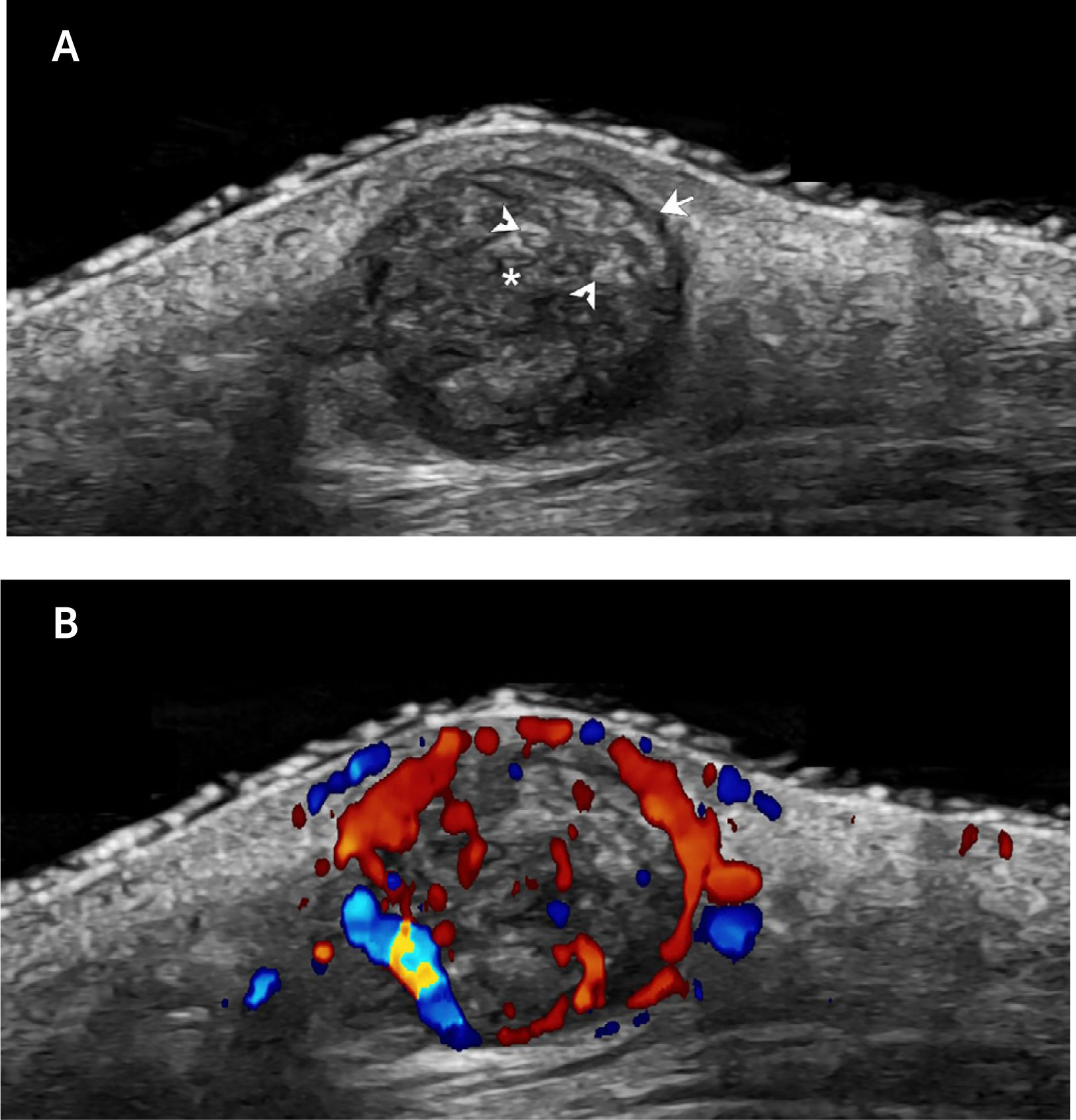
Dentro de los tumores más frecuentemente estudiados están los tumores glómicos que frecuentemente producen dolor ungueal. En el examen ecográfico, estos tumores comúnmente se presentan como lesiones nodulares hipoecogénicas, medianamente delimitadas e hipervasculares que remodelan el margen óseo de la falange distal (Fig. 5)4,6,23,27,28,32,61,78–82.
Tumor glómico ungueal. Tumor glómico ungueal (estudio comparativo entre ambos lados; eje longitudinal ambos dedos medios; 24MHz). A. Ecografía en escala de grises y B. Doppler color presenta formación nodular hipoecogénica (entre marcadores) en el lecho ungueal del dedo medio derecho que se acompaña de una remodelación del margen óseo de la falange distal subyacente (flecha). Con Doppler color se visualiza vascularización prominente en el interior de la formación nodular, la cual es asimétrica con respecto al lado contralateral.
Los onicomatricomas son tumores benignos derivados de la matriz ungueal y que generan clínicamente lesiones estriadas amarillentas en la placa ungueal. Ecográficamente estos tumores producen lesiones eccéntricas hipoecogénicas con líneas hiperecogénicas que protruyen hacia la placa ungueal. Su vascularización es variable pero en general tiende a presentarse como baja o intermedia con vasos de baja velocidad4,6,23,27,28,32,82–85.
Existen patrones ecográficos sugerentes de psoriasis ungueal, lo que permite ayudar al diagnóstico diferencial de otras entidades que generan onicodistrofias. En el examen ecográfico, estas uñas se caracterizan por presentar focos hiperecogénicos en la placa ventral, engrosamiento y disminución de ecogenicidad del lecho ungueal, pérdida de definición de la placa ventral, ondulación y engrosamiento de la placa ungueal. Al Doppler color se observan grados variables de hipervascularización del lecho ungueal de acuerdo al grado de actividad inflamatoria de la enfermedad. Se debe tener presente que la psoriasis, aparte de la piel y las uñas también puede afectar las articulaciones, entesis y los márgenes óseos en casos con artropatía psoriática. En estos últimos casos (artropatía), la ecotomografía Doppler color ha sido sugerida como el estándar de oro para confirmar o monitorear estos pacientes4,6,23,27,28,32,86.
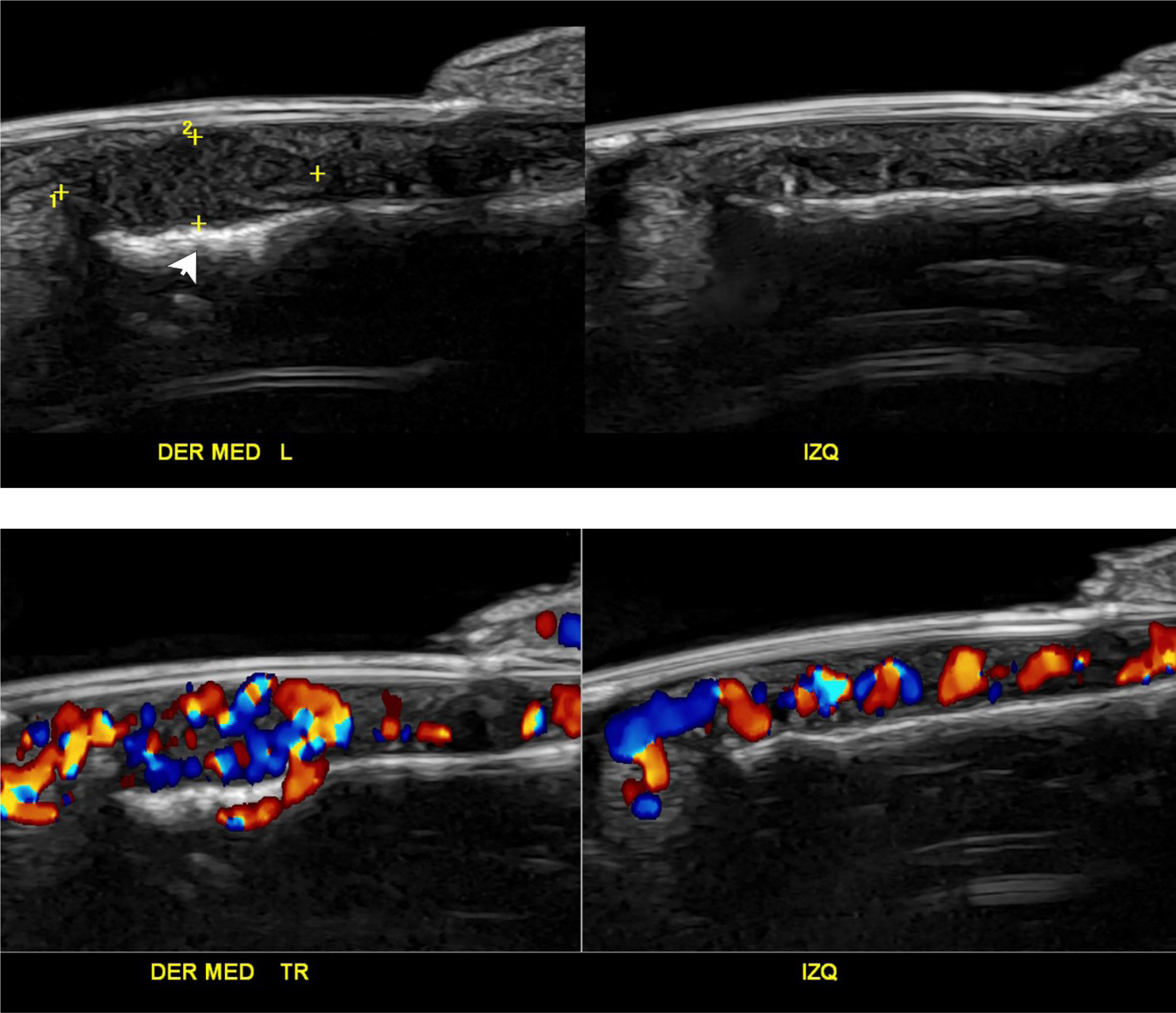
Las alteraciones de posición y crecimiento de la placa ungueal tales como la onicocriptosis y retroniquia son otras causas frecuentes de solicitud de estudios ungueales. En la onicocriptosis, el examen ecográfico puede detectar los fragmentos de placa ungueal desplazados a la regiones periungueales laterales1,4,6. En los pacientes con retroniquia, se observa un desplazamiento posterior de la placa ungueal hacia la región periungueal proximal, con grados variables de inflamación periungueal y subungueal proximal. Esta afección puede simular clínicamente una celulitis periungueal. La retroniquia se asocia frecuentemente a onicomadesis (fragmentación de la placa ungueal) y en ecografía existen criterios que apoyan su diagnóstico tales como la presencia de un halo hipoecogénico rodeando el origen de la placa ungueal, el engrosamiento y disminución de ecogenicidad del plano dérmico periungueal proximal y la disminución de la distancia entre el origen de la placa ungueal y la base de la falange distal en el lado afectado. También existen criterios ecográficos reportados para retroniquia bilateral4,6,19,27,28,77,87–92.
4.5Patología inflamatoria cutáneaLa ecotomografía permite ayudar al diagnóstico de numerosas patologías inflamatorias cutáneas. Entre las que revisaremos están dos enfermedades devastantes como la hidradenitis supurativa y la morfea.
La hidradenitis supurativa (HS) es una enfermedad inflamatoria autoinmune que afecta el folículo piloso y la queratinización.Compromete habitualmente las regiones axilares, inguinales, intermamarias, inframarias, glúteas e interglúteas pero puede comprometer también otras zonas93,94.
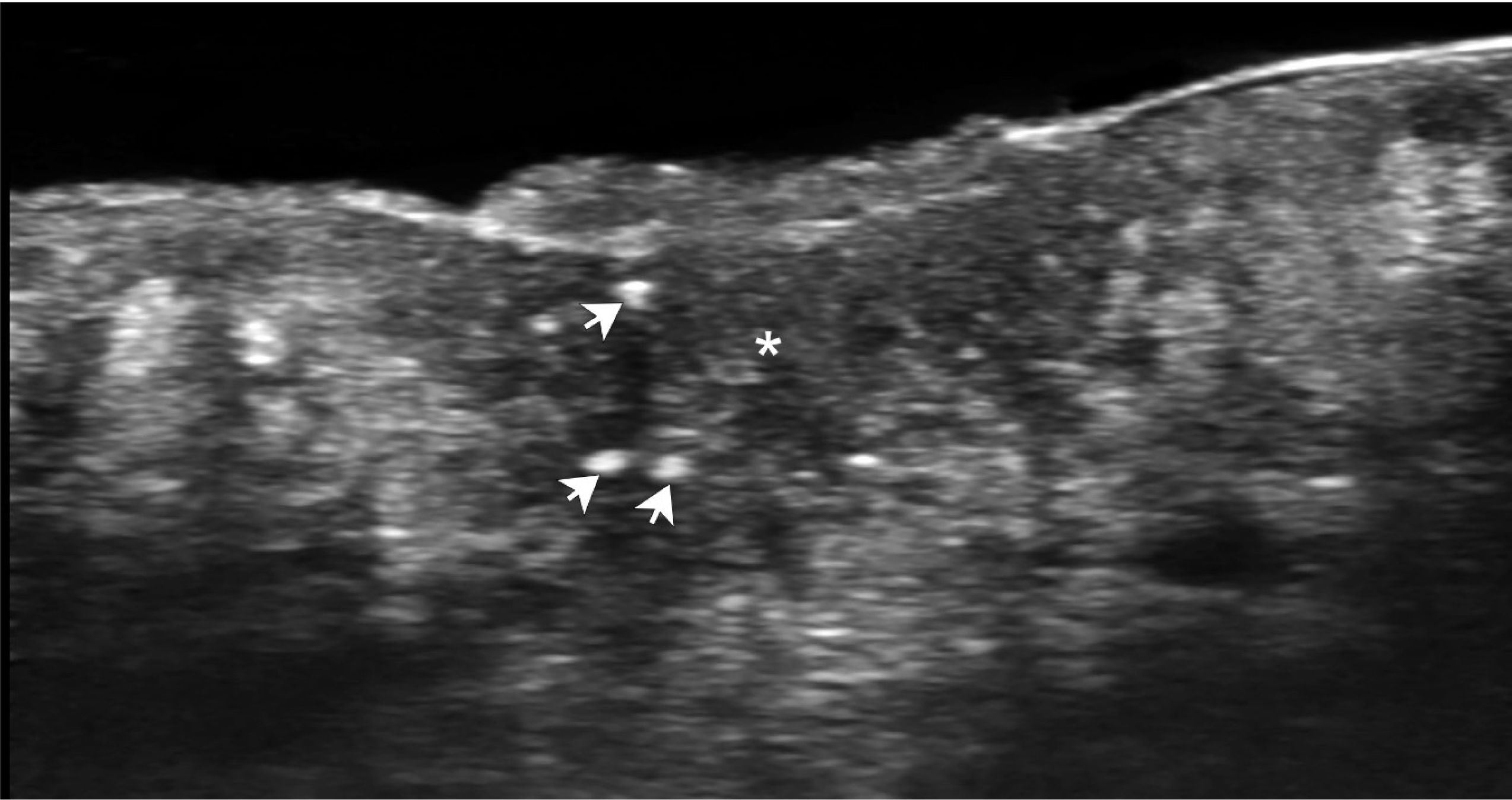
Ecográficamente existen criterios diagnósticos de HS que incluyen pseudoquistes, colecciones y fistulas (túneles) hipoecogénicos, localizados en la dermis y/o la hipodermis que comunican a las bases dilatadas de folículos pilosos y alteraciones en la ecogenicidad dérmica (Fig. 6)21,24,26,28,77,95–108.
Hidradenitis supurativa. Hidradenitis supurativa (escala de grises, 24MHz, eje longitudinal, región inguino-perineal derecha) presenta banda hipoecogénica dérmica compatible con fístula (túnel; entre marcadores). Note el aumento de ecogenicidad subcutánea superficial subyacente a la fístula lo cual es secundario a inflamación.
Los estadiajes clínicos en HS son limitados porque subestiman la severidad y actividad de la enfermedad. Por ende se recomienda que los pacientes sean etapificados ecotomográficamente a través del SOS-HS (Sonographic Scoring of Hidradenitis Suppurativa)104.
Con equipos especiales que llegan a los 70MHz se puede realizar el diagnóstico temprano de HS y detectar dilataciones y alteraciones de morfología precoces en los folículos pilosos y alteraciones de morfología de la queratina endofolicular10.
Las fistulas se clasifican ecográficamente de acuerdo a su grado de fibrosis y edema en tres tipos y de su localización en dérmicas o dermo-hipodérmicas103,109.
Con Doppler color se puede detectar el grado de actividad inflamatoria y monitorear el tratamiento de la enfermedad. Está descrito que posterior al examen ecográfico los tratamientos de HS se modifican en más de un 80% en los adultos y en más de un 90% en niños26,28,104,105,110.
La morfea, que es la forma de presentación cutánea de la esclerodermia, es una enfermedad autoinmune del tejido conectivo. En ecografía se ha demostrado que existe compromiso inflamatorio subclínico en todos los tipos de morfea y que es habitual que las alteraciones se extiendan más allá de las lesiones cutáneas visibles.Es por eso que se recomienda estudiar los segmentos corporales adyacentes al segmento corporal visiblemente comprometido y no sólo la zona de la placa cutánea. Ecotomográficamente, las placas de morfea tienden a no ser sincrónicas en actividad en un mismo paciente y en la misma placa pueden coexistir áreas activas e inactivas. Adicionalmente se ha demostrado que la atrofia e hiperpigmentación de las placas no es sinónimo de inactividad, de hecho pueden existir placas activas en el centro o en los bordes pero atróficas25,28,111–114.
Con ecotomografía Doppler, se puede realizar un seguimiento de los segmentos corporales afectados. Para esto se utiliza el US-MAS (Ultrasound Morphea Activity Scoring) que es el recientemente descrito estadiaje ecográfico de actividad en morfea1,4,6,25,114–116.
4.6EstéticaLas aplicaciones de la ecotomografía Doppler color en estética han crecido en forma importante. Hoy por hoy, la ecotomografía Doppler color es la única técnica por imágenes que permite detectar e identificar los rellenos cosméticos más frecuentemente utilizados. Estos rellenos se pueden detectar por sus patrones intrínsecos y por los artefactos que producen al ultrasonido. Los rellenos cosméticos más frecuentemente observados en ecografía son el ácido hialurónico, el aceite de silicona, la silicona pura, el polimetilmetacrilato, la policaprolactona y la hidroxiapatita de calcio. Cada uno de estos rellenos presenta un patrón ecográfico distinto, siendo algunos predominantemente anecogénicos, como el ácido hialurónico, y otros hiperecogénicos como el aceite de silicona, el polimetilmetacrilato o la hidroxiapatita de calcio28,117–119.
Un rol relevante tiene la ecotomografía Doppler color en el diagnóstico de complicaciones tempranas y tardías de los rellenos. Entre las complicaciones tempranas están las oclusiones vasculares, en las cuales el estudio del flujo vascular facial es esencial120,121. En las complicaciones tardías que habitualmente se presentan posterior a los 4 meses de inyección están la presencia de edemas o linfedemas, paniculitis, nódulos secundarios a granulomas, colecciones granulomatosas y fístulas1,4,6,7,28,118,122.
En estos casos es frecuente observar alteraciones ecográficas inflamatorias subagudas en las glándulas lagrimales, parótidas y submandibulares que se supone serían reactivas y parte del denominado síndrome de ASIA (por sus siglas en inglés, AutoinmuneSyndrome Induced by Adjuvants). Esta es una de las razones, aparte de la migración o escurrimientos de rellenos cosméticos, por lo que se recomienda realizar estudios faciales y submandibulares bilaterales incluyendo el estudio glandular123.
Adicionalmente, la ecotomografía Doppler color puede ayudar en el diagnóstico y manejo de complicaciones de otros procedimientos estéticos o de cirugía plástica. Esto incluye el diagnóstico de reacciones granulomatosas, colecciones y trayectos fistulosos, entre otros1,4,6,33.
5CONCLUSIÓNLa ecotomografía Doppler color es una técnica por imágenes relevante en el arsenal dermatológico que permite ayudar significativamente al diagnóstico y manejo de múltiples condiciones. Requiere de equipos especiales de alta frecuencia, médicos entrenados y de protocolos estandarizados.Consideraciones éticas
Las imágenes mostradas en este artículo son de pacientes que han dado su consentimiento para mostrarlas en esta publicación. Todos los exámenes ecográficos se han realizado siguiendo los principios de ética médica de Helsinki.Conflicto de intereses
La autora declara no tener conflictos de intereses relacionados con este artículo