Los quistes de inclusión epidérmica (QIE) son lesiones cutáneas benignas muy comunes. En la literatura se describen diferentes lesiones malignas y premalignas que pueden originarse de QIE cutáneos, incluyendo al carcinoma espinocelular (CEC), con una incidencia de entre que varía entre 0,01 a 2,2%. Se han propuesto varios mecanismos de transformación maligna, como la inflamación/irritación crónica, infección, traumatismo directo, virus papiloma humano, daño actínico e inmunosupresión. En el caso particular de pacientes receptores de trasplante de órganos sólidos, los CEC son las neoplasias cutáneas más frecuentes. La terapia inmunosupresora anti-linfocitos T, deprime la vigilancia antitumoral, determinando un incremento del riesgo de desarrollar este tipo de lesiones que va de 65 a 250 veces en comparación con población sana inmunocompetente, presentando un comportamiento más agresivo. El tratamiento primario de estos QIE neoplásicos es la escisión amplia, con márgenes adecuados. Se expone a continuación, el reporte de un caso clínico y una revisión actualizada de la literatura sobre CEC originado de un QIE en un paciente inmunosuprimido por trasplante renal.
Epidermal Inclusion Cysts (EIC) are a very common benign cutaneous lesion. Literature describes different malignant and premalignant neoplasia that can originate from cutaneous EIC, including squamous cell carcinoma (SCC), with an incidence varying from 0.01 to 2.2%. Various mechanisms of malignant transformation have been proposed, including chronic inflammation/irritation, infection, direct trauma, human papillomavirus, actinic damage, and immunosuppression. In the particular case of solid organ transplant recipients, SCCs are the most frequent skin neoplasms. Anti-T lymphocyte immunosuppressive therapy depresses antitumor surveillance, determining an increased risk of developing this type of lesions ranging from 65 to 250 times compared to healthy immunocompetent population, presenting a more aggressive behavior. The primary treatment of these neoplastic EICs is wide excision, with adequate margins. Next, we present an interesting, yet rare clinical case and an updated literature review of an SCC originated from an EIC in an immunosuppressed kidney transplant patient.
Los quistes epidérmicos, epidermoides o de inclusión epidérmica (QIE), mal llamados quistes sebáceos, son lesiones cutáneas benignas muy comunes, que a menudo se presentan como una lesión quística pequeña, nodular y móvil. La pared del quiste está constituida por epitelio escamoso estratificado con estrato granuloso, cuyo contenido consiste en queratina macerada más restos celulares ricos en lípidos. Comúnmente, se localizan en el cuero cabelludo, la cara y el tronco, pero también pueden presentarse en las extremidades y los genitales. La mayoría son asintomáticos, pueden variar de tamaño a lo largo del tiempo y, en algunos casos, complicarse con infecciones o ulceraciones1.
En la literatura se describen diferentes lesiones malignas y premalignas que pueden originarse a partir de QIE cutáneos, incluyendo el carcinoma de células escamosas (CEC), carcinoma de células de Merkel, carcinoma basocelular (CBC), papulosis bowenoide, enfermedad de Bowen, enfermedad de Paget y micosis fungoide2.
La evidencia recomienda la escisión y el examen histológico para todos los quistes epidérmicos grandes, o aquellos que crecen rápidamente, se ulceran, no responden al tratamiento médico o recurren3. Los tumores malignos derivados de QIE tienen una incidencia variable de entre 0,01 a 2,2%, según reportes mayoritariamente provenientes de casos aislados4. La transformación maligna de QIE a CEC es rara y varía ampliamente en la literatura, con incidencias que van entre 0,01 a 0,045%, sin diferenciar predilección por sexo o raza2,5.
Frank et al. realizaron una descripción de caso y revisión de CEC originado en QIE en el año 2018 donde se destaca los 62 años como edad media de presentación al momento del diagnóstico, afectando con mayor frecuencia a hombres (69%). El sitio de presentación más frecuente fue la cabeza y el cuello (54,8%), con tamaños variables de los QIE de entre 0,7 a 20cm de diámetro. Los síntomas más habituales fueron dolor (24,2%), crecimiento rápido (48,6%) y cambios en la piel suprayacente como eritema, ulceración o drenaje de contenido (38,2%)6.
La patogenia de los QIE aún no es clara, se han propuesto varios mecanismos de transformación maligna reconocidos en el desarrollo del cáncer en otras partes del cuerpo que también participarían en el desarrollo de este tipo de lesiones malignas, incluyendo inflamación/irritación crónica, infección, traumatismo directo, virus del papiloma humano, daño actínico e inmunosupresión3. Clínicamente, es difícil diferenciar entre lesiones quísticas benignas de las malignas. Un número significativo de estos tumores malignos se detectan incidentalmente durante el análisis histopatológico posterior a la extirpación de un quiste aparentemente benigno. A la histopatología, las células neoplásicas escamosas suelen contener núcleos redondos a ovalados, con nucléolos prominentes y abundante citoplasma. Además, los carcinomas espinocelulares bien diferenciados presentan frecuentes mitosis, perlas de queratina, células disqueratósicas y puentes intercelulares7. Otro punto a considerar para el diagnóstico histopatológico correcto de un CEC desarrollado en un QIE, es que se debe diferenciar de un CEC con cambios quísticos y, por lo tanto, es fundamental demostrar que no hay conexión entre el tumor y la epidermis, fenómeno que si ocurre en los QIE3. Hecho el diagnóstico, el tratamiento primario de un QIE neoplásico es la escisión amplia, con márgenes adecuados de 4mm para todas las lesiones y, al menos, de 6mm para aquellos quistes que tengan características de mayor riesgo de malignización (lesiones de ≥2cm de diámetro, tumores moderadamente diferenciados, invasión del tejido celular subcutáneo o aquellos ubicados en áreas de alto riesgo, como el cuero cabelludo, los labios y/o la oreja)8.
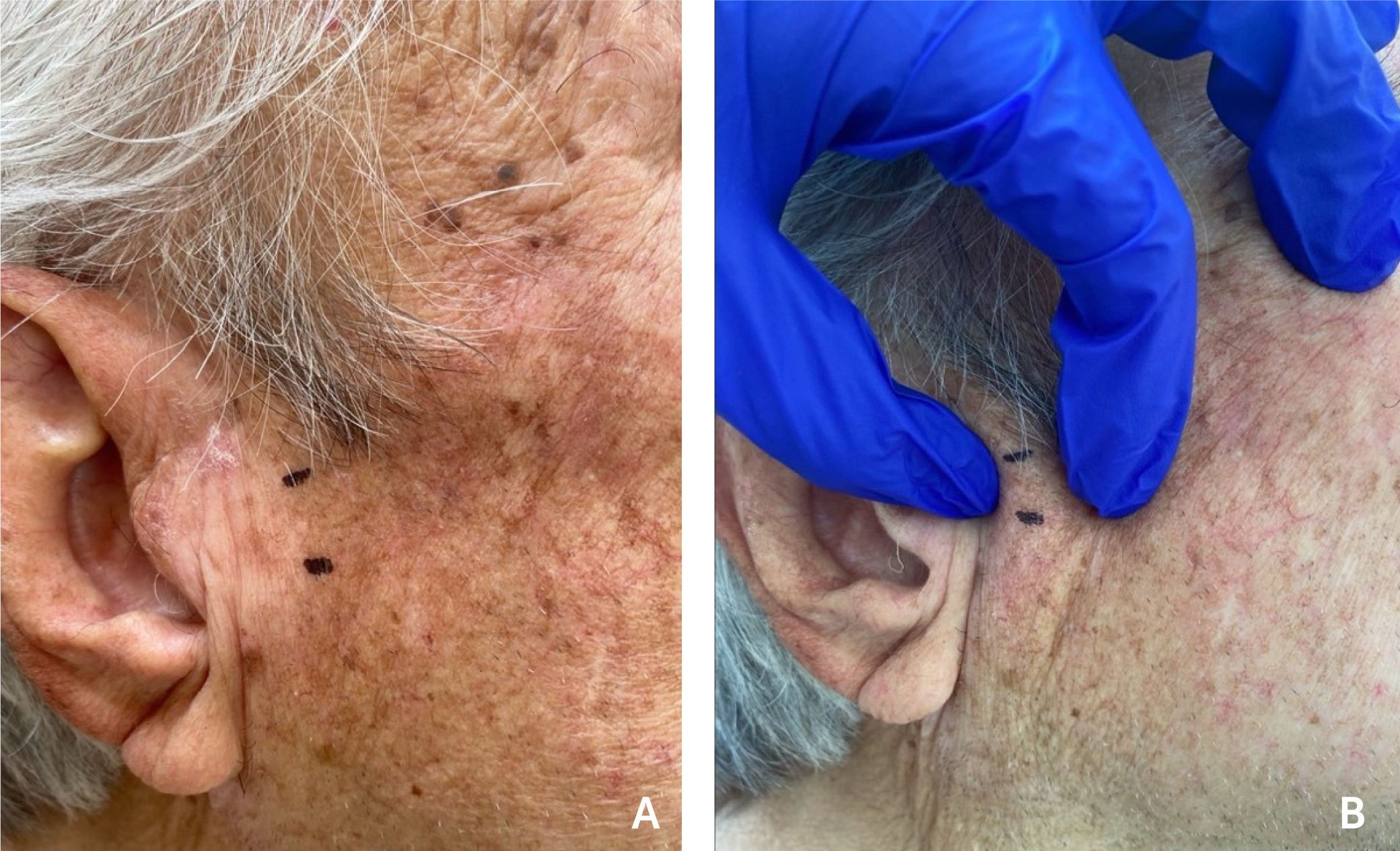
2REPORTE DE CASOSe presenta el caso de un hombre de 78 años, pensionado, con antecedentes de trasplante renal desde 2009, secundario a una nefropatía hipertensiva crónica de larga data. Recibe tratamiento farmacológico inmunosupresor desde esa fecha con prednisona, azatioprina, tacrolimus, además de losartán como antihipertensivo. En febrero del 2022, consulta a dermatología por aumento de volumen de más de 6 meses de evolución, móvil, firme, indoloro de aproximadamente 2×1cm de diámetro en la zona preauricular derecha, sin alteraciones de la piel suprayacente (Fig. 1).
Lesión quística en paciente con inmunosupresión secundaria a trasplante renal. Paciente hombre de 78 años, con inmunosupresión secundaria a trasplante renal desde el 2009, consulta por (A) aumento de volumen de más de 6 meses de evolución, móvil, firme, indoloro de aproximadamente 2 por 1cm de diámetro (B), en la región preauricular derecha que no compromete piel suprayacente.
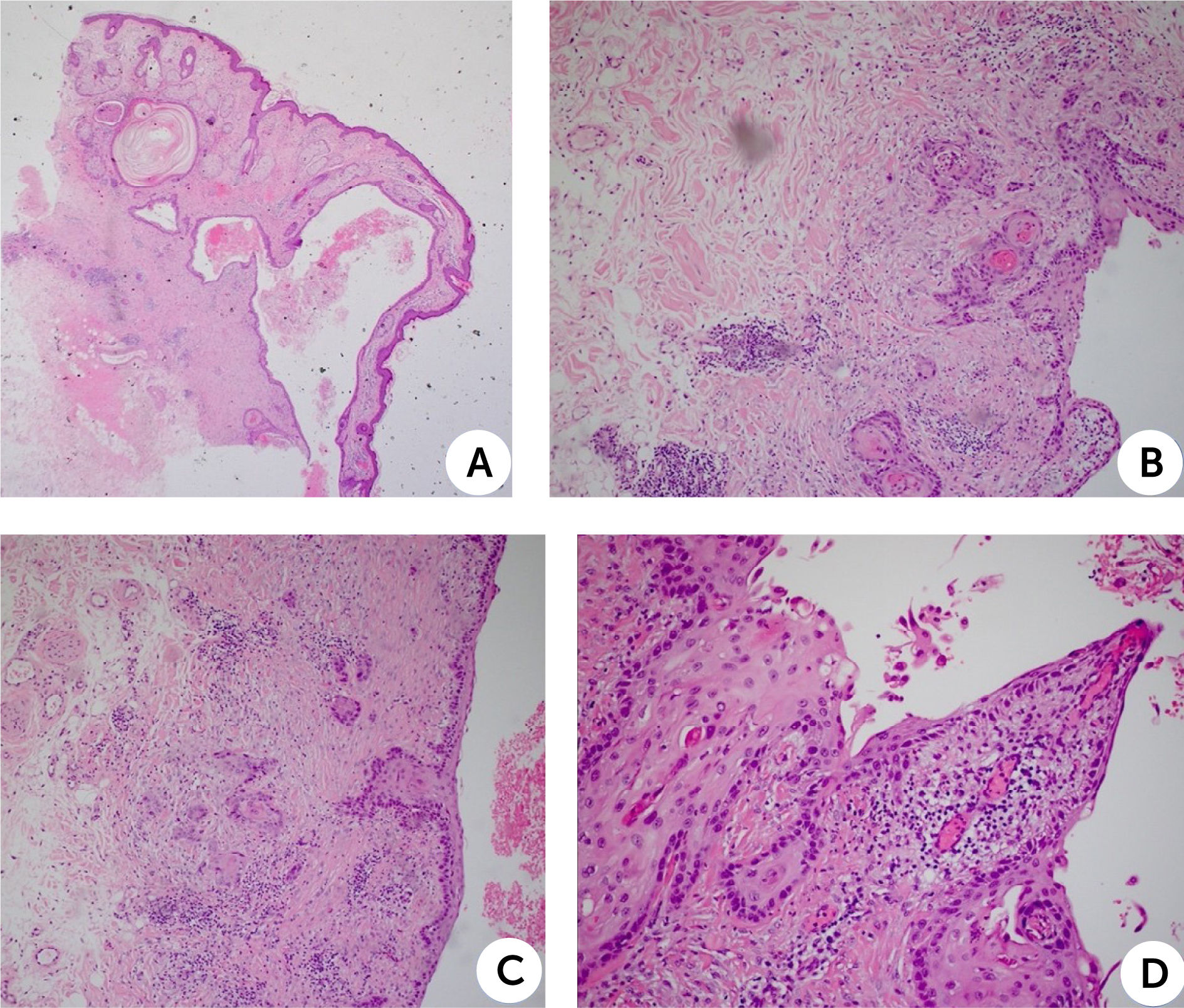
Se extirpa lesión completa de 2×0,9×0,3cm por losanjo, con sospecha de quiste anexial intraepidérmico y se envía para estudio histopatológico. El examen microscópico de hematoxilina y eosina (H&E) mostró en piel con anexos una epidermis con ortoqueratosis, más una discreta pigmentación del estrato basal. En la dermis destacaba una lesión quística revestida por epitelio escamoso maduro con diferentes grados de displasia epitelial, y desarrollo de una neoplasia maligna de estirpe epitelial, conformada por células de pleomorfismo moderado, citoplasma amplio eosinófilo y núcleos con nucleolo prominente. El tumor infiltraba extensamente el intersticio adyacente al quiste, hasta la hipodermis superficial, formando perlas córneas.
Si bien, en este caso no se realizaron técnicas de inmunohistoquímica, cuando existe una transición abrupta entre la pared del quiste y el tumor, podría ser de utilidad el análisis inmunohistoquímico con ciclina D1, p53 y Ki67 para evidenciar cambios displásicos intermedios entre los dos componentes2. Se diagnosticó como carcinoma espinocelular moderadamente diferenciado, infiltrante, queratinizante hasta la hipodermis superficial, desarrollado en un QIE, con uno de los bordes laterales comprometidos por la lesión, el resto de los bordes laterales y profundos permanecieron libres de tumor. No se observaron infiltraciones vasculares ni perineurales por el carcinoma (Fig. 2). Se planifica cirugía de ampliación de márgenes y estudio de diseminación, pero en mayo de 2022 se informa fallecimiento del paciente por causas ajenas a patología de base.
Histología de lesión quística revestida por epitelio escamoso maduro con diferentes grados de displasia epitelial. A la histopatología con tinción H&E de la lesión extirpada muestra una epidermis con ortoqueratosis más una discreta pigmentación del estrato basal, dermis con lesión quística revestida por epitelio escamoso maduro con diferentes grados de displasia epitelial (A, lupa de aumento 4x) y desarrollo de una neoplasia maligna de estirpe epitelial, conformada por células de pleomorfismo moderado, citoplasma amplio eosinófilo y núcleos con nucleolo prominente (B, C y D, aumentos 10x y 40x). El tumor infiltra extensamente el intersticio adyacente al quiste hasta la hipodermis superficial, formando perlas córneas (C, 10x). con bordes laterales y profundos libres de tumor. No se observaron infiltraciones vasculares ni perineurales.
El CEC es un tumor maligno derivado de queratinocitos epidérmicos. En la población general, es el segundo cáncer de piel no melanoma (CPNM) en frecuencia después del CBC, pero en receptores de trasplante de órganos sólidos (RTOS) es la neoplasia de piel más frecuente (Tabla 1)9.
Incidencia de cáncer de piel en RTOS, comparado con la población normal
| Cáncer de piel | Aumento en la incidencia |
|---|---|
| Carcinoma espinocelular | 65 veces |
| Carcinoma espinocelular de labio | 20 veces |
| Carcinoma basocelular | 10 veces |
| Melanoma | 3 veces |
| Sarcoma de Kaposi | 84 veces |
RTOS: receptores de trasplante de órgano sólido; CEC: carcinoma espinocelular; AR: artritis reumatoide; LES: lupus eritematoso sistémico; PUVA: fototerapia con psoraleno+luz ultravioleta A. Traducido y modificado de Lanz et al9.
Varios factores de riesgo se han asociado al desarrollo de cáncer de piel en RTOS (Tabla 2)9. Los receptores de trasplantes de corazón y pulmón tienen un mayor riesgo de desarrollar CEC, en comparación con receptores de trasplante renal o hepático debido a una inmunosupresión más intensa y edad avanzada al momento del trasplante9.
Factores de riesgo para el desarrollo de cáncer de piel en RTOS
| • Fototipo Fitzpatrick I a III |
| • Trasplante a edad avanzada |
| • Duración e intensidad de inmunosupresión |
| • Tipo de órgano trasplantado (corazón/pulmón>riñón>hígado) |
| • Trasplante previo |
| • CEC antes del trasplante |
| • Historia de linfoma pre/postrasplante |
| • Enfermedad terminal de órganos pretrasplante (AR; LES o hepatitis autoinmune) |
| • Receptores de trasplante hepático con psoriasis en tratamiento previo con terapia biológica/PUVA |
En estos pacientes, el tipo, intensidad y duración de la inmunosupresión determina el principal riesgo de desarrollar CPNM. La terapia farmacológica dirigida contra células T, deprime la vigilancia inmunitaria, en un esfuerzo por prevenir el rechazo. El tratamiento con azatioprina fotosensibiliza la piel a la radiación UVA, acelerando la fotocarcinogénesis, aumentando el riesgo de CEC hasta en un 56%10. La inmunosupresión triple (p. ej., ciclosporina, prednisona y azatioprina o sirolimus) tenían un mayor riesgo de desarrollo de cáncer de piel en comparación con el uso de dos fármacos (p. ej., prednisona y azatioprina o sirolimus)9,10. Este entorno local es permisivo para la perpetuación de la displasia y el desarrollo de carcinomas invasivos. Determina un riesgo 10 veces mayor de desarrollar cualquier tipo de neoplasia maligna, particularmente CEC, cuyo riesgo incrementa 65 a 250 veces más en comparación con población sana inmunocompetente, teniendo además un comportamiento más agresivo y con mayor posibilidad de metástasis a distancia, que pueden llegar a presentarse hasta en el 5 a 8% de los casos11. Veinte años después del trasplante, entre el 20% al 75% de los RTOS se ven afectados por al menos un CEC. Luego de un primer CEC invasor, pueden incluso desarrollar múltiples CEC, en hasta un 60 a 80% de los casos, en un período de 3 años9,11. En una revisión multicéntrica retrospectiva del 2019 realizada por Lanz et al. donde 51 pacientes que recibieron trasplante de órgano sólido (TOS), desarrollaron CEC agresivos, definidos como metástasis nodal o a distancia o muerte por progresión local de CEC primario. De estos casos, un 84,3% de los pacientes fueron hombres, la edad promedio de presentación fue de 51 años a la edad del TOS (con un intervalo de 19 a 71 años) y de 62 años (intervalo de 36 a 77 años) al diagnóstico de CEC agresivo. La ubicación más frecuente de esta neoplasia maligna fue en la cara (67%), el cuero cabelludo (12%) y las extremidades superiores (12%). Un 41% de los tumores estaban poco diferenciados, con una mediana de diámetro tumoral de 18,0mm (intervalo 4,0-64,0mm) y una profundidad tumoral media de 6,2mm (intervalo de 1,0-20,0mm). Hubo invasión perineural en 20 de los casos (39%), mientras que en 23 de los restantes (45%), se evidenció recidiva local. La sobrevida global a los 5 años fue del 23%, mientras que la sobrevida específica por enfermedad a los 5 años fue del 30,5%11. El tratamiento de primera línea para lesiones primarias es la escisión quirúrgica con control microscópico de márgenes. En caso de márgenes positivos, se hará una nueva escisión, para los casos operables. Se recomienda la disección de los ganglios linfáticos para CEC con afectación ganglionar regional confirmada por citología o histología. La radioterapia se debe considerar como tratamiento curativo para CEC inoperable o para candidatos para tratamiento no quirúrgico. Los anticuerpos anti-PD-1 son tratamiento sistémico de primera línea para pacientes con CEC metastásico o localmente avanzado que no son candidatos para cirugía curativa o radiación. Tratamientos sistémicos de segunda línea para CEC avanzado incluye inhibidores del receptor del factor de crecimiento epidérmico (cetuximab) combinados con quimioterapia o radioterapia. La frecuencia de los controles y el estudio de nuevos CEC, dependerán de las características de riesgo subyacentes8.
4CONCLUSIONESEl análisis de este caso clínico y la revisión de la literatura que hemos realizado, nos permite recalcar la importancia del aumento del riesgo de desarrollo de neoplasias malignas, en particular CEC, en aquellos pacientes receptores de trasplantes de órganos sólidos inmunosuprimidos. Por ende, debemos insistir en la vital importancia de mantener una vigilancia dermatológica estricta para poder identificar precozmente lesiones sospechosas. La extirpación completa de lesiones aparentemente benignas y el estudio histopatológico respectivo permitirán establecer un diagnóstico preciso de este tipo de neoplasias para así poder establecer un plan terapéutico y manejo acorde. Dado el aumento de pacientes RTOS y el aumento de la expectativa de vida de estos con el manejo inmunosupresor actual, es importante destacar este caso clínico dado la baja frecuencia de transformación maligna de lesiones benignas como el QIE. Creemos que es un aporte para la concientización del seguimiento clínico dermatológico frecuente y exhaustivo en estos pacientes en la búsqueda de cáncer de piel, fundamentalmente CEC, dada su mayor incidencia en esta población12. El reporte de este tipo de casos debe mantenernos pendientes del control de lesiones cutáneas benignas que cambien rápidamente su patrón clínico (crecimiento rápido, dolor, ulceración, recurrencia, etc.)
A la histopatología con tinción H&E de la lesión extirpada muestra una epidermis con ortoqueratosis más una discreta pigmentación del estrato basal, dermis con lesión quística revestida por epitelio escamoso maduro con diferentes grados de displasia epitelial (A, lupa de aumento 4x) y desarrollo de una neoplasia maligna de estirpe epitelial, conformada por células de pleomorfismo moderado, citoplasma amplio eosinófilo y núcleos con nucleolo prominente (B, C y D, aumentos 10x y 40x). El tumor infiltra extensamente el intersticio adyacente al quiste hasta la hipodermis superficial, formando perlas córneas (C, 10x). con bordes laterales y profundos libres de tumor. No se observaron infiltraciones vasculares ni perineurales.
Conflicto de interesesLos autores declaramos que no tenemos conflictos de interés alguno para la publicación de este reporte de caso clínico