El asma es una enfermedad frecuente de fisiopatología compleja. El asma severa constituye aproximadamente el 5% de la población de asmáticos, sin embargo representa un desafío clínico y una carga sanitaria importante. Estudios recientes demuestran la existencia de fenotipos en todo el espectro de gravedad. La eosinofilia en esputo y sangre ha demostrado utilidad como marcador de inflamación Th-2 y de respuesta clínica a esteroides, sin embargo aún no existe mucho conocimiento sobre el asma no-eosinofílica. Los tratamientos actuales en asma se enfocan a estrategias de terapia escalonada según severidad, pero en pacientes con asma severa se requiere también del manejo multidisciplinario de las comorbilidades y la determinación del fenotipo, para aplicar terapias más especificas. El desarrollo acelerado de nuevos tratamientos en asma severa como consecuencia del mejor conocimiento de los distintos fenotipos ha ampliado el arsenal terapéutico para un enfrentamiento personalizado y específico en los pacientes con asma severa.
Asthma is a common disease of complex pathophysiology. Severe asthma accounts about 5% of asthma population, however represents a clinical challenge and a significant health burden. Recent studies show the existence of phenotypes through all the spectrum of severity. Eosinophilia in blood and sputum has proven as a useful marker of Th-2 inflammation and clinical steroid response, however there is still little knowledge about non-eosinophilic asthma. Current treatments for asthma are focused on step-up approaches according to severity, but severe asthma patients also require multidisciplinary management of comorbidities and phenotyping to apply more specific therapies. The fast development of new treatments in severe asthma as a result of better understanding of different phenotypes has broadened the therapeutic arsenal for a personalized and targeted management in severe asthma patients.
Asma se define según la guía GINA (Global Initiative for Asthma) 2014 como una enfermedad heterogénea caracterizada por inflamación crónica de la vía aérea que se manifiesta por historia de síntomas respiratorios como sibilancias, disnea, sensación de obstrucción torácica y tos, variables en el tiempo y en intensidad, además de limitación obstructiva variable o reversible de los flujos espiratorios1.
El asma es una de las patologías crónicas más frecuentes, con aumento de la prevalencia en las últimas décadas. Según la ubicación geográfica varía entre el 1% y el 18% de la población1. El estudio ISAAC (International Study of Asthma and Allergies in Childhood) reportó que la prevalencia de asma en América Latina se incrementa en un 0,32% por año (16,5 a 18,8%) en adolescentes y un 0,07% por año (19,9 a 21,4%) en escolares de menor edad2. Aún no se dispone de estudios de prevalencia de asma bronquial en adultos en Chile. Según estudios extranjeros el asma severa afectaría el 5 a 10% de la población total de pacientes asmáticos, sin embargo representa la mayor carga sanitaria por esta enfermedad3,4.
El objetivo del manejo del asma es lograr el control de los síntomas con terapia ajustada según la severidad (la que puede fluctuar en el tiempo) y la disminución del riesgo de exacerbaciones1. La mayoría de los pacientes logra un adecuado control con corticosteroide inhalado (CSI) y agonistas ß-adrenérgicos, aunque existe un grupo de pacientes que requiere terapia adicional con otros medicamentos controladores, incluyendo los corticoesteroides orales (CSO).
La definición de asma severa ha evolucionado y hasta hace poco se reservaba para pacientes que necesitan de dosis alta de corticosteroides inhalados (CSI) o uso casi continuo de CSO para mantener el control de los síntomas. En el último año la ERS (European Respiratory Society) y la ATS (American Thoracic Society) han publicado en forma conjunta una Guía Internacional para la definición, manejo y tratamiento del asma severa 3. En ella se propone una nueva definición de asma severa: se requiere la presencia del diagnóstico confirmado de asma y el manejo adecuado de las comorbilidades, en un paciente que necesita terapia con alta dosis de CSI más un segundo medicamento controlador para prevenir la pérdida de control del asma o que persiste sintomático a pesar de este nivel de terapia. La definición operacional según esta nueva guía incluye a los pacientes asmáticos en terapia combinada en escalón 4 y 5 de la guía GINA (Ver Tabla 1). La dosis alta de CSI es dependiente de la edad (ver Tabla 2).
DEFINICIÓN DE ASMA SEVERA SEGÚN LA GUÍA ATS/ERS 2014
| DEFINICIÓN DE ASMA SEVERA Y ASMA NO CONTROLADA |
|---|
| Paciente con diagnóstico de asma confirmado que requiere de terapia según escalón GINA 4-5 (dosis alta de CSI y LABA, o anti-leucotrienos/teofilina) durante el último año, o CSO por más del 50% del año previo para prevenir el estado de asma “no controlada” o que permanece “no controlada” a pesar de esta intensidad de terapia. |
| El asma “no controlada” se define según la presencia de al menos 1 de los criterios siguientes: |
| 1) Pobre control de los síntomas: puntaje en cuestionario ACQ > 1.5, o puntaje ACT < 20, o bien “mal control” según criterios de la guía GINA. |
| 2) Exacerbaciones frecuentes severas: 2 o más tratamientos con CSO en el último año (duración 3 días en cada episodio). |
| 3) Exacerbaciones graves: antecedente de hospitalización, ingreso a unidad de cuidados intensivos o ventilación mecánica en el ultimo año a causa una exacerbación de asma. |
| 4) Espirometría con limitación obstructiva con VEF1 post broncodilatador 80%. |
| GINA: Global Initiative for Asthma; LABA: long-acting b2-agonista; CSO: corticosteroide oral; ACQ: Asthma Control Questionnaire ; ACT: Asthma Control Test; VEF1:Volumen Espiratorio Forzado del 1er segundo. |
Adaptada de (3).
DOSIS DE CORTICOIDE INHALADO (CSI) EN PACIENTES ADULTOS
| CORTICOIDE INHALADO | DOSIS DE CORTE EN ug/día |
|---|---|
| Beclometasona dipropionato | ≥ 1000 (IPS o CFC en IDM) ≥ 500 (HFA en IDM) |
| Budesonida | ≥ 800 (IDM o IPS) |
| Ciclesonida | ≥ 320 (HFA en IDM) |
| Fluticasona propionato | ≥ 500 (HFA en IDM o IPS) |
| Mometasona furoato | ≥ 800 (IDM o IPS) |
IPS: inhalador en polvo seco; CFC: clorofluorocarbono; IDM: inhalador en dosis medida; HFA: hidrofluoroalcanos. Adaptado de (3).
La definición de asma no controlada según la guía ATS/ERS del 2014 para el asma severa se resume también en la Tabla 1. Los pacientes que no se ajusten a la definición de asma “no controlada” según estos cuatro criterios, pero que empeoren el control al reducir los corticosteroides (dosis alta de CSI o CSO), también se clasifican como pacientes con asma severa3.
En todos los pacientes con asma severa se debe realizar una evaluación clínica para confirmar el diagnóstico de asma bronquial, evaluar la presencia de factores desencadenantes de los síntomas, la adherencia a la terapia y la presencia de comorbilidades. También se recomienda realizar una aproximación al fenotipo del asma en pacientes con asma severa para optimizar la terapia con estrategias personalizadas3.
EVALUACIÓN DIAGNÓSTICA Y DE LAS COMORBILIDADES EN EL PACIENTE CON ASMA SEVERAEn la historia clínica se debe enfatizar en algunos elementos que pueden ser de ayuda diagnóstica, como la caracterización de los síntomas típicos de asma (disnea, tos, expectoración, sibilancias, sensación de opresión torácica) y de otros síntomas que pueden orientar a otros diagnósticos (disfonía o ronquera, esputo en gran cantidad, síntomas constitucionales o la falta de mejoría con terapia antiasmática). Si los síntomas se inician luego de una infección respiratoria, pueden orientar a una bronquiolitis o la presencia de bronquiectasias si el paciente ha presentado infecciones recurrentes o un episodio de neumonía previa. El inicio de los síntomas en la edad precoz sugiere una asociación más frecuente con atopia, a diferencia del asma de inicio tardío en el adulto que puede ser más severa y con menos asociación a alergias. Síntomas nocturnos o durante el sueño se pueden relacionar a reflujo gastroesofágico o apnea del sueño.
En el examen físico se debe incluir la evaluación de la vía aérea alta (obstrucción nasal, poliposis, sinusitis, rinitis alérgica), examen del cuello (bocio, adenopatías, masas, desviación de la tráquea), examen cardiopulmonar completo (sibilancias difusas o localizadas, crepitaciones basales o localizadas, signos de insuficiencia cardiaca o hipertensión pulmonar), examen de la piel y fanéreos (estigmas de vasculitis, sarcoidosis, dermatitis atópica, acropaquia).
En la evaluación de la función pulmonar es recomendable realizar estudios complementarios a la espirometría con broncodilatador: curva flujo-volumen, volúmenes pulmonares, capacidad de difusión de monóxido de carbono (diffusing capacity factor of the lung for carbon monoxide, DLCO) y estudio de la fuerza muscular inspiratoria y espiratoria (presión máxima inspiratoria o PIM, presión máxima espiratoria o PEM). La confirmación del diagnóstico de asma se basa en la demostración de una limitación del flujo espiratorio con respuesta significativa al broncodilatador; sin embargo actualmente se acepta que la presencia de hiperreactividad bronquial (mediante flujometría seriada en al menos dos semanas con una variabilidad del peak del flujo espiratorio 20% o por test de provocación bronquial) puede ser compatible con el diagnóstico de asma. En los pacientes que presentan limitación de los flujos espiratorios sin cambio significativo con broncodilatador se puede explorar si existe reversibilidad luego de una prueba esteroidal oral (prednisona 40 mg al dia por 14 a 21 días) o alternativamente con CSI en dosis muy altas (fluticasona 1500 a 2000 mcg al día en 3 a 4 tomas al día, por 3 a 4 semanas), para luego repetir la espirometría5. La limitación persistente de los flujos espiratorios se puede observar en casi la mitad de los pacientes con asma severa6. El atrapamiento aéreo es frecuente en pacientes con asma severa y se puede detectar en los volúmenes pulmonares como aumento del volumen residual y de la capacidad pulmonar total. La DLCO es normal o incluso se puede encontrar aumentada en asma severa, a diferencia de las enfermedades del intersticio o compromiso del parénquima pulmonar en que se observa una disminución de la DLCO.
El estudio de la inflamación de la vía aérea es un aspecto relevante en asma severa, donde la eosinofilia en esputo inducido (3%) sería un predictor de respuesta a esteroides, por lo que se ha planteado que la terapia ajustada según la celularidad en el esputo tendría mejores resultados en el manejo de estos pacientes7, sin embargo existe controversia de la real utilidad en la practica clínica3,8. El predominio de neutrófilos en el esputo en asma severa se debe a una inflamación por mecanismos no bien conocidos. El mecanismo de la neutrofília es complejo y podría estar a asociado a una vía inflamatoria no-Th2, con aumento de la expresión de genes de interleukina 1 (IL-1), factor de necrosis tumoral-alfa (TNF-alfa)11, colonización por bacterias12 y ciertas alteraciones en la fagocitosis13, por lo que algunos estudios proponen usar macrólidos en baja dosis y por tiempo prolongado en pacientes con asma severa no-eosinofílica para reducir las exacerbaciones14. En general, se sugiere el estudio de esputo en pacientes con eosinofilia persistente y exacerbaciones frecuentes, sin embargo a pesar del potencial uso clínico de esta técnica requiere de personal entrenado para el análisis de la muestra, por lo que se recomienda por el momento realizar en centros de investigación clínica3.
El análisis de oxido nítrico en aire exhalado es una medición no invasiva disponible en la práctica clínica, sin embargo no se ha demostrado su utilidad en el diagnóstico y seguimiento de los pacientes adultos con asma severa3.
El uso de biopsia bronquial obtenida por fibrobroncoscopía no se recomienda en la práctica clínica habitual y solo se reserva a centros de investigación para el análisis de inflamación y remodelación de la vía aérea o en casos en que se sospeche la presencia de otras patologías como sarcoidosis, malignidad o enfermedades intersticiales del parénquima presentes en la tomografía axial computada (TAC) de tórax.
El estudio de imágenes en asma severa debe incluir al menos la radiografía de tórax. Se recomienda una evaluación con TAC de tórax de alta resolución en caso de compromiso del parénquima pulmonar en la radiografía de tórax, disminución de la DLCO o presentación clínica atípica en adultos y niños. Esta recomendación de estudio con imágenes de alta resolución se basa en la necesidad de descartar diagnósticos alternativos3 (ver Tabla 3). La TAC de tórax de alta resolución con fase en espiración permite además evaluar el grado de atrapamiento aéreo, fenómeno que se ha correlacionado con la severidad del asma y con exacerbaciones frecuentes15.
PATOLOGÍAS QUE PUEDEN SIMULAR EL DIAGNÓSTICO DE ASMA BRONQUIAL EN PACIENTES ADULTOS (SIN ORDEN DE FRECUENCIA)
| Disfunción de cuerdas vocales |
| Enfermedad Pulmonar Obstructiva Crónica (EPOC) |
| Bronquiolitis (aguda o crónica) |
| Crisis de pánico con hiperventilación |
| Insuficiencia cardiaca congestiva |
| Bronquiectasias/fibrosis quística |
| Neumonía por hipersensibilidad |
| Síndrome hipereosinofílico/neumonía eosinofílica crónica |
| Embolia pulmonar |
| Tumores endobronquiales/cuerpo extraño |
| Estenosis traqueal/traqueobroncomalasia |
| Aspergilosis broncopulmonar alérgica (ABPA) |
| Síndrome Churg-Strauss |
| Neumonía organizada criptogénica (COP) |
Adaptada de (3).
Al evaluar desencadenantes de los síntomas además de los alérgenos e irritantes habituales se debe siempre indagar la actividad laboral y recreativa. El asma ocupacional, o exacerbada por el trabajo, se estima que afecta aproximadamente al 15% de la población de asmáticos16,17; puede desarrollarse ante la exposición en el tiempo a diversos agentes inhalatorios capaces de producir sensibilización en el paciente, como por ejemplo la exposición a proteínas de animales de laboratorio, látex, glutaraldehído, diisocianato de tolueno (fabricación de espuma de poliuretano, barnices, pinturas y plásticos), harina en la industria de la panadería, entre otros.
La confirmación de la adherencia al tratamiento es un aspecto fundamental antes de realizar una exploración con exámenes complejos o escalar en la terapia, pues se ha demostrado que al menos el 50% de los pacientes no cumple con la terapia18. Se debe explorar periódicamente las causas de incumplimiento: temor a efectos secundarios, costos o acceso a medicamentos, desinformación, problemas en la técnica inhalatoria. El uso de un plan escrito simple y esquemático ha demostrado ser una herramienta útil para mejorar la adherencia1 y debe incluir la terapia controladora (de uso regular), la terapia de rescate (para controlar los síntomas), además de cuáles son los síntomas y los valores mínimos de PEF ante una crisis.
La contribución de algunas comorbilidades puede ser significativa en la severidad del asma y su manejo clínico puede mejorar los síntomas en algunos pacientes (ver tabla 4). La rinosinusitis crónica es una comorbilidad frecuente y constituye un factor de riesgo independiente de exacerbaciones en pacientes asmáticos19. La poliposis nasal puede asociarse a enfermedad exacerbada por aspirina, con riesgo de exacerbaciones gatilladas por ingesta de aspirina o de otros antiinflamatorios no esteroidales (AINE). El reflujo gastroesofágico sintomático es muy frecuente en asma severa y puede tratarse con inhibidores de la bomba de protones, sin embargo existe controversia si el tratamiento mejora el control del asma. La obesidad se asocia a un aumento de los síntomas de asma, sin embargo no está claro si la obesidad induce el desarrollo de asma o si actúa como una comorbilidad, pues la obesidad por sí misma puede producir cambios fisiopatológicos que se asocian a disnea y alteraciones en la mecánica respiratoria20. La disfunción de cuerdas vocales en presencia de asma severa debe manejarse con fonoaudiología. La cesación tabáquica es imperativa, pues constituye un factor de riesgo para exacerbaciones graves. En el caso de pacientes con síndrome de apnea obstructiva del sueño, su tratamiento especifico mejora los síntomas nocturnos de disnea. También, como en otras patologías, las enfermedades psiquiátricas pueden complicar el diagnóstico y manejo del asma severa. La ansiedad, depresión y otras patologías mentales también constituyen comorbilidades que deben ser manejadas y compensadas por un especialista antes de modificar la terapia antiasmática.
NUEVAS TERAPIAS EN ASMA BRONQUIAL PROPUESTAS SEGÚN EL FENOTIPO
| FENOTIPO | BIOMARCADOR | TRATAMIENTO |
|---|---|---|
| ASMA ALÉRGICA | IgE sérica elevada, atopia, eosinofilia en sangre | Anti IgE (omalizumab) |
| ASMA EOSINOFÍLICA | Exacerbaciones frecuentes, eosinofilia en esputo, asma dependiente de esteroides | Anti receptor de IL4 (dupilumab) |
| ASMA NEUTROFÍLICA | Neutrófilos en esputo inducido | Macrólidos (azitromicina) |
| OBSTRUCCIÓN DE FLUJOS ESPIRATORIOS | Remodelación de la vía aérea, reducción de VEF1, elevación de periostina en suero, FeNO elevado | Anti IL13 (lebrikizumab) |
| EXACERBACIONES FRECUENTES | Eosinófilos en esputo, uso de corticoide oral | Anti IL5 (mepolizumab) |
Adaptado de (41).
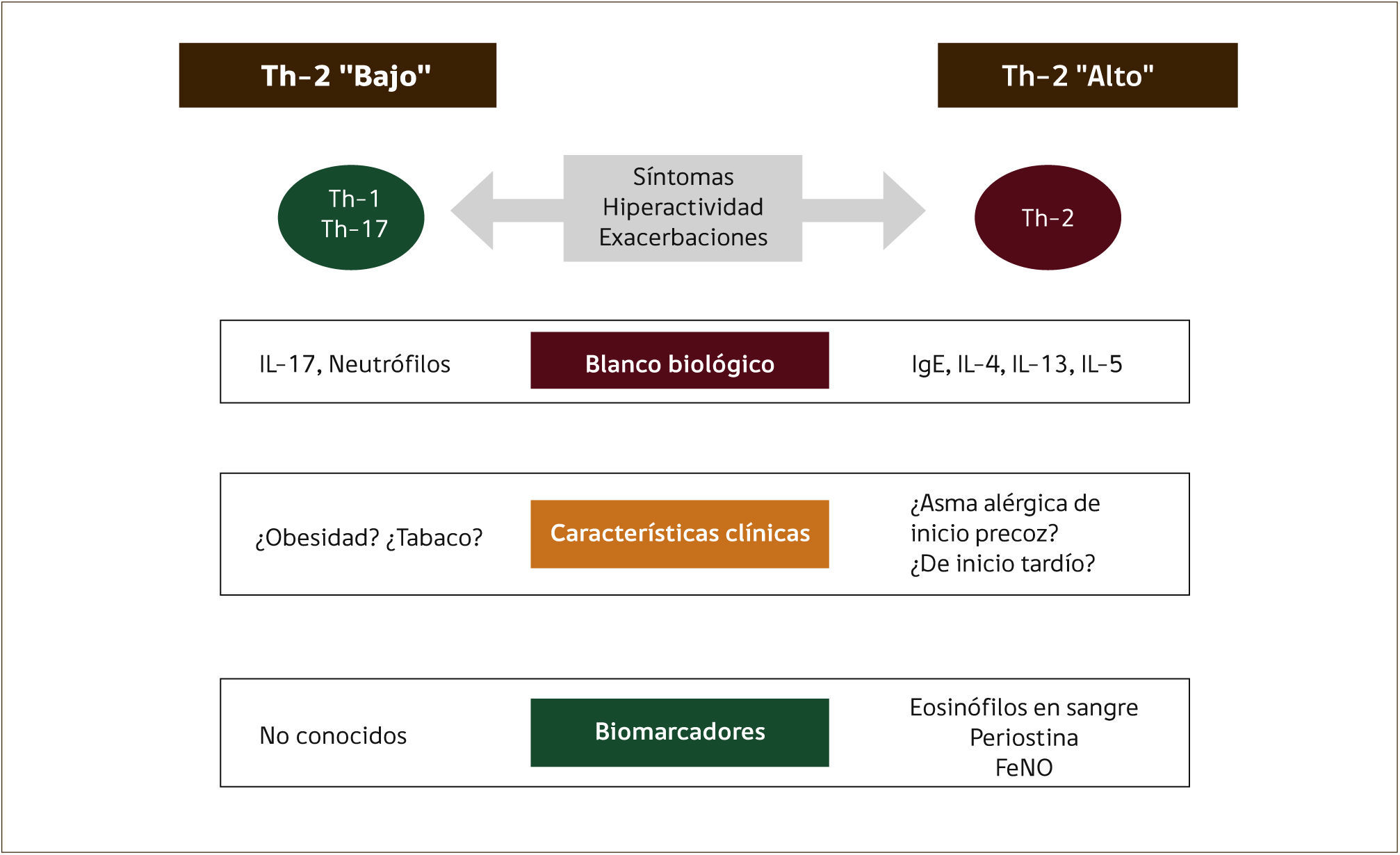
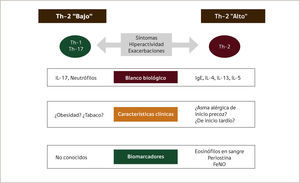
Actualmente se reconoce la variabilidad de las características clínicas, funcionales y biológicas de los pacientes con asma, lo que ha hecho surgir el concepto de fenotipos, es decir, diferentes subgrupos de pacientes con características observables y comunes que resultan de la interacción entre el genotipo y el ambiente. Si bien los pacientes con asma severa comparten ciertas características clínicas y de función pulmonar, existen marcadores biológicos que los diferencian entre asmáticos con perfil de tipo Th-2 “alto” y Th-2 “bajo”21,40. La inflamación de tipo “Th-2 alto” se asocia a mediadores de los linfocitos Th-2 (T helper) como la interleukina 4 (IL-4), interleukina 5 (IL-5) e interleukina 13 (IL-13), las cuales contribuyen a un aumento del número y activación de eosinófilos y a la producción de inmunoglobulina E (IgE). Últimamente han surgido nuevos marcadores como la medición de la fracción de óxido nítrico exhalado (FeNO), eosinófilos en sangre y en vía aérea y niveles de periostina en sangre (Ver Figura 1).
Estudios recientes realizados en base a análisis estadístico de cohortes de pacientes con asma severa demuestran la existencia de al menos cinco fenotipos agrupados según características clínicas, de función pulmonar, biológicas y de la inflamación presente en la vía aérea. En la cohorte del programa SARP (Severe Asthma Research Program, National Heart, Lung, and Blood Institute) en más de 1500 pacientes se identificó cinco fenotipos en adultos con asma severa, moderada y leve22: tres grupos de asma alérgica de inicio precoz (leve, moderada y severa), un cuarto grupo de pacientes con asma de inicio tardío asociado a obesidad y al género femenino, con reducción del VEF1 y uso frecuente de corticoide sistémico, y un quinto grupo de pacientes con asma de inicio tardío menos atópica, pero muy severa y con escasa reversibilidad de los flujos espiratorios. En un estudio europeo23 se analizó fenotipos en base a características clínicas y de esputo inducido (% de eosinófilos), demostrando la presencia de cuatro grupos que se aproximan a los fenotipos de otros estudios: asma alérgica de inicio precoz, asma en obesidad sin eosinofilia, asma de inicio precoz con predominio de síntomas, y asma de inicio tardío con predominio de la inflamación. Si bien existen diferencias en las características analizadas, existe concordancia en los resultados de diversos estudios de fenotipos en asma severa22-24.
El asma severa afecta al 5 a 10% de la población general de asmáticos3,4 y representa una considerable carga económica sanitaria. El mejor conocimiento de las características biológicas en estos pacientes ha permitido el desarrollo de nuevas terapias, más especificas y dirigidas al fenotipo. Actualmente ya se dispone de terapia biológica con anticuerpo anti-IgE (omalizumab), aprobado para pacientes con asma severa alérgica e IgE elevada. Es previsible que en los próximos años se disponga de nuevas terapias para el uso clínico pues existen varias moléculas en fase de estudio clínico avanzado, como por ejemplo mepolizumab (anticuerpo monoclonal anti IL-5) indicado en asma severa con eosinofilia y lebrikizumab (anticuerpo monoclonal anti IL-13)25. Ver Tabla 4.
TRATAMIENTO DEL ASMA SEVERA EN ADULTOS: ASPECTOS GENERALESDentro de los aspectos generales en el tratamiento se recomienda un manejo multidisciplinario, incluir educación para el paciente (identificar las crisis, técnica inhalatoria), la evaluación de la adherencia, el tratamiento de las comorbilidades y de los factores desencadenantes de síntomas.
Se considera medicamentos controladores de uso habitual a los CSI, los corticoides orales y los LABA. En asma severa se requiere habitualmente de dos o más fármacos controladores para lograr el control del asma, los que deben ser indicados en cada paciente según la respuesta clínica y tolerancia a efectos secundarios. Alternativamente, se considera terapia controladora a las teofilinas y a los antileucotrienos, sin embargo su eficacia es menor a la terapia con esteroides y LABA. Actualmente se han incorporado nuevos tratamientos, como la terapia biológica anti-IgE y la termoplastía bronquial endoscópica en pacientes seleccionados.
Broncodilatadores de acción prolongadaEn asma severa lo habitual es el uso de una combinación de LABA asociados a CSI. Estudios prospectivos han mostrado quela combinación de CSI más LABA mejoran el control del asma y disminuyen las exacerbaciones.
Anticolinérgicos de acción prolongadaEn los últimos años se ha evaluado los anticolinérgicos de acción prolongada en asma severa por la necesidad de nuevos fármacos controladores. El tiotropio se ha estudiado como terapia aditiva en pacientes que no logran el control de los síntomas a pesar del uso de dosis alta de CSI/LABA, demostrando una mejoría en la frecuencia de exacerbaciones y de la función pulmonar26. Sin embargo, a pesar de la evidencia creciente de su beneficio en algunos pacientes con asma severa no controlada aún no se considera una terapia de primera línea1,3.
Corticoesteroides inhalados (CSI)Constituyen el pilar de la terapia en los pacientes con asma severa. La dosis a utilizar depende de la molécula, idealmente en la menor cantidad de puff al día ajustado en forma prospectiva según la respuesta clínica. Existen características clínicas predictoras de respuesta favorable a CSI, como la reversibilidad de los flujos espiratorios en la espirometría, FeNO elevado, presencia de hiperreactividad bronquial e historia familiar de asma27. Cuando un paciente no logra controlar el asma pero presenta respuesta clínica a CSI se puede considerar aumentar la dosis, sin embargo existe poca evidencia de beneficio a 1000 mcg/dia de fluticasona (hasta 2000 mcg/día) o budesonida 1600 mcg/día28.
Corticoesterides Orales (CSO)Se utiliza en aproximadamente el 30% de los pacientes con asma severa (adicional a los CSI) para mantener el control del asma, por lo que se plantea que estos pacientes presentan “insensibilidad a corticoides”. Los mecanismos de esta presentación clínica en asma severa han sido relacionados a la presencia de obesidad, tabaco o inflamación “Th2-baja”29.
Terapia con anti IgE (anticuerpo monoclonal omalizumab)Esta aprobada desde el 2003 por la agencia FDA (Food and Drug Administration) para indicación en asma moderada-severa no controlada en pacientes 6 años de edad, IgE sérica elevada (30-700 UI/ml) y sensibilización a alérgenos perenne (prick test y/o in vitro por IgE específica). Se administra por vía subcutánea en dosis de 0,016 mg/kg de peso por UI/mL de IgE al mes, en intervalos de dos a cuatro semanas y por un mínimo de 16 semanas, siendo posible prolongar el tratamiento por al menos un año en caso de respuesta clínica favorable. En Chile actualmente se encuentra aprobado por el Instituto de Salud Pública en asma severa no controlada desde los seis años de edad, con dosis que se calculan según peso e IgE (30-1500 UI/ml). Los estudios clínicos con omalizumab demuestran una reducción significativa de las exacerbaciones, mejoría de los síntomas y calidad de vida, por lo que se recomienda realizar una prueba terapéutica por 16 semanas para evaluar respuesta clínica3. La eficacia es difícil de predecir por lo que se intenta identificar marcadores biológicos predictores de respuesta a omalizumab en pacientes con asma severa y fenotipo Th2 “alto”, por ejemplo, los niveles de periostina en sangre, recuento de eosinofilos en esputo y FeNO30. Omalizumab ha demostrando un perfil de seguridad comparable a placebo para riesgo de anafilaxia, efectos cardiovasculares y malignidad31. Actualmente es parte del arsenal terapéutico sugerido por las guías clínicas de manejo del asma severa1,3,40, siendo hasta el momento el único tratamiento biológico aprobado en asma.
Termoplastía bronquialSe ha utilizado desde el año 2010 para pacientes con asma severa y síntomas persistentes a pesar de tratamiento con CSI y LABA. Es una técnica experimental que se realiza por broncoscopía flexible y que consiste en la aplicación de calor por radiofrecuencia (65°C) a través de un catéter aplicado en el árbol bronquial para reducir la masa y capacidad contráctil del musculo liso bronquial, con el objetivo final de reducir las exacerbaciones, mejorar la función pulmonar y la calidad de vida. El estudio AIR-232, aleatorizado en 288 pacientes con VEF1 60% demostró una reducción de las exacerbaciones severas en un 32% con termoplastía (adicionada a la terapia convencional) comparada con broncoscopía placebo. Un análisis sistemático reciente de la Base de datos Cochrane con resultados de 429 pacientes reportó que la mejoría en la calidad de vida, de los síntomas y de la función pulmonar a 12 meses no es estadísticamente significativa luego de termoplastía33. Los criterios de selección de pacientes aún no están bien definidos, pero se sugiere considerar este procedimiento para asmáticos severos que requieran el uso intermitente o continuo de corticoide oral, que presenten deterioro de la función pulmonar (VEF1 50%) y ausencia de exacerbaciones con riesgo vital en el pasado. Es una técnica novedosa pero aún no se conoce bien los efectos a largo plazo, por lo que se recomienda realizar solo en centros de investigación clínica3.
¿CÓMO AJUSTAR LA TERAPIA ANTIASMÁTICA?Antes de escalar en la intensidad de la terapia se recomienda manejar las comorbilidades3. Las recomendaciones de las guías de expertos sugieren iniciar terapia controladora con CSI en dosis alta o CSI asociado a LABA; si no se logra el control, se recomienda adicionar un tercer medicamento controlador, con alternativas como teofilina, antileucotrieno o tiotropio1,3. Algunos pacientes pueden requerir en forma intermitente o de forma permanente CSO. Una vez instalada una terapia con medicamentos controladores se debe evaluar en forma prospectiva cada 4 a 8 semanas la mejoría del control del asma. Cuando este objetivo se logra en pacientes bajo tratamiento adicional con CSO se debe descender gradualmente la dosis hasta intentar la suspensión. La reducción de la dosis de CSI se debe considerar solo si se ha logrado el control del asma y si se ha suspendido previamente el CSO. Hasta el momento no existen guías ni consenso de cómo descender en la terapia antiasmática al lograr el control del asma. Algunas recomendaciones de expertos sugieren realizar el descenso de un 25-50% de la dosis de CSI cada 1 a 3 meses, hasta llegar a una dosis media o baja34.
Si se requiere escalar en la intensidad de la terapia desde un tratamiento con dosis alta de CSI (1000 mcg/día de fluticasona o equivalente), se recomienda antes de aumentar la terapia reevaluar el diagnóstico, la adherencia, la exposición a desencadenantes o alérgenos y la presencia de comorbilidades no resueltas. Se puede aumentar la dosis de CSI hasta 1600-2000 mcg/día, agregar o sustituir por otro CSI de partícula pequeña (ej. ciclesonida), intentar un curso de CSO o sistémico, adicionar un tercer medicamento controlador (antileucotrieno o teofilina), agregar terapia anti-IgE en pacientes con atopia demostrada, o finalmente explorar terapias experimentales. La recomendación en general es que debe referirse a un especialista en asma en caso de pacientes con necesidad de este nivel de tratamiento1,3.
OTROS TRATAMIENTOS EN EXPERIMENTACIÓNSe ha estudiado el uso de algunos medicamentos inmunomoduladores en pacientes con asma severa corticodependiente, con el fin de disminuir la dosis de esteroides. Metotrexato y ciclosporina demostraron (en series pequeñas de pacientes) reducir la dosis de corticoide oral, pero los efectos adversos especialmente con ciclosporina sobrepasaron el beneficio por lo que no se puede recomendar ampliamente su uso3. La hidroxicloroquina, azatioprina, colchicina, dapsona, ciclofosfamida y sales de oro no han demostrado beneficio en asma severa35.
Anticuerpos anti-interleukina 5 (IL-5)Se han estudiado en asma por su efecto potente para reducir el reclutamiento de eosinófilos en la vía aérea. La IL-5 es una citokina Th-2 crucial en la diferenciación, sobrevivencia y reclutamiento de eosinófilos. Mepolizumab y Reslizumab aún no se encuentran aprobados para el uso clínico, sin embargo han demostrado beneficio en pacientes con eosinofilia persistente y exacerbaciones frecuentes a pesar de terapia con dosis alta CSI y CSO36,40.
La IL-4 es una citoquina Th-2 relevante en la inflamación en asma que participa en la activación de linfocitos Helper Th-2 para la síntesis de IgE y reclutamiento de mastocitos; ejerce su efecto biológico mediante la unión a un receptor tipo I (une a IL-4) y tipo II (une a IL-4 e IL-13). Dupilumab es un anticuerpo monoclonal que se une al receptor tipo II e inhibe la señalización intracelular para IL-4 e IL-13 en asma moderada y severa con eosinofilia persistente en sangre. Los resultados preliminares muestran una reducción de las exacerbaciones y de la dosis de CSI, con mejoría de la función pulmonar37,40.
Los inhibidores del factor de necrosis tumoral-alfa (TNF-alfa) fueron estudiados en asma severa, sin embargo no se logró demostrar su utilidad. Con golimumab el beneficio clínico no superó los importantes efectos adversos observados38.
MacrólidosHan demostrado efecto antiinflamatorio además de su efecto antibiótico. En un estudio reciente en asma severa no eosinofílica (eosinófilos en sangre 200/μl) con exacerbaciones frecuentes, el uso de azitromicina comparado con placebo disminuyó la frecuencia de exacerbaciones graves e infecciones respiratorias del tracto respiratorio inferior, lo que sugiere su potencial uso en asma severa no eosinofílica39,40.
PERSPECTIVAS PARA EL MANEJO DEL ASMA SEVERAIndependiente de la definición de asma severa, esta patología representa un grupo heterogéneo de pacientes que constituyen un desafío para el médico tratante. Es importante reconocer la importancia del manejo multidisciplinario y de las comorbilidades. A medida que la comprensión de esta patología siga avanzando el desarrollo de nuevas terapias continuará expandiéndose para los diferentes fenotipos, lo que permitirá un enfoque más personalizado y dirigido para ofrecer una mejor terapia a estos pacientes.
Los autores declaran no tener conflictos de interés, en relación a este artículo.