La Broncoscopia es sin duda el ámbito de medicina respiratoria que más ha sufrido cambios en los últimos 30 años. Principalmente dado por los avances tecnológicos que han permitido llegar, ver y hacer mucho más de lo que se pensó que era factible por vía endoscópica.
The most evolved area in the respiratory medicine in the last 30 years, is without any doubt the Bronchoscopy. This are the results of the tecnological advances, that let us go, see and do, further than we thougth by endoscopy.
Los albores de la broncoscopia datan de la última década del siglo XIX, cuando los avances en el estudio endoscópico de la vía aérea superior y del esófago permiten a Gustav Killian, en 1897, realizar la primera traqueoscopía utilizando un tubo metálico, luz eléctrica y anestesia tópica con cocaína, para la extracción de un hueso de cerdo desde la vía aérea de un granjero, demostrando así la factibilidad y utilidad de su realización. El siguiente salto lo da Chevalier Jackson, sin duda el gran impulsor de la terapéutica endoscópica, quien además fue el primer catedrático en la materia (Universidad de Pensilvania, 1919).
En 1967 se presenta en el IX Congreso Internacional de Neumología en Copenhague, el primer Broncoscopio Flexible como lo conocemos hoy, instrumento desarrollado por Shigeto Ikeda y que cambió definitivamente la forma de explorar, estudiar y nomenclar el árbol bronquial.
INDICACIONES ACTUALES DE LA BRONCOSCOPIALas indicaciones actuales de la broncoscopia se muestran en la Tabla N°1 y son prácticamente todas las que involucran el estudio del árbol bronquial y el parénquima pulmonar, ya que hoy podemos: observar, obtener muestras para estudio bacteriológico y citológico, obtener muestras para estudio histológico tanto de la mucosa bronquial como del parénquima pulmonar, asear y destapar la vía aérea de secreciones y tumores, excluir bronquios para reducir el volumen pulmonar e incluso tomar muestras del mediastino, entre otras muchas intervenciones. Tabla 1.
INDICACIONES ACTUALES DE BRONCOSCOPIA
| Lesiones de etiología desconocida en radiografía de tórax o necesidad de evaluar neumonía recurrente, atelectasia persistente o infiltrados pulmonares. |
| Necesidad de estudiar la permeabilidad o las propiedades mecánicas de la vía aérea superior. |
| Sospecha de cáncer y/o citología de cáncer en esputo. |
| Necesidad de obtener secreciones de vía aérea inferior, lavados, citología y evaluación microbiológica. |
| Necesidad de determinar localización y extensión del daño por inhalación tóxica o aspiración. |
| Necesidad de evaluar problemas asociados con tubos endotraqueales o traqueostomía. |
| Necesidad de ayuda en intubaciones difíciles o traqueostomía percutánea. |
| Sospecha de tapones mucosos responsables de atelectasias. |
| Necesidad de remover tejido endobronquial anormal o material extraño por fórceps, canastillo o LASER. |
| Toilet endobronquial en neumonía asociada a ventilador. |
| Intubación selectiva en uno de los bronquios principales. |
| Necesidad de colocar o establecer permeabilidad de un stent. |
| Necesidad de dilatación por balón en tratamiento de estenosis traqueobronquial. |
(AARC Clinical Practice Guidelines, 2007)
El broncoscopio de Ikeda ha sufrido un sinnúmero de modificaciones, tanto en el tipo de materiales en su construcción como en el tipo de luz que se utiliza para la visualización durante el examen.
En un principio se realizaba el examen observando directamente a través del ocular del endoscopio. Hoy analizamos la vía aérea en una pantalla de video, gracias a la miniaturización de las cámaras y su incorporación al interior del instrumento, el cual denominamos videobroncoscopio. Figura 1.
De igual forma, la observación apoyada en la iluminación con luz blanca se puede complementar con dos tipos de técnicas que permiten discriminar las alteraciones de la mucosa que son sospechosas de neoplasia para su biopsia.
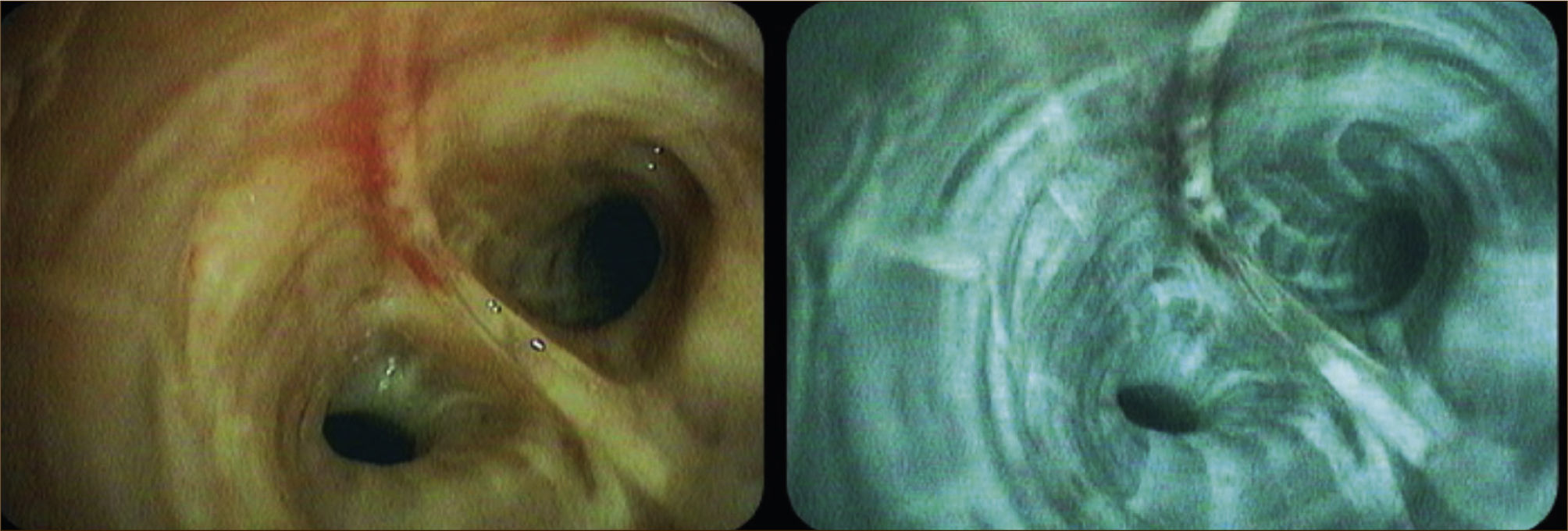
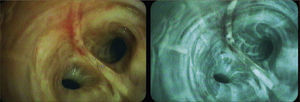
Autofluorescencia: Técnica en la que se utiliza una fuente de luz filtrada de longitudes de onda de alrededor de los 400nm o un láser de longitud de onda de 408nm, para distinguir en base a las propiedades fluorescentes y absortivas de los fluóforos endógenos, los cambios en la composición bioquímica (colágeno y elastina), y en el estado metabólico (NADH y flavinas) de la mucosa bronquial. De esta forma se pueden reconocer casi todas las etapas neoplásicas desde las displasias hasta el cáncer invasor, como cambios en la coloración de la mucosa la que adquiere tonalidades más oscuras. Su sensibilidad para el reconocimiento de lesiones neoplásicas es casi el doble que la obtenida con la observación con luz blanca (85%), sin embargo su especificidad es menor (60% vs. 90%) y está dado principalmente por falsos positivos como inflamaciones, infecciones, hiperplasias de la mucosa y por errores interobservadores 1Figura 2.
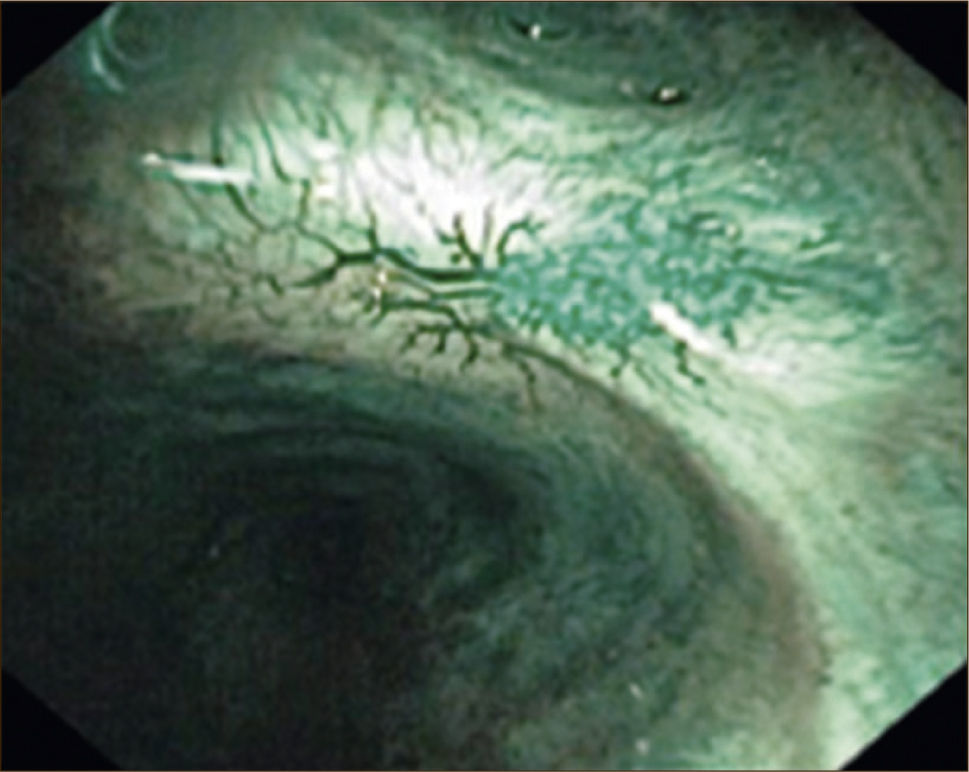
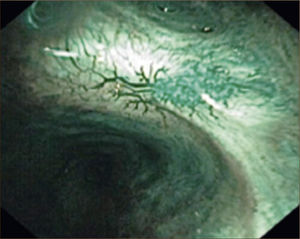
Imagen de Banda Estrecha (NBI): Método que utiliza luz azul centrada en 415nm y luz verde en 540nm, las cuales corresponden a los picos máximos de absorción de la hemoglobina. De esta forma se puede analizar la vasculatura tanto de la mucosa (luz azul), como de la submucosa (luz verde) y reconocerse los patrones aberrantes que se producen por la angiogénesis de las lesiones neoplásicas, los que aparecen desde muy temprano. Estos cambios se pueden observar como vasos punteados, vasos grandes, en red, en espiral tipo sacacorchos, etc. Tiene mejor sensibilidad que la broncoscopia con luz blanca y muy similar a la de la autofluorescencia, sin embargo las supera en especificidad 1Figura 3.
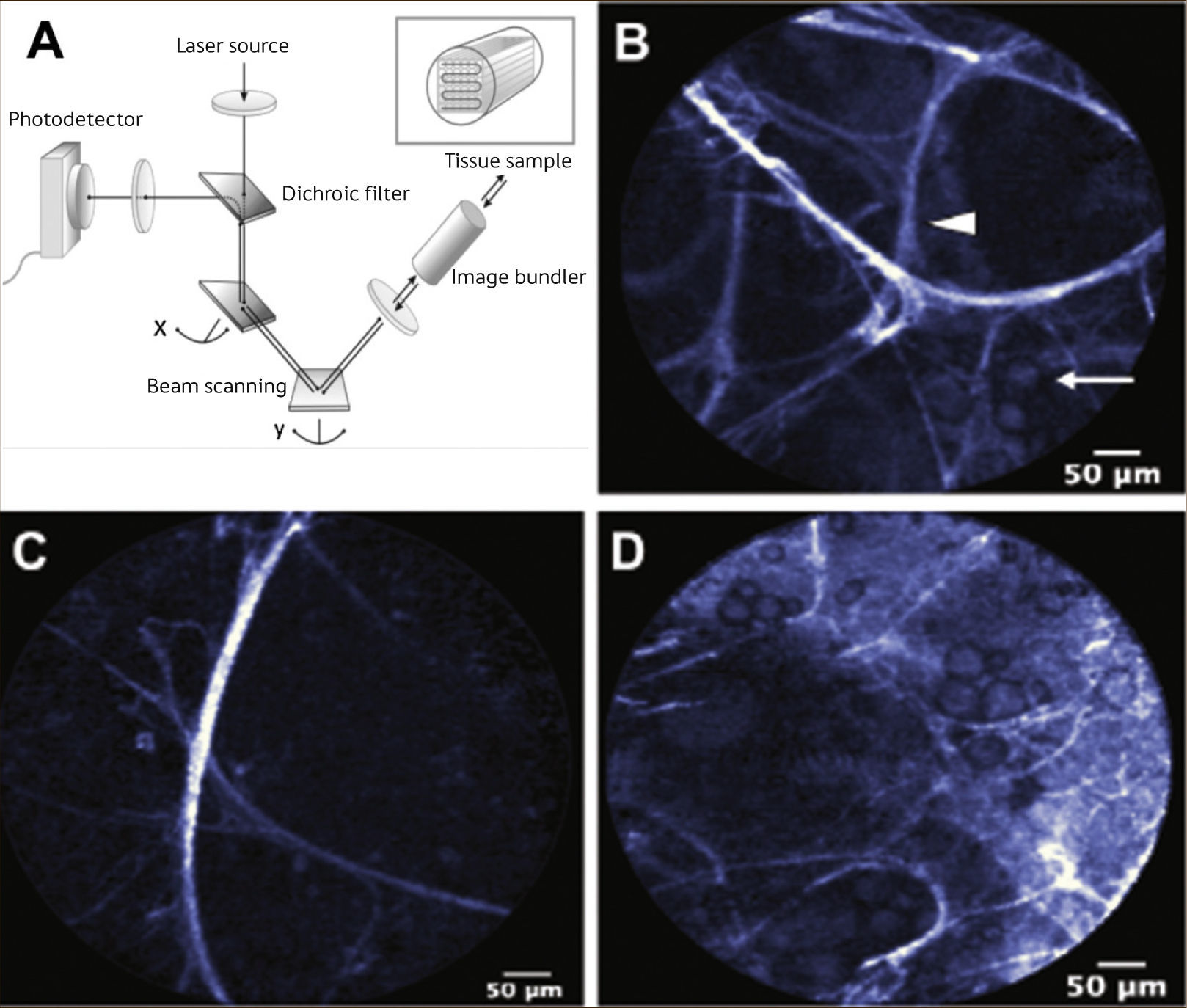
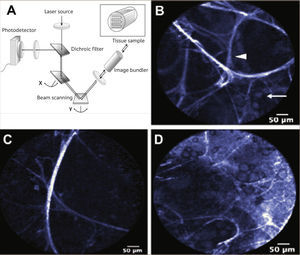
Broncoscopia Confocal: Procedimiento que al igual que la autofluorescencia, utiliza la refracción de los fluoróforos endóngenos al ser iluminados por una luz de una longitud de onda conocida (en este caso un láser de 488nm). La diferencia radica en que tanto la emisión del láser, como la recepción de los fotones emitidos por los tejidos, se realizan a través de una sonda de fibra óptica de 1,4mm que se introduce en el canal de trabajo del broncoscopio y que debe entrar en contacto con la mucosa bronquial o alveolar. La recolección de las imágenes y su procesamiento se realizan con un software específico que finalmente nos permite observar en tiempo real y a una tasa de 12 cuadros por segundo, un área fina de tejido de aproximadamente 20 micrones con una resolución lateral de 3 micrones, proporcionando así imágenes microscópicas “in vivo” de la vía aérea. Pese a que promete un rol protagónico en un futuro cercano, aún se encuentra en etapa de prueba 2Figura 4.
BRONCOSCOPIA CONFOCAL.
A) Esquema de funcionamiento. B) Alvéolo normal. Punta de flecha: septo alveolar. Flecha: Macrófagos alveolares. C) Enfisema Pulmonar caracterizado por disminución del número de septos y aumento de los espacios alveolares. D) Aumento del número de macrófagos alveolares. 2.
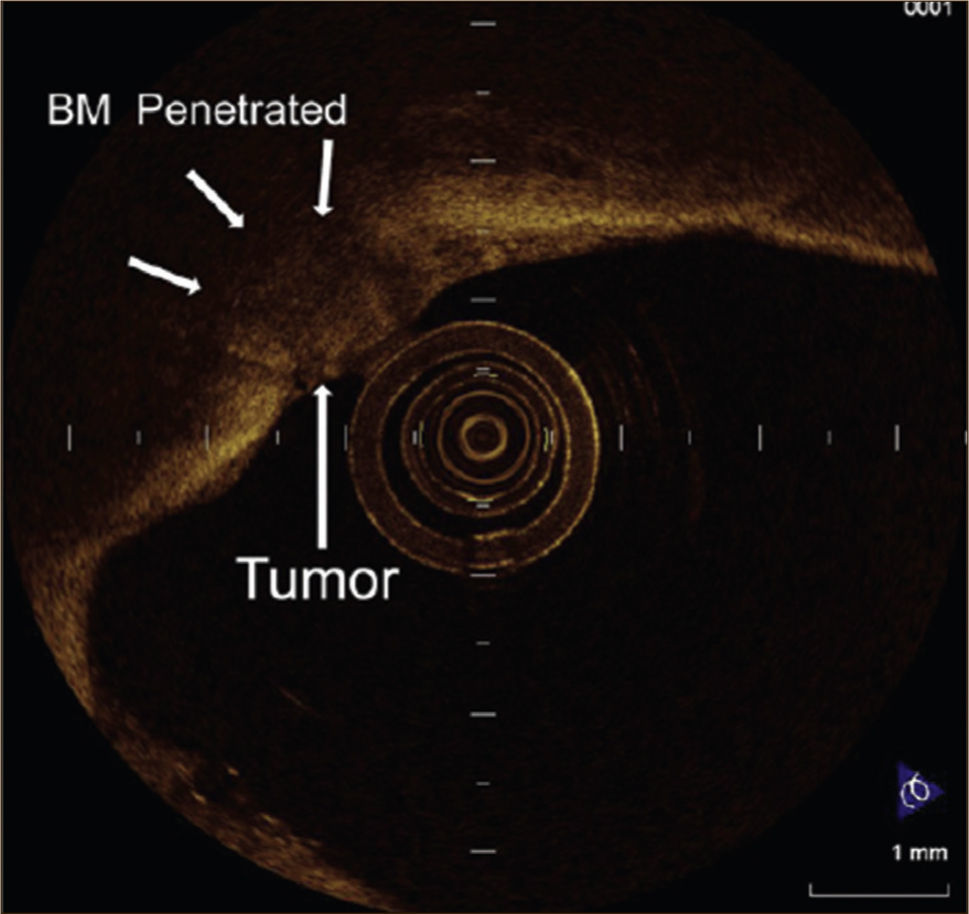
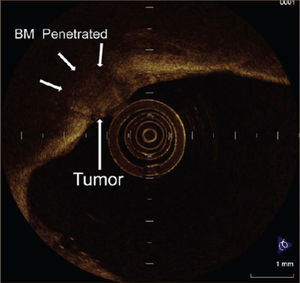
Tomografía de Coherencia Óptica: Este método también permite la visualización a un nivel histológico de la vía aérea, pero utilizando las propiedades de luz, de igual forma como lo hace un ecógrafo con las ondas de sonido. Nuevamente se utilizan sondas de fibra óptica a través del canal de trabajo del broncoscopio, para iluminar, recoger la luz reflejada por los tejidos y llevarla al Interferómetro óptico, el cual genera imágenes en 1, 2 y 3 dimensiones. La resolución obtenida es de una superficie de 5 a 30 micrones con una profundidad de 2 a 3mm. Al igual que la Broncoscopia Confocal, se encuentra en etapa de evaluación 3Figura 5.
TOMOGRAFÍA DE COHERENCIA ÓPTICA DE UN CARCINOMA ESCAMOSO MICROINVASOR.
La membrana basal (BM) posee una alta dispersión y se observa como una línea clara y se aprecia interrumpida por invasión tumoral 1.
Saltando del ámbito netamente observacional de la endoscopia, al intervencional y en especial al de la toma de muestras citológicas e histológicas, durante los últimos años han aparecido herramientas cuya utilidad crece cada día más en todos los centros de vanguardia:
EBUS: El acrónimo de Endobronchial Ultrasound o Ultrasonido endobronquial, es sin duda un nombre que resuena cada vez más en la literatura ligada al cáncer pulmonar, como parte fundamental de su algoritmo de etapificación. La incorporación de un transductor convexo de ultrasonido al extremo distal de un videobroncoscopio, nos ha permitido observar el mundo a través de las paredes traqueales y bronquiales, de manera de poder en un modo mínimamente invasivo, tomar muestras en tiempo real y con visión directa de estructuras como el mediastino y sus grupos ganglionares, los hilios pulmonares e incluso el mismo parénquima pulmonar. Su desarrollo parte con la inquietud planteada por el cirujano torácico danés Dr. Mark Krasnik, de miniaturizar los endosonógrafos utilizados por vía digestiva, para su utilización en la vía aérea y en el 2003 publica en la revista Thorax la primera experiencia con esta técnica en 11 pacientes 4. El aparato que utilizamos hoy en día, es un videobroncoscopio de 6.9mm de diámetro a nivel de la punta (en donde se aloja el transductor convexo de 7.5MHz) y de 6.2mm a nivel del tubo de inserción; posee una óptica de visión en 45° (para evitar la interferencia visual del transductor ecográfico), con un campo de visión de 100° y un canal de trabajo de 2.0 o 2.2mm. con su extremo distal angulado en 20°, para la realización de las biopsias transbroquiales con aguja fina bajo visión ecográfica en tiempo real 5Figuras 6 y 7.
Este procedimiento se lleva a cabo en un ambiente ambulatorio y pese a que se puede emplear sedación consciente y anestesia tópica durante su realización 6, en nuestro centro se prefiere la utilización de anestesia general y máscara laríngea ya que es un procedimiento largo, que requiere el paso del instrumento por la boca (es muy grueso para introducirlo por vía transnasal como habitualmente se hace en la broncoscopia diagnóstica) y evitamos los accesos de tos, los que entorpecen y enlentecen la intervención.
En cuanto a sus resultados en el estadiaje mediastínico del cáncer pulmonar, uno de los primeros estudios prospectivos demostró: sensibilidad 94.6%, especificidad 100%, valor predictivo positivo 100%, valor predictivo negativo 89.5% y una certeza diagnóstica del 96.3% 7. Si bien fue ideado para la etapificación tumoral, hoy en día se utiliza como método de diagnóstico para otros tipos de patologías como sarcoidosis, linfomas, tuberculosis e incluso para visualización ecográfica de émbolos pulmonares centrales 3. Sus complicaciones son las propias de la broncoscopia y las de las biopsias transbronquiales con aguja fina (neumotórax, neumomediastino, mediastinitis, bacteremia y pericarditis), pese a los cuales aún no se reporta mortalidad en la literatura actual 7,8.
Sistemas de Navegación Broncoscópica: Dado el avance en la calidad y definición de las imágenes obtenidas con los equipos actuales de Tomografía Axial Computada, cada vez se detectan más lesiones pulmonares que plantean una creciente necesidad de tomar muestras de ellas, para determinar su naturaleza y así la conducta terapéutica. El gran desafío para la broncoscopia aparece cuando se ubican en la periferia del parénquima pulmonar, lejos de los bronquios principales. Clásicamente se utiliza la fluoroscopía como apoyo en la guía del broncoscopio, la cual tiene como limitaciones el hecho que otorga una imagen bidimensional y muchas veces por el tamaño o la densidad de la lesión a biopsiar, simplemente no se logra reconocer, otorgando un 63% de sensibilidad en lesiones mayores a 2cm y de 34% en menores de 2cms 1. Ante esta necesidad han aparecido dos alternativas para la guía del broncoscopio y sus pinzas, las dos basadas en la reconstrucción 3D de las imágenes obtenidas de una TAC de tórax de corte fino:
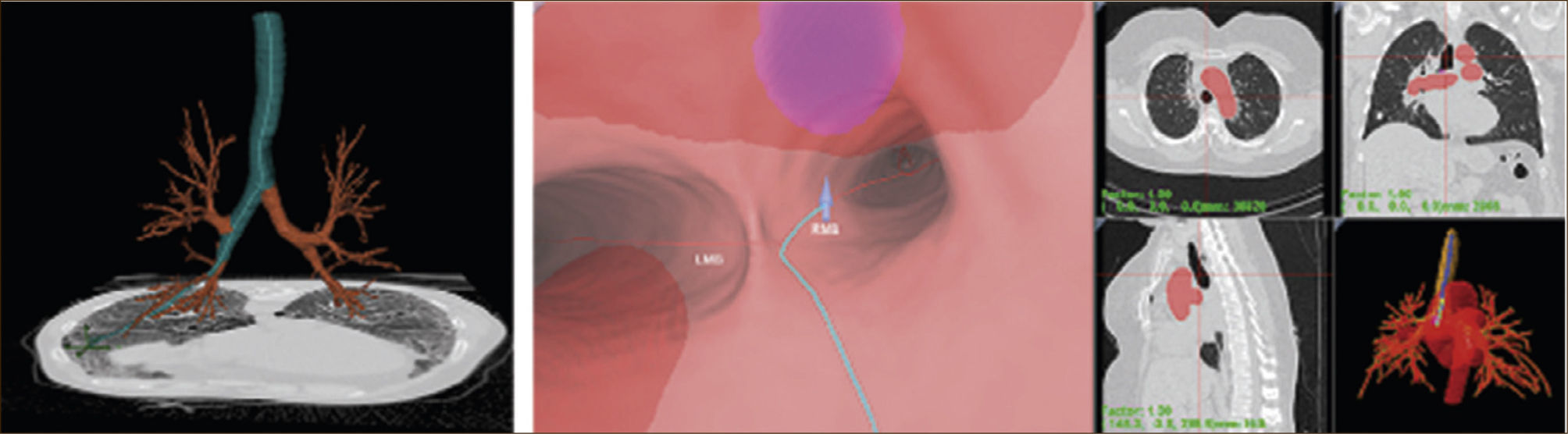
Broncoscopia Virtual: Utilizando un software que integra la reconstrucción 3D de las imágenes obtenidas por la Tomografía Axial Computada, con la imagen del la videobroncoscopia, el operador va siendo guiando bronquio por bronquio hasta el sitio de la lesión a estudiar 1Figura 8.
SOFTWARE DE NAVEGACIÓN ENDOBRONQUIAL 3.
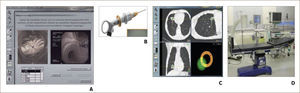
Navegador Electromagnético: Utiliza una tabla que genera un campo electromagnético sobre el paciente y un sensor magnético que se introduce a través del canal del trabajo del broncoscopio, con el cual se “navega” por el árbol bronquial hasta llegar a la lesión sospechosa, guiado en una imagen que integra en tiempo real, la videobroncoscopia con la ruta obtenida de la tomografía computada, al igual que lo hace un auto guiado por GPS 2. Una vez alcanzada la lesión, se avanza una vaina que permitirá el retiro de la sonda y su cambio por una pinza de biopsia, con la que se tomarán las muestras necesarias.
Si bien la sensibilidad de ambos métodos ronda el 75% en trabajos multicéntricos (ostensiblemente mejor que con guía fluoroscópica), en la actualidad se estudia el complemento de ellas con otras técnicas para mejorarla. Figura 9.
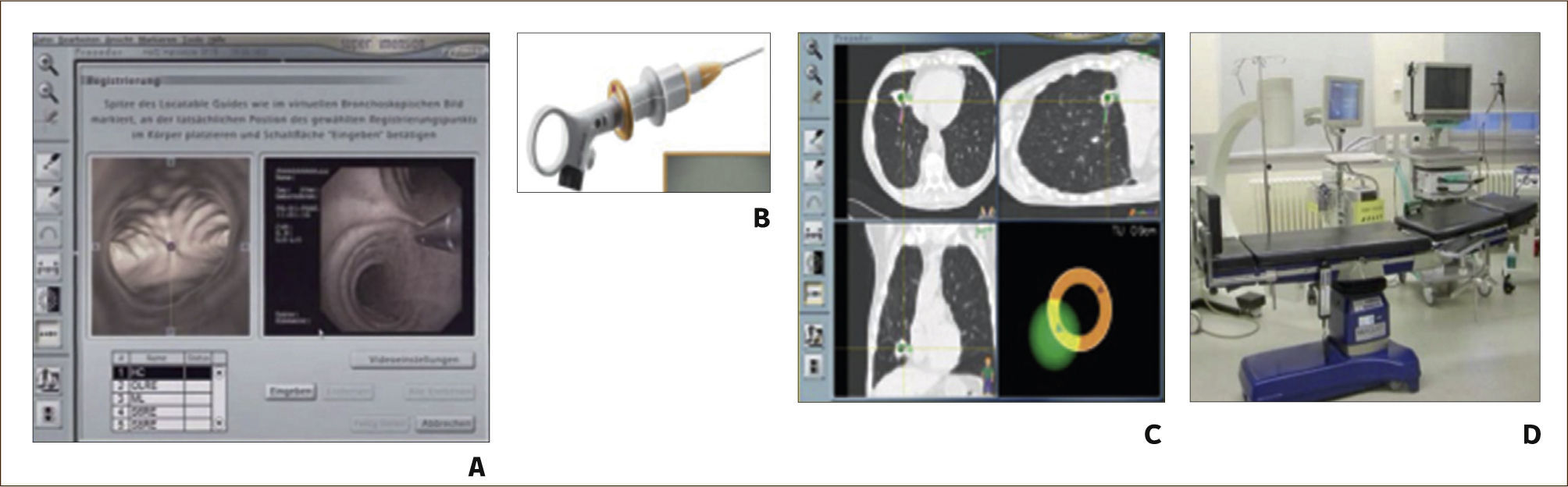
BRONCOSCOPIA CON NAVEGACIÓN ELECTROMAGNÉTICA.
A) Software que convierte las imágenes de la Tomografía Axial Computada en una broncoscopia virtual 3D. B) Mango de dirección del sensor que se introduce por el canal de trabajo del broncoscopio. C) Hoja de ruta hasta la lesión. D) Mesa con tabla generadora del campo electromagnético incorporada 8.
La endoscopia de la vía aérea sigue avanzando a pasos agigantados, permitiendo su estudio y tratamiento de una manera mínimamente invasiva. El gran desafío de los próximos años consiste en expandir su uso y hacerlo accesible a todos los habitantes de nuestro país.
Los autores declaran no tener conflictos de interés, en relación a este artículo.