Desde que se introdujo el concepto, en la década de los 70, de tratar una enfermedad reemplazando en el paciente su DNA dañado por un DNA corregido, la terapia genética ha prometido revolucionar la medicina. El primer modelo de trabajo se probó en ratones en la década de 1980 y, en la década de 1990, se comenzaron a utilizar estrategias de terapias genéticas, con un éxito limitado, para tratar deficiencias inmunitarias y nutricionales. Luego, en 1999, un paciente en un estudio clínico de terapia genética de la Universidad de Pensilvania murió por complicaciones asociadas a una respuesta inmune contra el vector genético. La tragedia detuvo temporalmente todo el campo, el cual se fue recuperando lenta pero sostenidamente, hasta el año 2012, donde el descubrimiento de CRISPR, una tecnología que permite fácilmente hacer modificaciones precisas en genes humanos, revitalizó nuevamente esta área. A continuación, se presentan los conceptos básicos de terapia génica y se realiza un recorrido histórico con los mayores hitos que han ocurrido en los últimos 50 años.
Gene therapy has promised to revolutionize medicine since the concept of treating disease by using viruses to replace damaged DNA in a patient with corrected DNA was introduced in the 1970s. The first working model was tested in mice, in the 1980s. In the 1990s, gene therapy strategies began to be used to treat some immune and nutritional deficiencies, with limited success. Later, in 1999, a patient died in a gene therapy trial due to complications associated with a severe immune response against the gene vector. This tragedy temporarily brought the entire field to a halt. Research recovered slowly but steadily, until 2012, when the discovery of CRISPR, a technology that enables easy and precise modifications of human genes, strongly reinvigorated the entire field. This review presents the fundamentals of gene therapy and a historical journey with the main milestones that occurred in the last 50 years.
El campo de la medicina personalizada y en particular de la terapia génica está viviendo un período excitante y muy prometedor. Las nuevas estrategias terapéuticas en desarrollo permiten vislumbrar un horizonte con tratamientos para enfermedades genéticas, mucho más tangible que lo visible hasta hace no muchos años atrás. Sin embargo, el camino para el desarrollo de estrategias de terapia génica no ha sido simple ni ha estado libre de complicaciones y fracasos. No obstante, los avances, especialmente con la aparición y desarrollo de CRISPR-Cas9, sitúan actualmente a la terapia génica en una posición muy auspiciosa. La terapia génica está dejando de ser una disciplina ligada a la ciencia ficción, y ya con algunos productos en el mercado y muchos otros en diversas fases de estudios clínicos, es realista esperar que nuevas terapias estén disponibles en el futuro cercano.
2Una partida en falsoJesse Gelsinger murió el 17 de septiembre de 1999 a los 18 años como consecuencia directa del uso de una estrategia de terapia génica en un estudio clínico. Jesse sufría una deficiencia de la enzima ornitina transcarbamilasa, una enfermedad del hígado ligada al cromosoma X, cuyos síntomas incluyen la incapacidad de metabolizar el amonio, que es un subproducto del metabolismo de proteínas. Dicha enfermedad es mortal en recién nacidos, pero Jesse no había heredado la enfermedad, sino que fue causada por una mutación espontánea, resultando en un fenotipo menos grave. Jesse podía mantener una calidad de vida decente con una dieta estricta y algunos medicamentos. Jesse fue incluido en una serie de ensayos clínicos realizados por la Universidad de Pensilvania que buscaba el desarrollo de un tratamiento para los recién nacidos con enfermedades severas. El 13 de septiembre, Jesse fue tratado con un adenovirus modificado que portaba la copia correcta del gen, que contrarrestaría su enfermedad. Jesse fue la decimoctava persona en recibir el vector viral modificado. Los pacientes anteriores en el ensayo habían experimentado efectos adversos con síntomas similares a los de una gripe. Jesse, sin embargo, tuvo una reacción adversa severa, muriendo cuatro días más tarde, como consecuencia de una fuerte respuesta inmune causada por el uso del vector adenoviral, lo que le produjo un fallo multiorgánico y muerte cerebral.
La noticia de la muerte de un paciente como consecuencia de un tratamiento experimental, sacudió el campo de la terapia génica y a las ciencias biomédicas. La prensa retrató a los investigadores del ensayo como demasiado ansiosos, ambiciosos y poco cautelosos1. El campo de la terapia genética colapsó rápidamente, cerrándose las investigaciones y estudios clínicos en marcha. En los 20 años transcurridos desde la muerte de Jesse el campo se ha ido recuperado. Hoy en día, empresas públicas y privadas en el mundo han invertido miles de millones de dólares en esfuerzos para curar enfermedades alterando o reemplazando genes defectuosos. Hasta la fecha, estos esfuerzos han producido solo unos pocos productos para terapia génica comercializables: tres terapias para enfermedades hematológicas, un tratamiento que revierte una forma de ceguera hereditaria y, más recientemente, una terapia para la atrofia del músculo espinal2. La innovación se ha acelerado dramáticamente en los últimos años gracias a CRISPR-Cas9, herramienta que ha permitido una edición altamente específica de genes, de forma mucho más barata y rápida que los métodos anteriores. Así, los tratamientos para la hemofilia, la distrofia muscular y otras enfermedades genéticas parecen ahora mucho más alcanzables.
3¿Qué es la terapia génica?Se define como terapia génica a cualquier procedimiento mediante el cual se modifiquen genéticamente las células de un paciente con el propósito de tratar o aliviar una enfermedad3. Acorde con esta definición, queda inmediatamente fuera de esta categoría cualquier estrategia que apunte a una eventual mejora genética distinta a la del tratamiento de una patología (como por ejemplo la búsqueda de un mayor rendimiento deportivo). La modificación genética puede incluir: 1) la introducción de genes ausentes; 2) la inhibición de genes sobre-expresados, y/o; 3) la corrección de genes defectuosos, para restablecer una función celular defectuosa o ausente, interferir con una función celular no deseada, o introducir una nueva función4–7. A diferencia de la farmacología clásica, en terapia génica, tanto el blanco terapéutico como la molécula terapéutica son ácidos nucleicos, DNA o RNA, y el mecanismo de acción ocurre a nivel de la transcripción del DNA a RNA mensajero, o la traducción del RNA mensajero a proteína. El efecto terapéutico de una terapia génica se relaciona directamente con la secuencia de ácido nucleico que se administra, o con el producto de la expresión genética de esta secuencia. Sin embargo, la Agencia Europea de Medicamentos (EMA) excluye a las vacunas contra enfermedades infecciosas como medicamentos de terapia genética, por lo que las vacunas en base a RNA mensajero usadas para el COVID-19 no caen dentro de la categoría de terapia génica.
En terapia génica cobra mucha relevancia la combinación de tres elementos claves: 1) el material genético a transferir; 2) el método de transferencia, y 3) el tipo celular que incorporará dicho material genético. Con respecto a este último punto, las estrategias pueden estar dirigidas a modificar células in vivo donde la entrega directa de material genético se realiza por vía intravenosa o localmente a un órgano específico8, o modificar a células ex vivo, es decir, extraer células específicas de una persona, alterarlas genéticamente en el laboratorio y luego implantarlas nuevamente al paciente8,9. La estrategia a elegir dependerá de la enfermedad específica y de las células involucradas, así como del objetivo final del tratamiento. Por ejemplo, para el tratamiento de células específicas, como las células del ojo, la transferencia génica in vivo funcionará bien para tratar un trastorno que afecte específicamente la estructura o función de los ojos de una paciente. Por otro lado, un tratamiento ex vivo puede ser más adecuado para tratar afecciones que afectan la sangre, como la hemofilia, en el que las propias células madre autorrenovables de un paciente pueden se extraídas, modificadas con un gen funcional y luego re administradas en el paciente 6,8,9.
4¿Cómo funciona la terapia genética?La terapia génica es un enfoque terapéutico que tiene como objetivo agregar, eliminar o corregir material genético para tratar una enfermedad. La modificación del material genético cambia la forma en que la célula produce una proteína. En otras palabras, la terapia génica le otorga a la célula un nuevo conjunto de instrucciones para cambiar la cantidad o el tipo de proteína que produce3,4.
Las estrategias de terapia génica pueden clasificarse en dos categorías: 1) terapia génica de línea germinal y 2) terapia génica somática. La diferencia entre estos dos enfoques es que, en la terapia génica somática, el material genético se inserta en algunas células blanco, pero el cambio no se transmite a la siguiente generación, mientras que, en la terapia génica de línea germinal, el gen terapéutico o modificado se transmitirá a la siguiente generación. Esta diferencia es importante ya que la legislación actual permite la terapia génica solo en células somáticas. En adelante nos referiremos solo a la terapia génica somática.
5Adición génicaLa adición de genes trata las enfermedades al agregar material genético a las células de una persona para compensar un gen faltante o defectuoso3. Esta estrategia generalmente implica la inserción de copias funcionales de un gen (también conocido como transgén) en las células de una persona. Los vectores entregan el transgén a las células del paciente, ya sea in vivo o ex vivo. Más adelante se presentarán los tipos de vectores disponibles para transferir genes en una célula. Una vez dentro de la célula, el transgén proporciona a la célula instrucciones que conducen a la producción de proteínas funcionales. Con la terapia de adición de genes, el gen mutado no necesita ser reemplazado ni eliminado5,6. La adición génica permite tratar enfermedades monogénicas. Algunas de estas enfermedades que afectan a un solo gen incluyen las hemoglobinopatías, como la anemia de células falciformes y la talasemia. Las áreas adicionales que se están estudiando para la terapia génica de adición son las enfermedades pulmonares, como la fibrosis quística, y las enfermedades de la sangre, como la hemofilia9–11.
6Edición génicaLa edición de genes trata las enfermedades modificando directamente el DNA de un paciente a través de varias técnicas que incluyen la inactivación o alteración de genes (también denominada silenciamiento génico), y corrección génica3. En las estrategias de edición génica, no se agrega el gen corregido, sino que se busca la generación de quiebres o rupturas específicas en el DNA de un paciente, con o sin las instrucciones para una reparación posterior5,12. Las rupturas generadas en el DNA del paciente buscan “inactivar” el gen defectuoso responsable de la enfermedad6. En algunas enfermedades, las mutaciones pueden hacer que el gen exprese proteína en exceso, que pueden acumularse en órganos clave del cuerpo y provocar los síntomas de una enfermedad. Apagar o inactivar el gen sobreexpresado puede detener su actividad y tratar la enfermedad2,3. Las rupturas en el DNA pueden también ser reparadas por la maquinaria de reparación intrínseca de las células. Si la ruptura se realiza en la región donde se ubica la variante genética patogénica responsable de la enfermedad, es posible corregir dicha ruptura proporcionando una plantilla correctiva o “insertando” nuevo material genético para que la célula lo utilice para reparar el gen mutado permitiendo así corregir o anular7. Esta forma de terapia, aún en fase experimental, puede jugar un papel importante en el futuro si se resuelven algunos problemas intrínsecos de la estrategia que se mencionarán posteriormente. Sin embargo, existen ejemplos promisorio de este tipo de estrategia experimental en células hematopoyéticas para el tratamiento de la beta-talasemia y anemia falciforme13.
7Vectores: herramientas para la entrega de genesComo se ha mencionado, la terapia génica funciona mediante la introducción del material genético en el núcleo celular. El sistema utilizado para entregar material genético se conoce como vector. Entonces, un vector es un vehículo de reparto microscópico que despacha paquetes de material genético a direcciones específicas que son las células blanco3,14. Existen 2 tipos de vectores, los vectores virales y no virales.
7.1Vectores no-viralesLos vectores no virales utilizan métodos físicos o químicos para introducir el material genético en una célula. Los métodos químicos utilizan materiales naturales o sintéticos, compatibles con el cuerpo humano, por lo que la probabilidad de generar una respuesta inmunitaria es baja. Estos incluyen moléculas lipídicas, polímeros y nanopartículas15. Los vectores no virales más activamente investigados incluyen los vectores basados en polímeros lipídicos que encapsulan al transgén, protegiéndolo de la degradación y entregándolo al interior celular al fusionarse con la membrana celular que también es de naturaleza lipídica. Debido a que los polímeros lipídicos son rápidos de fabricar, eficientes y escalables al tamaño del material que se entrega, tienen muchos usos potenciales en terapia génica16. La electroporación es una técnica física basada en el uso de pulsos eléctricos para formar poros en la membrana celular, lo que permite la introducción del material genético17. Aunque la electroporación se ha explorado in vivo, los ensayos clínicos recientes administran la terapia génica mediante la electroporación en las células del paciente fuera del cuerpo (ex vivo). Ésta y otras formas físicas de administrar terapia génica, incluido el DNA balístico (también llamado “pistola de genes”), que usa la fuerza, disparando nanopartículas de oro cubiertas con el transgén), la sonoporación (que usa el sonido) y la fotoporación (que usa la luz) son un campo de activa investigación y desarrollo15.
7.2Vectores viralesLos virus proporcionan un modelo ideal para administrar un transgén en una estrategia de terapia génica. El diseño natural de los virus los hace muy eficaces en ingresar a una célula. Actualmente se conoce el genoma completo de muchos virus. Con esta información, es posible aislar las partes del genoma del virus que los hacen tan eficaces en ingresar a las células, y eliminar aquellas partes que causan una enfermedad o que permiten la replicación del virus en el interior de la célula. Así, como un caballo de Troya genético, se pueden utilizar algunos componentes del virus original como su cápside o envoltura, que por sí solas no son capaces para causar una infección viral, reemplazando su contenido con el transgén terapéutico6,14. Actualmente, los vectores virales son el vehículo más utilizado en las estrategias de terapias génicas aprobadas por la FDA14.
Si bien existen varios tipos virales, la elección de un vector se basa en características como la duración de la expresión génica, el tamaño del material genético que se puede administrar, las células blanco a la cual se desea llegar, y la inmunogenicidad3.
7.3Vectores lentivirales (LVV)Los vectores lentivirales son una especie de retrovirus. El lentivirus mejor estudiado es el VIH. Los vectores lentivirales tienen la capacidad de ingresar a la célula e insertar su material genético en células en activa división, como las células madre, y células que no se dividen, como las células cardíacas. Los lentivirus integran su material genético en el genoma del huésped. Esta integración significa que el material genético tiene una mayor durabilidad, lo que permite una expresión continua del transgen6,18,19. Los lentivirus se han utilizado ampliamente como vectores de administración de genes desde mediados de la década de 199020,21. Desde entonces, se han desarrollado nuevas generaciones de vectores lentivirales, con mejoras en la seguridad y estabilidad de la expresión génica. Poletti y Mavilio presentan una reciente revisión sobre el diseño de vectores lentivirales para el tratamiento de enfermedades genéticas22.
7.4Vectores adenovirales (AdV)El primer vector viral utilizado en la terapia génica se basó en el adenovirus, que es un virus que causa el resfriado común. Se descubrió que algunos AdV desencadenan reacciones inmunes fuertes y potencialmente peligrosas en los pacientes. Sin embargo, una investigación considerable ha ayudado a comprender estas respuestas inmunitarias y los AdV se han mostrado prometedores en el tratamiento del cáncer. Aún se están explorando más investigaciones sobre el uso de AdV23. Los adenovirus se utilizaron por primera vez para la entrega de genes a mediados de la década de 1950, y su uso destaca en la investigación y desarrollo de tratamientos para tumores cancerosos, tratamientos de patologías vasculares y vacunas24,25.
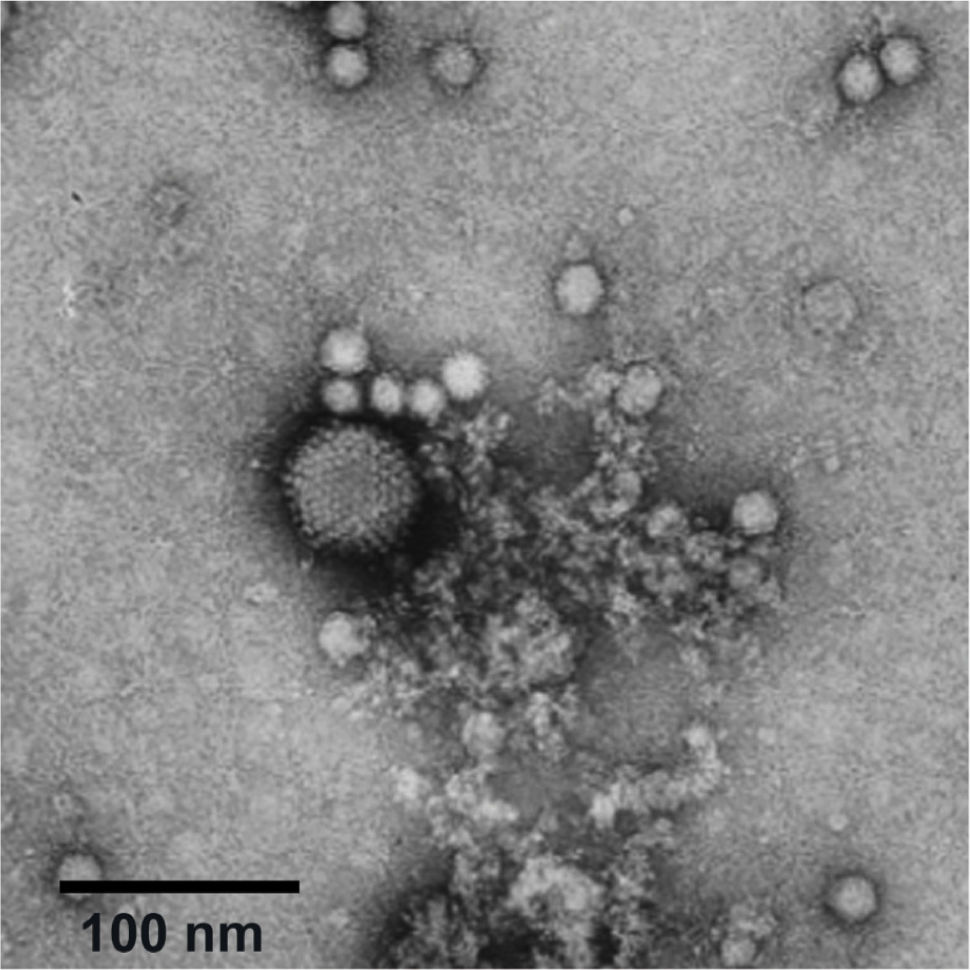
7.5Vectores virales adeno-asociados (AAV)Los estudios con adenovirus llevaron al descubrimiento de los AAV en la década de 1960 al aparecer en imágenes de microscopía electrónica como pequeñas partículas icosahédricas junto a los adenovirus (ver fig. 1)26,27. Los virus adenoasociados son virus muy pequeños, pertenecen a la familia de los parvovirus, y como su nombre lo dice, están asociados o dependen de los adenovirus para replicarse. Es decir, no son autónomos, y aunque los AAVs están extendidos en la población humana, no están asociados con ninguna enfermedad conocida. Estas características convierten a los AAV en el vector viral más utilizado en terapia génica, y en una amplia variedad de ensayos clínicos. Hay muchos tipos diferentes de AAV. Cada tipo tiene una propiedad diferente que les permite dirigirse a diferentes células, que van desde las células renales hasta las neuronas del cerebro28–30.
Adenovirus y virus adenoasociado. La microfotografía electrónica muestra un adenovirus rodeado de virus adenoasociados. Los virus adenoasociados son virus pequeños que dependen del adenovirus para poder infectar. Son de tamaño pequeño, no generan una respuesta inmune y no se han asociado a enfermedades en humanos. Los virus adeno-asociados son una gran herramienta para terapia génica ya que su modificación en el laboratorio permite utilizarlos como vectores para la entrega de material genético en una gran diversidad de tipos celulares. Imagen editada de http://www.virology.net/Big_Virology/BVDNAparvo.html.
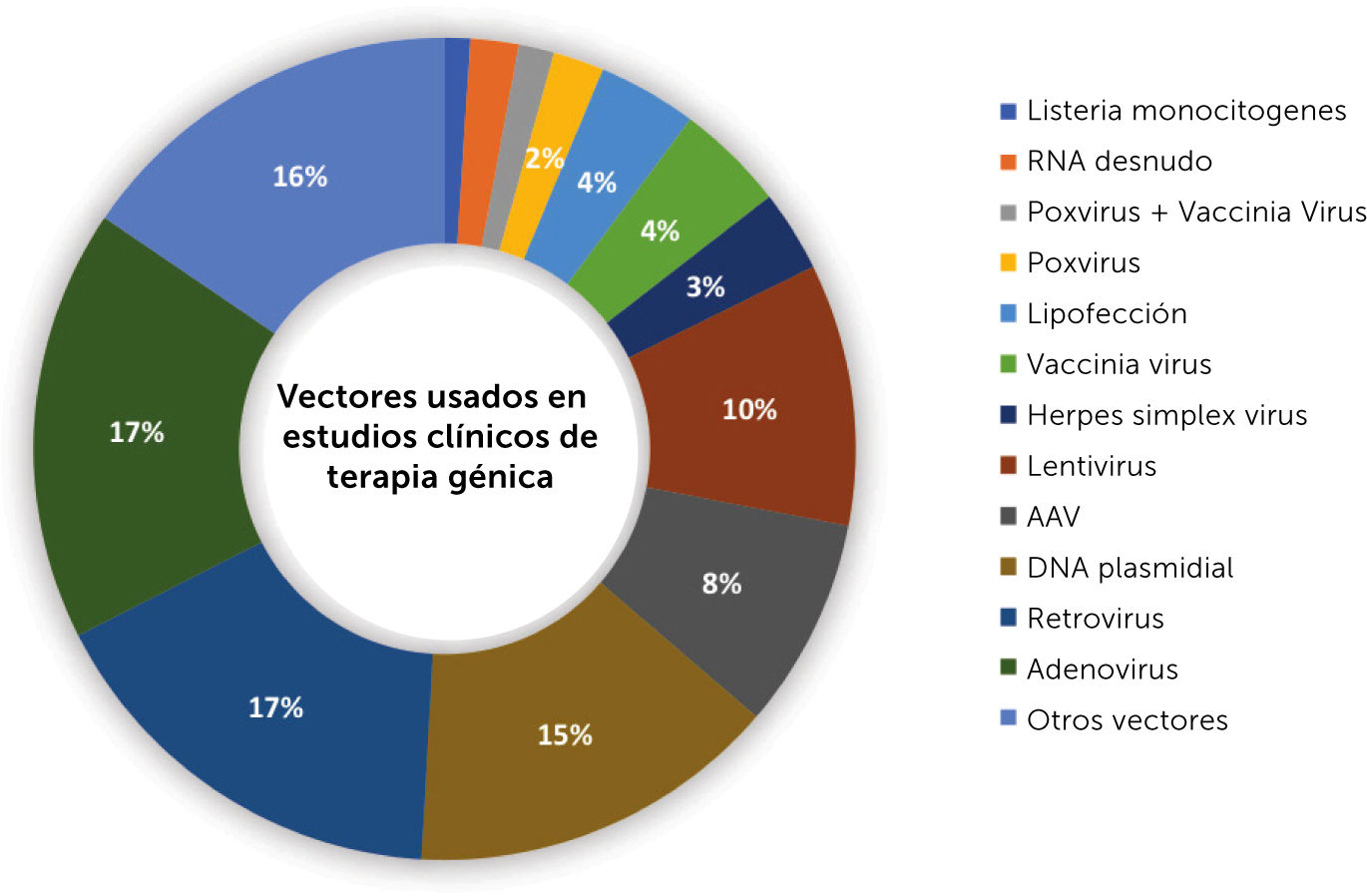
Los LVV son vectores integradores; el material genético entregado se integra permanentemente en el DNA de las células del huésped. Una ventaja de la integración es que, aunque las células se dividan, el material genético no se diluye en cada ciclo de división celular, ya que se convierte en parte integral del DNA de la célula original, y en consecuencia de cada nueva célula hija también. Esto significa que la expresión del transgén es duradera y, con el tiempo, puede seguir ofreciendo los mismos beneficios terapéuticos que cuando se entregó por primera vez27,28. Los AAV no integran el material genético en las células del huésped, y, por lo tanto, el efecto del tratamiento disminuye en el tiempo ya que el transgén se diluye cada vez que las células se dividen. Sin embargo, en las células que no se dividen, la expresión genética es duradera. Además, los AAV no son inmunogénicos, y diferentes tipos de AAV pueden infectar diferentes tipos de células. Debido a esto, los AAV se utilizan ampliamente en estrategias de terapia génica hoy en día para atacar diferentes enfermedades según los tipos de órganos y tejidos a los que afectan27,28. Los AdV tienen una mayor capacidad de empaquetamiento de material genético que los AAV, lo que implica que pueden transportar genes más grandes. Los AdV también tienen altos niveles de expresión de proteínas en comparación con el bajo nivel de expresión de proteínas de los AAV. Con respecto al inicio de la expresión del transgén, y en consecuencia del eventual efecto terapéutico, los AdV pueden iniciar la expresión de 16-24 horas después de la infección, mientras que los AAV tardan entre 3-21 días29. Uno de los principales beneficios de los AAV es que tienen un nivel muy bajo de desencadenar una respuesta inmune, mientras que los AdV generalmente desencadenan una alta respuesta inmune por lo que cualquier estrategia terapéutica debe considerar el manejo clínico de la respuesta inmunitaria29. La fig. 2 presenta un gráfico adaptado con los principales vectores utilizados en ensayos clínicos de estrategias de terapia génica en la actualidad31.
9Potenciales riesgos de la terapia génicaComo con cualquier tratamiento, existen riesgos asociados con la terapia génica. El riesgo depende del tipo de terapia génica, el tipo de vector utilizado para administrar la terapia génica, y el método de administración32. Los principales riesgos incluyen: 1) Reacción inmune: una reacción inmune al sistema de administración de la terapia génica o la proteína terapéutica podría hacer que la terapia sea menos eficiente. Además, los anticuerpos contra el sistema de administración de terapia génica pueden evitar que se administre una eventual segunda dosis32; 2) Mutagénesis de inserción: la utilización de vectores que inserten el transgén en ubicaciones no deseadas en el genoma del huésped puede resultar en una división celular descontrolada u oncogénesis de inserción32; 3) Inactivación involuntaria de otros genes con funciones importantes32.
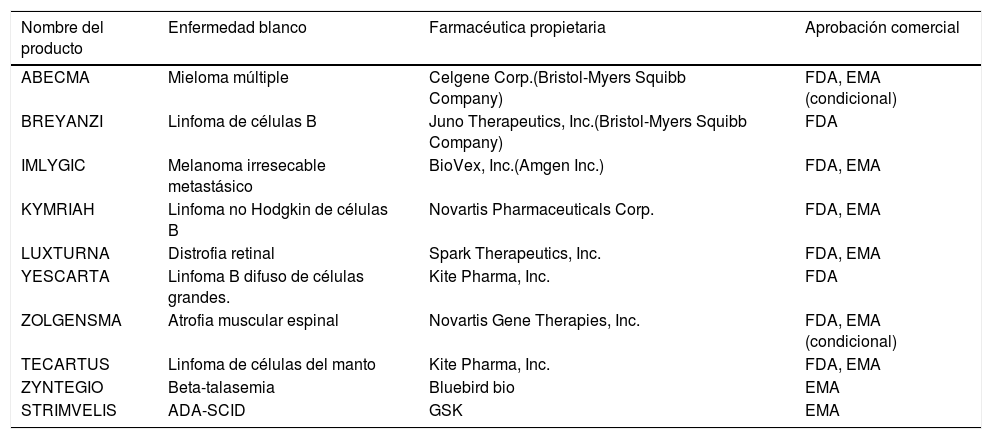
10Recorrido históricoLa mayoría de los investigadores creían que la terapia génica era posible desde el principio. Pero ha llevado décadas de trabajo, una mejor comprensión de la genética de los vectores virales, sus interacciones con el genoma celular y el desarrollo de técnicas con el potencial de tratar enfermedades hereditarias y cánceres a nivel genético. En los últimos años, la terapia génica ha avanzado mucho. Ahora, continúa avanzando desde la investigación hasta las posibles aprobaciones de la Administración de Drogas y Alimentos de los EE.UU. (FDA), con el objetivo final de servir a las poblaciones de pacientes que pueden beneficiarse. Hasta la fecha, la FDA ha recibido más de 900 solicitudes para investigar estrategias de terapia génica en ensayos clínicos, pero solo 10 productos han sido aprobados por la Food and Drug Administration (FDA) en EE.UU., y/o en Europa por la European Medicines Agency (EMA)2,33. La tabla 1 reúne los productos de terapia génica aprobadas.
Productos de terapía génica con aprobación comercial en EE.UU. y UE
| Nombre del producto | Enfermedad blanco | Farmacéutica propietaria | Aprobación comercial |
|---|---|---|---|
| ABECMA | Mieloma múltiple | Celgene Corp.(Bristol-Myers Squibb Company) | FDA, EMA (condicional) |
| BREYANZI | Linfoma de células B | Juno Therapeutics, Inc.(Bristol-Myers Squibb Company) | FDA |
| IMLYGIC | Melanoma irresecable metastásico | BioVex, Inc.(Amgen Inc.) | FDA, EMA |
| KYMRIAH | Linfoma no Hodgkin de células B | Novartis Pharmaceuticals Corp. | FDA, EMA |
| LUXTURNA | Distrofia retinal | Spark Therapeutics, Inc. | FDA, EMA |
| YESCARTA | Linfoma B difuso de células grandes. | Kite Pharma, Inc. | FDA |
| ZOLGENSMA | Atrofia muscular espinal | Novartis Gene Therapies, Inc. | FDA, EMA (condicional) |
| TECARTUS | Linfoma de células del manto | Kite Pharma, Inc. | FDA, EMA |
| ZYNTEGIO | Beta-talasemia | Bluebird bio | EMA |
| STRIMVELIS | ADA-SCID | GSK | EMA |
1973: Se descubrió una técnica de ingeniería genética que permite que el material genético de un organismo sea introducido, replicado y expresado artificialmente en otro34. El DNA se insertó en un plásmido (una estructura de DNA circular que puede replicarse sin un cromosoma), que luego se introdujo en una bacteria E. coli. Cuando la bacteria se reprodujo, replicó el DNA introducido, manteniendo su material genético original.
1980: Una de las primeras veces que se probó la terapia génica en 2 pacientes con beta-talasemia, un trastorno sanguíneo hereditario poco común, transfiriéndoles el gen de la beta-globina a sus células. Sin embargo, la estrategia no funcionó porque las células no se replicaron. Pero lo más grave fue que la estrategia se realizó sin el permiso de la universidad a la que se le proporcionaron los fondos por el Instituto Nacional de Salud de EE.UU. (NIH). El investigador perdió múltiples subvenciones y el NIH advirtió que la experimentación humana no sería tolerada35.
1990-95: El primer ensayo clínico de terapia génica se llevó a cabo en pacientes con inmunodeficiencia combinada grave, utilizando una nueva tecnología de vectores virales basados en retrovirus. Los resultados fueron mixtos, con 1 respuesta modesta y 1 respuesta limitada36. Otros estudios también reportaron resultados promisorios37,38.
1996: La primera generación de vectores lentivirales (LVV) se creó utilizando 3 plásmidos diferentes que contenían una porción desactivada del genoma del VIH, por lo que era poco probable que el VIH se replicase en las células humanas39. LVV de segunda y tercera generación siguieron un par de años más tarde, con una menor cantidad del genoma original del VIH ya que se les fueron extrayendo porciones de DNA importantes para su virulencia, reduciendo así características patogénicas del virus parental, sin afectar su capacidad como vector40,41.
1999: Luego de la muerte de Jesse Gelsinger, primera muerte asociada a una estrategia de terapia génica, la FDA y el NIH crearon nuevos programas, el Plan de Monitoreo de Ensayos Clínicos de Terapia Génica y los Simposios de Seguridad en la Transferencia Genética, en un esfuerzo por garantizar la seguridad y transparencia de los ensayos clínicos de terapia génica. La protección adicional del paciente causó retrasos en la investigación en ese momento, pero ha llevado a un mayor énfasis en la seguridad y el intercambio de datos en los esfuerzos de investigación de terapia génica desde entonces1.
2000: Un ensayo clínico de terapia génica con un retrovirus generó preocupación sobre la seguridad de la inserción de genes42,43. Se trataron pacientes con inmunodeficiencia combinada grave ligada al cromosoma X. De los 10 pacientes enrolados en el estudio, 9 fueron tratados, pero 4 de los 9 pacientes desarrollaron leucemia. Este estudio demostró la necesidad de mejorar los vectores virales en la terapia génica.
2001: La FDA aprobó el primer ensayo clínico en humanos (NCT00295477) que utilizó un LVV para probar la seguridad y tolerabilidad de una sola transducción en pacientes con VIH44. La prueba de fase 1 se completó con éxito, lo que abrió la puerta a más investigaciones con LVV, incluida una prueba de fase 2.
2003: La Administración Nacional de Productos Médicos de China, aprobó la primera terapia génica disponible comercialmente en el mundo para tratar el carcinoma de células escamosas, una forma de cáncer de piel45,46.
2009: En un ensayo clínico, se trató una enfermedad ocular genética con un vector viral adenoasociado (AAV). Ocho años después, este ensayo fundamental llevó a la aprobación de la FDA de la primera terapia génica en los EE.UU.47. En el 2009 también se presenta la primera aplicación clínica de una terapia para la corrección de una enfermedad neurometabólica utilizando vectores lentivirales en células troncales hematopoyéticas48.
2010: Un LVV autoactivante se utilizó por primera vez en ensayos clínicos de terapia de adición de genes en hemoglobinopatías21.
2012: La Agencia Europea de Medicamentos (EMA) aprobó la primera terapia de adición de genes utilizando un AAV para el tratamiento de la deficiencia de lipoproteína lipasa49. Esta terapia génica se retiró del mercado posteriormente en 2017 debido a su uso limitado50.
2012: Se desarrolló una técnica de edición de genes llamada CRISPR-Cas9 que puede modificar secuencias de DNA específicas51.
2016: La EMA aprobó la primera terapia de adición de genes basada en retrovirus para tratar la inmunodeficiencia combinada grave con adenosina desaminasa (ADA-SCID). Esta terapia contiene células CD34+ transducidas con un vector retroviral que codifica la secuencia de DNA complementario de ADA humana52.
2017: La FDA aprobó la primera terapia de adición de genes in vivo para tratar a pacientes con una forma rara de ceguera hereditaria llamada distrofia retiniana bialélica asociada a la mutación del gen RPE6553.
2017: La FDA aprobó una terapia con células CAR-T para el tratamiento de pacientes con linfoma de células B grandes en recaída/refractario (R/R DLBCL)54.
2018: Se inició el primer ensayo clínico con CRISPR-Cas9 (NCT03655678). Este estudio investiga el uso de CRISPR-Cas9 para la alteración genética en las hemoglobinopatías beta13.
2019: La FDA aprobó una terapia de adición génica in vivo basada en AAV para la atrofia muscular espinal55.
2019: La EMA respaldó una terapia de adición génica ex vivo basada en LVV para una enfermedad genética llamada beta-talasemia dependiente de transfusiones56, reportando que no había evidencia de desarrollo de leucemia mieloide aguda en los pacientes que recibieron el vector viral. Se concluye que los beneficios de la terapia génica superan los riesgos.
2020: La FDA finalizó 6 pautas de terapia génica que incluyen un borrador de pautas para la investigación y el desarrollo clínico de terapias génicas57.
2021: Una recién nacida de 4 días recibió terapia génica in vivo para la atrofia muscular espinal, lo que la convierte en la paciente más joven hasta la fecha en recibir terapia génica58.
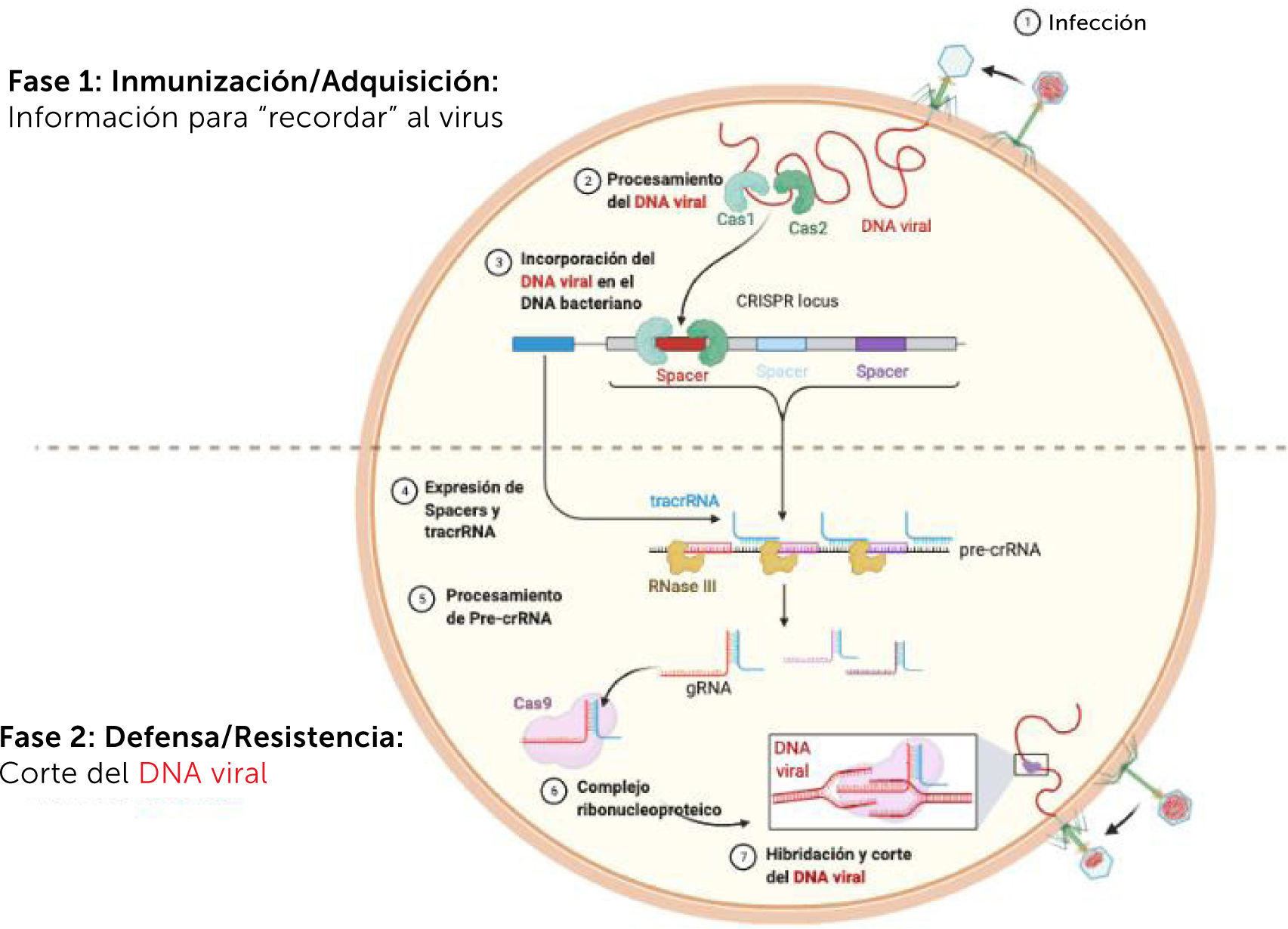
11CRISPR-CAS9CRISPR es el acrónimo del inglés para “Clustered Regularly Interspaced Short Palindromic Repeats” que en castellano significa “repeticiones palindrómicas cortas, agrupadas y espaciadas regularmente” Pero ¿qué es CRISPR y porqué es tan relevante para la terapia génica? CRISPR es un sistema biológico descubierto en bacterias, utilizado para protegerse de la infección de bacteriófagos (virus que infectan bacterias). Comúnmente se describe al sistema CRISPR como un sistema inmune rudimentario de las bacterias. Brevemente, las bacterias, al ser infectadas por un bacteriófago, son capaces de copiar fragmentos del DNA viral e integrarlo en su propio genoma, y, por lo tanto, perpetuarlo en las colonias de bacterias sucesivas. Si el bacteriófago volviese a infectar las colonias bacterianas que contienen el fragmento viral integrado expresarán proteínas especiales capaces de cortar DNA (nucleasas), y con ayuda de un RNA guía, generado a partir del DNA integrado en la infección inicial, formarán una molécula compuesta de RNA y proteína (ribonucleoproteína) capaz de dirigirse específicamente al segmento del DNA viral que fue copiado inicialmente, cortándolo y, por lo tanto, inactivando al virus (fig. 3). La analogía con un sistema inmunitario es evidente. El descubrimiento del sistema CRISPR-Cas9 le valió el premio Nobel de Química a Jennifer Doudna y Emmanuelle Charpentier en el año 202059. El sistema CRISPR-Cas9ha sido vigorosamente estudiado, adaptado y modificado, permitiendo su uso en humanos13 y animales. Actualmente, CRISPR no solo permite el corte e inactivación de genes sino su edición y reparación, de forma simple, efectiva y específica (Leonova y Gainetdinov60 presentan una buena revisión sobre el uso de CRISPR/Cas9 en medicina). La combinación de CRISPR y AAVs prometen grandes avances en materia de terapia génica en los próximos años, con potencial uso en la cura de la infección por VIH, y síndromes genéticos hereditarios61.
Funcionamiento del sistema CRISPR/-Cas9. El llamado “sistema inmune de las bacterias” es un mecanismo por el cual se reconoce el genoma de un virus que infecta a bacterias (bacteriófago), se inactiva y se destruye, al mismo tiempo que una parte de ese genoma viral se incorpora al genoma de la bacteria, para así generar una protección más eficiente frente a futuras infecciones. En la primera fase, (1) un bacteriofago infecta e introduce su DNA en una bacteria. (2) Luego, un tipo de proteínas Cas reconocen al DNA viral, y (3) integran un pequeño fragmento en el genoma bacteriano. Este fragmento servirá de “memoria” para futuras infecciones. En respuesta a una nueva infección estos fragmentos (4) se expresan y (5) se procesan, formándose (6) un complejo ribonucleoprotéico (RNA+proteínas) que consiste en proteínas Cas que portan unido un pequeño crRNA (“cr” por CRISPR) que es mucho más eficiente en su unión al DNA viral. Cuando la bacteria es infectada nuevamente por el mismo virus, (7) al DNA viral se le une el complejo crRNA/Cas, fragmentándose el DNA viral para luego ser degradado.
En Chile se han llevado a cabo estudios en fase preclínica con estrategias de terapia génica. Se ha estudiado estrategias de terapia génica para el tratamiento del alcoholismo62, diabetes mellitus mediante el uso de AAV63, y enfermedades neurodegenerativas64. Sin embargo, el paso de estudios en fase preclínica a fases clínicas requiere de una capacidad y financiamiento difíciles de alcanzar por universidades o centros de investigación locales sin el apoyo de otras fuentes de financiamiento. Las opciones más realistas son el desarrollo de estrategias que puedan ser patentadas y posteriormente licenciadas para su desarrollo en centros con capacidad de realizar estudios clínicos65. Pese a esto, herramientas como CRISPR están acercando el mundo de la investigación de laboratorio con el mundo de la clínica y los pacientes, lo que da mayor esperanza para el desarrollo de terapias génicas en un futuro no tan lejano.
13ConclusionesLa terapia génica ha recorrido un camino sinuoso desde sus primeros ensayos de prueba de concepto en humanos en la década de 1990, con algunos efectos adversos devastadores, pero también con algunos éxitos notables. Esos altibajos extremos se han estabilizado, y ahora la terapia génica ha comenzado a avanzar a un paso firme y sostenido. Se han aliviado algunos casos de ceguera, se ha abordado la causa subyacente de la anemia de células falciformes y se han comenzado a tratar trastornos congénitos, como la atrofia muscular espinal, que de otro modo podrían ser letales. El casi milagroso potencial curativo de la terapia génica trae consigo una abundancia de esperanza. Sin embargo, con esa esperanza vienen otros problemas: problemas de sobreexpectación, de asequibilidad y de accesibilidad. Los enfoques actuales de la terapia génica son costosos y no están fácilmente disponibles, aspectos que limitan su posible alcance. Resolver estos problemas puede ser el próximo gran desafío del campo.
Declaración de conflicto de interésEl autor declara no tener conflictos de intereses.