Las complicaciones mecánicas de los accesos venosos centrales son frecuentes, 2 a 15% y en ocasiones pueden comprometer la vida del paciente. Hay factores que determinan el riesgo de una u otra, que pueden ser modificados o enfrentados de diferente forma para minimizarlo.
En esta puesta al día se describen las complicaciones más frecuentes o de mayor gravedad como son: el neumotórax, la embolia aérea, mal-posición del catéter, perforación de grandes venas, punción arterial, arritmias, trombosis venosa asociada a catéter venoso central (CVC) y oclusión del CVC; algunos elementos de prevención, diagnóstico y tratamiento así como el impacto que puede tener la ultrasonografía rutinaria para instalar un CVC.
Mechanical complications of central venous access are frequent, 2 to 15% and occasionally may become life threathening. There are many risk factors that can be handled to increase the safety of the procedure.In this update there is a description of the commonest and the most serious complications as : pneumothorax, air embolism, catheter malposition, great veins perforations, accidental arterial puncture, arrhythmia, vein thrombosis related to central access and central venous catheter (CVC) occlusion; some prevention strategies, diagnostic and treatment and the impact of routinely use ultrasound guidance during CVC placement.
La instalación de CVC es un procedimiento invasivo y como tal no exento de potenciales complicaciones que pueden ocurrir en el 2 a 15% (1). Estas pueden ser menores y producir sólo inconvenientes, como retardo en el inicio de terapias específicas para lo cual se requiere el CVC, hasta mayores que incluso pongan en riesgo la vida del paciente (2, 3).
La seguridad de los pacientes es de suprema importancia, los pacientes deben recibir siempre el mejor cuidado, por ello es preciso que quienes instalan CVC estén familiarizados con sus complicaciones para prevenirlas, reconocerlas y manejarlas en forma oportuna y adecuada.
Para manejar el riesgo de complicación de un procedimiento determinado, del punto de vista operativo se puede sistematizar el procedimiento en factores. Para la instalación de un CVC se puede hablar de factores dependientes del operador, factores dependientes del paciente y factores dependientes del tipo de catéter a usar y que en mayor o menor medida determinan el riesgo de una complicación en particular y pueden incidir en su prevención (1, 2) (Tabla 1).
Factores que inciden en las complicaciones mecánicas en CVC
| Factores del Operador: | Experiencia. Uso de Ultrasonido. Uso de Radioscopia. |
| Factores del paciente: | Cardiopatías. I. Respiratoria. I. Renal Crónica. Coagulopatías. Edad. Peso. Radioterapia. Ubicación. Punciones previas. Estado de conciencia. Ventilación Mecánica. |
| Factores del catéter: | Tipo. Tamaño. |
Así por ejemplo, si se necesita un CVC en un paciente en falla respiratoria aguda en ventilación no invasiva, obeso, sin apoyo de imágenes para la instalación y con un operador poco experimentado que intenta un acceso subclavio; hay un determinado riesgo de neumotórax. Este riesgo se podría acotar con: uso de ultrasonografía, concurrencia de un operador experimentado y la elección del acceso yugular.
Se van a revisar las complicaciones más frecuentes o que revisten mayor gravedad en relación a los accesos venosos centrales, algunos elementos diagnósticos y de prevención y manejo.
NeumotóraxEs una complicación frecuente de la inserción de un CVC, con una incidencia estimada de 1,5-3,1% para de acceso subclavio (4, 5). Es raro en la cateterización de la vena yugular interna (VYI), pero también ocurre 0<.1 a 0.2%, especialmente con punciones anteriores bajas o posteriores (6).
Consiste en la presencia de aire en la cavidad pleural; entre el pulmón y la pared torácica (7) y es causado por la punción accidental de la membrana pleural con pérdida de su integridad dejando comunicados, a través de la vía aérea, la atmósfera con el espacio pleural y por la subsecuente pasada de aire de la atmósfera hacia la cavidad pleural de menor presión.
Puede ser causado por la aguja, la guía, el dilatador o el catéter usados para el acceso yugular o subclavio.
El diagnóstico de un neumotórax es a menudo tardío por lo que el operador debe estar atento. Cuando es pequeño, asintomático, a menudo puede no requerir tratamiento y se resuelve en forma espontánea, pero también se puede presentar como una emergencia y debe ser sospechado, diagnosticado y tratado prontamente.
Sospecha Clínica: La aspiración de aire con la jeringa durante una punción subclavia ya es sospechoso de pérdida de la indemnidad pleural.
Los síntomas de un neumotórax incluyen, disnea, taquicardia, hipotensión, agitación, tos seca, dolor pleurítico o dolor de hombro.
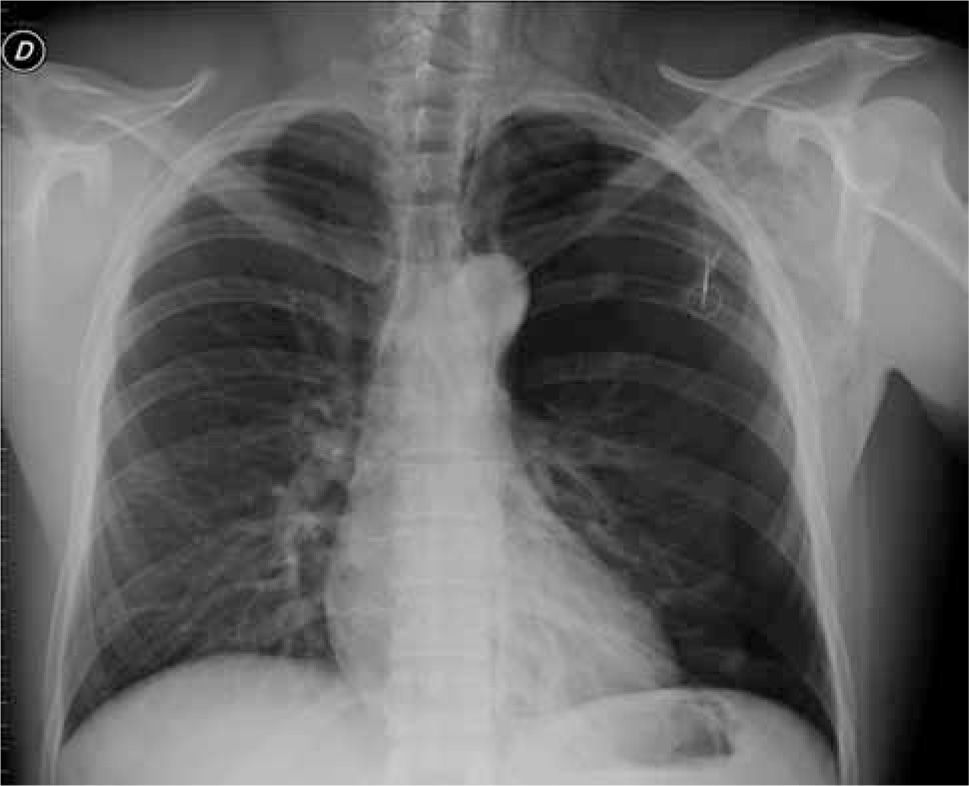
La Rx de tórax es característica (Figura 1), no obstante a veces la precocidad del examen para control de la ubicación del CVC no da tiempo para evidenciar la separación de las pleuras.
Por lo tanto una vez que hay sospecha clínica se debe indicar repetir el examen para diagnóstico, aún con una Rx de tórax previa normal.
Prevención: Los pacientes con mayor riesgo de neumotórax son aquellos que presentan insuficiencia respiratoria ya sea ventilados o no. Es deseable en estos casos evitar las punciones subclavias en favor de acceso yugular y en caso de no tener alternativas el concurso de un operador experimentado.
Un acceso extra-torácico que puede ser más seguro es el abordaje axilar bajo visión de ultrasonografía (8).
Manejo: Cuando el neumotórax es pequeño se puede resolver espontáneamente y basta con observación clínica y control de imágenes diario. Si el paciente experimenta dificultad respiratoria debe iniciar aporte de O2, monitoreo con SpO2 y hemodinámico mientras se avisa al cirujano correspondiente para evaluar la instalación de un drenaje pleural. Cuando ocurre en el paciente ventilado con presión positiva, en general requiere la instalación de un drenaje pleural para evitar la ocurrencia del neumotórax hipertensivo.
Embolia aéreaEs difícil determinar la incidencia real de Embolia Aérea (EA) relacionada a CVC pues la mayoría de las veces cursa en forma subclínica, sin resultar en repercusiones severas y por lo tanto no es notificado. No obstante, la instalación o retiro de un CVC puede hacer que pequeñas cantidades de aire entren a la circulación venosa por lo que, de un punto de vista operativo, este procedimiento se considera con riesgo relativo alto para EA, con incidencia mayor al 25% (9). Cuando producto de EA, se busca repercusiones clínicas severas hay reportes de 0.13 % (10) de incidencia.
El aire se distribuye según la posición del paciente, siguiendo el flujo de la sangre y la gravedad ubicándose en los lugares más altos, usualmente no causa mayores problemas, entra a la circulación pulmonar y allí se reabsorbe.
Diferente es la situación al pasar a la circulación arterial, como embolia paradojal, donde al alojarse en arterias cerebrales puede producir un accidente isquémico transitorio o incluso un accidente cerebro-vascular, el 20% de los pacientes presenta foramen oval permeable (11).
Un paciente en ventilación espontánea puede en forma inadvertida aspirar significativas cantidades de aire a la circulación venosa a través del orificio producido por un trócar o un dilatador, cuando la presión intratorácica llega a ser menor que la atmosférica, por ejemplo, si el paciente tose, llora, ríe, o inspira profundo, el cambio en la presión intratorácica generar un aspirado de 10 a 15 cc de aire resultando en embolia aérea.
La morbilidad y letalidad de la EA está directamente relacionada al volumen de aire y a la velocidad de acumulación. Estudios animales han escrutado el volumen necesario para producir colapso circulatorio, así, un bolo de aire de 0,5 a 0.75ml/k de peso en conejos (12) y 7,5 a 15ml/k en perros (13) son letales. En seres humanos hay reportes de colapso circulatorio con 150 a 300ml (14), pero no hay una dosis letal establecida.
La EA ocurren en la inserción o al remover el catéter. Durante la inserción se puede producir entrada de aire por el trócar en el lapso de tiempo que transcurre antes de la instalación de la guía y posterior al retiro de la misma (10).
Durante la remoción de un catéter puede ocurrir EA mientras es retirado de la vena o por la brecha dejada por catéter.
Prevención durante la inserción del catéter: Una técnica rigurosa, adecuada evaluación del paciente y conocimiento de los factores que reconocidamente aumentan la probabilidad de este evento son vitales. Un paciente bien hidratado y asegurarse que la vena en cuestión está bajo el nivel del corazón en el momento del procedimiento es básico. Los pacientes con accesos venosos en la mitad superior del cuerpo deben estar en posición de Trendelemburg, mientras aquellos con accesos en las femorales deben estar en posición de Fowler.
Es importante mantener la posición de Trendelemburg cuando se introduce el catéter en VCS (15), al aumentar el llene aumenta la presión venosa y por consiguiente disminuye el gradiente a favor de la entrada de aire atmosférico.
En caso de pacientes hipo-volémicos y aquellos que no toleran la posición de Trendelemburg, la maniobra de Valsalva durante los lapsos de tiempo deseados; para puncionar la vena, introducción de la guía, retiro del dilatador de una vaina, instalación de catéter, puede ser de utilidad (16), pero requiere un paciente colaborador (17).
Proceder con cautela al momento de decidir sedar pacientes para acceso venoso central. Un paciente profundamente sedado puede hacer obstrucción de vía aérea superior y presentar episodios de apnea obstructiva. Al hacer inspiraciones profundas y roncar, produce presiones negativas intra-torácicas mayores que lo habitual y hay mayor riesgo de EA por mayor gradiente de presión entre la atmósfera y la cavidad pleural.
En pacientes con accesos de tos descontrolados o con inspiraciones profundas evitar manipulaciones como retirar dilatador de una vaina, etc.
Diagnóstico: Los métodos de detección de EA de mayor sensibilidad son ecocardiografía trans-esofágica (ETE), Doppler precordial, catéter de swan-ganz y el doppler trans-craneano(DTC), todos métodos o de baja disponibilidad o francamente invasivos de cara al procedimiento (9).
El ECG y la SPO2 son obligatorios en la instalación de un CVC, fáciles de implementar, pero se alteran cuando hay repercusiones severas de un evento embólico significativo.
En un estudio de incidencia de EA, los casos presentaron un sonido como burbujeo, y como fueron realizados en sala de angiografía el aire fue visible bajo rayos, la cuantía del evento embólico fue severa, un paciente de los 25 casos murió como consecuencia directa (10).
En la práctica diaria en la instalación de un CVC los síntomas de una EA significativa puede ser respiratorios, como disnea, tos, sensación de falta de aire, dolor torácico; o neurológicos que van desde confusión al coma. Al examen pulmonar hay crepitaciones, sibilancias y polipnea. Si el paciente está ventilado habrá una caída del et CO2 y de la SpO2.
Si la EA es arterial puede haber signología neurológica deficitaria focal. La sospecha es clínica, un paciente al que se está instalando o retirando un CVC que post-procedimiento presenta brusca dificultad respiratoria, como “respiración entrecortada” es sospechoso de EA. Si a ello se suman alteraciones de la SPO2 y de ECG como cambios de ST y onda T, seguidas de taquiarritmias supra-ventriculares y ventriculares la sospecha es alta y hay que iniciar la reanimación y complementar con estudio ecocardiográfico (18).
Manejo: Los pilares del manejo en caso de EA significativa son: prevenir mayor entrada de aire; reducción, si se puede, del aire intravascular; soporte hemodinámico.
Soporte con O2 en la máxima proporción, idealmente 100% y en caso de estar bajo anestesia suspender óxido nitroso para reducir el tamaño del émbolo (19).
Tendría algún rol la maniobra de Durant (20): lateralizar a izquierda, para alguna manipulación del aire intravascular y la posición de Trendelemburg en optimizar la hemodinamia lo que no se ha podido replicar en experimentación animal (21).
Resucitación cardiaca con MCE y desfibrilación son sin duda eficaces (22, 23) al igual que el aspirado de aire intravascular aunque lo que se ha reportado no es más de 15 a 20 cc (24, 25).
Si bien es cierto el cuadro clínico de EA masiva es con aumento de resistencia vascular pulmonar, falla de ventrículo derecho y bajo débito secundario, el soporte inicial de emergencia pueden ser bolos de epinefrina para posteriormente instaurar Dobutamina a dosis de 5 ug por kilo minuto titulando hasta obtener respuesta estable y eventualmente norepinefrina para mejorar perfusión de ventrículo izquierdo (26, 27).
Mal posición de CVCSe define cuando el catéter está en el sistema venoso pero la punta del catéter no está en la aurícula derecha VCS o VCI; o cuando el catéter está fuera del sistema venoso, doblado o cuando el tercio distal del catéter no va paralelo a la pared de la vena.
La incidencia va de 5% para acceso yugular a 9% para acceso subclavio (28, 29).
Los catéteres subclavios pueden ubicarse en la vena yugular interna ipsi-lateral o en la subclavia contra-lateral (30). Los catéteres yugulares pueden seguir el curso de las subclavias y también de la yugular del lado opuesto.
Particularmente los catéteres puestos por el lado izquierdo, yugulares o subclavios mal posicionados pueden quedar con la punta apoyada en la pared lateral de la VCS en un ángulo agudo lo que condiciona mayor riesgo de perforación de la vena (31).
Los problemas derivados de esta complicación son: pérdida de la medición de PVC, mayor frecuencia de trombosis al quedar en venas más estrechas y con menor flujo o alterar el flujo (32, 33) y más posibilidades de daño local. Mayor daño mecánico y químico de la vena por los medicamentos a ser infundidos y por lo mismo mayor riesgo de perforación.
Diagnóstico: Cuando no se logra medición de PVC o hay un trazado anormal.
Cuando no refluyen los lúmenes.
Cuando hay problemas de permeabilidad del catéter.
Cuando hay molestias al pasar volumen o medicamentos.
Cuando hay trombosis de los lúmenes.
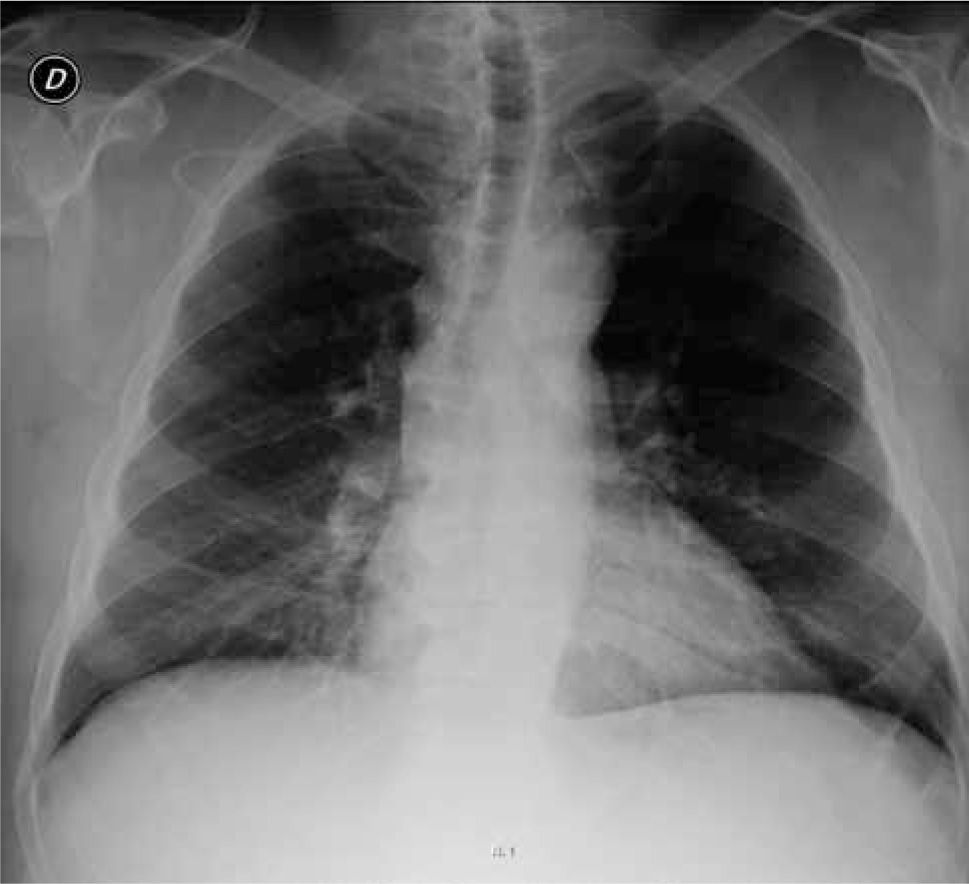
Radiografía de control (Figura 2).
Prevención: Contar con visión fluoroscópica al momento de instalar el CVC hace el diagnóstico inmediato de mal posición con la posibilidad de intentar corregir al instante.
En el caso de punciones sin contar con esta herramienta, en el acceso subclavio tendría algún rol mantener la cabeza en posición indiferente o ligeramente rotada hacia el lado del procedimiento (34), también ejercer una ligera presión sobre la yugular ipsi-lateral (35), ambas maniobras pueden servir para impedir que el catéter quede posicionado en la vena yugular interna del mismo lado.
Tener alguna metodología para ajustar la distancia a la cual queda insertado el CVC (36) aumentando la probabilidad de quedar bien situado. Control radiográfico siempre, la clínica tiene un mal valor predictivo negativo para complicaciones de los CVC (37) y la radiografía en la mayor parte de los casos nos da un diagnóstico de certeza. En los casos que la duda persiste, se puede complementar con fluoroscopía y uso de medio de contraste.
Manejo: La mayor parte de las veces un catéter mal posicionado debe ser reposicionado bajo control radiológico o sencillamente retirado y reinstalado por el mismo acceso o en otra posición anatómica. No obstante hay pacientes multi-puncionados cuyos accesos vasculares a veces quedan limitados a una sola opción. En estos casos se debe sopesar el riesgo de daño derivado de un catéter mal posicionado instalado con el riesgo de trombosis e infección etc. con los riesgos de someter al paciente a nuevas punciones.
Punción o cateterización arterialLa incidencia de punción de la arteria carótida para acceso yugular varía entre un 1.9 a 9.4% (38,39) y en general para punciones arteriales son más frecuentes en el acceso yugular que el subclavio 3% vs 0.5% (40). Con mayor frecuencia en operadores con poca experiencia y en pacientes pediátricos (41).
Las consecuencias de lesiones arteriales van desde hematomas, accidentes cerebro-vasculares, pseudo-aneurismas, disección, trombosis, hemotórax, tamponamiento cardiaco y fístula arterio-venosa. Puede haber hemorragia retroperitoneal, e isquemia de extremidades estos últimos para accesos centrales por vía femoral.
Si bien es cierto, para la frecuencia con que se puede presentar, hay pocos reportes de accidente cerebro-vascular u obstrucción de vía aérea secundario a hematoma cervical. Esta complicación especialmente con grandes catéteres puede conducir incluso a la muerte del paciente (42).
Otras arterias que se pueden puncionar accidentalmente son la vertebral, femoral, subclavia, braquiales y ramas de ellas.
De los tres accesos más usados la mayor frecuencia de punciones arteriales y hematomas las tienen los accesos yugular y femoral contra el acceso subclavio.
Prevención: Tener exámenes de coagulación adecuados, aunque en caso de emergencia no siempre se cuenta con el tiempo para disponer de ellos, por lo que se debe balancear el riesgo de hematoma con el beneficio del catéter. La asistencia de un operador experimentado es fundamental (38).
Uso rutinario de ECO para identificar el vaso y llevar a cabo una punción venosa central viendo la punta de la aguja es decir punción en plano (43, 44) lo que disminuye esta complicación al menos a la mitad (45). En caso de no disponer de ultrasonido y basarse en la palpación y anatomía, se puede usar agujas finas para buscar la vena. En caso de puncionar la arteria las consecuencias son menores con una aguja más fina, pero no inexistentes (46).
Diagnóstico: La punción accidental con un introductor es evidente, con salida de sangre de un rojo rutilante y a alta presión, ocasionalmente pulsátil. Pero a veces no es tan evidente y el riesgo de canular una arteria con un CVC existe (47).
Se puede conectar un catéter a transductor de presión para hacer el diagnóstico de catéter intra-arterial o si hay inestabilidad hemodinámica hacer gases de la sangre aspirada por el catéter.
El estudio con imágenes no es siempre clarificador por la vecindad de los grandes vasos, puede haber catéter triple lumen en la carótida con estudio de Tórax que informa la punta del catéter en VCS (48).
Manejo: La recomendación es, cuando uno accidentalmente punciona una arteria en el cuello, retirar la aguja y comprimir por 3 o 5 minutos y proseguir con la instalación del CVC. El paciente debe quedar en una unidad donde tenga algún grado de vigilancia y ser evaluado al menos en 2 oportunidades por el mismo operador, pues se pueden producir hematomas importantes en forma diferida (2), incluso hemorragias que pueden ser fatales (49).
En el caso del cuello, grandes hematomas deben ser cuidadosamente vigilados, ser evaluados por cirujano vascular, hacer imágenes para constatar magnitud y riesgo de compresión de vía aérea o formación de pseudo-aneurismas. Eventualmente exploración y reparación quirúrgica. Punciones inadvertidas de arterias subclavia, innominada, aorta son peligrosas porque sujetas a mayor presión y ubicadas en regiones de incluso menor presión que la atmosférica sin posibilidades de compresión pueden dar lugar a grandes hemotórax, hemo-mediastino hipovolemia brusca y muerte (2).
El pericardio se continua hacia la aorta ascendente de manera tal que lesiones de las ramas principales de la aorta también pueden vaciarse al saco pericárdico y producir hemo-pericardio y tamponamiento cardiaco (50).
De igual manera punciones venosas femorales pueden complicarse con lesiones arteriales femorales o de la iliaca que al cursar inadvertidas, porque no son visibles ni accesibles de comprimir, pueden producir grandes hematomas retro-peritoneales shock hemorrágico y muerte.
Perforación de grandes venasLa lesión de grandes venas en relación con la instalación o uso de un CVC, si bien es cierto es de baja ocurrencia, existe y puede ser fuente de importante morbilidad e incluso mortalidad (2, 51). La incidencia es difícil de determinar, anualmente hay reportes de serios eventos relacionados con esta complicación, lo que la hace una complicación, si bien infrecuente, no rara con un 0.25 a 0.4% (52). Durante la instalación de un CVC se puede producir por daño directo ocasionado por guías, dilatadores, introductores. Estos últimos de una longitud más que suficiente para producir lesiones vasculares intra-torácicas (53). También se puede producir perforación de VCS en forma diferida con catéteres mal posicionados (31) que al estar apoyados contra la pared venosa terminan por desvitalizarla y permean hacia el mediastino.
Las pérdidas de continuidad de grandes venas incluso de la aurícula derecha pueden ser “bien toleradas” cuando hay tejido intacto alrededor, buena coagulación y presiones venosas dentro de rangos de normalidad. El mayor riesgo es hemorragia incontrolable, hemo-pericardio con tamponamiento que puede ser temporalmente alejado de la instalación del CVC, no vigilado y desembocar en la muerte del paciente.
En un estudio de demandas por problemas asociados a la instalación y mantención de CVC, de 16 casos de tamponamiento cardiaco 13 se registraron como ocurridos alejados del momento de la inserción y fueron sintomáticos del día 1 a 5 post-operatorio, con incidencia de muerte de 81%. Un tercio de los pacientes era pediátrico (1).
Prevención: Como se describe hay dos etapas en que se puede evidenciar la complicación de rotura de grandes venas: el tiempo de inserción del catéter y el período de mantención. Por lo tanto la estrategia de prevención o diagnóstico de estas lesiones se puede ordenar en estas dos etapas.
Durante la instalación es fundamental manejar en forma adecuada dilatadores e introductores largos que pueden ser los responsables directos de esta catastrófica lesión (53), es suficiente con dilatar hasta la pared de la vena y no introducir el dilatador en toda su longitud. El uso del ultrasonido por parte de personal entrenado también puede incidir.
No usar fuerza excesiva con los dilatadores, en pacientes despiertos un súbito dolor visceral cuando se instala un CVC no debe ser ignorado.
Una vez instalado el CVC parece razonable especialmente ser cuidadoso con catéteres más rígidos como los de diálisis. Estar atento a mal posición y en caso de ser catéteres instalados por el lado izquierdo evaluar con radiografía la correcta ubicación, de lo contrario modificar la posición si están apoyados en la pared de la vena cava superior (31).
Elegir el catéter de la longitud adecuada. Suele ocurrir, que catéteres mal seleccionados, muy cortos, deben ser introducidos hasta el tope donde están los elementos de fijación a la piel y en caso de quedar por sobre la carina no hay posibilidad de avanzarlo para reposicionar.
Evitar que la punta del catéter quede dentro de la aurícula derecha, por la posibilidad erosión vascular y perforación de la VCS (54, 55) en su porción intra-pericárdica o de la aurícula derecha. Esta posición se comprueba en la radiografía de tórax, cuando la punta del CVC está a nivel de la carina. La carina está un promedio de 1.3 cms bajo la mitad de la VCS y 0.7 cms por debajo de la reflección del pericardio en la VCS (55). Por último, aunque el saco pericárdico cubre la VCS hasta 2 cms sobre la aurícula, los catéteres tienden a orientarse paralelos a la pared del vaso a este nivel y raramente causan tamponamiento cardiaco comparado con posiciones de la punta en aurícula o ventrículo (56, 57).
Diagnóstico y Manejo: La perforación de la VCS se puede presentar como hemotórax derecho o derrame pleural o pericárdico de fluidos administrados.
La perforación de la VCS inferior o de aurícula derecha puede presentarse como tamponamiento cardiaco, con hipotensión, incremento de las presiones yugulares, shock y asistolia.
Cualquier rotura venosa o de aurícula derecha en paciente con cardiopatía e incremento de presiones en cámaras derechas o fuerte reposición de volumen va a tener una evolución clínica más rápida. El gradiente de presión con el mediastino y la cavidad pleural favorecerá la pérdida de volumen a estos espacios.
Cualquiera sea la presentación clínica, la conducta es activa y se debe proceder al mismo tiempo con:
Soporte hemodinámico que incluye tener buenos accesos para aporte de volumen, hemoderivados, control de hematocrito.
Evaluación por cirujano cardiaco.
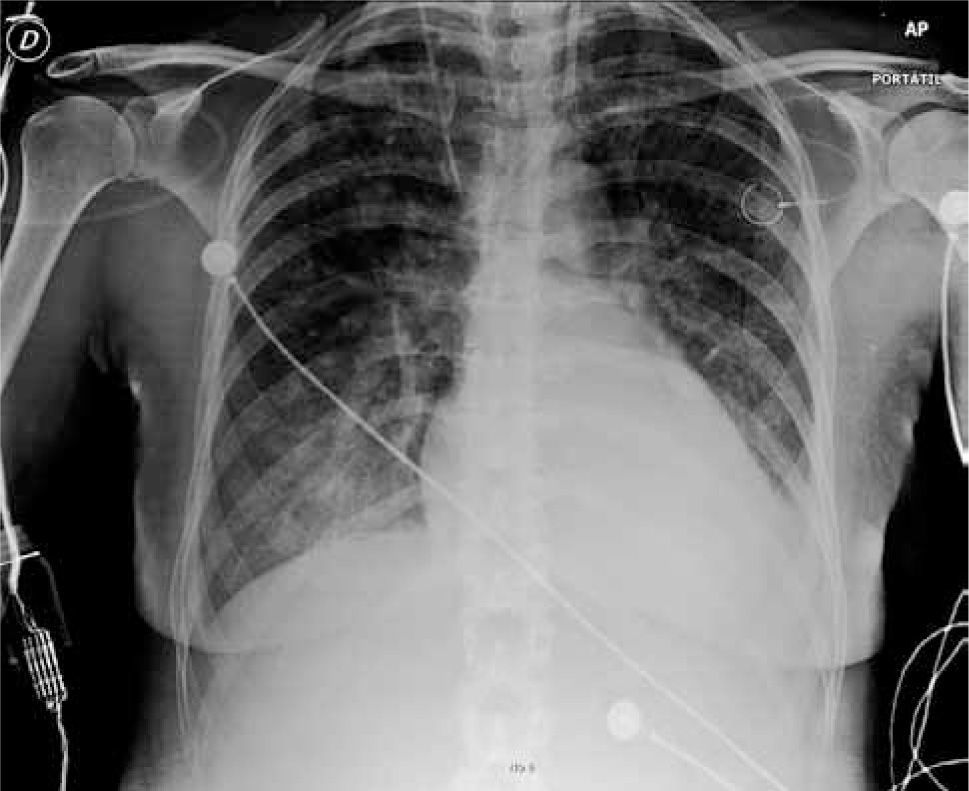
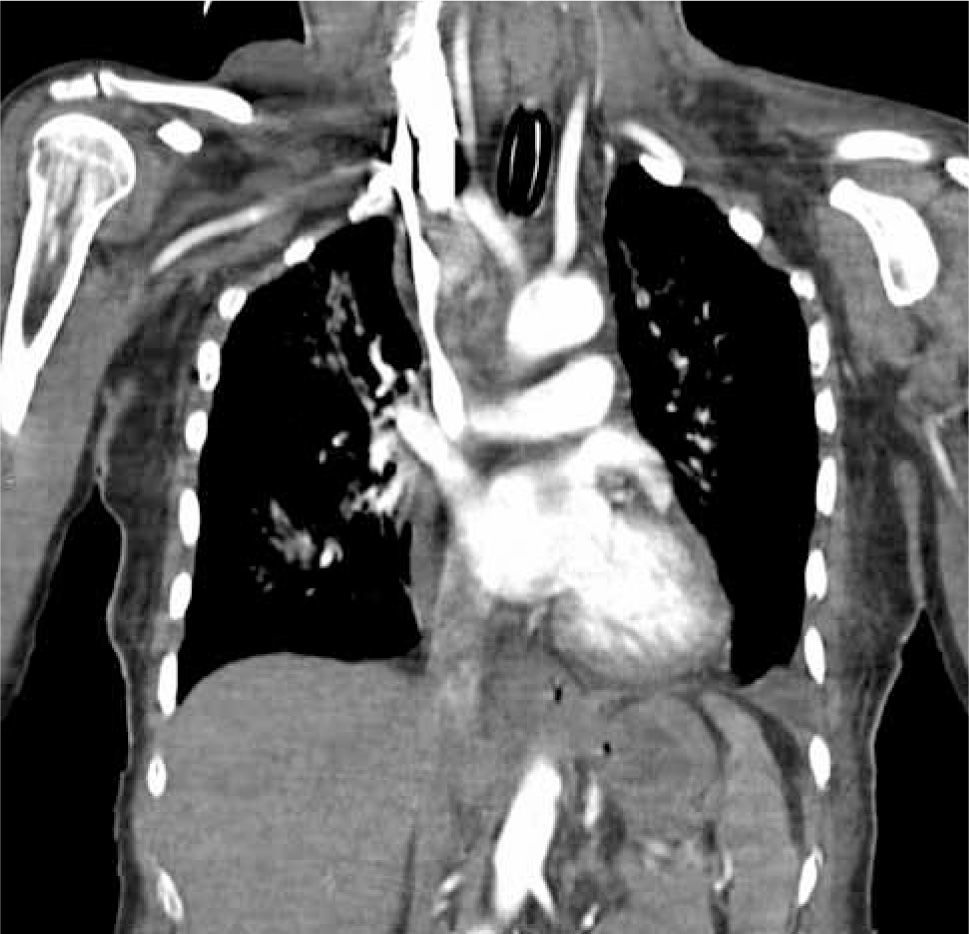
Imágenes, la radiografía de tórax puede mostrar derrame pleural o ensanchamiento de mediatino (Figura 3 y 4) el Eco Transtorácico o Transesofágico puede mostrar derrame pericárdico y si la condición hemodinámica lo permite TAC de tórax y mediastino (Figura 5).
Las arritmias en relación con los CVC son producidas por irritación mecánica de la superficie del endocardio, ocurren al contacto con las guías o el catéter y se presentan casi siempre al instalar un CVC (58).
Un estudio mostró arritmias de tipo supra-ventriculares en un 40%, arritmias ventriculares en un 25% y 11% con bigeminismo u otro tipo de ectopías ventriculares (59).
La mayor frecuencia de arritmias y más serias es para los catéteres de Swan Ganz y en aquellos pacientes con historia de patología cardiaca, alteraciones del potasio y edad avanzada.
Si bien es cierto en la mayoría de los casos son autolimitadas, pueden desembocar en reentradas y taquicardias ventriculares que pueden requerir cardio-versión eléctrica.
Por el mecanismo de producción de las arritmias, son más frecuentes y más serias cuanto más profundo se introduzcan catéter o guías, al introducir un catéter de arteria pulmonar casi el 60 % de las arritmias son ventriculares (60).
También se describe arritmias un lapso de tiempo después de la instalación del CVC, especialmente con catéteres centrales periféricos. En un reporte se estableció que cuando el paciente movía el brazo el catéter se introducía hasta 10 cms y estimulaba la aurícula o ventrículo derechos (61) por lo tanto la posición de la punta de los catéteres centrales periféricos es variable.
Prevención: Revisar antecedentes del paciente, descartar cardiopatías especialmente historia de arritmias. Fibrilación auricular crónica, latidos ectópicos supra e infraventriculares pueden indicar un endocardio más irritable. En los pacientes en falla renal, la uremia y la acidosis incrementan la irritabilidad del miocardio lo que se traduce en mayor frecuencia de arritmias que la población normal cuando se instala un catéter (62). La presencia de otras guías, como marcapasos endocavitarios, desfibriladores etc, hacen de preferencia intentar el CVC en el lado opuesto, a mayor ocupación de la vena de acceso hay mayor tendencia a trombosis, ver radiografía de tórax previa y ECG para asegurarse que el marcapaso o desfibrilador cuentan con batería.
Las alteraciones en la concentración de potasio plasmático igual alteran la electrofisiología del corazón, idealmente tener previo al procedimiento un examen de electrolitos plasmáticos, especialmente en pacientes usuarios de diuréticos.
Durante la instalación del CVC siempre debe haber monitoreo de ECG, para detectar precozmente cualquier arritmia e intervenir en la forma oportuna y radioscopía para ver las guías y la posición definitiva de la punta del CVC.
Siempre introducir la guía solo lo necesario para asegurar estar dentro de la vena.
Manejo: Una vez que se presentan arritmias al pasar una guía o CVC, retirar la guía o CVC por unos cms bastará para poner fin al evento. La inmensa mayoría de estos episodios son autolimitados.
De persistir, pese al cese del contacto del CVC con el endocardio, asistir al paciente con O2, evaluar repercusión hemodinámica, eventual cardio-versión según severidad del episodio.
En el caso de desarrollar fibrilación auricular, tener en mente que puede tratarse de pacientes que tengan FA paroxística con episodios anteriores. Puede haber trombos en la orejuela izquierda y lo más prudente cuando no hay compromiso hemodinámico es diferir el tratamiento previo estudio de la arritmia.
Cuando hay arritmias relacionadas a la mantención y uso del CVC se debe evaluar ubicación de la punta del CVC con radiografía de tórax y eventualmente reposicionar.
Trombosis venosa relacionada a catéterUn importante número de los pacientes que requieren un CVC tienen alto riesgo de trombosis venosa asociada a catéter. Aquellos que tienen operaciones recientes, diagnóstico de cáncer, trombofilias, quimioterapia, postración en cama, hemodiálisis, embarazo y diabetes por citar algunos.
Un estudio con doppler en UCI reveló que el 33% de todos los pacientes tenían trombosis venosa. De ellos el 15% estaba relacionado a catéter (63).
Por otra parte, la inserción y presencia de un CVC dañan localmente la pared del vaso, lo que desencadena la cascada de la coagulación por factor tisular, la respuesta normal del organismo.
También influye la localización del catéter. Hay trabajos que encuentran un 12% de trombosis para CVC yugulares y femorales contra un 8% para los accesos subclavios (64, 65).
La posición de la punta del catéter, catéteres previos, más de un catéter en un acceso, dispositivos preexistentes como marcapasos, venas utilizadas con anterioridad también influyen en el riesgo de trombosis venosa.
La trombosis asociada a catéter también está asociada a mayor compromiso infeccioso del catéter que puede derivar en sepsis de catéter y bacteremias.
También puede haber consecuencias mayores derivadas de trombosis venosa asociada a CVC como trombo-embolismo pulmonar y si el catéter se trombosa en la vecindad de las cámaras cardiacas formación de trombos en aurícula y ventrículo derechos (66, 67).
Diagnóstico: Puede tener un curso clínico silente o puede dar síntomas y signos locales como dolor, edema, distensión de las venas del cuello o periféricas, eritema. En el caso de CVC subclavios puede haber hinchazón del brazo o de la mano, la trombosis yugular unilateral puede ser silente.
Luego de establecida la sospecha clínica el diagnóstico se hace con doppler venoso o estudio fluoroscópico con medio de contraste que son los exámenes de mayor rendimiento.
La incidencia reportada varía de un 6 a 15% para estudios con doppler venoso de CVC transitorios, es mayor en CVC para uso prolongado. Un estudio en 57 pacientes oncológicos con CVC sin síntomas mostró un 56% de trombosis parcial o completa con venografía (68).
Otro estudio similar en pacientes en diálisis reportó una incidencia de 38% de trombosis para catéter central periféricamente insertado (69).
Prevención: Cuando un catéter está mal posicionado hay un reconocido mayor riesgo de trombosis. Cuando la punta del catéter está ubicada en VCS ó VCI y flota libremente paralela a la pared venosa el riesgo de trombosis es mucho menor (70).
El catéter subclavio tiene menor riesgo de trombosis venosa que femoral y yugular(64, 65, 71) probablemente esto lo hace la mejor elección para catéteres permanentes.
Evitar el cambio rutinario de CVC que somete el paciente a más riesgos inherentes a la punción y más territorios venosos traumatizados.
Probablemente cuando hay cambio de catéter se debería preferir un acceso que no haya sido usado.
Manejo: La conducta varía según el catéter: en la trombosis venosa relacionada a catéteres transitorios se anticoagula para que el trombo no siga creciendo y se retira el catéter al quinto día de tratamiento anticoagulante, período estimado necesario para que el trombo quede adosado al endotelio venoso y no haga embolias a distal.
Para catéteres a más largo plazo simplemente se anticoagula y de no haber disfunción del lúmen del catéter se sigue usando (72).
En caso de presentar trombos intra-cavitarios o TEP evaluación por cirujano vascular o cardiaco para anticoagulación y eventual manejo quirúrgico.
Oclusión del catéter venoso centralLa oclusión del lumen del CVC ocurre en el 14 a 36% en uso crónico y alrededor del 10 % en el uso de catéteres transitorios.
Puede ser parcial, cuando no se puede aspirar pero se puede infundir, o completa de manera tal que ni se aspira ni se puede infundir.
En su génesis puede ser por obstrucción mecánica, precipitación de medicamentos o trombosis.
Las causas de oclusión mecánicas puede ser por nudos, sutura compresiva, clamp externo (73). También puede haber oclusión por pellizcamiento entre la clavícula y primera costilla.
Basta con inspeccionar el catéter para solucionar una buena parte de las obstrucciones, pero para ver el pellizcamiento en caso de sospecha una venografía hará el diagnóstico.
Descartada la oclusión mecánica se debe buscar obstrucción relacionada a productos infundidos. Puede haber mezclas incompatibles que causen precipitación de medicamento en el lumen del CVC. Fármacos muy alcalinos o ácidos también pueden precipitar. También puede ocluirse un catéter por precipitación de cristales de fosfato de calcio cuando calcio y fosfato son co-administrados en concentraciones inapropiadas. La nutrición parenteral deja un residuo lipídico que también puede ocluir el CVC.
La oclusión por depósito de cristales de fosfato de calcio o precipitación de medicamentos de bajo Ph puede ser tratada con ácido clorhídrico al 0.1% (74).
Oclusión por medicamentos como fenitoina o pentotal (de Ph muy elevado) que precipitan en un ambiente ácido se puede tratar con bicarbonato de sodio.
El catéter por último se puede ocluir por trombosis. Puede ser depósito de fibrina alrededor de la punta del catéter, un coágulo intra-luminal o por trombosis venosa.
La vaina de fibrina es una de las causas de obstrucción trombótica más frecuente. Se puede desarrollar durante las primeras 24 hrs. Un estudio post-mortem determinó que casi la totalidad de los catéteres están envueltos en fibrina (75). La fibrina usualmente no afecta la función del catéter pero puede causar obstrucción parcial.
Los coágulos intra-luminales pueden constituir del 5 a 25% de la causa de oclusión de CVC y son los responsables de la oclusión completa. Descartadas las causas anteriores, un estudio de contraste puede mostrar la segmentación del medio de contraste dentro del CVC.
El tratamiento de la oclusión trombótica en EE.UU. es con Alteplasa o Urokinasa para disolver el trombo vía activación del plasminógeno (76). La trombosis venosa o intra-luminal puede estar asociada a procesos de colonización o infección por dos mecanismos:
- -
Las bacterias responsables por la mayoría de las infecciones relacionadas a catéter son altamente trombogénicas, crean un ambiente propicio para que haya coagulación en la zona colonizada.
- -
Por otra parte, las proteinas dentro del coágulo tales como fibrinógeno o fibronectina atraen especies de estafilococos e incrementan su adherencia a la superficie del catéter (77).
La punción venosa central puede lesionar cualquier estructura no vascular que esté anatómicamente cerca del sitio de punción.
Están descritas lesiones del esófago, tráquea, linfáticos, nervios frénico, vago, cadena simpática, plexo braquial, incluso catéter central en el espacio subaracnoideo.
Sin duda, la ayuda de la ultrasonografía en manos de operadores entrenados, tiene un rol importante en prevenir lesiones. Sin embargo debe complementarse con una técnica rigurosa.
Aparte de las complicaciones descritas existe una miscelánea, por mencionar algunas: extravasación de fármacos con daño tisular local, derrames pleurales por catéteres extravasculares intratorácicos, nudos producidos al instalar el CVC especialmente con el catéter de arteria pulmonar, guías que accidentalmente se dejan dentro del territorio venoso, fractura de catéter, fractura de guía en la colocación, flebitis, etc.
SíntesisLas complicaciones mecánicas de los CVC como se ha descrito, son frecuentes, pueden ser de gran importancia y tener graves consecuencias para el paciente. Afortunadamente las más severas son de rara ocurrencia, pero existen y por eso siempre que se indica o instala un CVC, debe haber certeza de los beneficios que se obtienen con su uso y de los riesgos que implica instalarlo. Llevar la frecuencia de complicaciones a cero es imposible, pero se pueden prevenir mediante una técnica rigurosa, adecuada evaluación del paciente, uso de ultrasonografía y uso de radioscopía rutinaria.
El autor declara no tener conflictos de interés, en relación a este artículo.