Las crisis epilépticas son un problema neurológico que afecta entre un 4-10% de los niños hasta los 16 años. Las crisis deben ser diferenciadas de otros desórdenes neurológicos de los niños y clasificadas según su tipo. El tratamiento de emergencia está focalizado en la estabilización del paciente, terminar con la actividad convulsiva y determinar la causa de ésta. Diferentes modalidades de tratamiento existen a largo plazo, pero el adecuado tratamiento va a depender de un diagnóstico correcto y el conocimiento de los beneficios y efectos adversos de la terapia indicada.
Seizures are a neurological problem that affects between 4 to 10% of children up to age 16. The crisis must be differentiated from other neurological disorders of children and classified by type. Emergency treatment is focused on stabilizing the patient, ending the seizure activity and determine the cause of this. There are different treatment modalities in the long term, but proper treatment will depend on a correct diagnosis and awareness of the benefits and adverse effects of prescribed therapy.
Las crisis epilépticas son el desorden neurológico más frecuente en los niños y es uno de los eventos que producen mayor ansiedad en los padres. Ocurren aproximadamente entre un 4-10% de los niños y son alrededor del 1% de las atenciones de urgencia pediátrica (1, 2). Los niños bajo 3 años son los de mayor incidencia de crisis y ésta va disminuyendo a medida que incrementa la edad (3). En estudios realizados en base a la atención de Urgencia en Estados Unidos, calculando número de atenciones por crisis en relación a 1000 visitas de urgencia, la tasa más alta la tiene el grupo entre 1 - 5 años (15/1000), dada principalmente por las atenciones de crisis febriles, seguida por los menores de un año (8.5 por cada 1000), luego entre 6 a 10 años (8 por cada 1000) y la menor, en la población infantil entre 11 a 15 años (7 cada 1000 visitas de Urgencia) (1).
Los pacientes con crisis epilépticas consultan frecuentemente en urgencia y los pediatras de estos servicios deben estar atentos a reconocerlas y manejarlas eficientemente en agudo, estabilizando al niño. Es imperativo que los profesionales de emergencia sean capaces de diferenciar crisis verdaderas de eventos que las semejan, pudiendo así proporcionar tratamiento adecuado, tranquilidad a los padres y seguridad al paciente. Su evolución a largo plazo determinará la conducta a seguir y tratamiento crónico si es necesario.
DefinicionesLas crisis epilépticas (CE) no son un diagnóstico por sí mismas, si no el síntoma de un proceso que resulta de una descarga excesiva y/o hipersincrónica de las neuronas cerebrales, usualmente autolimitada (4). Esta descarga paroxística, eléctrica, de un grupo de neuronas en el cerebro produce una alteración de la función o conducta. El área cortical envuelta, la dirección y la velocidad del impulso eléctrico y la edad del niño, contribuyen a las diferentes manifestaciones del la CE (5, 6).
El diagnóstico de Epilepsia es sólo hecho luego de la ocurrencia de dos o más CE, sin evidencia de factores gatillantes. Un síndrome epiléptico es la conjunción de signos y síntomas generalmente dentro de un rango de edad en los niños, asociados a hallazgos específicos neurológicos y electroencefalográficos (7, 8).
El estado epiléptico (EE) es una condición patológica caracterizada por crisis epilépticas recurrentes (generalizadas o focales) sin recuperación completa entre ellas, o actividad ictal continua eléctrica y/o clínica, por 30 minutos o más, con o sin alteración de conciencia, o por lo menos dos o más crisis entre las cuales no haya recuperación de conciencia (7, 8). Sin embargo, frente a esta definición de consenso hay evidencias, tanto en modelos animales como en la clínica, sobre la existencia de daño neuronal antes de los 30 minutos de establecida la condición en aquellas generalizadas. Por esta razón, Lowenstein ha propuesto reemplazar los criterios previos por otros más precoces, y definir EE convulsivo generalizado inminente, como crisis > a 5 minutos de duración, o dos o más crisis entre las cuales el paciente no recupere la conciencia plenamente (9).
FisiopatologíaDurante la crisis, se produce incremento del consumo de oxígeno y glucosa, y la producción de lactato y anhídrido carbónico. Si la ventilación se mantiene, el incremento del flujo sanguíneo es generalmente suficiente para compensar estos cambios. Como resultado de esto, crisis breves raramente causan daño neurológico a largo plazo. En adultos, Gastaut y Broughton demostraron que las crisis típicamente tónico-clónicas generalizadas raramente duraban más de cinco minutos y en un trabajo de Theodore et al, mostraron que el promedio de duración de crisis tónico clónico generalizada (TCG) en pacientes adultos monitorizados con Video Electroencefalograma, era de 62 segundos (10). En niños, sin embargo, las crisis pueden ser más largas que cinco minutos, especialmente si hablamos de crisis febriles. No es infrecuente que las crisis sean de mayor duración que el adulto, llegando hasta 10 minutos. Sin embargo, es similar a los adultos en el sentido que mientras más larga la crisis, más difícil es de detener. Es razonable usar un corte más laxo entre 5 a 10 minutos, que el estricto corte de 5 minutos del adulto (11). Sobre estos tiempos, la crisis por sí sola puede tener la potencialidad de no ser autolimitada y provocar daño si se prolongara.
Durante una crisis, generalmente se produce actividad simpática, provocando taquicardia, hipertensión e hiperglicemia, sumado en algunos casos a la dificultad de algunos pacientes en mantener vía aérea permeable. Cuando esto último sucede, la ventilación inadecuada puede provocar hipoxia, hipercapnia y acidosis respiratoria. Si la crisis continúa se corre el riesgo de acidosis láctica, rabdomiolisis, hipercalemia, hipertermia e hipoglicemia.
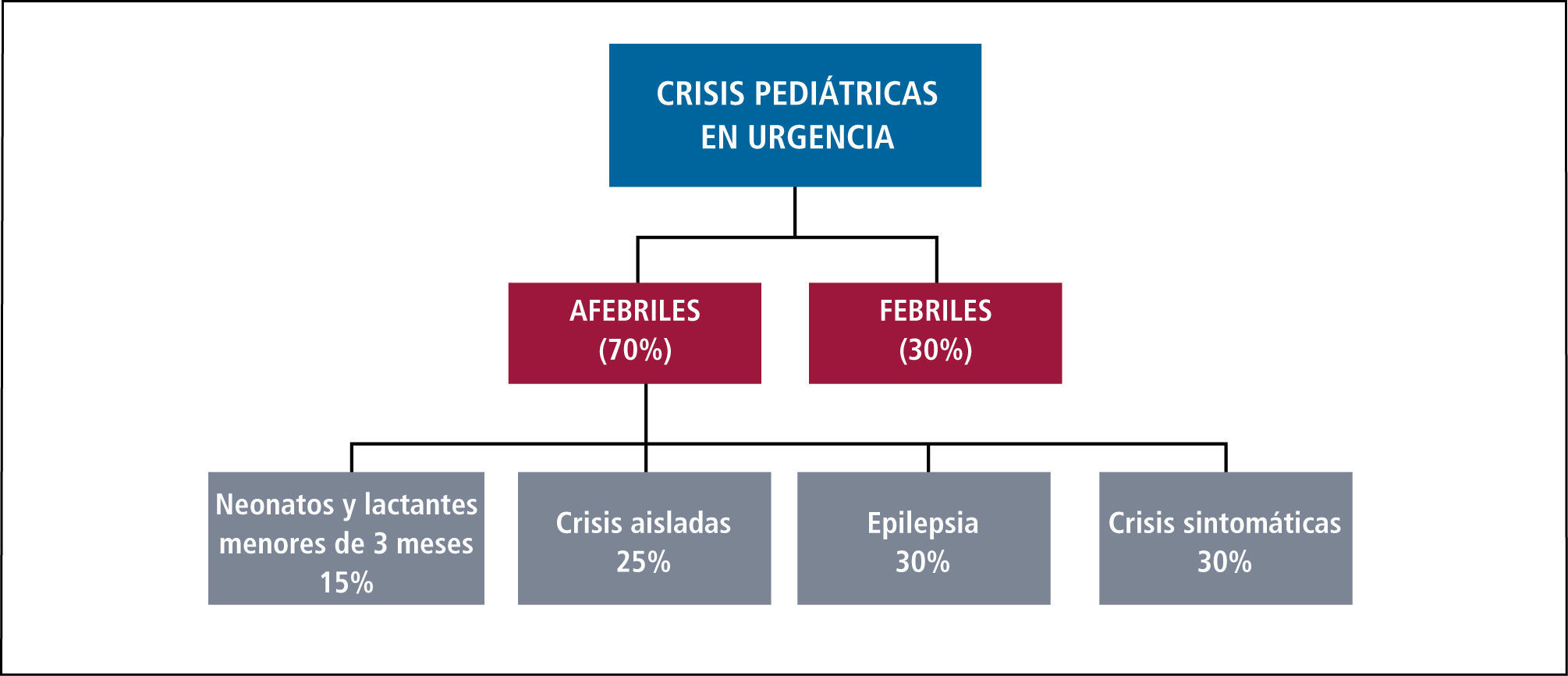
Clasificación de las crisisHay muchas maneras de clasificarlas. La determinación de la posible causa patológica (Tabla 1) y la clasificación correcta del tipo de crisis (Tabla 2), son de fundamental ayuda para determinar el tratamiento correcto. En relación a la etiología de las crisis, las más frecuentes (30%) corresponden a crisis febriles (12). En relación a las crisis no febriles, un 30% corresponde al debut de una Epilepsia, sintomáticas otro 30%, 25% son aisladas y un 15% se presenta en niños menores de tres meses (13) (Tabla 3).
Etiología más frecuente de crisis epilépticas en edad pediátrica
| Crisis febriles |
|---|
| Procesos Infecciosos del sistema nervioso central |
|
| Lesiones traumáticas/vasculares |
|
| Condiciones tóxicas |
|
| Alteraciones Metabólicas |
|
| Desórdenes neurocutáneos |
|
| Enfermedades neurodegenerativas |
| Epilepsia de origen genético |
| Misceláneo |
|
Clasificación del tipo de crisis epilépticas
| 1. CRISIS GENERALIZADAS |
Tónico-clónicas (en cualquier combinación)
|
| 2. CRISIS FOCALES |
|
| 3. CRISIS QUE PUEDEN SER FOCALES, GENERALIZADAS O NO CLARAS |
| Espasmos epilépticos |
Versión traducida y adaptada del artículo: Revised terminology and concepts for organization of the epilepsies: Report of the Commission on Classification and Terminology 2010.
Muchos tipos de clasificación se han planteado, pero lo importante es estandarizar la terminología a usar para la descripción de la actividad convulsiva. La descrita en la tabla 2 es aquella propuesta en el año 2010 por una comisión de expertos de la Liga Internacional de Epilepsia (14). Uno de los principales cambios es que no hay una clasificación natural para las crisis focales y estas deben ser descritas según sus manifestaciones clínicas.
Consideraciones especialesA. Crisis neonatalesEl período neonatal, definido como los primeros 28 días de vida para un recién nacido de término (>38 semanas de gestación) y hasta 44 semanas de edad concepcional para un pretérmino, es el de mayor riesgo de presentar crisis epilépticas en toda la vida, con una incidencia global de 1.8-3.5/1000 recién nacidos vivos, de 0.95-2.8/1000 en términos o de peso >2500g, y un aumento progresivo a menor edad gestacional y peso de nacimiento alcanzando 19 - 57.5/1000 en neonatos de <1500g (15-18).
El cerebro inmaduro es más excitable que el de un niño mayor. Dentro de los mecanismos específicos edad-dependientes en el cerebro neonatal se cuentan:
- a)
Un estado de hiperexcitabilidad relativa (19-21).
- b)
El número de sinapsis y densidad dendrítica alcanza un peak en el período neonatal y postnatal temprano, lo que lleva a un balance mayor de actividad excitatoria sobre la inhibitoria, generando aumento en la formación de sinapsis, plasticidad y remodelación de éstas (22, 23).
- c)
Mielinización inicial tanto de estructuras corticales como subcorticales, que aporta a la semiología focal o multifocal de las crisis.
Esto resulta en actividad epiléptica no organizada en el cerebro inmaduro y por consiguiente las crisis son difíciles de detectar y diferenciar de los movimientos normales del recién nacido. Las crisis neonatales son variables en su forma, a menudo se presentan como fenómenos fragmentarios, desorganizados o con patrones evolutivos inhabituales, raramente se observa una crisis generalizada como se conoce en niños mayores. Las crisis neonatales se presentan como fenómenos aislados o transitorios con recuperación del estado basal entre las crisis, o en el contexto de un neonato encefalopático, con alteración de conciencia y anormalidades en el examen neurológico.
La clasificación semiológica de uso habitual distingue cuatro categorías de crisis neonatales: clónicas, mioclónicas, tónicas y sutiles, cada una de ellas sub-divisible en focal, multifocal o generalizada.
Las crisis clónicas se caracterizan por sacudidas rítmicas, repetitivas de segmentos corporales. Pueden ser focales o multifocales, involucrando diferentes segmentos de modo simultáneo o sucesivo en secuencias azarosas. Son más frecuentes en niños de término. Habitualmente tienen correlato ictal concordante en el electroencefalograma (EEG). Estas crisis no evolucionan a la generalización como ocurre en edades mayores.
Las crisis mioclónicas se caracterizan por sacudidas bruscas, breves y aisladas, de tipo generalizado, en salvas similares a espasmos infantiles, asociadas a cambios en el EEG de tipo estallido-supresión; también pueden ser fragmentarias, erráticas y migratorias, como se observa en la encefalopatía mioclónica precoz relacionada a errores innatos del metabolismo.
Las crisis tónicas se presentan con aumento sostenido del tono muscular flexor y/o extensor. Pueden ser focales si comprometen un segmento y/o desviación de la mirada, o generalizadas; estas últimas se asocian a cambios autonómicos. Se presentan en el contexto de una alteración severa del sistema nervioso central (SNC) y se originan probablemente en una disfunción de tronco cerebral, no se acompañan de actividad electrográfica ictal.
Las crisis sutiles corresponden a combinaciones variables de signos oculares: desviación tónica, sacudidas, parpadeos, vagabundeo; automatismos motores: orales: chupeteo, saboreo, movimientos de lengua o de extremidades como movimientos de nado, pedaleo, también denominados movimientos de progresión; manifestaciones autonómicas: aumentos de presión arterial, frecuencia cardíaca, salivación, apnea central. La apnea es poco frecuente como manifestación ictal única; cuando se asocia a actividad crítica EEG, es habitual observar otras manifestaciones sutiles, oculares y oro-linguales. A diferencia de las apneas no ictales, es poco probable que se asocie a bradicardia (24). Las crisis sutiles son más frecuentes en neonatos prematuros y/o con severa noxa al SNC; habitualmente se gatillan con la estimulación y se suprimen con la contención y reposicionamiento. El EEG suele tener actividad de base anormal e inadecuada organización de estados comportamentales. Los correlatos EEG ictales son variables (25).
El diagnóstico no debe ser sólo clínico, siempre debe ser apoyado con monitoreo EEG. Esto lo avalan diversos trabajos. En uno de ellos, (Murray et al) estudiaron 51 niños de término encefalopáticos, encontrando que solo el 34% de las crisis eléctricas tenían un correlato clínico observado en el video monitoreo. De este 34%, sólo el 9% de las crisis fueron reconocidas por el staff neonatal a cargo del recién nacido. Además, durante el período de monitoreo, enfermería anotó un total de 177 eventos clínicos sospechosos de crisis, pero sólo el 27% tenía un correlato ictal electro-clínco real (26, 27).
La causa más frecuente de crisis neonatal sigue siendo la encefalopatía hipóxico isquémica, entre un 50 a 60%, seguida de un 15% secundaria a hemorragia intracranial. Un 5 a 10% resulta de alteraciones infecciosas, anormalidades metabólicas y tóxicas (28, 29). Se distinguen dos síndromes idiopáticos de presentación neonatal, ambos monogénicos de herencia autosómica dominante, que se manifiestan en neonatos sanos como series de crisis, durante algunas semanas. Las convulsiones neonatales familiares benignas (CNFB) inician las crisis al segundo o tercer día de vida en niños de término y, al alcanzar la edad concepcional de término en prematuros y las Convulsiones neonatales-infantiles familiares benignas de presentación más tardía que CNFB, entre el segundo día y los siete meses de vida con remisión espontánea durante el primer año (30).
B.- Crisis febrilesSon crisis que ocurren asociadas a fiebre, pero sin evidencia de infección intracranial o causa definida, en lactantes mayores a 3 meses y preescolares hasta 5 años. El peak de ocurrencia es entre los 18 a 24 meses. Entre el 2 a 5 % de los niños experimentará al menos una crisis febril antes de los 5 años, siendo por lo tanto el tipo de crisis más frecuente en la edad pediátrica.(12, 31). Las crisis se clasifican en simples o complejas (Tabla 4). Existe una predisposición genética, observándose que un 25 a 40% de los niños posee historia familiar de crisis febriles (5).
Elementos clínicos de una crisis febril simple
|
Las crisis febriles simples son TCG, duración menor a 15 minutos y en general el niño al llegar a Urgencia ya no está convulsionando, pero sí irritable o letárgico, lo cual progresivamente va cediendo llegando a su estado basal. El diagnóstico diferencial más importante es con un proceso infeccioso central. En un estudio retrospectivo de meningitis aguda sólo encontraron que el 23% de los niños debutaron con crisis epiléptica y fiebre y sólo el 7% de ellos, sin compromiso de conciencia (32). Las causas infecciosas concomitantes más frecuentes (80 a 90%) son cuadros infecciosos virales (infección respiratoria de la vía aérea superior exantemas u otros), otitis media aguda y amigdalitis. Otros menos frecuentes son gastroenteritis, infecciones de las vías urinarias, y de la vía aérea inferior, entre otros (13).
La división entre simple y compleja de las crisis febriles tiene importancia en la posibilidad de recurrencia de estas y la probabilidad de desarrollar epilepsia a futuro (Tabla 5).
Pronóstico de crisis febriles
| Riesgo | % |
|---|---|
| • Población de riesgo de crisis febril | 2.7 a 3.1 |
| • Riesgo de recurrencia de crisis febril después de una 1ra crisis | 27 a 32 |
| • Riesgo de Epilepsia luego de una crisis febril simple | 1.5 a 2.4 |
| • Riesgo de Epilepsia luego de crisis febril compleja | 4.1 a 6.3 |
Muchas entidades clínicas pueden semejar crisis epilépticas. Todas aquellas que provoquen compromiso de conciencia, que se asocien a movimientos o posturas anormales, desórdenes sicológicos y alteraciones del sueño, tienen síntomas en común con las crisis epilépticas. A menudo una historia detallada del evento y examen físico son solamente necesarios para distinguirlos, en otros debemos apoyarnos en exámenes para lograrlo. El diagnóstico diferencial va depender de la edad del niño. Por ejemplo, en la edad de recién nacido están las mioclonías del sueño
REM, que en el neonato se asocia a mioclonías focales o generalizadas y la hipereplexia que es una condición rara, producida por alteración de la inhibición mediada por glicina, caracterizada por una respuesta exagerada de sobresalto, hipertonía, temblor e hiperreflexia. Ambas condiciones tienen EEG normales (33-W36).
En las otras edades, se adjunta una lista de las probables causas, separadas por tipo de evento clínico Tabla 6 (5).
Diagnóstico diferencial de crisis en edad pediátrica
| EVENTOS CON ALTERACIÓN DE CONCIENCIA |
|
| MOVIMIENTOS PAROXÍSTICOS |
|
| ALTERACIONES DEL SUEÑO |
|
| DESÓRDENES PSICOLÓGICOS |
|
La historia y el examen físico detallados son elementos importantes, que no sólo sirven para diferenciar entre crisis epilépticas y otros desórdenes paroxísticos no epilépticos, sino que también sirven para diferenciar el tipo de crisis que, asociado a la edad de presentación y los hallazgos electroencefalográficos, pueden encontrar la etiología de la crisis. Siempre se deben buscar factores precipitantes de crisis, como son la fiebre, enfermedad sistémica concomitante o infección, historia de enfermedad neurológica previa, trauma, posible ingestión de medicamentos o tóxicos, inmunización reciente e historia de crisis previas. En pacientes con historia de crisis anteriores, se debe investigar el tipo de crisis o síndrome epiléptico que presenta el niño y el uso de anticonvulsivantes. En relación a estos últimos, saber qué toma, dosis, cambios recientes de terapia o pérdida en la toma de dosis previo a la crisis (37). En relación a la crisis es bueno intentar objetivar la duración, cuáles son los primeros síntomas y cuál fue su progresión, la presencia de estado post-ictal y su duración. Además, recuperar historia familiar, desarrollo psicomotor, desempeño escolar, presencia de cefalea, problemas visuales, enfermedades recientes u exposición a precipitantes de crisis. En relación al examen físico, controlar signos vitales, ver si hay signos de infección, signos meníngeos, signos de hipertensión endocranenana (fontanela abombada, cambios en los signos vitales), traumatismo craneano. Además, destacar en la descripción el estado de conciencia, presencia de dismorfias, alteraciones en la piel y pigmentaciones anómalas, circunferencia craneana, respuesta pupilar, fondo de ojo, postura del niño, marcha y reflejos osteo-tendíneos. Todo esto en busca de signos neurológicos focales o que orienten a la etiología.
Exámenes de laboratorio1. Test de LaboratorioLos exámenes de laboratorio deben basarse siempre en la historia y examen físico del paciente. Siempre se debe contar con un hemoglucotest, tomar electrolitos plasmáticos y determinación de glóbulos blancos. Según la historia, podría incluirse screening toxicológico, niveles de amonio u otros exámenes metabólicos (aminoacidemia, ácidos orgánicos) y si ya está en tratamiento, niveles plasmáticos de anticonvulsivantes (38). La punción lumbar debe ser considerada en pacientes con signos meníngeos, compromiso de conciencia, período post ictal prolongado o en crisis neonatales. Los pacientes que luego de una crisis afebril vuelven a su estado de base previo, no requieren punción lumbar (39). La necesidad de punción lumbar en un niño con crisis febril genera controversia. Las guías de la Academia Americana de Pediatría recomiendan considerar fuertemente la necesidad de punción lumbar en niños menores de 12 meses y considerarlo en menores de 18 meses (40).
2. NeuroimágenesLa decisión de realizar neuroimágenes en la sala de emergencia, se debe evaluar caso a caso.
La tomografía cerebral es de baja sensibilidad en el estudio de epilepsia, pero de gran utilidad como examen de urgencia, en aquel paciente con antecedente de traumatismo encefalocraneano (TEC) reciente, de derivativa ventrículo peritoneal, sospecha de hemorragia o bien crisis que persistan con déficit focales en el período post ictal o asociadas a compromiso de conciencia, en que se sospechen complicaciones hemorrágicas. (13, 31, 37).
Resonancia Magnética Cerebral es de elección cuando se sospecha un síndrome epiléptico, pero no es un examen de urgencia.
Indicaciones de realización post primo crisis afebril- Crisis focal con o sin generalización secundaria.
- Examen neurológico anormal previo o posterior a la crisis.
- Pacientes con primocrisis afebril menor de 1 año.
3. Electroencefalograma (EEG)Electroencefalograma de emergencia debe ser reservado sólo a pacientes con sospecha de estado epiléptico no convulsivo o con actividad epiléptica ictal subclinica. El comité de calidad de la Academia Americana de Pediatría encuentra que la realización de un EEG, luego de una crisis afebril, puede ser muy útil en predecir el riesgo de recurrencia, puede servir para diferenciar una crisis epiléptica de otros eventos no convulsivos, para diagnosticar ciertos síndromes epilépticos y puede proveer información para el pronóstico a largo plazo del niño. Además, puede influenciar la necesidad de neuroimágenes y el manejo del niño (40).
Manejo inicialLas crisis epilépticas en su gran mayoría son de evolución autolimitada, no duran más de 2 a 3 minutos, por lo que es suficiente. Con medidas generales si se prolonga por sobre lo esperado, el tratamiento farmacológico es necesario.
Medidas generales- Lateralizar al paciente sin inmovilizarlo a fin de evitar sobre-excitación.
- Proteger cabeza evitando riesgo de golpe, quitar anteojos.
- Administración de oxígeno al 50% con mascarilla.
- Si es posible, permeabilización y mantenimiento de vías aéreas. Sin introducir nada por boca en caso de crisis generalizada por trismus secundario y riesgo de fractura dental, mandibular o vómito con aspiración secundaria.
Medidas FarmacológicasSi la crisis no cede en 3 minutos se iniciará tratamiento farmacológico escalonado en función a respuesta. Las benzodiacepinas son el fármaco de elección.
Manejo agudo de la crisis- •
Diazepam: 0,5mg/kg vía rectal, con un máximo de 10mg. repetido por 2 veces. Se alcanzan máximas dosis plasmáticas a los 10-15 minutos.
- •
Lorazepam: Vía sublingual o EV. Dosis: 0,02 - 0,05mg/kg con un máximo de 4mg.
- •
Midazolam: IV, se administra a dosis de 0,1-0,3mg/kg/dosis, para continuar de ser necesario en dosis de 0,1-0,4mg/kg/hr.
- •
Fenitoína: IV, se administra bajo monitoreo electrocardiográfico en solución de suero fisiológico a un ritmo de 100 gotas/minuto. Dosis de carga 20mg/kg/dosis.
- •
Otros fármacos: la falta de respuesta a esta línea terapéutica nos pone en un escenario de estatus epiléptico inminente. El paciente ya es derivado a una Unidad de cuidados intensivos y los fármacos a usar van depender de la etiología de base, antecedentes previos del niño y los exámenes ya realizados.
- 1.
Manejo de la fiebre, cuando esté presente.
- 2.
Bolo de dextrosa (2–4 mL/kg/dosis of 25% dextrosa intravenosa) debe ser dado en todos los casos donde se documenta hipoglicemia.
- 3.
En pacientes con intoxicación a fármacos poner su antídoto.
- 4.
En el caso de neonatos, el manejo inicial es similar a los niños mayores. La prioridad inmediata incluye estabilización de vía aérea, respiratoria y circulatoria, asociado a la terapia para abortar la crisis. El manejo clínico habitual de las CN ha cambiado poco en los últimos 50 años; frente a una crisis documentada la mayoría (>92%) de los recién nacidos recibe tratamiento antiepiléptico, siendo la elección de primera línea:
- •
Fenobarbital (20-40mg/k),
- •
siguiendo con Fenitoína (20mg/k)
- •
y/o benzodiazepinas como Lorazepam (0.05-0.1mg/k) en caso de refractariedad
- •
En crisis refractarias a fenobarbital y fenitoína, se ha considerado la efectividad de midazolam en un bolo inicial de 0.15mg/kg, seguido de una infusión continua (1ug/kg/min) aumentando 0.5 a 1ug/kg/min cada 2 min (máximo: 18ug/kg/min) hasta obtener respuesta favorable clínica y EEG.
Aunque no se cuenta con información acerca de la farmacocinética, interacciones y efectos adversos de levetiracetam y topiramato en neonatos, cerca del 50% de un grupo de neuropediatras encuestados declara recomendar estos fármacos en el tratamiento de segunda línea de CN refractarias (41-43).
Manejo a largo plazoLuego del control inicial de la crisis, el manejo posterior va a depender de la etiología de base, la posibilidad de recurrencia, la edad del niño y si constituye o no un síndrome especifico epiléptico. Las variables son múltiples, se debe tener en cuenta que el tratamiento anticonvulsivante puede disminuir la ocurrencia de una segunda o posterior crisis, pero no disminuye la incidencia de Epilepsia posterior.
La autora declara no tener conflictos de interés, en relación a este artículo.