El deterioro cognitivo y las demencias constituyen un importante problema de salud pública, convirtiéndose en una de las principales causas de discapacidad en los adultos mayores. Se estima que existen en la actualidad 46.8 millones de personas que padecen algún tipo de demencia en el mundo, proyectando que esta cifra se duplicará cada 20 años1. La Organización Mundial de la Salud (OMS) estima que existen actualmente cerca de 600 millones de personas con más de 60 años, cifra que se duplicará el año 2025 y llegará a los 2000 millones en el año 20502.
Este fenómeno se observa además a nivel local. Según cifras de la Encuesta CASEN 2013 hay 2.885.157 de adultos mayores de 60 años en Chile, lo que equivale al 16,7% de la población 3, estimando que en la actualidad existen cerca de 181.000 personas que padecen demencia 4.
Como en muchos trastornos crónicos, es importante considerar toda medida preventiva que pueda tener un impacto en su progresión. En la última década, una parte no menor de la investigación en deterioro cognitivo y demencia ha sido enfocada en la prevención mediante la modificación de hábitos de vida, la implementación de la dieta mediterránea y la corrección del déficit de vitamina D, existiendo aún controversia en este tema.
Cognitive impairment and dementia are an important public health problem, becoming one of the leading causes of disability in older adults. It is estimated that there are currently 46.8 million people suffering from some form of dementia in the world, projected that this number will double every 20 years 1. The World Health Organization (WHO) estimates that currently there are about 600 million people over 60 years, which number will double by 2025 and will reach 2000 million in 2050 2.
This phenomenon is also observed locally. According to numbers from the 2013 CASEN Survey there are 2.885.157 older adults over 60 years in Chile, this is equivalent to the 16.7% of the population 3, estimating that there are about 181,000 people suffering dementia 4.
Like in many chronic conditions, it is important to consider any preventive action that may have an impact on its progression. In the past decade, the major part of the cognitive impairment and dementia research has been focused on prevention by modifying lifestyles habits, by implementation of the Mediterranean diet and correction of vitamin D deficiency, even though there is still controversy on this topic.
Ante la carencia actual de una terapia curativa para las demencias y el deterioro cognitivo, los esfuerzos actuales están enfocados en parte en intentar modificar los múltiples factores que pueden influir en su desarrollo y progresión.
Revisiones recientes, muestran el rol de algunos alimentos y dietas específicas en la disminución del riesgo de desarrollar enfermedad de Alzheimer (EA) 5 deterioro cognitivo mínimo y demencia vascular 6.
Dentro de los factores potencialmente protectores identificados contra la demencia, destacan los antioxidantes presentes en frutas y verduras, ácidos grasos dietarios y algunos micronutrientes como la vitamina D 7.
La dieta mediterránea (DM) es reconocida a nivel mundial como una de las dietas más saludables 8, siendo reconocida por la UNESCO el año 2010, como Patrimonio de la Humanidad como estilo de vida saludable
En esta revisión, analizaremos información actual sobre la potencial utilidad de la DM y el uso de vitamina D en estas condiciones tan prevalentes.
DIETA MEDITERRÁNEAEsta dieta comenzó a adquirir notoriedad en la comunidad científica, dada la publicación en 1970 del Estudio de los Siete Países donde se observó que la mortalidad coronaria era mayor en Finlandia, Holanda y Estados Unidos, comparada con la mortalidad en Italia y Creta, llegando a la conclusión que no sólo era importante la proporción de lípidos en la dieta (similar en los tres primeros países y en Creta) sino que, además era importante el tipo de ácidos grasos que la componen, siendo la dieta mediterránea baja en grasas saturadas, alta en grasas monoinsaturadas con una adecuada proporción de ácidos grasos omega 6/omega 3, baja en proteína animal y alta en antioxidantes, carbohidratos complejos y fibra 9.
Como patrón alimentario, este tipo de dietas es típicamente alta en frutas y verduras frescas de estación, granos enteros, legumbres, nueces y semillas e incluyen el aceite de oliva extra virgen rico en ácidos grasos monoinsaturados como principal fuente de grasa. Normalmente hay cantidades bajas a moderadas de pescado, aves y productos lácteos, con poca cantidad de carne roja y moderado consumo de alcohol con las comidas (vino tinto) 10.
Existe evidencia acerca del factor protector de la dieta mediterránea sobre el deterioro cognitivo y el desarrollo de demencia. Publicaciones recientes demuestran que una mayor adherencia a la dieta mediterránea se asocia a un menor deterioro de los test de función cognitiva en población mediterránea añosa 11.
Además, un reciente estudio que comparó el volumen cerebral, medido en resonancia magnética cerebral, en una muestra de 700 adultos mayores no dementes, de un población multiétnica adherente y no adherente a la dieta mediterránea, encontró diferencias significativas en áreas temporales, parietales y singulares reflejando una diferencia de 5 años de envejecimiento 12.
También, se ha mostrado una reducción significativa en el riesgo de desarrollar EA en sujetos sin demencia previa que siguen una DM, utilizando el consumo de ácidos grasos monoinsaturados como marcador de adherencia a la dieta 8.
El estudio longitudinal Italiano de envejecimiento mostró que la ingesta de AGMI (mayormente obtenidos del aceite de oliva) en población añosa en el sur de Italia, se asoció con una reducción global del riesgo de deterioro cognitivo 13.
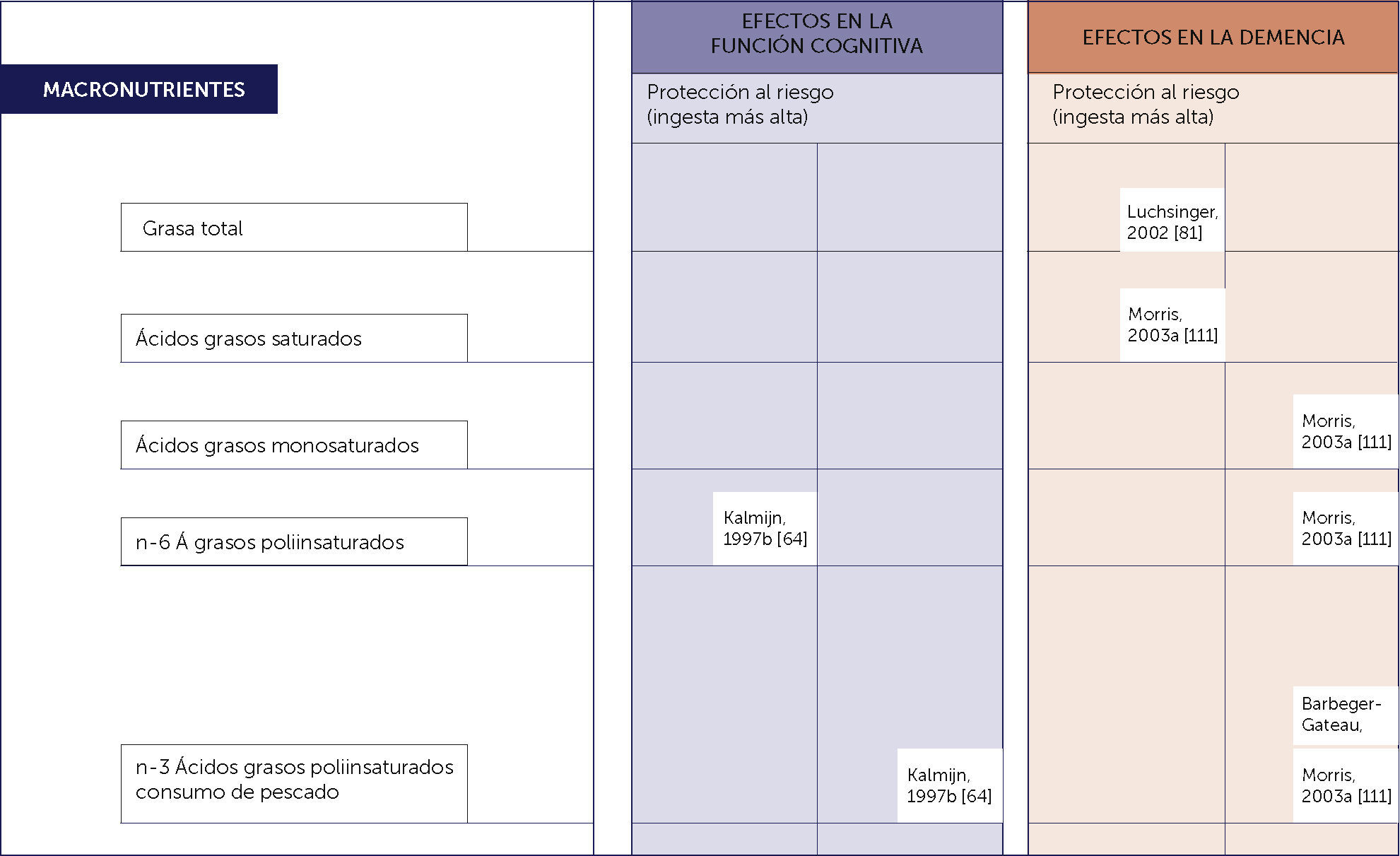
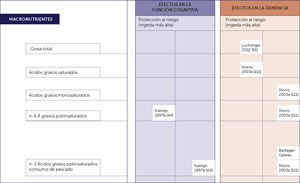
El alto consumo de pescados ricos en omega 3 si demuestra una relación inversa con el desarrollo de deterioro cognitvo 6,14. Figura 1.
SINOPSIS DE LA EVIDENCIA DE ESTUDIOS PROSPECTIVOS BASADOS EN POBLACIONES SOBRE LOS POSIBLES EFECTOS DE LOS MACRONUTRIENTES EN LA FUNCIÓN COGNITIVA Y LA DEMENCIA EN LA VEJEZ
Adaptado de Del Parigi et al. Nutritional Factors, cognitive decline, and dementia. Brain Res. Bull, 69(2006):1-19.
Dentro de los componentes de la dieta mediterránea, es importante el alto contenido de antioxidantes que ésta aporta. El tejido cerebral es particularmente sensible al daño producido por los radicales libres dado el bajo nivel de antioxidantes endógenos que posee 15.
Existen diversos estudios epidemiológicos que demuestran la relación entre las concentraciones plasmáticas de micronutrientes y antioxidantes con el deterioro cognitivo, como se ilustra en la Tabla 1 y Tabla 26.
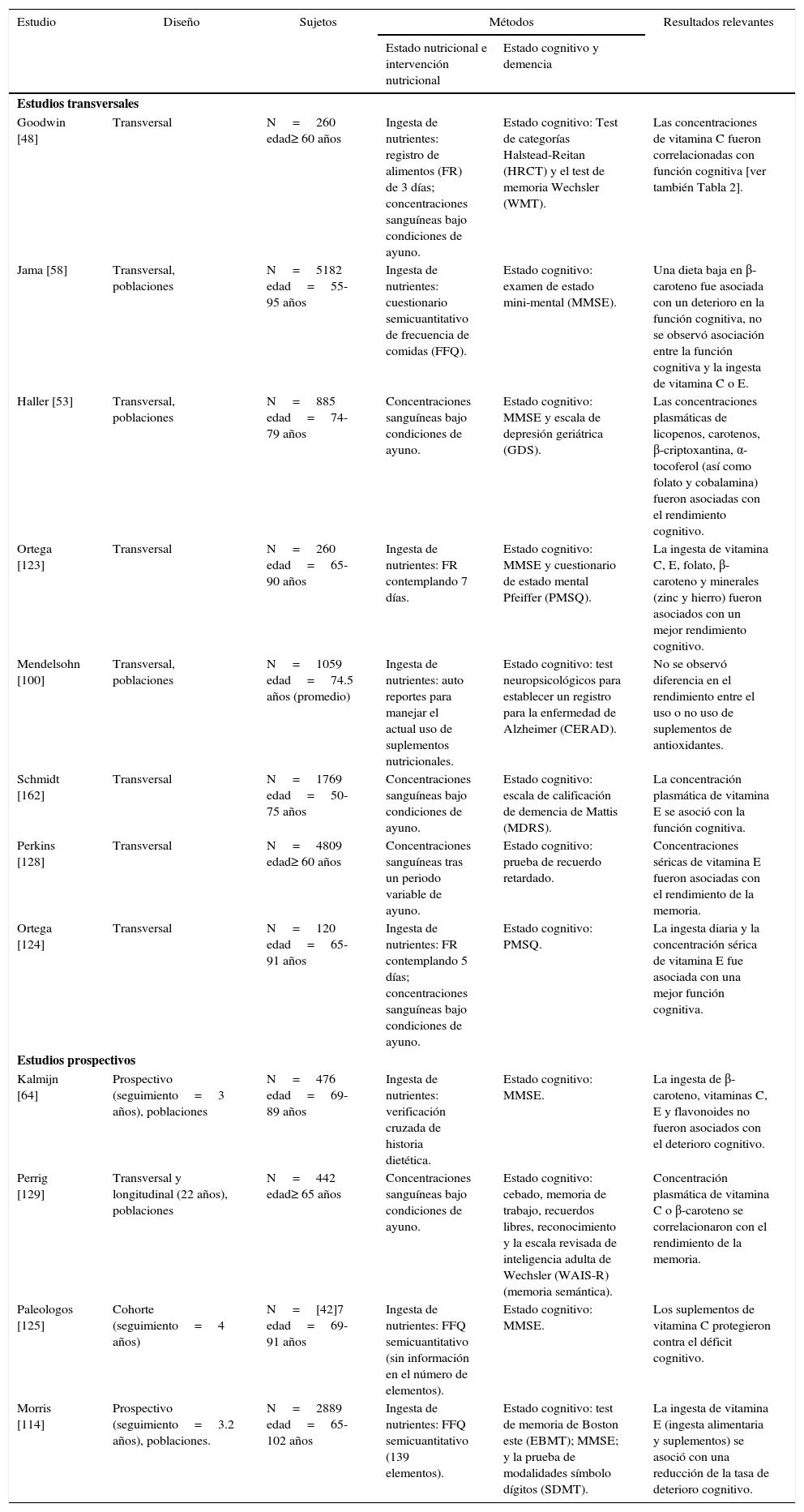
PRINCIPALES ESTUDIOS TRANSVERSALES Y ESTUDIOS PROSPECTIVOS EN LA RELACIÓN ENTRE LA INGESTA DE ANTIOXIDANTES Y EL DETERIORO COGNITIVO
| Estudio | Diseño | Sujetos | Métodos | Resultados relevantes | |
|---|---|---|---|---|---|
| Estado nutricional e intervención nutricional | Estado cognitivo y demencia | ||||
| Estudios transversales | |||||
| Goodwin [48] | Transversal | N=260 edad≥ 60 años | Ingesta de nutrientes: registro de alimentos (FR) de 3 días; concentraciones sanguíneas bajo condiciones de ayuno. | Estado cognitivo: Test de categorías Halstead-Reitan (HRCT) y el test de memoria Wechsler (WMT). | Las concentraciones de vitamina C fueron correlacionadas con función cognitiva [ver también Tabla 2]. |
| Jama [58] | Transversal, poblaciones | N=5182 edad=55-95 años | Ingesta de nutrientes: cuestionario semicuantitativo de frecuencia de comidas (FFQ). | Estado cognitivo: examen de estado mini-mental (MMSE). | Una dieta baja en β-caroteno fue asociada con un deterioro en la función cognitiva, no se observó asociación entre la función cognitiva y la ingesta de vitamina C o E. |
| Haller [53] | Transversal, poblaciones | N=885 edad=74-79 años | Concentraciones sanguíneas bajo condiciones de ayuno. | Estado cognitivo: MMSE y escala de depresión geriátrica (GDS). | Las concentraciones plasmáticas de licopenos, carotenos, β-criptoxantina, α-tocoferol (así como folato y cobalamina) fueron asociadas con el rendimiento cognitivo. |
| Ortega [123] | Transversal | N=260 edad=65-90 años | Ingesta de nutrientes: FR contemplando 7 días. | Estado cognitivo: MMSE y cuestionario de estado mental Pfeiffer (PMSQ). | La ingesta de vitamina C, E, folato, β-caroteno y minerales (zinc y hierro) fueron asociados con un mejor rendimiento cognitivo. |
| Mendelsohn [100] | Transversal, poblaciones | N=1059 edad=74.5 años (promedio) | Ingesta de nutrientes: auto reportes para manejar el actual uso de suplementos nutricionales. | Estado cognitivo: test neuropsicológicos para establecer un registro para la enfermedad de Alzheimer (CERAD). | No se observó diferencia en el rendimiento entre el uso o no uso de suplementos de antioxidantes. |
| Schmidt [162] | Transversal | N=1769 edad=50-75 años | Concentraciones sanguíneas bajo condiciones de ayuno. | Estado cognitivo: escala de calificación de demencia de Mattis (MDRS). | La concentración plasmática de vitamina E se asoció con la función cognitiva. |
| Perkins [128] | Transversal | N=4809 edad≥ 60 años | Concentraciones sanguíneas tras un periodo variable de ayuno. | Estado cognitivo: prueba de recuerdo retardado. | Concentraciones séricas de vitamina E fueron asociadas con el rendimiento de la memoria. |
| Ortega [124] | Transversal | N=120 edad=65-91 años | Ingesta de nutrientes: FR contemplando 5 días; concentraciones sanguíneas bajo condiciones de ayuno. | Estado cognitivo: PMSQ. | La ingesta diaria y la concentración sérica de vitamina E fue asociada con una mejor función cognitiva. |
| Estudios prospectivos | |||||
| Kalmijn [64] | Prospectivo (seguimiento=3 años), poblaciones | N=476 edad=69-89 años | Ingesta de nutrientes: verificación cruzada de historia dietética. | Estado cognitivo: MMSE. | La ingesta de β-caroteno, vitaminas C, E y flavonoides no fueron asociados con el deterioro cognitivo. |
| Perrig [129] | Transversal y longitudinal (22 años), poblaciones | N=442 edad≥ 65 años | Concentraciones sanguíneas bajo condiciones de ayuno. | Estado cognitivo: cebado, memoria de trabajo, recuerdos libres, reconocimiento y la escala revisada de inteligencia adulta de Wechsler (WAIS-R) (memoria semántica). | Concentración plasmática de vitamina C o β-caroteno se correlacionaron con el rendimiento de la memoria. |
| Paleologos [125] | Cohorte (seguimiento=4 años) | N=[42]7 edad=69-91 años | Ingesta de nutrientes: FFQ semicuantitativo (sin información en el número de elementos). | Estado cognitivo: MMSE. | Los suplementos de vitamina C protegieron contra el déficit cognitivo. |
| Morris [114] | Prospectivo (seguimiento=3.2 años), poblaciones. | N=2889 edad=65-102 años | Ingesta de nutrientes: FFQ semicuantitativo (139 elementos). | Estado cognitivo: test de memoria de Boston este (EBMT); MMSE; y la prueba de modalidades símbolo dígitos (SDMT). | La ingesta de vitamina E (ingesta alimentaria y suplementos) se asoció con una reducción de la tasa de deterioro cognitivo. |
CERAD, batería de 15 pruebas evaluando el desempeño en varios dominios cognitivos (función mental global, nombramiento, aprendizaje inmediato y retrasado, fluidez verbal, etc.); EBMT, recuerdo inmediato y retrasado; HRCT, test no verbal de pensamiento abstracto y resolución de problemas; MDRS, función cognitiva global; MMSE, función cognitiva global; PMSQ, función cognitiva global; SDMT, velocidad de percepción; WAIS, rendimiento cognitivo, coeficiente de inteligencia (IQ); WMT, recuerdo inmediato.
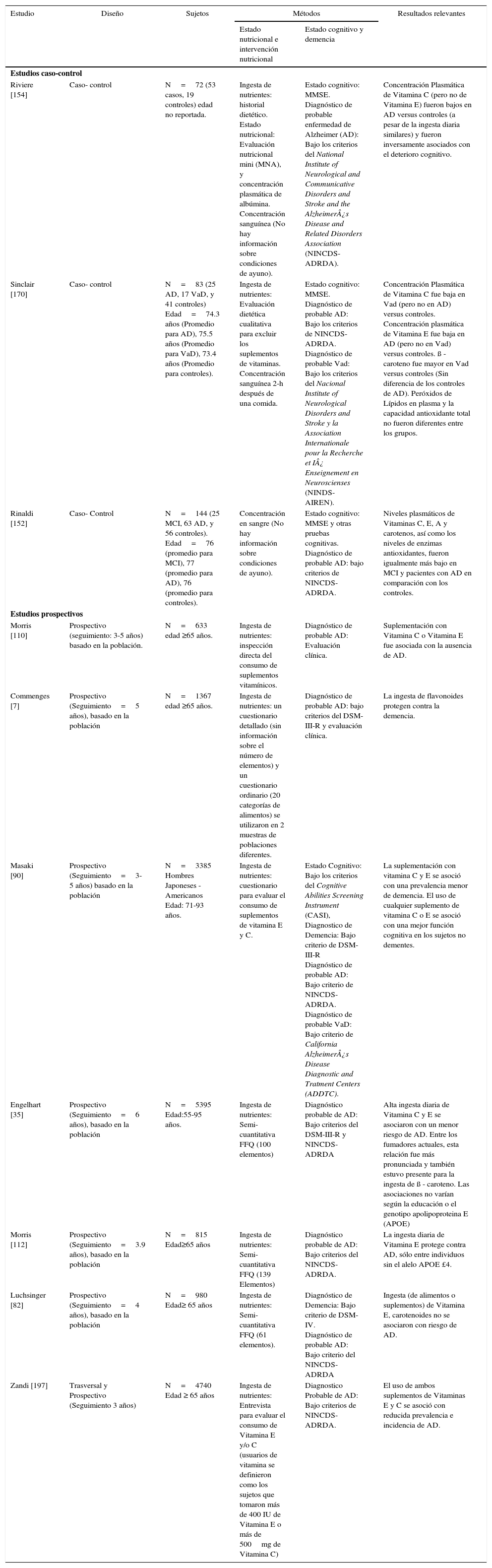
PRINCIPALES ESTUDIOS CASO-CONTROL Y ESTUDIOS PROSPECTIVOS EN LA RELACIÓN ENTRE LA INGESTA DE ANTIOXIDANTES Y EL DETERIORO COGNITIVO
| Estudio | Diseño | Sujetos | Métodos | Resultados relevantes | |
|---|---|---|---|---|---|
| Estado nutricional e intervención nutricional | Estado cognitivo y demencia | ||||
| Estudios caso-control | |||||
| Riviere [154] | Caso- control | N=72 (53 casos, 19 controles) edad no reportada. | Ingesta de nutrientes: historial dietético. Estado nutricional: Evaluación nutricional mini (MNA), y concentración plasmática de albúmina. Concentración sanguínea (No hay información sobre condiciones de ayuno). | Estado cognitivo: MMSE. Diagnóstico de probable enfermedad de Alzheimer (AD): Bajo los criterios del National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer¿s Disease and Related Disorders Association (NINCDS- ADRDA). | Concentración Plasmática de Vitamina C (pero no de Vitamina E) fueron bajos en AD versus controles (a pesar de la ingesta diaria similares) y fueron inversamente asociados con el deterioro cognitivo. |
| Sinclair [170] | Caso- control | N=83 (25 AD, 17 VaD, y 41 controles) Edad=74.3 años (Promedio para AD), 75.5 años (Promedio para VaD), 73.4 años (Promedio para controles). | Ingesta de nutrientes: Evaluación dietética cualitativa para excluir los suplementos de vitaminas. Concentración sanguínea 2-h después de una comida. | Estado cognitivo: MMSE. Diagnóstico de probable AD: Bajo los criterios de NINCDS- ADRDA. Diagnóstico de probable Vad: Bajo los criterios del Nacional Institute of Neurological Disorders and Stroke y la Association Internationale pour la Recherche et I¿ Enseignement en Neuroscienses (NINDS- AIREN). | Concentración Plasmática de Vitamina C fue baja en Vad (pero no en AD) versus controles. Concentración plasmática de Vitamina E fue baja en AD (pero no en Vad) versus controles. ß - caroteno fue mayor en Vad versus controles (Sin diferencia de los controles de AD). Peróxidos de Lípidos en plasma y la capacidad antioxidante total no fueron diferentes entre los grupos. |
| Rinaldi [152] | Caso- Control | N=144 (25 MCI, 63 AD, y 56 controles). Edad=76 (promedio para MCI), 77 (promedio para AD), 76 (promedio para controles). | Concentración en sangre (No hay información sobre condiciones de ayuno). | Estado cognitivo: MMSE y otras pruebas cognitivas. Diagnóstico de probable AD: bajo criterios de NINCDS- ADRDA. | Niveles plasmáticos de Vitaminas C, E, A y carotenos, así como los niveles de enzimas antioxidantes, fueron igualmente más bajo en MCI y pacientes con AD en comparación con los controles. |
| Estudios prospectivos | |||||
| Morris [110] | Prospectivo (seguimiento: 3-5 años) basado en la población. | N=633 edad ≥65 años. | Ingesta de nutrientes: inspección directa del consumo de suplementos vitamínicos. | Diagnóstico de probable AD: Evaluación clínica. | Suplementación con Vitamina C o Vitamina E fue asociada con la ausencia de AD. |
| Commenges [7] | Prospectivo (Seguimiento=5 años), basado en la población | N=1367 edad ≥65 años. | Ingesta de nutrientes: un cuestionario detallado (sin información sobre el número de elementos) y un cuestionario ordinario (20 categorías de alimentos) se utilizaron en 2 muestras de poblaciones diferentes. | Diagnóstico de probable AD: bajo criterios del DSM-III-R y evaluación clínica. | La ingesta de flavonoides protegen contra la demencia. |
| Masaki [90] | Prospectivo (Seguimiento=3-5 años) basado en la población | N=3385 Hombres Japoneses - Americanos Edad: 71-93 años. | Ingesta de nutrientes: cuestionario para evaluar el consumo de suplementos de vitamina E y C. | Estado Cognitivo: Bajo los criterios del Cognitive Abilities Screening Instrument (CASI), Diagnostico de Demencia: Bajo criterio de DSM-III-R Diagnóstico de probable AD: Bajo criterio de NINCDS-ADRDA. Diagnóstico de probable VaD: Bajo criterio de California Alzheimer¿s Disease Diagnostic and Tratment Centers (ADDTC). | La suplementación con vitamina C y E se asoció con una prevalencia menor de demencia. El uso de cualquier suplemento de vitamina C o E se asoció con una mejor función cognitiva en los sujetos no dementes. |
| Engelhart [35] | Prospectivo (Seguimiento=6 años), basado en la población | N=5395 Edad:55-95 años. | Ingesta de nutrientes: Semi-cuantitativa FFQ (100 elementos) | Diagnóstico probable de AD: Bajo criterios del DSM-III-R y NINCDS-ADRDA | Alta ingesta diaria de Vitamina C y E se asociaron con un menor riesgo de AD. Entre los fumadores actuales, esta relación fue más pronunciada y también estuvo presente para la ingesta de ß - caroteno. Las asociaciones no varían según la educación o el genotipo apolipoproteina E (APOE) |
| Morris [112] | Prospectivo (Seguimiento=3.9 años), basado en la población | N=815 Edad≥65 años | Ingesta de nutrientes: Semi-cuantitativa FFQ (139 Elementos) | Diagnóstico probable de AD: Bajo criterios del NINCDS-ADRDA. | La ingesta diaria de Vitamina E protege contra AD, sólo entre individuos sin el alelo APOE £4. |
| Luchsinger [82] | Prospectivo (Seguimiento=4 años), basado en la población | N=980 Edad≥ 65 años | Ingesta de nutrientes: Semi- cuantitativa FFQ (61 elementos). | Diagnóstico de Demencia: Bajo criterio de DSM-IV. Diagnóstico de probable AD: Bajo criterio del NINCDS-ADRDA | Ingesta (de alimentos o suplementos) de Vitamina E, carotenoides no se asociaron con riesgo de AD. |
| Zandi [197] | Trasversal y Prospectivo (Seguimiento 3 años) | N=4740 Edad ≥ 65 años | Ingesta de nutrientes: Entrevista para evaluar el consumo de Vitamina E y/o C (usuarios de vitamina se definieron como los sujetos que tomaron más de 400 IU de Vitamina E o más de 500mg de Vitamina C) | Diagnostico Probable de AD: Bajo criterios de NINCDS-ADRDA. | El uso de ambos suplementos de Vitaminas E y C se asoció con reducida prevalencia e incidencia de AD. |
CASI, Función cognitiva global; MNA, evaluación integral del estado nutricional, incluyendo medidas antropométricas, un cuestionario dietético, y una evaluación global.
Por otra parte, es importante considerar el estatus de vitamina D en nuestra población, dado que su deficiencia se asocia con anormalidades estructurales cerebrales, deterioro cognitivo y demencia. Estudios recientes muestran una alta prevalencia de insuficiencia o deficiencia de vitamina D en individuos hispanos y afroamericanos 16.
El interés por la vitamina D ha aumentado enormemente desde la década pasada, ya no sólo por su rol en el sistema esquelético, sino por que se descubrió que la vitamina D se comporta como una hormona al actuar, a través de receptores nucleares, en tejidos no relacionados con calcio o sistema óseo. Muchos investigadores clínicos han comenzado a sugerir una alta ingesta de vitamina D como suplemento, basándose en la interpretación de mediciones epidemiológicas que demuestran que la vitamina D podría jugar un rol fundamental en la supresión de un gran número de patologías 17,18.
La deficiencia de vitamina D continúa siendo común tanto en adultos como en niños, in útero y durante la infancia. La deficiencia de vitamina D puede causar retraso en el crecimiento y deformidad esquelética. En adultos además, puede precipitar o acelerar la osteopenia y la osteoporosis, causar osteomalacia y debilidad muscular, aumentando el riesgo de fractura de cadera en adultos mayores. El descubrimiento de que la mayoría de los tejidos y células del cuerpo tienen receptores de esta vitamina, y toda la maquinaria enzimática para convertir la forma primaria de circulación plasmática de vitamina D (25 hidroxivitamina D) a su forma activa (1, 25 dihidroxivitamina D), ha dado una nueva perspectiva a la función de esta vitamina 19.
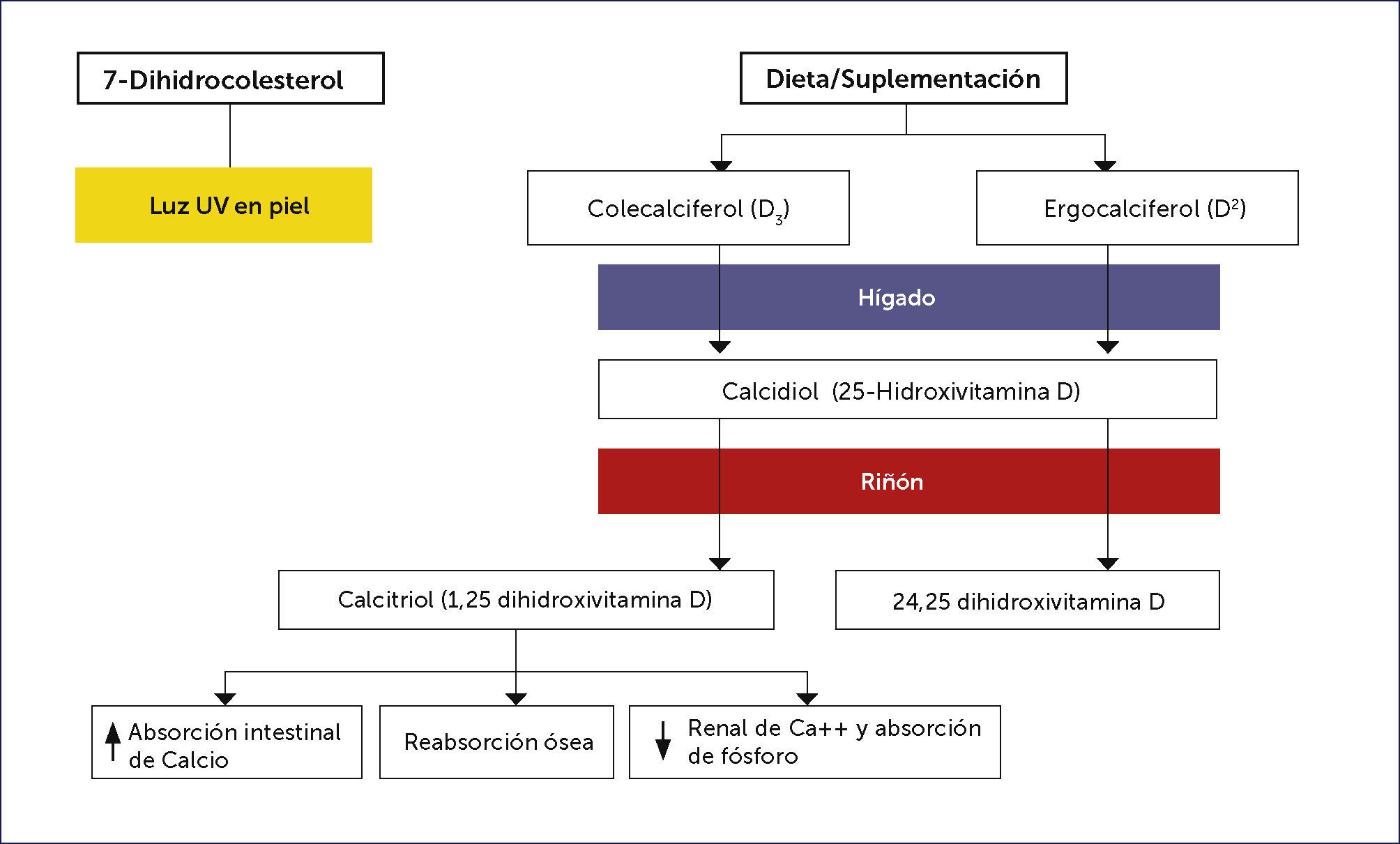
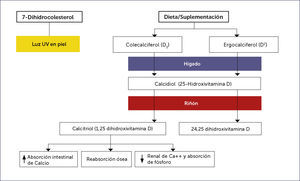
Fuentes y metabolismo de vitamina DMuy pocos alimentos contienen vitamina D (a excepción del hígado de pescados grasos) siendo la síntesis cutánea la principal fuente natural de la vitamina. La previtamina D3 se sintetiza no enzimáticamente en la piel a partir de 7-dehidrocolesterol durante la exposición a los rayos ultravioletas del sol (con una longitud de onda entre 290 a 315nm).
Luego, sufre un reordenamiento dependiente de la temperatura, para formar la vitamina D3 (colecalciferol). Este sistema es sumamente eficiente y se estima que una breve exposición informal de los brazos y la cara es equivalente a la ingestión de 200 unidades internacionales por día 20. Sin embargo, la duración de la exposición diaria necesaria para obtener el equivalente de la luz solar por vía oral (suplementos de vitamina D) es difícil de predecir en forma individual y varía con el tipo de piel, la latitud, la estación y la hora del día 21,22. La exposición prolongada de la piel a la luz solar no produce cantidades tóxicas de vitamina D3, ya que, existe fotoconversión de previtamina D3 y vitamina D3 en metabolitos inactivos (lumisterol, taquisterol, 5,6-transvitamina-D y suprasterol 1 y 2) 23,24.
La luz solar induce la producción de melanina, lo que reduce la producción de vitamina D3 en la piel. Los bebés, las personas discapacitadas y los ancianos, son las más predispuestas a tener una exposición al sol inadecuada, mientras que la piel de los mayores de 70 años de edad se caracteriza por tener disminuida la capacidad de convertir la vitamina D (mecanismos menos eficaces). Por otro lado, en las latitudes del norte, no hay suficiente radiación como para convertir la vitamina D, especialmente durante el invierno.
Por lo tanto, los seres humanos obtienen la vitamina D de la exposición a la luz solar, de la dieta, y de suplementos dietéticos. Una dieta alta en pescados aceitosos, previene la deficiencia de vitamina D3 25.
La vitamina D2 es fabricada por la irradiación ultravioleta de ergosterol proveniente de levadura, en tanto, la vitamina D3, a través de la irradiación ultravioleta del 7-dihidrocolesterol proveniente de lanolina.
La vitamina D de la piel y de la dieta, es metabolizada en el hígado a 25-hidroxivitamina D, la cual es medida en plasma para determinar el nivel circulante efectivo en los pacientes 26.
Metabolismo hepáticoLa vitamina D proveniente de la dieta es soluble en grasa y se absorbe en el intestino delgado incorporado a los quilomicrones. Luego, ligada a proteínas de unión, viaja hasta el hígado, en continua asociación con los quilomicrones y lipoproteínas 27,28. La enzima hepática 25-hidroxilasa agrega un grupo hidroxilo en la posición 25 de la molécula de la vitamina D, dando como resultado, la formación de 25-hidroxivitamina D o calcidiol.
El hígado es el sistema de almacenamiento habitual de vitamina D, cuando se ingieren grandes cantidades de vitamina D, la mayor parte del exceso de ésta, se almacena en el tejido adiposo 29. Cuando este mecanismo se satura, se mantiene en el suero y se convierte en niveles tóxicos de 25-hidroxivitamina D 21. (Figura 2).
Metabolismo renalLa 25-hidroxivitamina D es metabolizada en los riñones por la enzima 25-hidroxivitamina D-1 α hidroxilasa (CYP27B1) a su forma activa, 1,25-dihidroxivitamina D (Figura 1). La producción renal de 1,25-dihidroxivitamina D está fuertemente regulada por los niveles plasmáticos de hormona paratiroides, calcio y fósforo como se ha estudiado ampliamente 26.
La 25-hidroxivitamina D2 y D3 (25OHD) producida por el hígado entra en la circulación y viaja a los riñones, vinculado a proteínas de unión. Esta proteína tiene un solo sitio de unión, que une la vitamina D y todos sus metabolitos. Sólo de 3 a 5% del total que circula, posee los sitios de unión normalmente ocupados, por lo tanto, esta proteína no es la limitante en el metabolismo de vitamina D a menos que, grandes cantidades se pierdan en la orina como sucede en el caso del síndrome nefrótico 29.
La enzima 1-αhidroxilasa, se expresa también en los sitios extrarrenales, incluyendo el tracto gastrointestinal, piel, vasos sanguíneos, las células epiteliales mamarias, y en los osteoblastos y los osteoclastos 30. La concentración plasmática de 1,25-hidroxivitamina D es una función tanto de la disponibilidad de 25OHD, como de las actividades de las enzimas renal 1-α-hidroxilasa y 24-α-hidroxilasa.
La actividad de la enzima renal 1-α-hidroxilasa está regulada principalmente por los siguientes factores:
- •
La hormona paratiroidea (PTH)
- •
El calcio sérico y las concentraciones de fosfato
- •
Factor de crecimiento fibroblástico 23 (FGF23)
El aumento de la secreción de PTH (con mayor frecuencia debido a una caída en la concentración de calcio en el plasma) e hipofosfatemia estimulan esta enzima y aumentan la producción de 1,25 dihidroxivitamina D 31.
Metabolismo extrarrenal: rol de la 1-alfa-hidroxilasaLa manifestación más conocida de la síntesis extrarrenal de 1,25-hidroxivitamina D es la hipercalcemia e hipercalciuria en los pacientes con enfermedades granulomatosas, como la sarcoidosis (producción por manifestación pulmonar).
La enzima 1-α-hidroxilasa, se expresa también en otros sitios extrarrenales, incluyendo el tracto gastrointestinal, piel, vasos sanguíneos, células epiteliales mamarias, osteoblastos y osteoclastos 30,31. La importancia fisiológica de la producción extrarrenal de 1,25-hidroxivitamina D sigue siendo incierta. La hipótesis más aceptada es que la 1,25 hidroxivitamina D extrarrenal, funciona en un tejido específico para regular la proliferación y diferenciación celular, además de la secreción hormonal y la función inmunológica.
La 1,25-hidroxivitamina D se une a receptores intracelulares en los tejidos y regula la transcripción de genes 32. Su acción biológica más importante es promover la diferenciación de los enterocitos y la absorción intestinal de calcio. Otros efectos incluyen la estimulación de la menor absorción de fosfato intestinal, la supresión directa de la liberación de PTH de la glándula paratiroidea, la regulación de la función de los osteoblastos y la permisividad dada por PTH inducida por la activación de los osteoclastos y la resorción ósea. A través de estas acciones, el calcitriol contribuye al mantenimiento de las concentraciones plasmáticas normales de calcio y fosfato, lo que permite que la mineralización del hueso recién formado tenga lugar, además de la prevención de hipocalcemia sintomática o hipofosfatemia.
Además de su importante papel en la homeostasis del calcio y el hueso, la 1,25-hidroxivitamina D, regula potencialmente muchas funciones celulares, jugando un rol cada vez más preponderante en enfermedades como la demencia.
La demencia es un problema creciente, que afecta principalmente a pacientes de edad avanzada. La enfermedad de Alzheimer (EA) es la forma más común de demencia en los ancianos, que representan el 60 al 80% por ciento de los casos 33.
Existe alguna evidencia de que la deficiencia de vitamina D se asocia con deterioro cognitivo en los adultos mayores. Un estudio poblacional transversal de mujeres adultas mayores demostró que aquellas con deficiencia de vitamina D tenían menores puntuaciones cognitivas en comparación con aquellas que no presentaban deficiencia 33, mientras que otro encontró que las mujeres con la ingesta de vitamina D en el nivel recomendado tenían mayores puntuaciones cognitivas en comparación con el grupo de ingesta insuficiente 34,35. Un segundo estudio de corte transversal mostró que los pacientes con bajos niveles de vitamina D tenían una mayor incidencia de infarto cerebral, así como una probabilidad más alta (dos veces) de todas las causas de la demencia 36.
Un estudio prospectivo que siguió a 1.604 hombres mayores, encontró una relación significativa entre el estado de vitamina D y la demencia 37. En contraste, los niveles bajos de vitamina D se asocian con el deterioro cognitivo en un período de seis años de observación en una cohorte de 858 adultos mayores de 65 años 38.
CONCLUSIONESEn las enfermedades neurodegenerativas -siendo su paradigma la enfermedad de Alzheimer- que carecen aún de terapia eficaz, no puede soslayarse toda medida preventiva de potencial impacto en la evolución de la enfermedad. Las terapias actuales son sintomáticas y de pobre resultado. Se ha ido acumulando evidencia que, cambios en estilos de vida, como actividad física, el consumo de dieta mediterránea y corrección de deficiencia de vitaminas como la D, tan prevalente en la población mayor, puede ser de ayuda para lograr este objetivo. Faltan estudios que confirmen estas experiencias, pero son esfuerzos que ameritan irse implementando. Apoyo a esto, lo dan los trabajos que fueron mencionados y que muestran cambios estructurales cerebrales favorables en quienes implementan por ejemplo, la dieta mediterránea.
Los autores declaran no tener conflictos de interés, en relación a este artículo.