Las enfermedades inflamatorias intestinales representan una patología de alta morbilidad. Esto debido a que se asocia a mayor su riesgo de desarrollo de neoplasias tanto colorrectales como colangiocarcinoma, desarrollo de complicaciones como fístulas, abscesos, estenosis intestinales espontáneas o postoperatorias y estenosis biliares en aquellas asociadas a colangitis esclerosante primaria. El rol del endoscopista avanzado en este grupo de pacientes se encuentra en la vigilancia de ambas neoplasias y en el tratamiento endoscópico de las complicaciones ya mencionadas. En relación a la vigilancia de cáncer colorrectal, existen distintas recomendaciones internacionales respecto a los intervalos y las técnicas de vigilancia, situándose la cromoendoscopia como método de elección emergente en los últimos años. Es importante destacar la publicación del uso de nueva nomenclatura para los hallazgos colonoscópicos durante la vigilancia del cáncer colorectal, abandonando los conceptos de DALM o lesiones o masas asociadas a displasia, lesiones tipo adenoma o no adenomatosas.
ConclusiónNos parece que existe suficiente evidencia a la fecha para recomendar el entrenamiento en procedimientos terapéuticos y técnicas de vigilancia de CCR en EII como parte de la formación de endoscopistas avanzados, lo que permitiría que se integren al equipo multidisciplinario que maneja estos pacientes, ofreciéndoles alternativas de tratamiento a algunas patologías hasta hace un tiempo se reservaban para el manejo quirúrgico.
Inflammatory bowel diseases represent a high morbidity pathology given their high risk of developing both colorectal cancer and cholangiocarcinoma, besides the development of fistulas, abscesses, spontaneous or postoperative intestinal stenosis and biliary strictures in patients diagnosed with primary sclerosant cholangitis. The advanced endoscopist's rol in this group of patients lies within surveillance of both neoplasms and the endoscopic treatment of complications already mentioned. In relation to surveillance of colorectal cancer, there are various international recommendations regarding surveillance intervals and techniques, with chromoendoscopy emerging as a method of choice in recent years. It is important to highlight the use of new nomenclature for colonoscopic findings during surveillance, abandoning concepts as DALM, adenoma-like lesions or non adenoma-like lesions.
ConclusionIt is our opinion that to date there is enough evidence to recommend training in therapeutic procedures and colorectal cancer surveillance techniques in IBD as part of the training process for advanced endoscopists. This will enable them to take part in multidisciplinary teams that handles those patients, offering treatment alternatives for some pathologies that until now had only been managed with surgery.
Las enfermedades inflamatorias intestinales (EII) corresponden a un grupo de enfermedades determinadas por una inflamación crónica del intestino, caracterizadas por períodos de remisión y reactivación alternantes. La Colitis Ulcerosa (CU) y la Enfermedad de Crohn (EC) son las enfermedades más importantes de este grupo, que resultan de una respuesta inflamatoria inapropiada a patógenos intestinales en individuos genéticamente susceptibles1. Contribuyen en forma importante a la patología colorrectal por la pérdida funcional de los segmentos intestinales afectados a largo plazo, su evolución hacia la cronicidad y el deterioro de la calidad de vida de los pacientes2. Su potencial evolución hacia complicaciones representa hasta ahora un alto riesgo de morbilidad quirúrgica, como la aparición de estenosis, fístulas, abscesos y el mayor riesgo de desarrollo de cáncer colorrectal (CCR) y colangiocarcinoma (CC) en el subgrupo de pacientes que desarrollan colangitis esclerosante primaria (CEP).
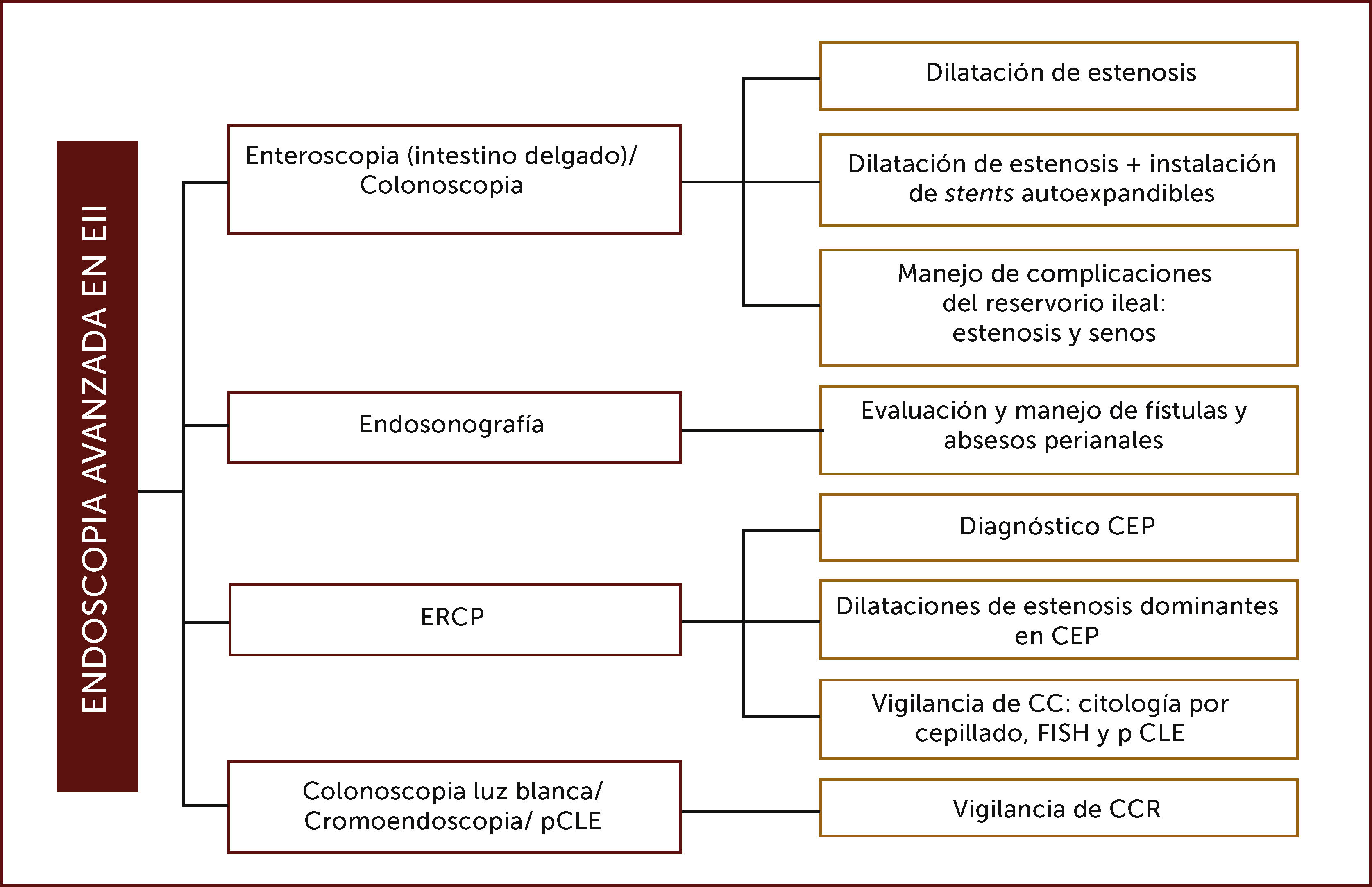
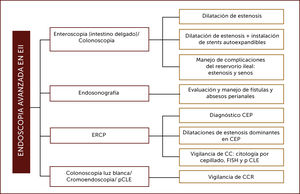
Hasta hoy el rol del endoscopista en EII está bien definido en el diagnóstico inicial, la diferenciación entre estas dos patologías y en evaluar su severidad. Con el desarrollo actual de técnicas de endoscopia más avanzadas, tanto diagnósticas como terapéuticas, se han expandido las indicaciones de procedimientos endoscópicos en estos pacientes3. La incorporación de endoscopistas avanzados en su manejo ha permitido el tratamiento endoscópico de estenosis anastomóticas y de intestino delgado, complicaciones del reservorio ileal post colectomía como estenosis y senos, la evaluación de fístulas y abscesos perianales mediante endosonografía rectal y la detección de displasia y CCR. Además, mediante la utilización de la colangiopancreatografía retrógrada endoscópica (CPRE), participan en el diagnóstico y manejo de la CEP y la pesquisa del CC (Figura 1).
ROL DEL ENDOSCOPISTA AVANZADO EN PACIENTES CON EII
Adaptado de Modha K, Navaneethan U. Advanced therapeutic endoscopist and inflammatory bowel disease: Dawn of a new role. World J Gastroenterol 2014. Siglas: CPRE: colangiopancreatografía retrógrada endoscópica, CEP: Colangitis esclerosante primaria, CC: Colangiocarcinoma, FISH: Hibridación in situ con fluorescencia, pCLE: endomicroscopia láser confocal, CCR: Cáncer colorrectal.
Discutiremos en esta revisión el rol del endoscopista avanzado en el manejo de pacientes con EII.
VIGILANCIA DE NEOPLASIAS EN ENFERMEDAD INFLAMATORIA INTESTINALI. VIGILANCIA DE CÁNCER COLORRECTALLos pacientes con EII de larga data tienen mayor riesgo de desarrollar CCR en comparación con la población general. Eaden et al estimó en su meta-análisis que la prevalencia global de CCR en CU es de 3,7% 4 y Ekdan et al en su estudio en población sueca estimó la razón de incidencia estandarizada en 5,7 5, sin embargo ambos estudios datan de la década del 90. Un metaanálisis reciente estimó el riesgo relativo en 2.4 6 y estudios más actualizados muestran un riesgo de CCR menor e incluso inexistente, con un riesgo relativo entre 1 y 2,75 7. En la EC, el riesgo de desarrollar CCR se iguala al de CU si existe compromiso colónico de al menos 1/3 de su extensión 8.
Las diferencias entre los estudios más antiguos con los actuales podrían estar determinadas por sesgos en la selección de los pacientes incluidos, el uso amplio de 5-ASA, la mejoría en el control de la inflamación de la mucosa, la realización de colectomía a tiempo y la implementación de programas de vigilancia 6.
Se conoce que el riesgo de CCR aumenta en proporción a los años transcurridos desde el inicio de los síntomas, y que éste comienza a aumentar desde los 8-10 años del debut de la enfermedad para colitis extensa y 15-20 años para colitis izquierda. Eaden mostró una incidencia acumulativa de 2% a 10 años, 8% a 20 años y 18% a los 30 años de la enfermedad. La duración promedio desde el debut a la presentación de CCR fue de 16.3 años 4. El estudio de vigilancia con mayor número de pacientes hasta el momento, mostró que el riesgo de CCR tiene una presentación lineal y no exponencial, estimando 2,5% a 20 años a 10,8% a 40 años de CU extensa, con una media hasta la presentación de 23,5 años 9. A pesar de estas cifras y de que la vigilancia se inicia clásicamente a los 8-10 años de enfermedad, Lutgens calculó que 17-22% de los pacientes desarrollarían CCR previo a este período. Creemos que dado que se trata de los resultados de un solo artículo, la recomendación de colonoscopía en pacientes con EII debe ser estratificada según la presencia de factores de riesgo de cada paciente 10. Es importante destacar el subgrupo de pacientes con EII asociado a CEP, quienes deben iniciar el programa de vigilancia con una colonoscopía anual desde el momento del diagnóstico 11. Otros factores de riesgo independiente de CCR en EII se mencionan en la Tabla 1
FACTORES DE RIESGO INDEPENDIENTES DE CÁNCER COLORRECTAL EN LA ENFERMEDAD INFLAMATORIA INTESTINAL
| Factor | Riesgo |
|---|---|
| Extensión de inflamación de la mucosa: Proctitis, colitis izquierda y colitis extensa | SIR de 1,7 – 2,8 y 14,8 respectivamente 5 |
| Inflamación macroscópica | OR 2,5 12 |
| Inflamación histológica | OR 5,1 12 |
| Presencia de múltiples pseudopólipos | OR 2,14 13 |
| Asociación con CEP | OR 4,09 14 |
| Historia familiar de CCR | OR 2,5 15 |
| Antecedente de un familiar de primer grado con CCR antes de los 50 años de edad | OR 9,2 15 |
La racionalidad de la secuencia inflamación-displasia-adenocarcinoma es lo que sustenta la realización de vigilancia de CCR en estos pacientes. Hasta la fecha, no existen estudios randomizados prospectivos que muestren un beneficio en términos de mortalidad de CCR en EII atribuible a la vigilancia, y probablemente no contaremos con ellos por razones éticas. El grupo Cochrane ha realizado revisiones sistemáticas en los años 2004 y 2006, sin poder establecer evidencia que la vigilancia mejore la sobrevida 16. Sin embargo, en la última revisión sólo dos estudios cumplieron los criterios de inclusión. Lutgen et al señalaron en su estudio retrospectivo que los pacientes diagnosticados con CCR mediante vigilancia tenían mejor pronóstico que aquellos fuera de ésta, con una sobrevida a cinco años de 100% vs 75% (p= 0,042), con una muerte en el grupo vigilancia vs 29 muertes en el otro grupo (p=0,047), y un diagnóstico de CCR en estadío temprano mayor que en el grupo sin vigilancia (p=0,004) 17.
La vigilancia mediante biopsias escalonadas como estándar fue establecido previo a la aparición y disponibilidad amplia de endoscopios de alta resolución y nuevas técnicas avanzadas endoscópicas de inspección de la mucosa.
Rubin et al estimó en el año 1992 que para obtener una sensibilidad adecuada para lesiones displásicas en mucosa plana, debían obtenerse entre 33 y 64 biopsias aleatorias en la colonoscopía 18. Sin embargo, en la actualidad se conoce que con este número de biopsias, el porcentaje de mucosa evaluado es muy bajo. En un estudio realizado a 300 profesionales en EE.UU., aproximadamente el 50% de los gastroenterólogos cumple con este número de biopsias y la tasa de detección de displasia mediante este método es baja, estimada en 0,2% versus 23% en biopsias dirigidas 19. A su vez, la evidencia actual demuestra que con el uso de la tecnología actual, las lesiones displásicas son visibles por el endoscopista 20. Es importante destacar que el uso de las nomenclaturas DALM (traducido como lesión o masa asociada a displasia), lesiones tipo adenoma o no adenomatosas actualmente se han abandonado, dando paso al uso más descriptivo de las lesiones según lo expuesto en la Tabla 221,22 .
TERMINOLOGÍA PARA DESCRIBIR LOS HALLAZGOS COLONOSCÓPICOS EN LA VIGILANCIA DE PACIENTES CON ENFERMEDAD INFLAMATORIA INTESTINAL 21
| Término | Definición |
|---|---|
| Displasia visible | Displasia identificada en biopsias dirigidas de una lesión colonoscópicamente visualizada |
| - Polipoidea | Lesión que protruye de la mucosa al lúmen ≥ 2,5 mm |
| • Pedunculada | Lesión adjunta a la mucosa por un tallo |
| • Sésil | Lesión caracterizada porque su base completa se encuentra contigua a la mucosa |
| - No-polipoidea | Lesión con protrusión mínima (<2,5mm) o ausente sobre la mucosa |
| • Superficialmente elevada | Lesión que protruye desde la mucosa pero <2,5 mm |
| • Plana | Lesión que no protruye sobre la mucosa |
| • Deprimida | Lesión con al menos una porción deprimida bajo el nivel de la mucosa |
| Descripción general | |
| • Ulcerada | Ulceración dentro de la lesión (base de aspecto fibrinoso con profundidad) |
| • Bordes | |
| -Distinguible | Borde es discreto y puede distinguirse de la mucosa circundante |
| -Indistinguible | Borde no puede ser distinguido de la mucosa circundante |
| Displasia invisible | Displasia identificada en biopsias aleatorias (no dirigidas) del colon sin una lesión visible. |
Si bien existe acuerdo entre expertos que los pacientes con EII deben ser sometidos a vigilancia, la implementación y la metodología de ella es motivo de desacuerdo, lo cual se refleja en la diferencia de las recomendaciones entre las distintas guías que existen hasta la fecha (Tabla 3).
RECOMENDACIONES INTERNACIONALES DE VIGILANCIA DE CÁNCER COLORRECTAL EN LA ENFERMEDAD INFLAMATORIA INTESTINAL
| Declaración de posición médica en el diagnóstico y manejo de neoplasias colorrectales en EII, Asociación Americana de Gastroenterología, AGA, año 2010 11: |
|---|
| - La técnica de vigilancia colonoscópica en pacientes con EII debe incluir biopsias extensas de todos los segmentos anatómicos de la mucosa colorrectal. |
| - Aunque no hay datos adecuados disponibles para recomendar un intervalo de vigilancia óptimo, se sugieren intervalos de 1 a 3 años. |
| - La inspección cuidadosa de la mucosa junto a un número suficiente de biopsias deberían obtenerse de todos los segmentos anatómicos del colon. |
| Consenso Europeo basado en evidencia para endoscopia en EII, ECCO, 2013 (23): |
| Declaración ECCO 13 E:- La vigilancia debe realizarse en todos los pacientes excepto en aquellos con proctitis o colitis de Crohn comprometiendo sólo un segmento colónico. Al no existir evidencia clara de los intervalos de vigilancia, intervalos individualizados basados en la estratificación de riesgo se recomiendan (NE 5, 100% de acuerdo): |
| a) Alto riesgo definido como estenosis o displasia detectada en los últimos cinco años, CEP, colitis extensa con inflamación activa severa o historia familiar de CCR en un familiar de primer grado antes de los 50 años: colonoscopía anual (NE 4, 93% de acuerdo). |
| b) Riesgo intermedio definido como colitis extensa con inflamación activa leve a moderada, presencia de pseudopólipos o historia familiar de CCR en familiar de primer grado mayor de 50 años: colonoscopía cada 2 a 3 años (NE 5, 100% de acuerdo) |
| c) Pacientes que no cumplan criterios de alto ni mediano riesgo, se agendará colonoscopía cada cinco años (NE 4, 93% de acuerdo). |
| Declaración ECCO 13G:- La vigilancia colonoscópica debe ser efectuada por cromoendoscopia pancolónica con azul de metileno o índigo carmín, con biopsias dirigidas de cualquier lesión visible (NE 2). Si no existe la experiencia apropiada en cromoendoscopia, se deben realizar biopsias escalonadas (4 cada 10 cms) (NE3); sin embargo, esto es inferior a la cromoendoscopia en la detección de lesiones neoplásicas (NE2, 100% de acuerdo). |
| Posición de consenso internacional SCENIC para la vigilancia y manejo de displasia en EII, Sociedad Americana de Endoscopia Gastrointestinal (ASGE), 2015 (21): |
| - Declaración 1: Cuando se realice vigilancia con colonoscopio de luz blanca, se recomienda alta definición por sobre definición estándar. |
| - Declaración 2: Cuando se realice vigilancia con colonoscopio de definición estándar, se recomienda cromoendoscopia por sobre colonoscopia con luz blanca. |
| - Declaración 3: Cuando se realice vigilancia con colonoscopio de alta definición, se recomienda cromoendoscopia por sobre colonoscopia con luz blanca. |
Vemos entonces que las guías de la AGA recomiendan una vigilancia uniforme en intervalos y basada en biopsias escalonadas, versus las guías europeas que recomiendan intervalos según estratificación de riesgo y como primera opción con cromoendoscopía más biopsias dirigidas. Se puede ver, como, en las últimas guías disponibles (ASGE), ya se recomienda en forma definitiva el uso de cromoendoscopía por sobre cualquier otra técnica.
Técnicas de detección de displasia
1) Colonoscopia con luz blanca estándar y luz blanca más alta definición:
La gran mayoría de las lesiones displásicas y neoplásicas en EII pueden ser detectadas con colonoscopios de luz blanca estándar, tanto las lesiones planas como elevadas. Esto basado en los hallazgos de los estudios de Rutter y Rubin, quienes reportaron una tasa de detección de displasia de 77,3% y 71,8% y de detección de neoplasia de 89,3% y 100% respectivamente 20,24.
La colonoscopia con luz blanca de alta definición (es decir una imagen con resolución de 850.000 a 1.000.000 de pixeles, versus 100.000 a 400.000 pixeles de los colonoscopios estándar) agrega más sensibilidad para la detección de displasia, sumando una relación de prevalencia ajustada de 2,99 25.
2) Cromoendoscopia:
La cromoendoscopía es la aplicación de tintes tópicos sobre la mucosa colónica para mejorar la delineación y detección de irregularidades de su superficie. Los más usados son el azul de metileno, que es absorbido por los colonocitos normales, no así por las células displásicas o inflamadas por lo que resalta el “pit pattern” de las lesiones mucosas, y el índigo carmín que no es absorbible y decanta hacia las criptas, demarcando las lesiones neoplásicas. Estos tintes se aplican a toda la mucosa colónica, mediante un catéter spray o inyectándolos directamente por el canal de trabajo. No hay estudios que comparen la eficacia entre ambos tintes 25.
A la fecha existe bastante evidencia que avala la efectividad del uso de cromoendoscopía en EII. Un estudio realizado por Keisslich et al comparó colonoscopía convencional versus cromoendoscopía usando azul de metileno en 165 pacientes con CU de larga data, estimando un aumento de tres veces en la detección de neoplasia intraepitelial (p=0,003), permitiendo diferenciar entre lesiones neoplásicas y no neoplásicas con una sensibilidad y especificidad del 93% 26. Rutter et al en un estudio de 100 pacientes, logró diagnosticar siete casos de displasia adicional con cromoendoscopia 27. Un metaanálisis reciente que incluyó seis estudios con un total de 1.277 pacientes, estimó la diferencia global de detección de displasia entre colonoscopía regular y cromoendoscopia de 7%, con un NNT de 14,3. Es importante destacar que el aumento del diagnóstico de lesiones displásicas planas fue de 27% 28. Un segundo metaanálisis estimó la correlación de detección por cromoendoscopia de neoplasia intraepitelial-histología en un 83.8% de sensibilidad y un 91.3% de especificidad 29.
Las desventajas de la cromoendoscopia son la necesidad de un entrenamiento en aplicación de tinciones, análisis de “pit pattern” e identificación de lesiones, especialmente planas, y un mayor tiempo de examen, estimándose en promedio 11 minutos adicionales, que podrían compensarse eliminando el protocolo de toma de biopsias escalonadas 25.
Respecto a las recomendaciones de guías internacionales para cromoendoscopia, ya mencionamos que el grupo ECCO la prefiere sobre las biopsias escalonadas. Las guías AGA del año 2010 reconocen su superioridad en detectar displasias, sin embargo consideran que está sujeta a la experiencia del endoscopista y que por el momento recomiendan mantener el sistema de biopsias por segmentos. Las últimas guías disponibles (ASGE), ya sitúan a la cromoendoscopia como el método de elección para vigilancia sobre cualquier otro.
3) FICE y i-Scan:
Estas dos técnicas son métodos de cromoendoscopia virtual, sin la necesidad de aplicar tinciones. FICE (Fujinon® Intelligent Chromoendoscopy, Tokyo, Japón) y i-Scan (Pentax®, Tokyo, Japón) funcionan en base a un algoritmo computacional que procesa la imagen después de ser captada con luz blanca regular. No existen hasta la fecha estudios realizados de detección de displasia/neoplasia en EII con estos métodos (3).
4) NBI o Narrow Band Imaging:
NBI es una tecnología que resalta la estructura de los vasos y la arquitectura de las criptas, usando filtros de luz especializados que modulan la intensidad de los constituyentes del espectro de luz blanca. Existen tres estudios en vigilancia en EII con endoscopios de primera generación y segunda generación (incluyendo de alta resolución), sin encontrar beneficio en la detección de displasia, con una mayor tasa de falsos positivos en biopsias y de lesiones no vistas en la colonoscopía (OR 4.21) 23,25. Las últimas guías ASGE no la recomiendan, situando incluso la colonoscopía con luz blanca de definición estándar por sobre la NBI.
5) AFI o Colonoscopia con autofluorescencia:
La colonoscopía con autofluorescencia usa los espectros de emisiones diferenciales de los tejidos para construir imágenes símiles a la cromoendoscopia. La presencia de fluoróforos en los colonocitos permite que al aplicar una luz de corta longitud, la mucosa emita (autofluorescencia) una mayor longitud de onda. La diferencia entre ambas entrega información acerca de si esa mucosa es normal, presenta inflamación, hiperplasia o displasia. Si bien ha mostrado resultados prometedores en la detección de displasia en EII, hasta el momento se ha restringido a centros altamente especializados y de investigación 25.
6) CLE o Endomicroscopia láser confocal:
Esta técnica permite el examen microscópico de la mucosa in vivo, requiriendo el uso adicional de contraste, siendo la fluoresceína la más utilizada. Por su nivel de magnificación, examina un pequeño porcentaje de la mucosa colónica, por lo que se reserva para el análisis de lesiones sospechosas detectadas por otros métodos, por ejemplo combinada con cromoendoscopía. Sin embargo es altamente operador dependiente, para endoscopistas avanzados y formados en esta técnica, no pudiendo ser recomendada actualmente en forma masiva (25).
II. VIGILANCIA DE COLANGIOCARCINOMALos pacientes con EII y concomitantemente CEP tienen mayor riesgo de CC. Este riesgo asciende a 9% a los 10 años y 19% a los 20 años desde el debut. Los pacientes que presenten deterioro de su status funcional, de pruebas hepáticas o pérdida de peso deben ser evaluados por un posible CC. La diferenciación entre CC y una estenosis dominante representa un desafío (3). Un valor de corte de CA 19-9 de 129 tiene una sensibilidad de 79% y especificidad de 98% para CC 30.
El cepillado mediante CPRE es la técnica de obtención histológica más utilizada, pero posee una baja sensibilidad y especificidad para CC (43% y 50-60% respectivamente). Al añadir cepillado para hibridación in situ o FISH, que evalúa la presencia de aneuploidía genética en las células obtenidas, se alcanza una sensibilidad de 68% y una especificidad de 70% (3). En evaluación se encuentran las técnicas de colangioscopía, endomicroscopía confocal y cromoendoscopía ductal, con resultados prometedores (3).
Endoscopía terapéutica en la Enfermedad Inflamatoria IntestinalI.- Dilatación de estenosis con balón
Las estenosis predominan en EC, principalmente ileales o ileocolónicas. Pueden ocurrir de novo, en relación a la anastomosis o del reservorio ileal post colectomía. Pueden ser de tipo inflamatoria, susceptibles de tratamiento médico, o fibróticas. Hasta un 64% de estos pacientes requerirá cirugía para su manejo y de estos hasta un 24% necesitará una segunda cirugía, con el riesgo de desarrollar síndrome de intestino corto y sus complicaciones 31.
Los metaanálisis disponibles incluyen estudios muy heterogéneos en términos del calibre del balón utilizado, el número de dilataciones por sesión y la duración de cada dilatación. En la revisión de Hassan et al se logró un manejo exitoso en 86% de los casos con una tasa de complicación <5%, logrando evitar la cirugía en 112 de 347 pacientes (67%) 32. El estudio de Gustavsson et al es el más grande hasta la fecha, con 178 pacientes evaluados de los cuales 80% presentaban estenosis anastomóticas, presentando sólo un 1,4% de tasa de perforación, que aumenta a 9,3% con el uso de balones de 25mm 33. Son factores de riesgo para un resultado desfavorable la presencia de estenosis de la válvula ileocecal, fístulas y el hábito tabáquico.
El uso de corticoides y/o Infliximab intralesional se encuentra actualmente en etapa de investigación sin resultados que avalen su uso hasta la fecha (3).
Respecto al uso de stents autoexpandibles, la evidencia es limitada y controversial, mayormente extrapolada de la experiencia de su uso en CCR obstructivo. La tasa de éxito reportada varía entre 40-80% pero con una alta tasa de migración del stent (3).
II.- Manejo de las complicaciones del reservorio:Las estenosis de la anastomosis del reservorio ileoanal (IPAA) son frecuentes. Un estudio que incluyó 1005 pacientes sometidos a IPAA señala una incidencia de estenosis del 14%, tratándose 97,9% con dilatación digital o con bujías y sólo 2,1% con cirugía 34. Otro estudio menciona que de los pacientes dilatados, 87,3% pudo conservar su reservorio en una media de seguimiento de 9,6 años, confirmando que las dilataciones endoscópicas son eficaces, seguras, con una baja tasa de complicaciones cuando son realizadas por un endoscopista experimentado (3).
Otra complicación de IPAA es la aparición de senos en el reservorio, una manifestación precoz de filtración de la anastomosis, generalmente localizada en la región pre-sacra. Se presenta como dolor perianal, presión en la zona pélvica, presencia de sepsis de foco pélvico, reservoritis o cuffitis refractaria a tratamiento, aunque puede ser asintomática. El manejo es con incisión con “needle knife” y drenaje del seno vía endoscópica y si se insinúa un trayecto fistuloso uso de goma de fibrina. Con estas medidas se alcanza hasta 84% de respuesta 35.
III.- Uso de endosonografía (EUS) en patología anorrectal en enfermedad inflamatoria intestinal:Aproximadamente un 25% de los pacientes con EC desarrollará en algún momento una fístula perianal, especialmente aquellos con compromiso rectal. La identificación de las fístulas en estos pacientes es difícil mediante el examen anal e incluso en el examen bajo anestesia, ya que generalmente la zona rectal se encuentra inflamada e indurada (3). Mediante la EUS rectal se pueden detectar estas fístulas, visualizándose como estructuras hipoecogénicas de contenido hiperecogénico (aire o gas). Además se pueden apreciar abscesos relacionados con las fístulas, que se visualizarán como masas anecogénicas o hipoecogénicas en la región perianal 36.
Estudios comparativos entre EUS y resonancia magnética de pelvis han encontrado resultados similares en términos de sensibilidad (91 vs 87%) 37. Por lo tanto la EUS tiene un rol diagnóstico y terapéutico en la patología anorrectal, sirviendo además como una herramienta de seguimiento del tratamiento de la fístula perianal.
IV.- Diagnóstico y manejo de colangitis esclerosante primaria:La CEP corresponde a una enfermedad hepática colestásica crónica, caracterizada por la aparición de fibrosis en múltiples puntos del árbol biliar con estenosis secundarias y un alto riesgo de desarrollo de CC.
El método de diagnóstico de elección inicial es la colangiografía por resonancia, pero con frecuencia una CPRE es requerida para confirmar el diagnóstico y para determinar si existen una estenosis dominante, definida como una estenosis de 1,5mm en el conducto biliar común o de 1mm en los conductos hepáticos. Las estenosis dominantes aparecen hasta en un 60% de los pacientes y representan un riesgo para el desarrollo de CC 38. Se presentan con síntomas colestásicos requiriendo drenar la vía biliar.
El manejo óptimo de drenaje de la vía biliar es debatible, pues hasta la fecha no se ha realizado un estudio randomizado que compare dilatación con balón versus stents autoexpandibles, por lo que las recomendaciones se basan actualmente en series de casos.
La dilatación endoscópica de las estenosis mediante CPRE más instalación de stents autoexpandibles es efectiva. Respecto a la permanencia del stent instalado, los estudios han mostrado que un período prolongado (stent por tres meses) tiene una altísima tasa de complicaciones (hasta 50%) de colangitis e ictericia por oclusión del stent, al contrario de la terapia acortada (stent por 11 días) que se asocia con sólo un 7% de complicaciones 39.
CONCLUSIONESActualmente existe consenso entre las distintas organizaciones internacionales acerca de la realización de vigilancia de CCR en EII, sin cuestionar la necesidad de efectuarla. Sin embargo existen diferencias en las recomendaciones respecto a los intervalos y las técnicas de vigilancia, emergiendo la cromoendoscopia como la técnica de elección. Un campo incipiente y atractivo para el endoscopista avanzado es el manejo endoscópico de las complicaciones específicas que se desarrollan en la evolución de la enfermedad. Aún quedan preguntas por resolver y la necesidad de mayores estudios, por ejemplo, en la evaluación de la instalación de stents en las estenosis relacionada con EII y el uso de esteroides e Infliximab intralesionales. Recoger mayor evidencia referente a las distintas técnicas de evaluación endoscópica para detección de neoplasia (FICE, i-Scan, AFI, CLE). También evaluar el rol de la colangioscopía, la CLE y la CE ductal para el diagnóstico y vigilancia de colangiocarcinoma, además de las dilataciones con stents vs balón en estenosis dominante en CEP.
Esta revisión muestra que existe suficiente evidencia a la fecha para recomendar el entrenamiento en procedimientos terapéuticos y técnicas de vigilancia de CCR en EII como parte de la formación de endoscopistas avanzados, lo que permitirá su integración al equipo multidisciplinario que maneja estos pacientes, ofreciéndoles alternativas de tratamiento en algunas patologías, que hasta hace un tiempo se reservaban para el manejo quirúrgico.
Los autores declaran no tener conflictos de interés, en relación a este artículo.