En este artículo se enfocará la diarrea aguda del adulto desde una perspectiva clínica, incorporando definiciones básicas de epidemiología, fisiopatología, enfrentamiento clínico, estudio cuando corresponda y tratamiento. Se presentarán nuevas herramientas diagnósticas basadas en biología molecular, de reciente introducción en clínica y que han significado un aporte en casos seleccionados. Además, se enfrentan situaciones especiales como la diarrea del viajero y de los pacientes inmunocomprometidos. La diarrea asociada a antibióticos se tratará en un artículo aparte.
In this article of acute diarrhea in adults, will present from a clinical perspective, including different basic definitions from epidemiology, pathophysiology, clinical approach, corresponding studies and treatment. It includes new diagnostic tools based on molecular biology, of recent use in medical practice, that have had a relevant effect in selected cases. It also includes special situations, such as traveler's diarrhea and immunosuppressed patients. We exclude from this article antibiotics-related diarrhea.
Diarrea deriva del griego “diarrhoia” que significa fluir a través de. Constituye un síntoma, no una enfermedad. Sin duda, todos tenemos un concepto y entendemos cuando nos referimos a diarrea, que son deposiciones líquidas. Sin embargo, la diarrea se define como un peso de la deposición no formada, mayor de 250g en 24 horas. Esta definición, poco práctica, puede resumirse como:
a) Aumento del contenido líquido de la deposición y/o
b) Aumento de la frecuencia (más de 3 veces al día). En general ocurren ambos fenómenos.
Aplicando criterios de duración, se clasifica como aguda cuando se extiende hasta dos semanas. La diarrea persistente va de dos a cuatro semanas y crónica cuando excede cuatro semanas en forma continua u ocho semanas en forma intermitente 1.
Deben diferenciarse otras condiciones como la incontinencia fecal, la pseudodiarrea producto del impacto fecal (enfermos postrados, Parkinson, etc.) diagnóstico que se confirma con el tacto rectal o la hiperdefecación, aumento de la frecuencia defecatoria con deposiciones de consistencia normal como ocurre en el hipertiroidismo.
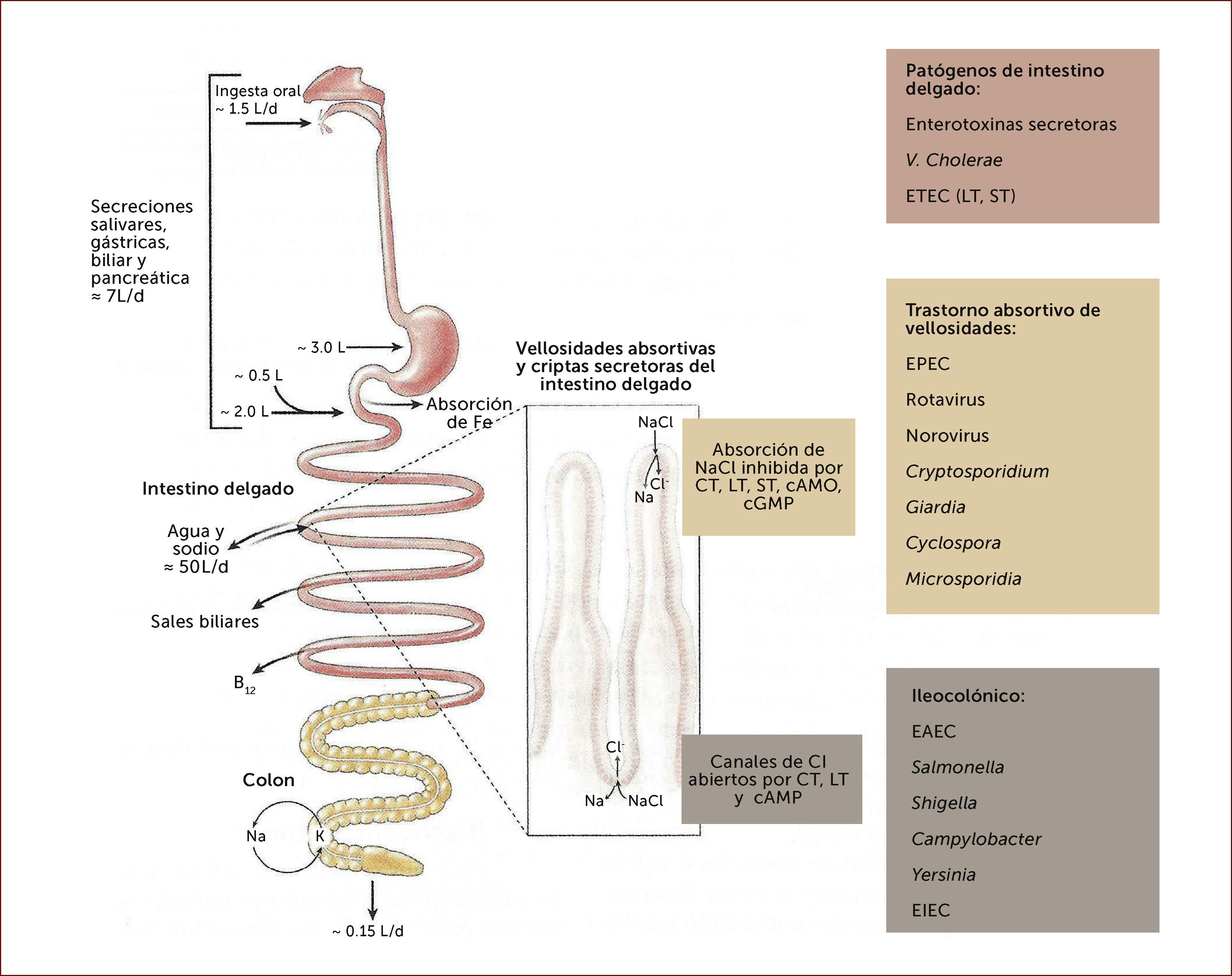
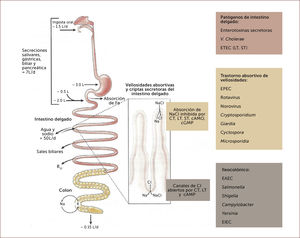
FISIOPATOLOGÍA2La fisiopatología básica de los patógenos involucrados ha aportado a un mejor diagnóstico y tratamiento de las enfermedades diarreicas (Figura 1). El promedio de ingesta oral para adultos es 1,5 L/día combinado con la saliva, secreciones gástricas, biliares y pancreáticas hace un total de 7-8 litros de líquido que ingresa al intestino alto diariamente, el que es absorbido en la medida que alcanza el intestino delgado distal. Sin embargo, este fluido del intestino delgado está mezclado con un notable flujo bidireccional de agua y electrolitos en el intestino delgado proximal que probablemente exceda 50 L de fluido isotónico cada día, para ayudar a la absorción de la ingesta dietética diaria. Este transporte bidireccional de electrolitos es conducido por una bomba de sodio dependiente de ATP localizada en la membrana basolateral tanto de las criptas como en el vértice de las vellosidades. Dado que los canales de cloro están ubicados en la superficie luminal de las células de las criptas, esta bomba de sodio regula la secreción de cloro (junto al sodio y agua) desde las criptas y se produce un absorción neutra de NaCl en el vértice de las vellosidades. Así, una discreta alteración en este gran flujo bidireccional puede sobrepasar la capacidad absortiva del colon, que raramente excede 2 L en 24 horas. Como la toxina del cólera, la toxina termolábil de E. Coli abren los canales de cloro llevando a la diarrea secretoria acuosa. La toxina termoestable de E. Coli activa la guanilciclasa incrementando la guanosina cíclica monofosfato intracelular, inhibiendo la absorción de NaCl y llevando a diarrea secretoria. El daño selectivo del vértice de las vellosidades que ocurre en infecciones virales, por protozoos y otros procesos que dañan las vellosidades lleva a un desbalance de las criptas secretoras produciendo diarrea acuosa.
Otro mecanismo es la invasión del epitelio intestinal distal y del colon y citotoxicidad produciendo reacción inflamatoria con daño tisular como ocurre en el caso de Shigella, Campylobacter, Salmonella, Yersinia, E coli enteroagregativa, Bacteroides fragilis y Clostridium difficile. Es el mismo tipo de daño que producen parásitos como Entamoeba histolytica y Balantidium coli. En inmunocomprometidos hay que agregar adenovirus y citomegalovirus.
La ingestión de toxinas preformadas, presente en el alimento antes de la ingesta, como las producidas por S. Aureus Bacilus cereus, Clostridium perfringens alteran la fisiología, al igual que lo que ocurre frente a la enterotoxina termoestable (ácido okadoico) presente en el fitoplancton (dinoflagelados) que sirve de nutriente a moluscos bivalvos en la denominada marea roja 3.
La ingesta de peces del género escómbridos (atún y palometa en nuestro medio) que no han estado sometidos a una rigurosa cadena de frío y llegan al consumidor con cierto grado de descomposición que da a la carne un sabor “metálico”, da lugar a la presencia en la carne de estos peces una substancia histaminosímil de rápida absorción post ingesta que se manifiesta por vasodilatación periférica, apremio respiratorio, aumento de la velocidad del tránsito intestinal de minutos de “incubación” que a veces se confunde con alergia alimentaria. En general cuando se presenta, afecta a todos los comensales y se denomina escombrotoxismo 4.
La keriorrhea 5, eliminación a veces involuntaria de una deposición grasosa de color anaranjado post ingesta del pescado mero se debe a malabsorción de la grasa (ésteres cerosos) que posee esta variedad de pez. Es motivo relativamente frecuente de consulta pues el escurrimiento fecal involuntario causa mucha alarma en el paciente. El reconocer en la anamnesis este cuadro por un médico informado causa mucha sorpresa y alivio en el enfermo.
El uso en la industria alimentaria de substancias como sorbitol, lactulosa, hidróxido de magnesio también pueden causar estos síntomas, así como un largo listado de medicamentos (colchicina, sertralina, eritromicina, metformina y muchos otros) deben ser investigados en la anamnesis.
En síntesis, las causas que pueden llevar a la presencia de este síndrome son muy variadas.
Desde un punto de vista etiológico las causas pueden ser agrupadas en infecciosas (virales, bacterianas, parasitarias) y no infecciosas (intoxicaciones alimentarias, fármacos, keriorrhea, escombotoxismo, marea roja, etc.).
Desde el punto de vista del mecanismo de producción pueden clasificarse en: 6
Osmótica: presencia de substancias no absorbibles en el lumen (lactulosa, sorbitol, lactosa en intolerantes, etc.).
Secretora: secundaria a toxinas bacterianas que disminuyen la absorción o aumentan la secreción (V. cholerae).
Inflamatoria: daño de la mucosa por inflamación o isquemia: Shigella spp., enfermedades inflamatorias intestinales (Crohn, colitis ulcerosa) o colitis isquémica.
Alteración de la motilidad con aumento del peristaltismo: síndrome de intestino irritable, hipertiroidismo.
EPIDEMIOLOGÍANo se dispone en general de datos confiables de incidencia y prevalencia en población adulta nacional, pues existe pobre notificación y en general es poco frecuente estudiar etiología. En este sentido hay mayor información en población pediátrica. En países con mejores registros se estima 0,6 episodios por individuo/año, cifras de Estados Unidos y Alemania. El agente más frecuente en EE.UU. es norovirus, responsable del 50% de los brotes de diarrea 7. Datos del Centro para Control y Prevención de Enfermedades de EE.UU. (CDC), para bacterias patógenas del 2012 en tasas por 100.000 habitantes revelan salmonella: 16,4 casos; Campylobacter: 14,3 casos; E. Coli 0157:H7 productora de toxina Shiga: 1,1 casos; vibrio: 0,4 casos y Yersinia 0,3 casos 8. El 2011 la tasa en EE.UU. para Shigella fue 2,3 casos por 100.000 habitantes 9.
Factores del huésped influyen marcadamente: personas de edades extremas, inmunocomprometidos por enfermedades o terapias, uso de bloqueadores de la bomba de protones, etc.
También influyen las dosis infectantes 1: Bajo inóculo: entre 100 a 500 gérmenes viables: Shigella, E coli 0157:H7 incluyendo la que produce la toxina Shiga, norovirus, rotavirus, giardia y criptosporidium. Inóculo moderado: entre 1.000 a 100.000 gérmenes viables Salmonella, Campylobacter. Alto inóculo: más de 100.000 de gérmenes viables E. coli enteroinvasiva, E. coli enterotoxigénica, E. coli enteropatogénica, Vibrio cholerae.
Dentro de los alimentos involucrados destacan:
Agua: Vibrio cholerae, norovirus, Giardia lamblia, cryptosporidium sp.
Pollo: Salmonella, Campylobacter, Shigella.
Vacuno (hamburguesas mal cocidas): E coli enterotoxigénica.
Pescados y mariscos bivalvos. Vibrio cholerae, Vibrio parahemolítico, Salmonella.
Quesos: Listeria sp.
Huevos: Salmonella sp.
Cremas y mayonesas: Staphylococcus, Clostridium, Salmonella.
Transmisión de persona a persona:
- •
Casas de acogida: Shigella, Campylobacter, Clostridium difficile, Giardia Lamblia, Crytosporidium, agentes virales.
- •
Hospitales y antibióticos: Clostridium difficile y quimioterapia.
- •
Piscinas: Giardia lamblia y Cryptosporidium sp.
- •
Viajes (diarrea del viajero): depende de epidemiología local.
Un buen interrogatorio, como en todas la áreas de la medicina, es básico 10. Este debe incluir contactos epidemiológicos, actividad laboral especialmente si se desempeña en áreas de la salud, viajes recientes, hospitalizaciones recientes, ingesta de fármacos en especial antibióticos en las ocho semanas precedentes u otros (metformina, sertralina, colchicina, etc), forma de comienzo de la enfermedad, latencia entre la ingesta sospechosa y el comienzo del cuadro (en intoxicaciones alimentarias y escombrotoxismo puede ser minutos), en etiología viral, más de 14 horas, en general 24 a 48 horas, tipo de alimentos consumidos (huevos crudos o mayonesas caseras, mariscos bivalvos y pescados crudos incluidos sushi y cebiche, hortalizas crudas, etc.), presencia de fiebre, en general ausente en intoxicaciones alimentarias, dolor abdominal con todas sus características semiológicas, vómitos (más frecuentes en etiología viral e intoxicación alimentaria con una toxina preformada) y una detallada descripción de las características de las deposiciones: acuosas, presencia de sangre, mucosidades, lientería, grasa, etc. (con el advenimiento de la tecnología no es infrecuente que el paciente aporte imágenes de su smartphone), frecuencia, horario, compromiso del estado general: sed, oliguria, lipotimia, etc. En casos seleccionados hábitos sexuales de riesgo, comorbilidades (diabetes, HIV/SIDA, trasplante de órganos, inmunosupresión farmacológica, embarazo, etc.).
Examen físicoAdemás de lo habitual, presencia de fiebre sobre 38,5°C, compromiso sensorial, búsqueda de signos de deshidratación, ortostatismo, turgor cutáneo, llene capilar u otros que lleven a decidir hidratación parenteral u hospitalización. Especial detalle en la exploración abdominal: ruidos hidroaéreos, puntos sensibles, rebote, masas palpables, etc.).
LaboratorioExámenes sanguíneos: Electrolitos plasmáticos y creatinina, hemograma completo en búsqueda de leucocitosis y desviación a izquierda en pacientes comprometidos es importante. La eosinofilia puede verse en infecciones parasitarias con migración extraintestinal (strongiloidiasis).
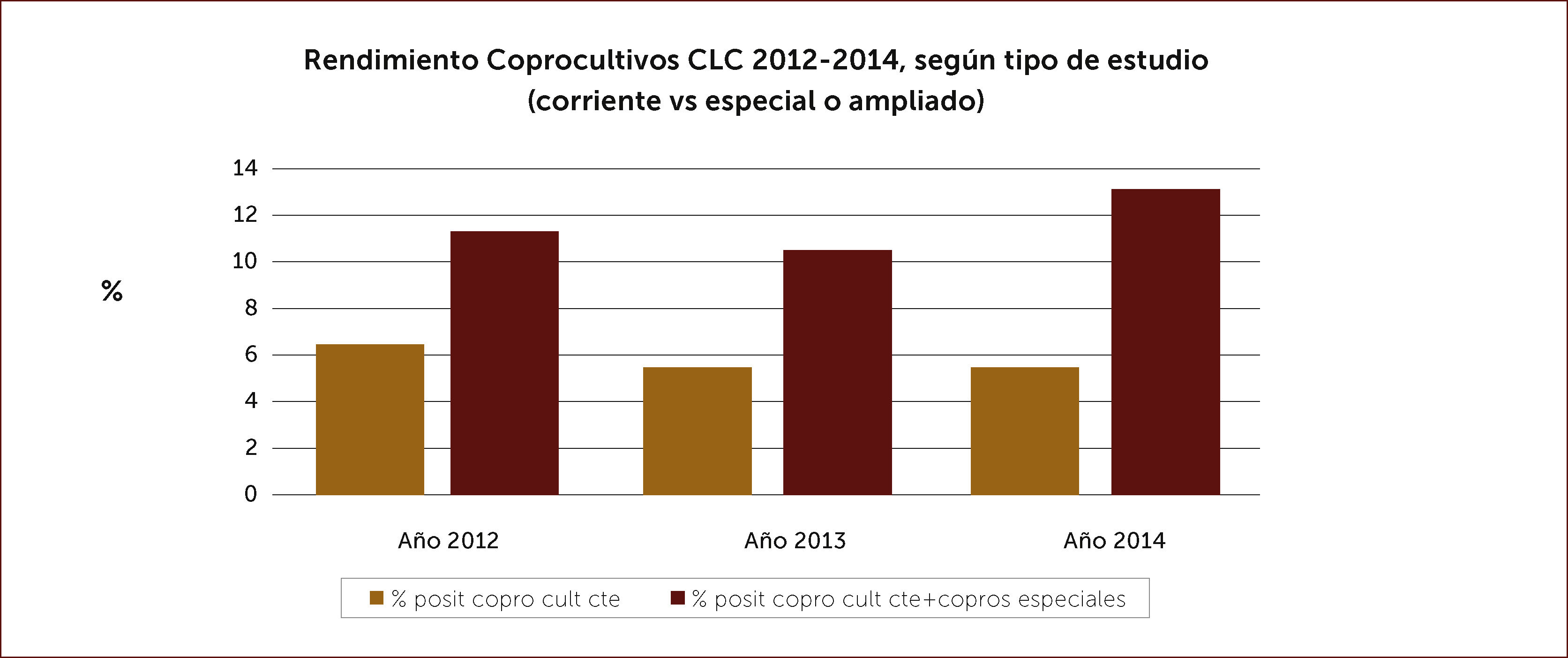
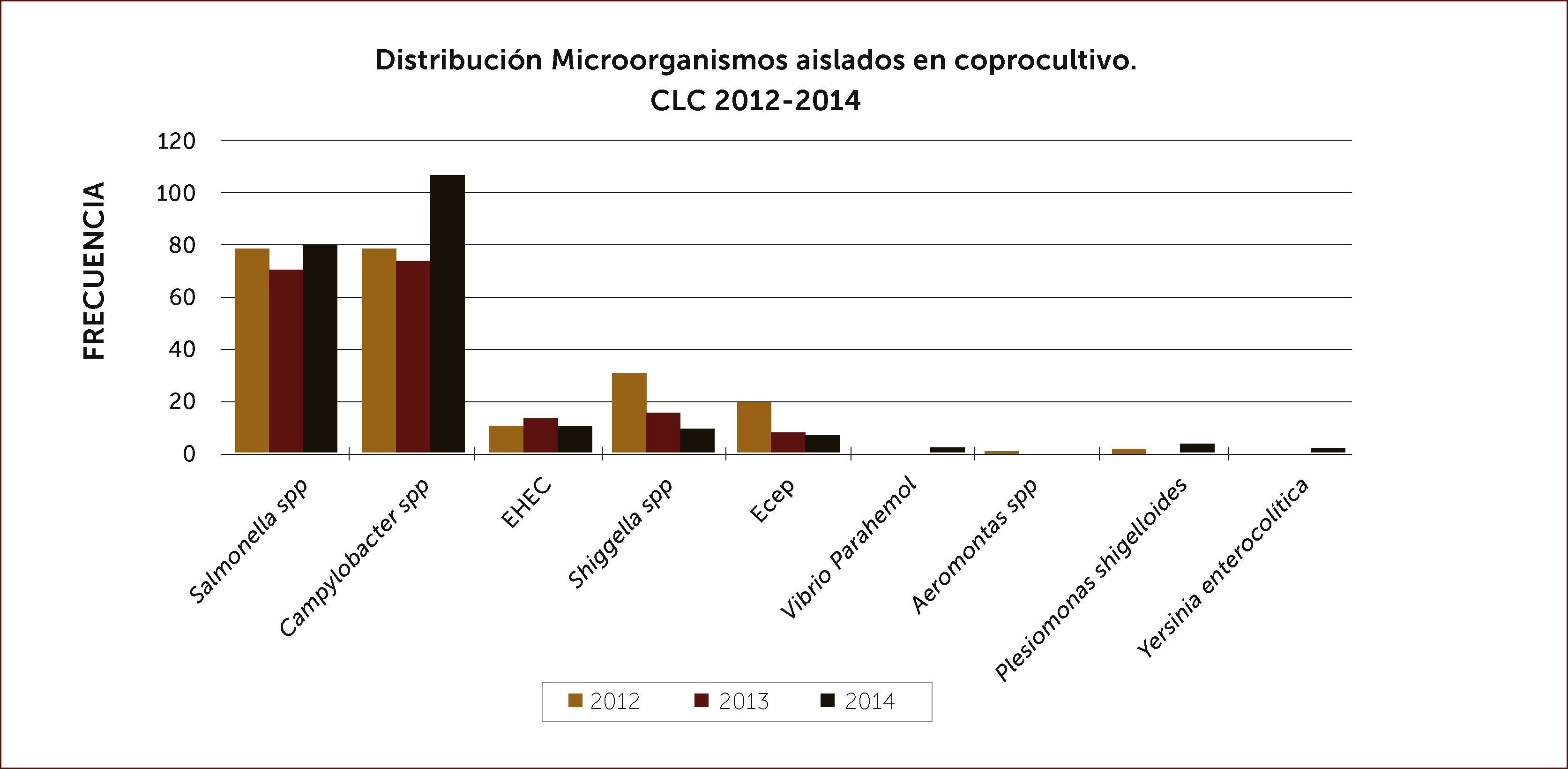
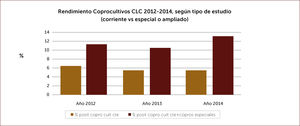
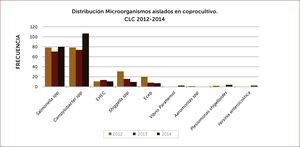
Exámenes fecales. La presencia de leucocitos fecales orienta a gérmenes que actúan invadiendo la mucosa intestinal. Es un examen sencillo, barato y prácticamente disponible en muchas partes. La calprotectina fecal, proteína del citoplasma de los leucocitos también se encuentra elevada en deposiciones cuando hay inflamación de la mucosa intestinal. Es muy sensible. No tenemos experiencia con el uso de la lactoferrina que tiene el mismo significado. Los estudios bacteriológicos tradicionales, parasitológicos y más recientemente los basados en biología molecular deben reservarse para pacientes de alto riesgo o en casos en que la identificación del agente patógeno es muy importante. Está indicado en diarrea aguda severa asociada a fiebre mayor de 38,5°C, coexistencia de comorbilidad severa (diabetes, VIH/SIDA, trasplantados, pacientes con tratamientos inmunosupresores, embarazadas), en paciente hospitalizado recibiendo antibióticos (C.difficile), diarrea que se prolongue por más de 14 días, diarrea aguda profusa con caracteres de cólera, deshidratación y disentería. Además considerar a adultos mayores, residentes en hogares, manipuladores de alimentos o trabajadores sanitarios. También es importante el estudio etiológico en brotes de diarrea aguda en comunidades, para aplicar medidas de salud pública. Las muestras deben ser procesadas idealmente dentro de las cuatro horas post emisión y deben solicitarse en forma dirigida aquellos estudios dependiendo de la sospecha clínica 11. El coprocultivo corriente identifica salmonella y shigella. Deben solicitarse en forma explícita estudios especiales para Campylobacter, yersinia, rotavirus, cuando la impresión clínica lo aconseje. En nuestro medio la positividad de los coprocultivos en la población estudiada es relativamente baja y bordea el 6% para el coprocultivo corriente y el 12% para los coprocultivos ampliados a gérmenes más específicos (Figura 1). En la Figura 2 se muestran los gérmenes identificados en el Laboratorio de Microbiología de Clínica Las Condes en los últimos tres años 12. En caso de sospechar parasitosis, tres muestras seriadas mejoran la positividad del estudio.
Actualmente se dispone de estudios basados en PCR que ofrecen pruebas combinadas en una sola muestra para detectar múltiples enteropatógenos. La ventaja es que mejora la sensibilidad poniendo el foco en los genes, más que en los factores de virulencia y el resultado se obtiene en pocas horas, muchas veces dentro del día. Puede detectar ADN de bacterias que transitoriamente colonizan el intestino en pacientes que están enfermos por otras causas. No es infrecuente en estos estudios detectar ADN de dos o tres agentes. Con la técnicas inicialmente introducidas, (Acute Intestinal Infectious Screen Real T-M) 13 se detecta material nuclear de Shigella spp. E. Coli, Salmonella spp. Campylobacter spp., adenovirus F, rotavirus A, norovirus genotipo 2 y astrovirus. La técnica es operador-dependiente. El denominado Bio Fire Film Array (MR) Gastrointestinal Panel, aprobado por la FDA, ofrece un abanico más amplio de 22 patógenos para detección simultánea de una muestra fecal (Tabla 1) y es una técnica donde el factor humano se reduce al mínimo. En la interpretación de estos resultados debe imperar el criterio clínico, ya que en una reciente comunicación que incluyó 1.556 especímenes estudiados con esta técnica, en 12,79% se detectó material de dos posibles patógenos y en 3,21%, de tres posibles patógenos.
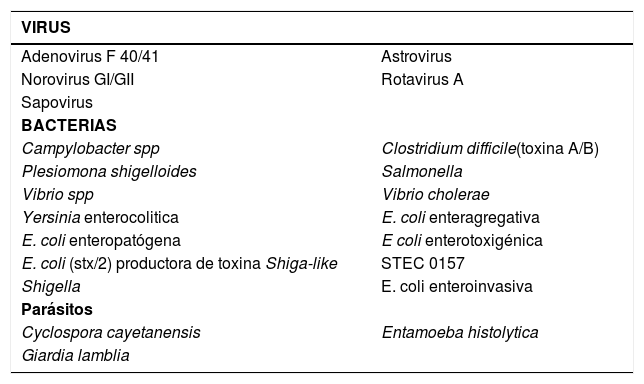
AGENTES INFECCIOSOS DETECTADOS POR EL BIOFIRE ARRAY® GASTROINTESTINAL PANEL
| VIRUS | |
|---|---|
| Adenovirus F 40/41 | Astrovirus |
| Norovirus GI/GII | Rotavirus A |
| Sapovirus | |
| BACTERIAS | |
| Campylobacter spp | Clostridium difficile(toxina A/B) |
| Plesiomona shigelloides | Salmonella |
| Vibrio spp | Vibrio cholerae |
| Yersinia enterocolitica | E. coli enteragregativa |
| E. coli enteropatógena | E coli enterotoxigénica |
| E. coli (stx/2) productora de toxina Shiga-like | STEC 0157 |
| Shigella | E. coli enteroinvasiva |
| Parásitos | |
| Cyclospora cayetanensis | Entamoeba histolytica |
| Giardia lamblia | |
Adaptado de: Buss S N, Leber A, Chapin K et al. Prospective clinical evaluation of the Film Array GI panel. J. Clin. Microbiol 2015; doi:10-1128/JMC.02674-14 Accepted Manuscript Posted Online 14 January 2015
La sigmoidoscopía flexible y colonoscopia total tienen un valor limitado en el estudio de la diarrea aguda. Podría ser de valor en el estudio de la diarrea asociada a C. difficile con estudio fecal negativo para toxina. Otra indicación sería el síndrome disentérico con estudio fecal negativo para agente etiológico. Muchas veces puede omitirse la preparación de intestino. La endoscopia digestiva alta tendría indicación en contados casos en que se sospeche infección por Gardia lamblia o etapas iniciales de enfermedad celíaca. La tomografía axial computada puede mostrar engrosamientos parietales u otros cambios en casos de colitis isquémica, hemorrágica o inflamatoria. Podría ser importante en colitis fulminante por C. Difficile.
TRATAMIENTOEn pacientes con diarrea moderada a severa el primer objetivo es mantener la hidratación y el equilibrio hidroelectrolítico y ácido-base. El tratamiento de los síntomas (dolor abdominal, vómitos, fiebre) es muy importante.
El reposo depende de cada caso en particular. Deben hospitalizarse aquellos pacientes con criterios de gravedad: deshidratación severa, fiebre mayor de 38,5°C, compromiso sensorial, disentería, adultos mayores, embarazadas, co-morbilidad importante (diabetes, inmunosupresión, etc.) y cuando el buen juicio clínico lo aconseje. Estos pacientes requerirán de hidratación parenteral y el estudio ya descrito. En el caso de pacientes ambulatorios, el reposo dependerá de la tolerancia del paciente a sus síntomas. No hay muchos estudios que objetivamente demuestren que restricciones particulares de la dieta mejoren la evolución de los síntomas. Este es un tema que preocupa mucho a los pacientes. La denominada dieta BRAT (banana, rice, apple sauce, toast) ha mostrado una utilidad limitada 14. Puede desarrollarse una intolerancia transitoria a la lactosa durante algunos episodios de diarrea aguda por lo que parece razonable recomendar durante el tratamiento productos sin lactosa ampliamente comercializadas en nuestro medio 15. Hay soluciones de rehidratación oral disponibles en el mercado como Pedialite® y ReHsal®, las que se deben indicar en ausencia de vómitos. Las bebidas isotónicas que utilizan los deportistas (Gatorade®) son pobres en sodio, el que se puede suplementar con caldos ricos en sal. Los antiespasmódicos deben usarse prudentemente al igual que los antipiréticos como el paracetamol en caso de fiebre.
Agentes antidiarreicos. Loperamida (1). Aumenta la absorción de agua y electrolitos disminuyendo la motilidad y secreción intestinal. No acorta la evolución de la enfermedad. La dosis máxima inicial es 4mg seguida de 2mg después de cada deposición no formada con una dosis máxima total de 8mg en 24 horas por un máximo de dos días. No debe ser usada en diarrea febril o disentérica. Si se usa debe indicarse la dosis mínima para evitar la constipación post tratamiento. Muchas veces la dosis inicial de 4mg es suficiente. Es muy útil frente a situaciones particulares como inminencia de viajes o asistencia obligada a compromisos ineludibles.
Racecadotril 16. (Hidrasec ®, Resorcal®). Es un inhibidor de encefalinas. Disminuye la secreción intestinal. No tiene efecto sobre la motilidad. Se utiliza en dosis de 100mg cada 8 horas por 3 días.
Probióticos 17. Saccharomyces boulardii (Perenteryl ®, Vintix®) ha demostrado su utilidad en población pediátrica. Degrada la toxina A de C difficile, estimula la IgA secretora, reduce niveles de AMP cíclico inducido por V. cholerae e interfiere con la adherencia de E. Histolytica. Se utiliza en dosis de 250mg 2 veces al día por 3 días. En una revisión Cochrane de 2009 los autores concluyen: Utilizándolos junto a rehidratación, los probióticos parecen ser seguros y tienen claros efectos beneficiosos en acortar la duración y reducir la frecuencia de las deposiciones en diarrea aguda. Sin embargo, se requiere mayor investigación para guiar el uso de regímenes especiales de probióticos en grupos específicos de pacientes.
Subsalicilato de Bismuto. (Pepto Bismol®). No disponible en nuestro medio. Muy utilizado en Estados Unidos donde se expende sin receta médica.
Antibióticos (1-18). La terapia antibiótica empírica está indicada en casos especiales: ancianos, inmunocomprometidos, evidencias de sepsis, portadores de prótesis (cardíacas, articulares, etc.), diabéticos, cuadros disentéricos febriles, portadores de VIH/SIDA, casos especiales de diarrea del viajero y en espera de estudios bacteriológicos. Están indicados en un pequeño porcentaje con una causa infecciosa establecida de diarrea aguda (Tabla 2). En estos pacientes la terapia antibiótica puede acortar la duración de la enfermedad, disminuir la transmisión y prevenir complicaciones. No es necesaria en casos de diarrea leve causada por Salmonella. Algunos antibióticos inducen el fago que codifica la toxina Shiga y pueden precipitar un síndrome hemolítico urémico. En la Figura 3 se sugiere algoritmo de conducta frente a cada situación clínica.
RECOMENDACIONES PARA EL DIAGNÓSTICO Y TRATAMIENTO DE INFECCIONES ENTÉRICAS POR ORGANISMOS ESPECÍFICOS EN ADULTOS
| Enfermedad Entérica | Método Diagnóstico | Terapia Antimicrobiana |
|---|---|---|
| Shigellosis | Coprocultivo | Ciprofloxacino 750 mg/día por 3 días o azitromicina 500 mg/día por 3 días |
| Salmonelosis no tifoidea | Coprocultivo | No tratar en pacientes sin enfermedad severa. En caso contrario, levofloxacino 500 mg/día oral por 7-10 días o ceftriaxona 1-2g iv por 7-10 días (14 días en inmunocomprometidos) |
| Fiebre tifoidea, fiebre entérica o salmonellosis bacterémica | Hemo y coprocultivos | Fluoroquinolona o cefalosporina intravenosa por 7 días (14 días en inmunosuprimidos) |
| Portador crónico de Salmonella typhi | Coprocultivo (persistentemente positivo o en manipulador de alimentos) | Ciprofloxacino 750mg oral dos veces al día por 4-6 semanas o norfloxacino 400mg oral dos veces al día por 4-6 semanas. Investigar colelitiasis. Eventual colecistectomía. |
| Campylobacteriosis intestinal | Coprocultivo | Azitromicina 500mg oral por 3 días o eritromicina 500mg oral 4 veces al día por 5 días. |
| Yersinia enterocolitica | Coprocultivo en medios especiales | Tratar como infección por Shigella |
| E coli productora de toxina Shiga | Coprocultivo en medio especial | No antibióticos. Sólo tratamiento de soporte, incluyendo diálisis para insuficiencia renal. |
| Vibrio no cólera | Coprocultivo en medio con TCBS | Ciprofloxacino 750 mg/día oral por 3 días o azitromicina 500 mg/día oral por 3 días |
| V. cholerae | Coprocultivo en medio con TCBS. | Doxyciclina 300mg oral por 1 vez. |
| Diarrea del viajero o por E. Coli enterotoxigénica | Ninguno | Sin fiebre ni disentería: rifaximina 200mg oral 3 veces/día por 3 días o ciprofloxacino 750mg oral 1-3 días; pacientes con fiebre o disentería: azitromicina 1000mg oral dosis única. |
| Norovirus | PCR en tiempo real en deposiciones o emesis | Terapia con fluidos y electrolitos. Estudios en voluntarios sugieren que subsalicilato de bismuto mejora síntomas. |
| Rotavirus | Detección rápida de antígeno en deposiciones | Terapia con fluidos y electrolitos. |
| Adenovirus entéricos | Inmunoensayo enzimático en deposiciones. | Terapia con fluidos y electrolitos |
| Giardiasis | Parasitológico de deposiciones o inmunoensayo enzimático | Tinidazol 2g oral, dosis única o metronidazol 250mg oral 3 veces al día por 5-7 días o nitazoxanida 500mg oral 2 veces al día por 3 días. |
| Criptosporidiosis | Inmunoensayo enzimático en deposiciones | Nitazoxanida 500mg oral dos veces al día por 3-14 días. |
| Amibiasis intestinal | Parasitológico de deposiciones, inmunoensayo enzimático en deposiciones para antígeno o PCR. | Metronidazol 750mg oral 3 veces al día/5 días más o diloxanida furoato 500mg oral 3 veces al día por 10 días o pa ramomicina 25-35 mg/kg/día dividida en 3 dosis por 7 días. |
| Cyclosporiasis | Ensayo en deposiciones con método ácido resistente. Aparece del mismo tamaño que cryptosporidia. | Trimetoprim/Sulfametoxazol 160/800mg respectivamente oral 2 veces al día por 7 días. Prolongar en inmunodeprimidos. |
| Infección por Cytoisospora belli | Ensayo en deposiciones con método ácido resistente. Aparece más grande que ooquistes de cyclospora. | Trimetoprim/Sulfametoxazol 160/800mg respectivamente 4 veces al día por 10 días. |
| Enterocytozon bieneusi o infección por Encephalitozoon intestinalis | Examen fecal al microscopio de luz con tinción de Weber basada en cromotrope o anilina azul para detectar esporas pequeñas. | Albendazol 400mg oral 2 veces al día por 14-28 días o fuma gillina 20mg 3 veces al día por 14 días. |
| Estrongyloidiasis | Examen fecal con microscopio de luz para detectar larvas. | Ivermectina 200 mcg/kg/día oral por 2 días o albendazol 400mg oral 2 veces al día por 7 días. |
| Dientamoeba fragilis | Muestra fecal para microscopio de luz y ensayo por PCR convencional o en tiempo real. | Paramomicina 25-35 mg/kg/día oral en 3 dosis diarias por 7 días o iodoquinol 650mg oral 3 veces al día por 21 días. |
| Blastocistis hominis | Muestra fecal para microscopio de luz | Patogenicidad en duda. En casos sospechosos, metronidazol, paramomicina o trimetoprima/sulfametoxazol por 10 días. |
| Colitis por citomegalovirus en inmunocomprometido | Biopsia de mucosa o test serológico | Ganciclovir 5 mg/kg intravenoso cada 12 horas por 14 días o valganciclovir, 900mg 2 veces al día oral por 21 días. Dosis de mantención u otro agente puede ser necesario. |
Adaptado de: DuPont HL. Acute infectious diarrhea in immunocompetent adults. N Eng J Med 2014;370:1532-1540. y Pffeiffer ML, DuPont HL, Ochoa TJ. The patient presenting with acute dysentery-a systematic review. Journal of Infection 2012;64:374-386.
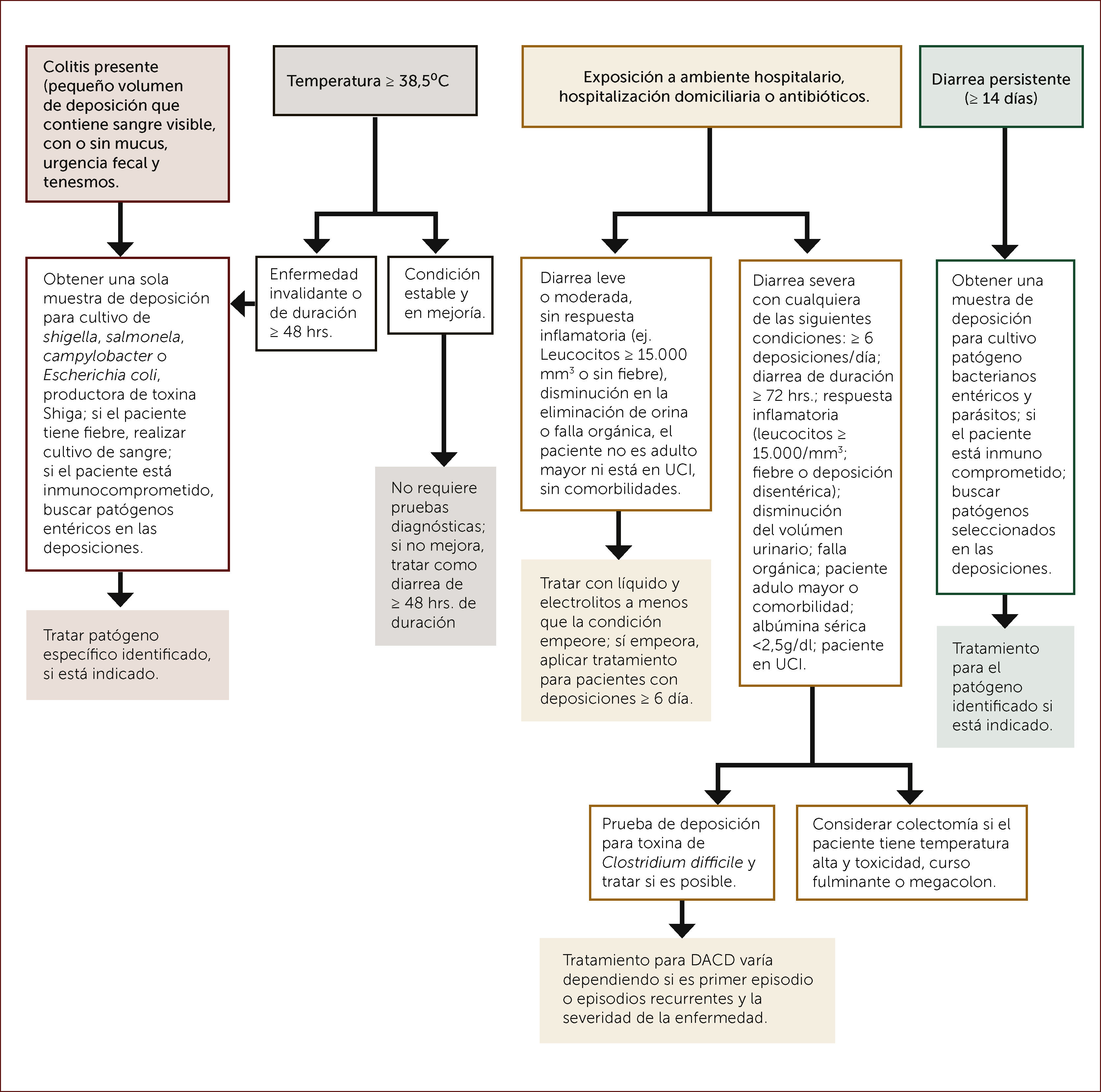
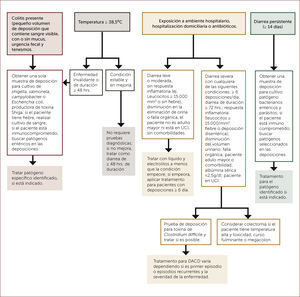
EVALUACIÓN Y TRATAMIENTO DE PACIENTES CON DIARREA SEVERA, DE ACUERDO A SI TIENEN SÍNTOMAS DE COLITIS, FIEBRE, HOSPITALIZACIÓN, CASAS DE REPOSO, ANTIBIÓTICOS Y DIARREA PERSISTENTE
Adaptado de DuPont HL. Acute infectious diarrhea in immunocompetent adults. N Eng J Med 2014;370:1532-1540.
a) Artritis reactiva19. Puede ocurrir después de infecciones digestivas por salmonella, shigella y yersinia por respuestas autoinmunes teniendo como blancos epítopes comunes tanto al patógeno infectante y los tejidos articulares o periarticulares.
b) Desórdenes funcionales digestivos (Síndrome de intestino irritable post-infeccioso)20. Puede ocurrir en el 5 a 10% de los pacientes después de una infección entérica por bacterias. Es menos común después de la infección por virus o parásitos. En intestino irritable post infeccioso el organismo lleva a una inflamación de bajo grado, atrapando aire en el intestino y alterando la motilidad en la forma constipada de la enfermedad. Es más común en diarreas muy virulentas, enfermedad severa, jóvenes, género femenino y factores sicológicos pre-existentes. Tiene mejor pronóstico que el síndrome de intestino irritable idiopático pero puede prolongarse por más de ocho años. Factores genéticos del huésped, que involucran a la serotonina, factor epitelial e inmunidad innata juegan un rol en el desarrollo de un síndrome de intestino irritable post infeccioso.
c) Síndrome de Guillain-Barré 21. Este síndrome ocurre dos meses después de un episodio de infección por campylobacter en aproximadamente 1 a 2 casos por 10.000 pacientes como resultado de una reacción cruzada entre el organismo infectante y epítopes ganglionares neurales. Constituyen factores de riesgo la virulencia del germen infectante y factores genéticos del huésped.
d) Síndrome hemolítico urémico 22. Causado por infecciones digestivas por E. Coli 0157:H7, de especial importancia en población pediátrica, transmitido por carne de vacuno no suficientemente cocida, especialmente hamburguesas.
Situaciones especiales
a) Diarrea del viajero. Depende de la bacteriología local. Hay dos escenarios: el paciente que regresa de un viaje a nuestro medio o el viajero que enferma en nuestro país. En general, deben aplicarse los mismos criterios antes expuestos. En inmunocomprometidos que viajan se ha postulado el uso profiláctico de ciprofloxacino 500mg oral al día o rifaximina 200mg 2 veces al día hasta por 2 a 3 semanas. Se ha postulado el uso de este fármaco en diarreas producidas por algunas cepas de E. Coli enterotoxigénica, pero en la práctica, si no se dispone de estudio de material fecal no hay fundamento sólido para su utilización.
b) Diarrea asociada con antibióticos. Ver artículo correspondiente.
c) Diarrea en pacientes VIH/SIDA. Investigar Cryptosporidium y microsporidios, además de gérmenes habituales. Considerar intolerancia a antiretrovirales.
d) Diarrea en la embarazada. Puede ocurrir hasta en el 34% de los embarazos. La etiología es similar a la no embarazada. Sin embargo esta condición es relevante pues son más susceptibles a complicaciones por lo que se aconseja estudio etiológico, la enfermedad febril puede provocar aborto o parto prematuro, la interpretación clínica del dolor abdominal es más compleja, algunos agentes etiológicos pueden dañar directamente al feto (salmonella, listeria). Las embarazadas son más susceptibles a la diarrea del viajero.
e) Diarrea con sangre 18–22. Múltiples patologías pueden manifestarse con esta sintomatología. Excluiremos aquí colitis isquémica, enfermedades inflamatorias intestinales, neoplasias, radioterapia, sangrados por malformaciones vasculares, hemorroides, fármacos, amiloidosis, discrasias sanguíneas, invaginación intestinal, Meckel, enfermedad diverticular, vasculitis, etc. Dentro de las causas bacterianas destacan Campylobacter jejuni, Salmonella, E coli 0157:H7 y algunas productoras de toxina Shiga, V. Parahaemolyticus, Shigella, Yersinia, Aeromonas, C difficile. Virales: Cytomegalovirus. Parásitos: Entamoeba histolityca, Schistosomiasis. Requieren de estudio etiológico y tratamiento específico.
PREVENCIÓNComo médicos, debemos educar a nuestra población en medidas de autocuidado. A pesar que las condiciones sanitarias en nuestro país han mejorado en cuanto a disponibilidad de agua potable y alcantarillado, tratamiento de aguas servidas, la disponibilidad de vacuna para rotavirus que por años se aplica a nuestra población pediátrica, etc., la frecuencia de esta patología es muy prevalente. Esto puede deberse a mala manipulación de alimentos, contaminación cruzada, violación de las cadenas de frío, etc. Particular acento debe ponerse en evitar el consumo de mariscos bivalvos crudos, productos del mar crudos, cebiche, sushi, mayonesas caseras o ingesta de huevos crudos y hortalizas no debidamente lavadas. Si va de viaje no olvidar: hiérvalo, cocínelo, pélelo u olvídelo.
DESAFÍOS FUTUROSConseguir métodos diagnósticos moleculares para identificar otros agentes como sapovirus, bocavirus, polyomavirus, parechovirus, torovirus y aichivirus. Identificar y establecer mecanismos patogénicos de nuevas cepas de E. coli detectadas en algunos brotes epidémicos como el ocurrido en Europa el 2011 debidas a la cepa E coli 0104:H4. También deberían desarrollarse métodos para investigar agentes patógenos en alimentos y una vez desarrollados introducirlos en la industria alimentaria. Se requieren avances en el estudio de los huéspedes, particularmente los receptores de órganos que los hacen más susceptibles a estas infecciones. Además debe estudiarse el impacto que tiene sobre estas patologías el consumo masivo por diversas causas, de los fármacos inhibidores de la bomba de protones a nivel gástrico, que inhiben una barrera bacteriológica natural. Finalmente, el desarrollo de vacunas como la que está en uso para rotavirus, presentan un futuro promisorio.
CONCLUSIONESLa diarrea aguda del adulto es una patología de alta prevalencia, generalmente autolimitada y que requiere sólo de tratamiento sintomático en la gran mayoría de los casos. Es una causa frecuente de consulta en servicios de urgencia y en atención ambulatoria. La mejoría de las condiciones sanitarias en nuestro país, la disponibilidad de agua potable, alcantarillado, el tratamiento de las aguas residuales antes de devolverlas a los cauces naturales van en el sentido correcto para disminuir las patologías infecciosas que se transmiten por vía fecal-oral. Asimismo la mejor manipulación de los alimentos, el observar cadenas de frío, evitar contaminación cruzada tanto en el hogar como en alimentación industrial constituyen un aporte al bienestar sanitario de la ciudadanía. Otro aporte es la educación sobre estos temas a la población. El buen juicio clínico debe identificar aquellos pacientes de riesgo que requieren de tratamiento y estudios específicos. Educar a nuestra población en el autocuidado para prevenir estas patologías es parte de nuestra obligación como médicos clínicos.
El autor declara no tener conflictos de interés, en relación a este artículo.