El trastorno de conducta durante el sueño REM (TCSR) se caracteriza por conductas motoras vigorosas, pesadillas y ausencia de atonía muscular durante el sueño REM. Se debe a la disfunción directa o indirecta de las estructuras del tronco cerebral que regulan el sueño REM, especialmente el núcleo subceruleus. El TCSR puede ser idiopático o asociado a enfermedades neurológicas como la enfermedad de Parkinson (EP), la demencia con cuerpos de Lewy (DCL), la atrofia multisistémica (AMS) y la narcolepsia. Los pacientes con la forma idiopática, especialmente los que tienen alterados el SPECT del transportador de la dopamina, la sonografía de la sustancia negra, los test de olfato y de la visión de colores, tienen un elevado riesgo de desarrollar la E P, DCL y AMS. El TCSR no debe considerarse como un simple trastorno del sueño, sino como una manifestación de una enfermedad neurológica. El clonazepam (0.25-4mg) y la melatonina (3-12mg) a la hora de acostarse mejoran los síntomas del TCSR pero no evitan, en la forma idiopática, la conversión a una enfermedad neurodegenerativa.
REM sleep behavior disorder (RBD) is characterized by dreamenacting behaviors, nightmares and lack of atonia during REM sleep. It is caused by indirect or direct impairment of those structures that regulate REM sleep atonia, particularly the locus subceruleus. RBD may be idiopathic or linked to Parkinson disease (PD), dementia with Lewy bodies (DLB), multiple system atrophy (MSA) and narcolepsy. Idiopathic RBD patients, especially those with abnormal dopamine transporter uptake imaging, hyperechogenicity of the substantia nigra, hyposmia and color vision damage are those with high risk to develop PD, DLB and MSA. RBD may not be considered as a parasomnia but rather as an integral part of a neurodegenerative disease. Clonazepam (0.5-4mg) and melatonin (3-12mg) at bed time improve the symptoms of RBD but does not prevent the conversion to a neurodegenerative disease.
El trastorno de conducta durante el sueño REM (TCSR) se caracteriza por conductas motoras vigorosas, pesadillas y la ausencia de atonía muscular durante el sueño REM (1-4). Generalmente ocurre en personas de más de 55 años. No se conoce su prevalencia en la población general, aunque podría estimarse que no es mayor del 2% en sujetos de más de 55 años. El TCSR es una parasomnia, es decir una alteración de la conducta durante el sueño. Sin embargo, los avances conseguidos durante estos últimos 10 años han demostrado que no es una simple alteración del sueño sino que en muchos casos es la primera manifestación de una enfermedad neurodegenerativa como la enfermedad de Parkinson (EP), la demencia con cuerpos de Lewy (DCL) y la atrofia multisistémica (AMS). La descripción del TCSR como entidad médica en humanos es de 1986 (2), pero ya existe algún pasaje Cervantino en el Quijote (5) y en películas de Walt Disney donde podemos reconocerlo (6).
Los sueños de los pacientes con TCSR suelen tener un contenido desagradable que incluye discusiones, peleas, persecuciones, robos, ataques de animales y caídas por precipicios. En el sueño, el sujeto suele ser el agredido, puede o no reconocer las caras de sus agresores y el contexto suele estar situado en situaciones o lugares del pasado del sujeto (el pueblo de origen, el antiguo trabajo). Ocasionalmente, en el sueño hay un contenido cómico y es excepcional el sexual o alimentario. Hay algunos pacientes que niegan recordar los sueños, pero cuando se insiste alguno reconoce haber soñado alguna vez sueños de persecuciones o discusiones. Otros pacientes con TCSR refieren que nunca recuerdan lo que sueñan. Cuando se despierta a un paciente durante un episodio de TCSR puede o no recordar lo que soñaba.
Las conductas anormales durante el sueño suelen ser referidas por el compañero/a de cama y muchos pacientes no acudirían al médico si no fuera por lo observado por el compañero/a. Es decir, muchos pacientes refieren que duermen bien y en estos casos la historia debe hacerse con el compañero/a de cama. Los pacientes durante el sueño REM pueden gritar, gemir, sollozar, llorar, hablar (en la mayoría de ocasiones el contenido no se entiende), decir o gritar palabrotas o expresiones soeces y en ocasiones incluso pueden reír o cantar. Los movimientos suelen ser manotazos, puñetazos, patadas, y menos frecuentemente pueden dar mordiscos, incorporarse en la cama, saltar y caerse de la cama, levantarse de la cama y deambular por la habitación. No es infrecuente que al dar manotazos tiren los objetos de la mesita de noche, golpeen al acompañante lesionándole o se lesionen así mismos. Estas conductas pueden producir lesiones como hematomas, laceraciones, equimosis, incisiones, fracturas (costales, extremidades, escapulares, vertebrales) e incluso se han descrito hematomas subdurales tras caídas bruscas de la cama. Debido a estas conductas violentas no es extraño que los compañeros de cama se vayan a dormir a otra habitación o que compren camas separadas. Hay casos en los que los sujetos se atan a la cama, ponen parapetos con toallas en los radiadores cercanos a la cama o colocan colchones y almohadas en el suelo para amortiguar posibles caídas. Es muy raro que salgan corriendo por la casa o adopten posturas y gesticulaciones con connotaciones sexuales. En ocasiones pueden presentar conductas complejas como si estuvieran dando un discurso, inspeccionado un ejército, cabalgando o llamando a alguien. A diferencia de los sonámbulos, los pacientes con TCSR tienen los ojos cerrados cuando presentan conductas anormales durante el sueño REM.
Los familiares refieren que hay noches en las que no hay alteraciones y que pueden pasar unas temporadas más tranquilas que otras. Sin embargo, la falta de atonía siempre ocurre cada noche, aunque su intensidad y expresividad puede ser variable, incluso entre las diferentes fases REM de una misma noche. Por eso, es probable que la capacidad de observación del paciente sea la que en la anamnesis determine la intensidad y frecuencia del TCSR del paciente.
DiagnósticoEl diagnóstico del TCSR debe ser clínico y polisomnográfico con registro audiovisual sincronizado. Actualmente, la International Classification of Sleep Disorders requiere la realización de un polisomnograma para poder realizarse el diagnóstico de TCSR (7). La sospecha clínica la encontramos cuando los pacientes o sus acompañantes refieren durante el sueño conductas vigorosas o violentas junto a somniloquia que se asocian a sueños de temática desagradable. Estos hallazgos clínicos deben confirmarse polisomnográficamente demostrando que en el sueño REM se pierde la atonía muscular característica de esta fase coincidiendo con conductas anormales. Por ello, lo ideal es que los registros polisomnográficos sean acompañados de monitorización audiovisual simultánea que permita detectar movimientos anormales durante un sueño REM sin atonía.
Los criterios diagnósticos establecidos en 2005 por la American Academy of Sleep Medicine son los siguientes (7):
- A)
Presencia de un sueño REM sin atonía: aumento constante o intermitente de la actividad electromiográfica en el mentón o un aumento de la actividad fásica electromiográfica en el mentón o en las extremidades (inferiores o superiores).
- B)
Como mínimo uno de estos dos:
- i.
Historia de conductas vigorosas durante el sueño que producen lesiones, tienen el riesgo de producir lesiones o fragmentan la continuidad del sueño.
- ii.
Conductas anormales durante el sueño REM detectadas durante el estudio polisomnográfico.
- i.
- C)
Ausencia de actividad epileptiforme durante el sueño REM coincidiendo con la actividad motora.
- D)
El trastorno del sueño no se explica por otra alteración del sueño, enfermedades médicas, neurológicas o psiquiátricas, o por el uso de un fármaco o una sustancia.
Los criterios dan un mismo valor a la historia clínica como a los hallazgos polisomnográficos con el objetivo de reducir la frecuencia de falsos positivos y negativos. Dan un valor crucial a los hallazgos polisomnográficos pues admiten la presencia del TCSR si se demuestran las alteraciones vídeo-polisomnográficas descritas, aunque no existan quejas clínicas. Esto es especialmente útil en aquellos pacientes que no son conscientes de sus conductas anormales durante el sueño y que viven o duermen solos y que por lo tanto no tienen un testigo que explique lo que hacen mientras duermen. Por otra parte hay sujetos que clínicamente parecen que puedan tener un TCSR al tener pesadillas y conductas anormales durante el sueño, pero cuando se les efectúa un registro polisomnográfico se demuestra un REM normal con atonía muscular, y suele descubrirse otra alteración (apneas obstructivas, actividad epileptiforme, parasomnias no REM, movimientos periódicos de las extremidades que engloban a todo el cuerpo, etcétera) que justifica la clínica referida (Tabla 1). Sólo en estos casos el registro polisomnográfico ayudará a descartar el TCSR mostrando una fase REM con atonía conservada y sin movimientos anormales. Por ejemplo, identificamos un grupo de 16 pacientes con clínica de pesadillas y movimientos vigorosos durante el sueño idéntica a los de los sujetos con TCSR. Además, estos pacientes tenían una historia de ronquidos, apneas observadas y somnolencia diurna excesiva. El estudio polisomnográfico con vídeo mostró que no padecían un TCSR (se conservaba la atonía muscular en la fase REM) y, en cambio, tenían un número elevado de apneas obstructivas (el índice de apneas medio fue de 67 apneas) que se seguían en los microdespertares de las conductas anormales referidas por historia. El tratamiento con CPAP resolvió las apneas, los ronquidos, la somnolencia, las pesadillas y las conductas anormales durante el sueño y en los que no toleraron el CPAP la clínica persistió (8). De todas maneras, hay de tener en cuenta que el TCSR puede coexistir por casualidad con otras alteraciones del sueño como apneas obstructivas, movimientos periódicos de las extremidades, parasomnias no-REM. Los estudios polisomnográficos ayudarán también a identificar estas alteraciones en un paciente con TCSR. Los cuestionarios con preguntas clínicas para detectar el TCSR difícilmente detectan falsos positivos y negativos como lo hace el vídeo-polisomnograma.
Diagnóstico diferencial del TCSR
| 1. Síndrome de las apneas obstructivas durante el sueño. |
| 2. Epilepsia durante el sueño, especialmente la del lóbulo frontal. |
| 3. Parasomnias no-REM; despertares confusos, terrores nocturnos y sonambulimo. |
| 4. Movimientos periódicos de las piernas que engloban también al resto del cuerpo. |
| 5. Parálisis del sueño recurrente. |
| 6. Stress postraumático. |
| 7. Despertares confusionales en pacientes con demencia. |
| 8. Alucinaciones visuales en pacientes con enfermedades neurodegenerativas. |
El TCSR puede presentarse de forma aguda, subaguda o crónica según su tiempo de evolución. Según su origen se clasifican en idiopático (primario) o sintomático (secundario).
TCSR agudo o subagudoEsta forma se relaciona con el uso de fármacos como betabloqueantes liposolubles tales como el bisoprolol (9) y los antidepresivos (3, 10)(tanto tricíclicos como inhibidores selectivos de la recaptación de la serotonina) que al retirarse producen la desaparición de la parasomnia en la mayoría de los casos. En otros el TCSR persiste y el fármaco ha sido un precipitante de su aparición. El TCSR también se relaciona con la aparición de lesiones en la protuberancia, el bulbo y el sistema límbico, como infartos, hemorragias, placas desmielinizantes y encefalitis (11).
TCSR crónico idiopático (Tabla 2)La forma crónica del TCSR se clasifica en idiopática y secundaria. En la forma idiopática los pacientes no tienen quejas motoras ni cognitivas, y la exploración neurológica y la resonancia magnética cerebral son normales. No se asocia a ninguna enfermedad, pero al cabo de algunos años de seguimiento los pacientes pueden desarrollar una enfermedad neurodegenerativa (12-14). Describimos en 2006 que un 45% (20 de 44) de los sujetos inicialmente diagnosticados como de TCSR idiopático desarrollaron una enfermedad neurológica después de un seguimiento medio de 5 años y de 11 años de iniciarse los síntomas del TCSR. Las enfermedades que desarrollaron fueron la EP en nueve casos (en dos asociada a demencia), la DCL en seis, la AMS con predominio cerebeloso en un caso y el deterioro cognitivo leve con afectación visuoespacial y mnésica en 4 casos. El análisis estadístico con regresión logística demostró que a mayor tiempo de seguimiento, mayor probabilidad de desarrollar una enfermedad neurodegenerativa (15). El seguimiento de esta muestra confirma este dato, ya que en 2012 el 82% de los pacientes había desarrollado la E P, DCL, AMS o deterioro cognitivo leve (15). El deterioro cognitivo leve es una fase que suele preceder a la demencia en la que los sujetos tienen quejas cognitivas que se ven reflejadas en los tests neuropsicológicos, pero las actividades de la vida diaria siguen intactas.
Hallazgos en pacientes con tcsr idiopático
| 1. Déficit de olfato. |
| 2. Déficit de la visión de los colores. |
| 3. Lentecimiento electroencefalográfico espectral. |
| 4. Alteraciones visuoespaciales, ejecutivas y mnésicas en los tests neuropsicológicos. |
| 5. Disautonomía. |
| 6. Disminución de la captación del trazador en el SPECT del transportador de la dopamina. |
| 7. Hiperecogenicidad de la sustancia negra. |
| 8. Alteración de la difusión en la protuberancia. |
| 9. Hipoperfusion cortical e hiperperfusión en la protuberancia. |
| 10. Alteración de la escintigrafía cardiaca. |
En los sujetos diagnosticados como idiopáticos se pueden detectar de forma asintomática la presencia de hiposmmia, mal reconocimiento de los colores, alteraciones cognitivas, disautonomía, lentecimiento electroencefalográfico, signos parkinsonianos que no son suficientes para definir la EP, disminución del transporte de la dopamina en el estriado, hiperecogenicidad de la sustancia negra, alteraciones de la difusión en la protuberancia, hipoperfusión cortical e hiperperfusión en la protuberancia, y alteración de la escintigrafía cardiaca (3, 4, 15, 16). Todos estos hallazgos son típicos de la E P, DCL y AMS. En los pacientes con TCSR idiopático la actividad tónica y fásica excesiva de la fase REM aumenta con el tiempo, indicando un proceso neurodegenerativo progresivo en los núcleos del tronco que controlan el tono muscular de la fase REM (17).
Todos estos hallazgos indican que el TCSR no debe ser considerado simplemente como una parasomnia, sino como una manifestación, que en muchas ocasiones puede ser la primera, de una enfermedad neurodegenerativa, especialmente la EP y la DCL. Esto ha llevado a buscar marcadores que identifiquen a los pacientes con TCSR idiopático que tienen mayor riesgo de desarrollar en poco tiempo los signos típicos de la EP (bradicinesia, rigidez, alteraciones posturales, temblor), la DCL (deterioro cognitivo, alucinaciones, delirios, fluctuaciones) y AMS (síndrome parkinsoniano, síndrome cerebeloso, signos disautonómicos como hipotensión ortoestática y problemas urinarios). Para responder esta pregunta estudiamos a 43 pacientes con TCSR idiopático mediante una sonografía transcraneal (ST) y SPECT del transportador de la dopamina en el putamen y caudado (DAT-SPECT). Estas dos pruebas evalúan el estado de la sustancia negra y son anormales en la E P, DCL y AMS. En nuestra serie, el 40% tenían una ST alterada (aumento de la hiperecogenicidad en la sustancia negra que refleja un aumento del depósito de hierro), y un 36% un DAT-SPECT anormal (disminución de la captación del trazador en los ganglios basales reflejando un déficit de la síntesis de la dopamina en la sustancia negra). El 63% de los pacientes tenían las dos o una de las dos pruebas alteradas. Tras un seguimiento clínico de 2.5 años, ocho de los 43 pacientes (30%) fueron diagnosticados de EP (n=5), DCL (n=2) o AMS (n=1). En estos ocho sujetos la ST y/o el DAT-SPECT habían sido anormales 2.5 años antes. Los 15 pacientes en los que la ST y el DAT-SPECT habían sido normales no desarrollaron ninguna enfermedad después de los 2.5 años de seguimiento. Estos hallazgos nos permitieron concluir que en los pacientes con TCSR idiopático, la ST y el DAT-SPECT nos permiten detectar aquellos sujetos con más riesgo de desarrollar la EP y la DCL (18).
En otro estudio de diseño similar, 62 pacientes con TCSR idiopático fueron estudiados con test de olfato (test UPSIT) y de la visión de color (test FM-100). Tras cinco año de seguimiento clínico 21 pacientes desarrollaron la EP o la DCL y 41 siguieron con el TCSR idiopático. Los tests UPSIT y FM-10 fueron más frecuentemente anormales en los pacientes que desarrollaron una enfermedad que en los que seguían libres de enfermedad tras cinco años de seguimiento. Por lo tanto, los tests de olfato y visión de los colores también identifican los pacientes con TCSR idiopático que tienen mayor riesgo de enfermar (19).
Los pacientes con TCSR idiopático, y especialmente aquellos con alteraciones en el DAT-SPECT, ST, test de olfato y test de la visión de los colores, podrían tener un elevado riesgo de desarrollar en pocos años los síntomas motores y cognitivos clásicos de la EP y la DCL. Deberíamos tratar a estos sujetos con fármacos neuroprotectores que eviten la aparición de estos síntomas. Desgraciadamente estos fármacos no existen todavía. Para poder ensayar estos medicamentos en los pacientes con TCSR idiopático deberíamos encontrar un marcador para saber si son efectivos o no para frenar o detener el proceso neurodegenerativo. Para contestar esta pregunta hicimos un estudio en 20 pacientes con TCSR idiopático y en 20 controles a los que les hicimos un DAT-SPECT seriado basal, a los 1.5 años y a los 3 años. Al comparar la captación del trazador en los ganglios basales vimos que había una disminución a lo largo del tiempo significante mayor en los pacientes (entre un 19-16% en el putamen) que en los controles (entre un 9-10% en el putamen). Esta disminución fue mucho mayor (del 30% en el putamen) en aquellos 3 pacientes que a los tres años de seguimiento desarrollaron la E P. De este estudio se puede concluir que el DAT-SPECT seriado muestra una disminución progresiva de la captación del trazador en los ganglios basales que refleja un déficit progresivo dopaminérgico en la sustancia negra. Este hallazgo puede ser útil para estudios futuros con fármacos neuroprotectores en sujetos con TCSR idiopático. Si el fármaco empleado muestra que la disminución del trazador con el tiempo no es superior a la de los controles, sería un dato que indicaría una probable eficacia del medicamento para detener o ralentizar la degeneración dopaminérgica en la sustancia negra (20).
De todas maneras, sería más fácil monitorizar un estudio con tests de olfato o de la visión de los colores ya que son más rápidos, cómodos, no invasivos y más baratos que el DAT-SPECT. Sin embargo, estos tests no son útiles para este propósito ya que a diferencia del DAT-SPECT, el olfato y la visión no empeoran a lo largo del tiempo en los pacientes con TCSR idiopático (19).
En definitiva, los pacientes con TCSR idiopático tienen un elevado riesgo de desarrollar una enfermedad neurodegenerativa como la EP, DCL y AMS. Los que tienen mayor riesgo a medio plazo son los que tienen alterados el DAT-SPECT, TCS y los tests de olfato y visión de colores. Estos pacientes están esperando ser evaluados con fármacos potencialmente neuroprotectores. Estos ensayos clínicos tendrían como objetivo que el DAT-SPECT no empeorara a lo largo del tiempo más que en los controles, y evidentemente que los pacientes no desarrollaran una enfermedad como la EP, DCL y AMS.
Por razones desconocidas, la forma idiopática del TCSR es mucho más frecuente en los hombres que en las mujeres. La razón no es hormonal, ya que las hormonas femeninas y masculinas son normales en los pacientes con TCSR idiopático cuando se compara con controles (21) Es posible, que en las mujeres el TCSR sea igual de frecuente que en los hombres pero menos espectacular, y por lo tanto más difícilmente detectable por parte de la paciente y de su pareja.
TCSR crónico secundarioEn esta forma, el TCSR coexiste habitualmente con una enfermedad neurológica, generalmente degenerativa. Las enfermedades que se asocian más frecuentemente son la E P, DCL, AMS (22-25). También se ha descrito en la enfermedad de Machado-Joseph (26) y el parkinsonismo por mutaciones en el gen de la parkina (27). Es muchísimo menos frecuente en otras enfermedades neurodegenerativas como la enfermedad de Alzheimer, enfermedad de Huntington, parálisis supranuclear progresiva, demencia frontotemporal, y la degeneración corticobasal (3). Ante un paciente con demencia y TCSR hemos de pensar que la demencia sea debida a la DCL.
El TCSR afecta a un 30-40% de los pacientes con E P, prácticamente a todos los sujetos con AMS y al 70% de los afectos de la DCL (3). Ante un paciente con parkinsonismo y ausencia de TCSR, casi podemos descartar que la causa del parkinsonimo sea la AMS. EL TCSR precede a los signos y síntomas parkinsonianos o cognitivos en un 20% de los pacientes con EP a un 50% de los afectos de una AMS y a un 40% de los afectos de la DCL.
En la narcolepsia (28), especialmente en sujetos de más de 50 años y de ambos sexos, también es frecuente que se asocie al TCSR. En la narcolepsia el TCSR casi siempre aparece después de la somnolencia y la cataplejía y es un síntoma que preocupa poco a los pacientes. Lesiones estructurales del tronco del encéfalo como tumores, infartos, encefalitis o placas desmielinizantes también se han relacionado con el TCSR (11). El TCSR también puede ser secundario a lesiones que afectan principalmente al sistema límbico como la encefalitis límbica idiopática no paraneoplásica asociada a anticuerpos contra canales de potasio (29). También aparece en otras encefalitis como la paraneoplásica con anticuerpos anti-Ma2 (30), la corea de Morvan y el insomnio fatal familiar.
La forma crónica del TCSR se suele iniciar sobre los 50-65 años, tanto en su forma idiopática como en la secundaria, aunque cuando se asocia a la narcolepsia puede aparecer en algunos casos durante la infancia o adolescencia (28). En la forma idiopática, en la E P, en la DCL y en la narcolepsia el TCSR aparece en un 85-90% de varones, pero cuando se asocia a la AMS la proporción tiende a igualarse entre ambos sexos. Esto es quizá debido a que en la AMS la proporción de hombres es similar a la de mujeres, y prácticamente todos los pacientes tienen TCSR. En los pacientes con EP y TCSR los niveles de hormonas sexuales son normales.
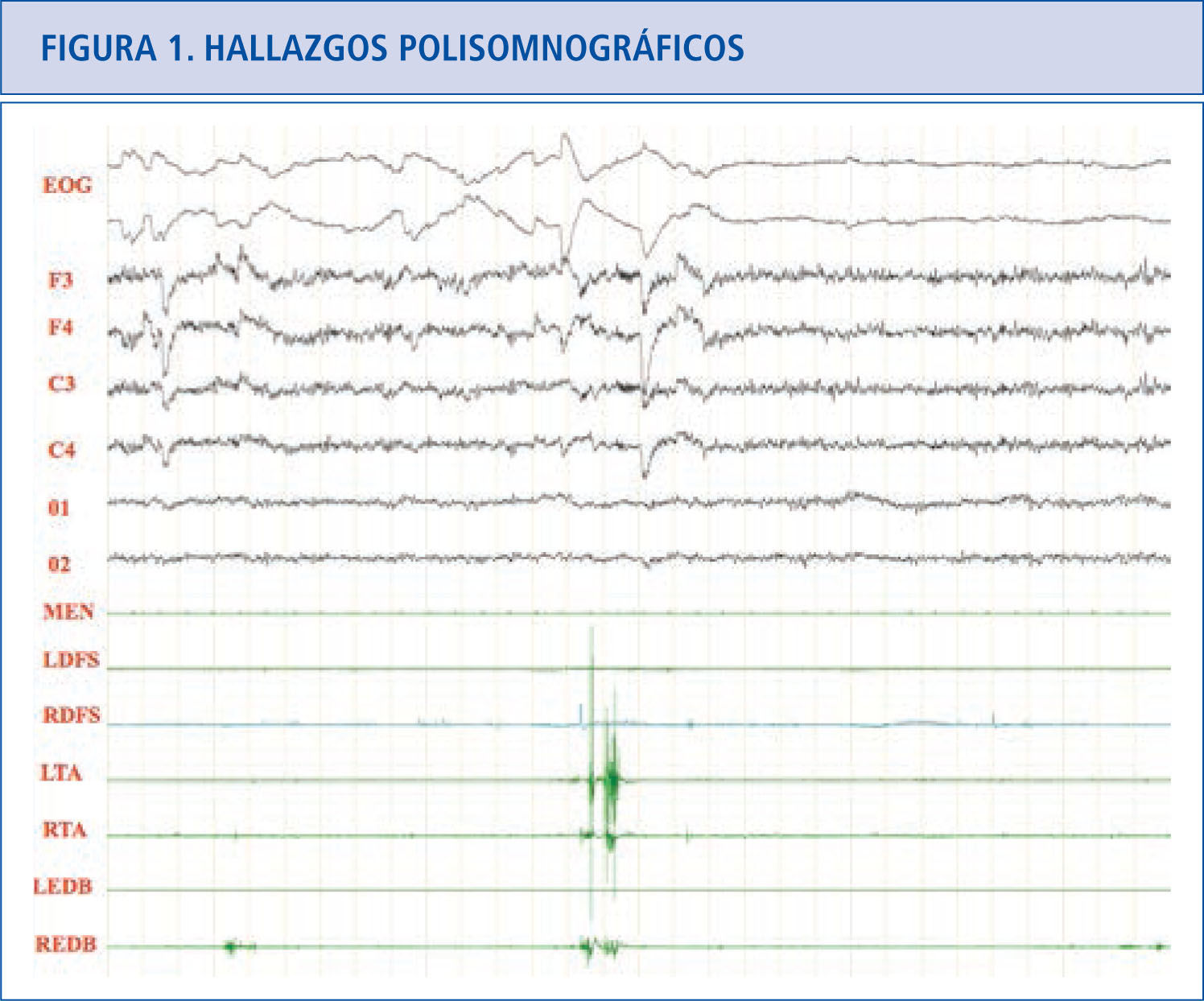
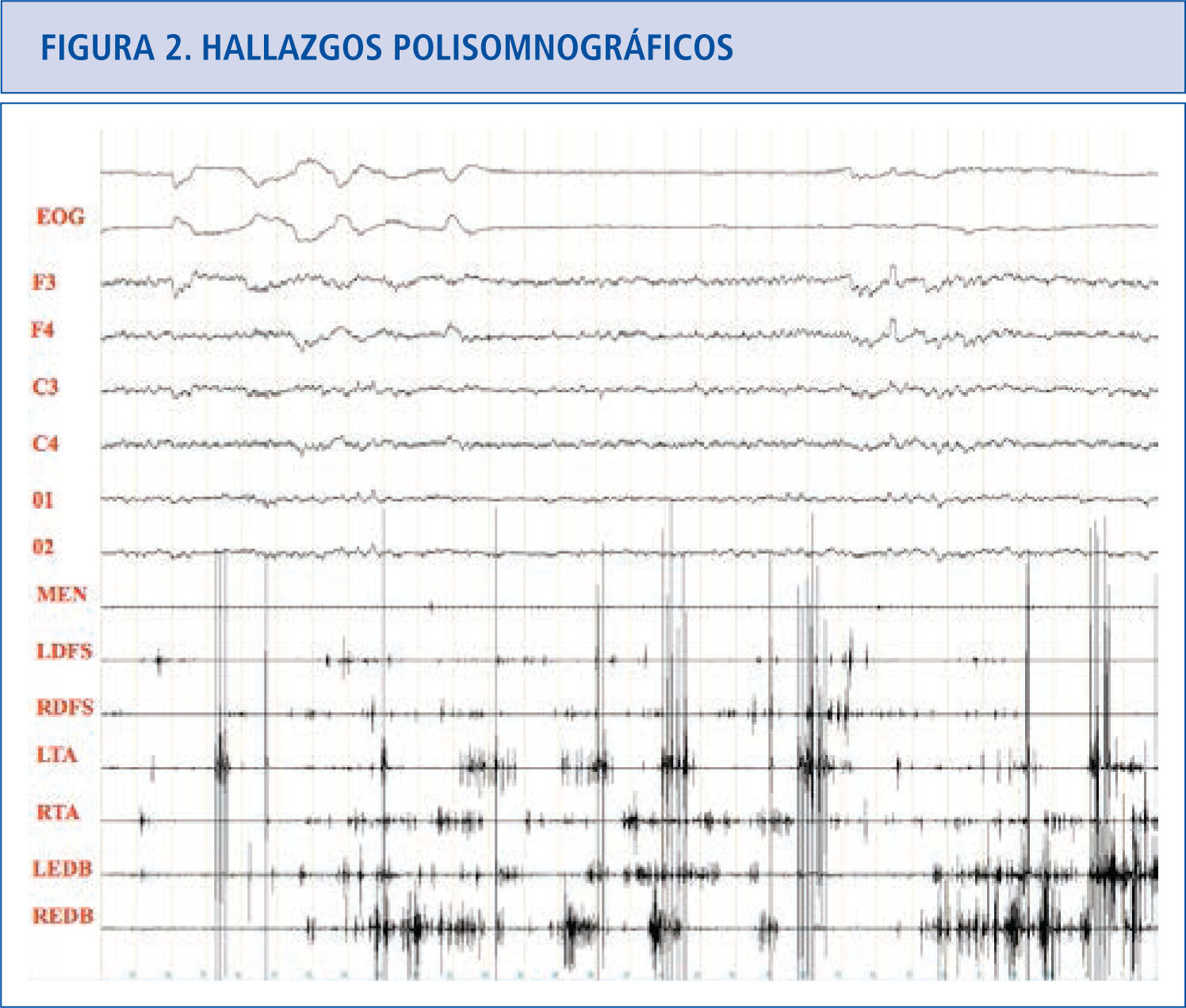
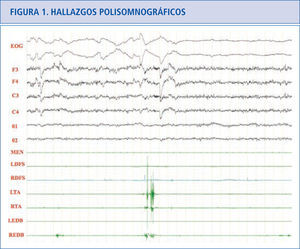
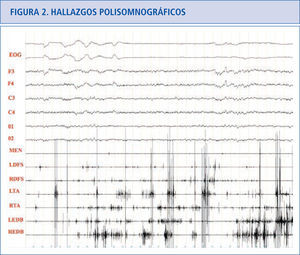
Hallazgos polisomnográficosEn el sueño REM normal hay atonía muscular, pero pueden haber breves descargas fásicas intermitentes que en ocasiones se asocian a leves y discretos movimientos de la boca o dedos, especialmente en las extremidades inferiores (Figura 1). En los pacientes con TCSR, los estudios polisomnográficos demuestran la presencia de un sueño REM sin esta atonía muscular. Hay una actividad muscular excesiva que puede ser fásica (aumento muscular breve e intermitente que dura más de 0.5 segundos que se va repitiendo a lo largo del sueño REM) y/o tónica (aumento sostenido y constante del tono muscular) (31). La actividad tónica excesiva es asintomática. En las extremidades las descargas fásicas se suelen asociar a movimientos bruscos y muy raramente encontramos actividad tónica (cuando la hay aparece en músculos proximales como el deltoides). En el mentón hay un incremento electromiográfico tónico asintomático y/o fásico que pueden ser asintomático o asociarse a movimientos de tipo masticatorio, que a diferencia del bruxismo no se acompañan de ruido. En el mentón es más fácil encontrar actividad fásica que tónica, pero frecuentemente coexisten las dos. La actividad fásica es más frecuente en las extremidades superiores que en las inferiores. La actividad fásica en las extremidades es más frecuente en los músculos distales que en los proximales. La actividad fásica se encuentra especialmente en el mentón, seguida del flexor superficial de los dedos en las extremidades superiores y del extensor breve de los dedos en las extremidades inferiores (32). Un polisomnograma con un montaje electromiográfico en el mentón, los dos flexores superficiales de los dedos y los dos extensores breves de los dedos, capta actividad fásica en el 94% de los movimientos que se produce en REM en los pacientes con TCSR idiopático (33) (Figura 2).
Sueño REM normal donde podemos ver actividad fásica mínima en los dos tibiales anteriores y en el extensor breve de los dedos derecho.
EOG: electrooculograma.
F3: actividad EEG frontal izquierda, F4: actividad EEG frontal derecha.
C3: actividad EEG central izquierda.
C4: actividad EEG central derecha.
01: actividad EEG occipital izquierda.
02: actividad EEG occipital derecha.
MEN: músculo mentalis.
LFDS: flexor de los dedos superficial izquierdo.
RFDS: flexor de los dedos superficial derecho.
LTA: tibial anterior izquierdo.
RTA: tibial anterior derecho.
LEDB: extensor breve de los dedos izquierdo.
REDB: extensor breve de los dedos derecho.
Paciente con TCSR donde podemos ver actividad fásica excesiva en las extremidades superiores e inferiores preservándose la atonía en el músculo mentalis.
EOG: electrooculograma.
F3: actividad EEG frontal izquierda,
F4: actividad EEG frontal derecha.
C3: actividad EEG central izquierda.
C4: actividad EEG central derecha.
O1: actividad EEG occipital izquierda.
02: actividad EEG occipital derecha.
MEN: músculo mentalis.
LFDS: flexor de los dedos superficial izquierdo.
RFDS: flexor de los dedos superficial derecho.
LTA: tibial anterior izquierdo.
RTA: tibial anterior derecho.
LEDB: extensor breve de los dedos izquierdo.
REDB: extensor breve de los dedos derecho.
De todos modos, en ocasiones la expresividad muscular de la falta de atonía de la fase REM no es muy llamativa, aunque si excesiva, y los registros audiovisuales detectan unos pocos y poco expresivos movimientos bruscos de intensidad y amplitud leves similares a las mioclonías de origen espinal. En estos casos, cuando la sospecha de TCSR es alta, puede repetirse el estudio para estar más seguros del diagnóstico y decidir si lo que estamos observando es normal o patológico, de acuerdo a nuestra experiencia. Esto es debido a que la actividad motora puede variar de una noche a otra, y que en algunas noches puede no ser muy llamativa. Para solventar ciertos casos ambiguos, en un estudio reciente hemos visto que un 32% de actividad fásica y tónica en el mentón y fásica en los flexores superficiales de los dedos de ambos antebrazos distingue a los controles de los pacientes con TCSR con una alta sensibilidad y especifidad (34). Este valor umbral debería servir como corte para el diagnóstico del TCSR, una práctica muy importante en la forma idiopática ya que su diagnostico correcto en un sujeto sano implica un alto riesgo de que desarrolle al cabo de unos años la EP y la DCL. El problema es que los sistemas para cuantificar la actividad tónica y fásica en el sueño REM, son muy laboriosos y requieren mucha experiencia y mucho tiempo. Sería deseable un método automático fiable que cuantificara esta actividad y que el valor obtenido en cada paciente definiera si está o no afecto del TCSR, de acuerdo con el 32% ya establecido (34).
En un estudio vimos que en los pacientes con TCSR idiopático tanto la actividad excesiva fásica como la tónica aumenta con el paso de los años antes de que los pacientes conviertan a una enfermedad degenerativa (17). Por otra parte, el clonazepam y la melatonina (los dos fármacos que mejoran los síntomas del TCSR) parecen disminuir la actividad excesiva fásica y tónica, respectivamente.
En el TCSR no se modifica el tiempo pasado en sueño REM a lo largo de la noche, ni el número de fases REM ni la latencia del inicio del sueño REM (17).
La actividad electroencefalográfica en los pacientes con TCSR idiopático durante la vigilia y el sueño es aparentemente normal. Sin embargo, el estudio detallado de las franjas electroencefalográficas muestra actividad lenta delta y theta en las regiones parietales y occipitales respecto a los controles, tanto en vigilia como en el sueño. Este hallazgo es especialmente frecuente en los pacientes con TCSR idiopático que años más tarde desarrollaran deterioro cognitivo leve y demencia.
En algunos pacientes con enfermedades neurodegenerativas a los que se asocia demencia como la E P, DCL o la parálisis supranuclear progresiva, la actividad electroencefalográfica durante la vigilia puede ser lenta al haberse perdido el ritmo alfa a favor de actividad theta. Esto dificulta la interpretación de las fases de sueño, especialmente la de la fase REM donde aunque hayan movimientos oculares rápidos puede no conservarse la atonía muscular. Por lo tanto, en algunos pacientes puede resultar difícil reconocer desde el punto de vista electroencefalográfico si estamos ante un estado de vigilia o un sueño REM sin atonía en un enfermo con un lentecimiento electroencefalográfico de base ya en vigilia. La situación extrema de esta situación se conoce con el término de “estado disociado” en la que incluso clínicamente es muy difícil saber si el paciente está despierto o durmiendo en un sueño REM sin atonía (1). Un nuevo problema puede aparecer cuando los pacientes toman antidepresivos, ya que estos fármacos disminuyen la proporción de sueño REM, y por lo tanto reducen las posibilidades de detectar un REM anormal.
FisiopatologíaPara conocer la fisiopatología del TCSR, es necesario dar un breve repaso a las estructuras encefálicas y neurotransmisores que intervienen en la génesis del sueño REM, con énfasis a la atonía muscular de esta fase. Estudios detallados en ratas han involucrado al núcleo subceruleus, que está situado en la protuberancia, como la estructura central del origen del sueño REM normal. El sueño REM aparece cuando este núcleo se activa y se inhiben las estructuras que favorecen el sueño noREM, especialmente la sustancia gris periacueductal y el tegmento lateral pontino, también situadas en la protuberancia (35, 36). Las conexiones entre el núcleo subceruleus y el complejo sustancia gris periacueductal/tegmento lateral pontino son inhibitorias y se efectúan mediante el neurotransmisor GABA. Es una inhibición reciproca similar a un interruptor eléctrico (flip-flop), ya que cuando se estimula las estructuras REM se inhiben rápidamente las noREM, y viceversa. Así, se explica que las transiciones que existen entre el sueño REM y noREM sean rápidas y no duren más de dos minutos. Hay otras estructuras reguladoras del sueño REM estimulando al núcleo subceruleus como el núcleo pedunculopontino (colinérgico) y en núcleo central de la amígdala (glutamatérgico), pero su papel es secundario. Otros núcleos también participan en la génesis del sueño noREM como el locus ceruleus (noradrenalina), el rafe dorsal (serotonina) y las células del hipotálamo posterior que secretan hipocretina (35).
La atonía muscular característica de la fase REM se genera a partir del locus subceruleus que lanza glutamato, que activa al núcleo magnocelularis en la región ventromedial del bulbo raquídeo. Esta activación hace que el núcleo magnocelularis inhiba mediante GABA y glicina a las motoneuronas de la médula espinal y a las de los pares craneales motores. Al inhibirse las motoneuronas, se produce una atonía completa en la musculatura esquelética evitando que cuando uno sueñe durante el sueño REM se mueva y se lastime. Además, el núcleo subceruleus recibe proyecciones del núcleo central de la amígdala, explicándose así el contenido emocional (placer, miedo) que pueden tener algunos sueños durante el sueño REM. Durante el sueño REM la secreción de hipocretina desde el hipotálamo disminuye, y con ello se estimula la actividad de la amígdala y del núcleo subceruleus (35, 36).
A mediados de los años sesenta del siglo XX se documentó en gatos que lesiones experimentales inducidas en el tegmento mesopontino podían eliminar la atonía muscular característica de la fase REM y aparecer movimientos bruscos (37). Posteriormente se observó que según la localización y extensión de la lesión en el tegmento mesopontino el comportamiento del animal durante el sueño REM era más o menos complejo variando desde mínimos movimientos bruscos hasta un comportamiento de ataque o defensa (38). Estudios posteriores en roedores demostraron que este modelo animal de TCSR se producía cuando se lesionaba selectivamente en la protuberancia el núcleo sublaterodorsal (llamado núcleo subceruleus en el hombre y peri-alfa locus ceruleus en los gatos) (36-39). Este modelo de REM sin atonía asociado a conductas complejas también se puede apreciar cuando se lesiona el núcleo magnocelularis en la parte ventromedial del bulbo raquídeo (38). La manipulación genética ha conseguido también modelos animales del TCSR. Un estudio en roedores mostró la falta de atonía en el sueño REM después de que en el núcleo sublateradorsal y en el magnocelularis se eliminara al gen del transportador vesicular 2 del glutamato (36). Así, este estudio no solo vuelve implicar a estos dos núcleos en la génesis del TCSR sino también al déficit de glutamato. Otro modelo genético de TCSR se ha obtenido en ratones donde se hicieron desaparecer a los receptores de GABA y glicina (40).
En resumen, los estudios experimentales en animales descritos han mostrado que el TCSR aparece cuando hay una disfunción del núcleo subceruleus, del núcleo magnocelularis, del glutamato, del GABA y de la glicina. Pero además hay otras estructuras que pueden tener un papel importante en el origen del TCSR. La amígdala se activa durante el sueño REM y estimula al núcleo subceruleus. La disfunción del núcleo central de la amígdala puede explicar el contenido desagradable de los típicos sueños de los pacientes con TCSR (ser perseguidos, ser atacados por animales, etc). En la encefalitis límbica mediada por anticuerpos contra canal de potasio hay una lesión amigdalar bilateral, sin afectar aparentemente al tronco cerebral, y el TCSR es frecuente en esta entidad. En estos casos, es posible que la lesión amigdalar haya interrumpido sus conexiones anatómicas con el núcleo subceruleus dando lugar al TCSR (29). Por otra parte, el TCSR también puede aparecer en el contexto de la narcolepsia con cataplejía, una entidad donde no se sintetiza hipocretina (28). La hipocretina en condiciones normales inhibe la aparición del sueño REM al desactivar al núcleo subcerulus. Por lo tanto, el déficit de hipocretina de la narcolepsia favorece la aparición de un sueño REM sin atonía, es decir el TCSR.
La aparición del TCSR en el contexto de la E P, DCL y AMS no es muy difícil de explicar. En estas tres entidades la pérdida celular y el depósito anormal de alfa-sinucleína (en forma o no de cuerpos de Lewy) es frecuente en el núcleo subceruleus, el núcleo magnocelularis y en la amígdala. Pero el TCSR no aparece en todos los pacientes con EP y DCL. Es posible que en estos sujetos sin TCSR la cantidad de pérdida celular o disfunción en estos núcleos exista, pero no sea la suficiente para que aparezca un REM sin atonía y conductas anormales durante el sueño REM.
El hecho de que los pacientes con TCSR idiopático puedan desarrollar al cabo de unos años los síntomas motores clásicos (el parkinsonismo) de la EP también puede explicarse desde un punto de vista anatomopatológico. Recordemos primero que en la EP el parkinsonismo (bradicinesia, rigidez, temblor en reposo y alteraciones de la postura) se debe a la pérdida celular y depósito de cuerpos de Lewy en la sustancia negra del mesencefalo y el consiguiente déficit de dopamina que no llega a los ganglios basales. Braak et al. (41), al estudiar encéfalos de pacientes con EP establecieron que el depósito de cuerpos de Lewy empieza en el bulbo olfatorio y en el bulbo raquídeo donde está el núcleo magnocelularis (estadio 1), para ir ascendiendo de manera secuencial por la protuberancia donde está el núcleo subceruleus (estadio 2), el mesencéfalo donde está la sustancia negra (estadio 3), la amígdala (estadio 4) y la corteza cerebral (estadios 5 y 6). Así, el TCSR correspondería a la afectación de los estadios 1 (núcleo magnocelularis) y 2 (núcleo subceruleus) que precedería al estadio 3 (sustancia negra). Esto es consistente con los estudios de neuroimagen funcional en los pacientes con TCSR idiopático. En estos sujetos la resonancia magnética con difusión señala afectación en el tronco de los núcleos que regulan el sueño REM como el subceruleus. El DAT-SPECT demuestra en estos sujetos un déficit del transportador de la dopamina en los ganglios basales que indica que hay un déficit de la síntesis de la dopamina en la sustancia negra, que todavía no tiene la suficiente magnitud para producir parkinsonismo clínico (los pacientes con TCSR idiopático no tienen una manifiesta rigidez, bradicinesia, temblor ni alteraciones posturales). Tiene que quedarnos bien claro que este déficit dopaminérgico de la sustancia negra no es la causa del TCSR, sino un epifenómeno. De hecho, los síntomas del TCSR no mejoran con medicaciones dopaminérgicas. Lo mismo pasa con la sonografía transcraneal, que en el TCSR idiopático muestra un aumento de la hiperecogenicidad de la sustancia negra que refleja que empieza a tener alteraciones que todavía no son lo suficientemente graves para provocar parkinsonismo.
EL TCSR es muy frecuente en las sinucleinopatías, es decir en las enfermedades neurodegenerativas asociadas a un depósito anómalo intracelular de la proteína alfa-sinucleína como la E P, la AMS y la DCL. Esto ha hecho pensar a diversos autores que el TCSR es secundario a un depósito anómalo intracelular de la proteína alfa-sinucleína. Esta idea es interesante, pero probablemente no sea cierta ya que el TCSR también aparece de forma frecuente en enfermedades neurodegenerativas, esporádicas o hereditarias, que se asocian al depósito de otras proteínas anómalas en el encéfalo como en la enfermedad de Machado-Joseph (proteína ataxina 3), el parkinsonismo por mutaciones en el gen de la parkina (proteína parkina), o en la parálisis supranuclear progresiva (proteína tau). Todas las entidades donde el TCSR aparece, comparten la característica de que presentan una importante neurodegeneración en el tronco del encéfalo lesionando a las estructuras que en condiciones normales modulan el sueño REM. El TCSR no es frecuente en la enfermedad de Alzheimer porque el tronco no está severamente dañado. Por otra parte, el hecho de que en el TCSR el contenido de los sueños tenga un contenido emocional desagradable y angustioso sugiere que el sistema límbico, además del tegmento mesopontino, también esté implicado en la fisiopatología del TCSR. En resumen, la fisiopatología del TCSR parece que radica en una disfunción de las estructuras del tronco del encéfalo que generan y modulan el sueño REM, especialmente los núcleos subceruleus y magnocelularis, donde hay una disfunción del glutamato, GABA y glicina independiente del origen patológico o sustrato subcelular.
TratamientoDebe iniciarse con clonazepam o melatonina cuando 1) existe riesgo de lesiones, 2) las pesadillas molestan al paciente y, 3) las conductas vigorosas molestan al compañero de cama. Hay pacientes que no precisan tratamiento porque la intensidad de las conductas es leve. En algunos casos puede recurrirse a apartar muebles lejos de la cama, dormir separado de la pareja, poner barandillas acolchadas en la cama o colchones en el suelo.
El 85-90% de los pacientes con TCSR responde al tratamiento con clonazepam a dosis entre 0.25 y 4mg antes de acostarse. Esto ocurre tanto en la forma idiopática como en la sintomática de cualquier origen. La respuesta favorable consiste en la disminución de la intensidad de las conductas violentas y de las pesadillas. Los polisomnogramas muestran una reducción de la actividad muscular fásica en REM, pero no la tónica (31). La buena respuesta de los síntomas no evita la futura conversión a una enfermedad neurodegenerativa en al forma idiopática. No es frecuente que estos pacientes desarrollen abuso o tolerancia con el clonazepam. Los efectos secundarios son somnolencia, mareos, incontinencia e impotencia. La supresión del tratamiento hace que la clínica nocturna vuelva a aparecer inmediatamente. No se sabe por qué el clonazepam es efectivo y no otras benzodiacepinas.
La melatonina, a dosis entre 3 y 12mg al acostarse también es efectiva para controlar los síntomas. No se sabe por qué es efectiva, pero se ha visto que disminuye la actividad muscular tónica en REM, pero no la fásica (41). Sus efectos secundarios son escasos. Los agentes dopaminérgicos no son efectivos (42).
ConclusionesEl trastorno de conducta durante el sueño REM es una parasomnia caracterizada por pesadillas y conductas vigorosas durante un sueño REM sin atonía. Se debe a una disfunción de los núcleos del tronco del encéfalo encargados de que en la fase REM no haya tono ni actividad muscular. Ya que estos núcleos suelen estar dañados en la enfermedad de Parkinson y la demencia con cuerpos de Lewy, no es de extrañar que el trastorno de conducta del sueño REM sea frecuente en estas entidades neurodegenerativas. Es bien conocido que la forma idiopática del trastorno de conducta del sueño REM es un potente indicador de la futura aparición en unos años de los síntomas motores y cognitivos clásicos de algunas enfermedades neurodegenerativas. Esto invita a que se ensayen medicamentos neuroprotectores para evitar la aparición de parkinsonismo y demencia. El tratamiento con clonazepam y melatonina mejora los síntomas del trastorno de conducta del sueño REM, pero no evita la conversión hacía enfermedades neurodegenerativas.
El autor declara no tener conflictos de interés, con relación a este artículo.