Las enfermedades degenerativas del cerebro son cada vez más frecuentes, debido al envejecimiento de la población en Chile y en prácticamente todas las regiones del mundo. Las alteraciones del sueño son un componente importante cada vez mejor reconocido en sus manifestaciones clínicas, si bien frecuentemente ignorados en muchas de las evaluaciones. No obstante, es muy importante reconocer estos trastornos porque dificultan el manejo óptimo de estas complejas enfermedades. Por ejemplo, cuadros como el trastorno conductual del sueño REM (por Rapid Eye Movements, en Inglés, un componente de los ciclos del sueño que incluye el fenómeno de “actuar los sueños”) se han configurado como potenciales biomarcadores de la presencia de la enfermedad de Parkinson. Por lo tanto, se trata no sólo de identificar trastornos y manifestaciones específicas dentro del contexto de las enfermedades ya aludidas, sino que también de utilizar estos trastornos clave como elementos importantes en el diagnóstico precoz de las mismas. En esta revisión analizamos los principales problemas relacionados al sueño que es posible observar en este tipo de enfermedades, y que forman parte de las consideraciones esenciales para un manejo óptimo, actualizado e integral de estas enfermedades (Parasomnias, enfermedades neurodegenerativas, apneas del sueño).
In this review we consider some late findings in new aspects in neurodegeneratives disease, mainly Parkinson´s disease and associated Dementias, specifically regarding the presence of sleep disorders. Sleep disorders have become an integral part in the phenomenology of the neurodegeneratives disease that enable us also to understand their pathophysiology: REM behaviour disorder is an oustanding example. Sleep apnea besides its pivotal importance in cardiovascular and metabolic complications, is of special interest because appropiate treatment may improve or even arrest cognitive impairment in some patients. In this regard, the future is extremely exciting regarding the presence of sleep disorders in Parkinson‘s disease and dementia because may give us a new tool to treat this prevalent conditions
En la descripción original de la enfermedad hecha por el doctor James Parkinson a comienzos del Siglo XIX, destacan no sólo las manifestaciones motoras (es decir del movimiento), sino que también aspectos relacionados con el sueño: “el temblor persiste en etapas avanzadas del sueño y puede aumentar hasta despertar al enfermo, en ocasiones agitado”.
A pesar de la creencia habitual de que los movimientos anormales que acompañan a las enfermedades extrapiramidales desaparecen en el sueño, varios de ellos como los tics, distonias, pueden persistir en el sueño. Por otro lado, el temblor, los movimientos periódicos y los movimientos no periódicos de las extremidades, el aumento de actividad electromiográfica y el trastorno de conducta durante el sueño REM, pueden preceder o acompañar a estas enfermedades desde su inicio. Es fundamental la patología cerebral que subyace a la Enfermedad de Parkinson (EP) y que daña los circuitos reguladores del ciclo de sueño vigilia (sustancia negra, núcleo pedunculopontino, núcleo dorsal del rafe, etc.) así como el efecto de la terapia dopaminérgica.
En casi el 90% de los pacientes con EP se observan alteraciones del sueño. Las más importantes son el insomnio, el trastorno de la conducta durante el sueño REM, las alteraciones respiratorias y la somnolencia diurna excesiva (1).
InsomnioLas polisomnografías nocturnas (PSGN) muestran una pobre eficiencia del sueño, una disminución de las etapas 3 y 4 de sueño no REM (NREM), numerosos microdespertares y una marcada fragmentación del sueño. El insomnio suele ser de mantenimiento. Se consideran como factores inductores los síntomas motores en el sueño, la nocturia, el efecto de las drogas dopaminérgicas, el efecto de la sintomatología depresiva, y los movimientos periódicos de las extremidades. Los despertares nocturnos probablemente contribuyen a la fatiga diurna e hipersomnolencia de las que se quejan muchos pacientes.
La fragmentación del sueño, producto de los periodos off, puede verse en cualquier etapa del sueño, aunque es más frecuente en fases de sueño superficial (fases 1 y 2 de sueño NREM). La identificación de estos trastornos ha sido útil, ya que ha permitido establecer que la terapia dopaminérgica, el uso de la apomorfina y la estimulación cerebral profunda mejoran la calidad del sueño. Por lo tanto, el uso apropiado de la PSGN tiene implicaciones prácticas en el manejo de estos pacientes.
Trastornos respiratoriosSe estima que un 20-50% de los pacientes con EP a los que se les realiza una PSGN presentan un síndrome de apnea e hipopnea obstructiva del sueño (SAOS), inclusive aquellos que presentan un índice de masa corporal normal, y por lo tanto tendrían un menor riesgo de dichos trastornos si no tuviesen E P. En estos pacientes, si bien no existe sobrepeso, destaca de manera importante la rigidez de la musculatura torácica y la descoordinación de los músculos involucrados en la respiración. Además pueden contribuir las manifestaciones off en relación a la terapia y las diskinesias inducidas por levodopa. Sin embargo, no alcanza la gravedad que se presenta en la Atrofia Multisistémica (una enfermedad distinta, dentro del gran espectro de los síndromes con parkinsonismo), que puede llegar a presentar estridor por parálisis de cuerdas vocales.
Nuevamente, dada la existencia de tratamientos efectivos para la SAOS, la ejecución de una PSGN en pacientes debidamente calificados tiene consecuencias tangibles para su manejo óptimo. En efecto, la paliación o corrección de un SAOS no sólo mejora al mismo, sino que mitiga el impacto motor y cognitivo de la E P, además de disminuir significativamente el riesgo de infartos cerebrales (2).
Trastorno de conducta durante el sueño REMEl trastorno de la conducta en el sueño REM (RBD; del inglés, REM Sleep Behavior) también es frecuente en la E P. A grandes rasgos, se trata de una falla en la atonía Disorder muscular o la parálisis que normalmente impide el “actuar” los sueños. Por lo tanto, el paciente y/o (aún más frecuentemente) el acompañante del paciente, se queja de movimientos muy exagerados y hasta violentos durante el sueño. El seguimiento a los pacientes con este trastorno muestran que hasta el 75% de los pacientes con RBD llega a presentar una sinucleopatía (cuerpos de inclusión intraneuronales que contienen α-sinucleína), tales como la E P, la Atrofia Mulsistémica o la Demencia con cuerpos de Lewy (DCL) (2). Un tercio de ellos manifiesta también hiposmia, signo que constituye también una manifestación precoz de la E P. Estudios patológicos asocian esta alteración del sueño con daño en los núcleos tegmental pedunculopontino del puente o protuberancia, con reducción de neuronas colinérgicas y la presencia de cuerpos de Lewy (que contienen entre otras proteínas α-sinucleína). También hay compromiso del área extrapiramidal mesencefálica localizada en la unión del meséncefalo y protuberancia y la región subcerulea. Estas zonas contienen neuronas caracterizadas como REM on ó REM off que proyectan a las neuronas reticuloespinal bulbares del área llamada zona inhibitoria bulboespinal. La descarga de esas neuronas en relación al sueño REM y son necesarias para mantener la atonía del REM a través de la acción inhibitoria de neuronas que utilizan glicina y que inervan a las motoneuronas espinales.
La relación con la parálisis supranuclear progresiva y la enfermedad de Alzheimer, hace pensar que el RBD sería la expresión precoz de las sinucleopatías. Además parece constituir una manifestación de un mayor compromiso del tronco encefálico, y un factor de riesgo o probable biomarcador para el desarrollo posterior de alucinaciones y demencia. El tratamiento de elección es clonazepam 0.5 mg/noche. Se ha observado también que la melatonina a 3-12 mg/noche y el donepezilo mitigan estos síntomas. Debe también evitarse el uso de antidepresivos inhibidores de la recaptación de serotonina, ya que agravan el RBD.
Fenómenos alucinatorios durante el sueñoSe estima que al menos un 40% de los pacientes parkinsonianos desarrollan una psicosis inducida por la terapia dopaminérgica. Existen estudios que demuestran que el 82% de los pacientes que presentan alucinaciones tienen trastornos del sueño añadidos. Se cree que las alteraciones del sueño REM participan en la fisiopatología de las alucinaciones. Dado el efecto supresor de levodopa sobre el sueño REM se ha postulado que un rebote del sueño REM puede originar las alucinaciones que experimentan estos pacientes. Enfermos estudiados electrográficamente durante el día muestran que en los periodos de alucinaciones tienen intrusiones del sueño REM con contenido onírico. A través de estudios con PSG y test de latencias múltiples se ha demostrado que algunos pacientes que alucinan durante el día tienen una mayor ocurrencia de RBD nocturno y un sueño REM anormal en las siestas diurnas. La correlación entre ambas patologías (RBD y alucinaciones asociadas al sueño REM) plantea la posibilidad de que los trastornos de la regulación del sueño pueden ser uno de los factores importantes implicados en la patogenia de las alucinaciones inducidas por fármacos. Se necesitan más estudios al respecto para formular recomendaciones a fin de adaptar mejor la farmacoterapia en aquellos pacientes con mayor riesgo, o que ya experimentan estas manifesta-ciones clínicas.
Somnolencia diurna excesivaAlrededor de un 50% de los pacientes parkinsonianos presenta somnolencia diurna significativa (hasta un 30% evaluada mediante la escala de Epworth). Se ha postulado que los mecanismos implicados en la vigilia están alterados en la enfermedad de Parkinson. Esta hipótesis se apoyaría en el hecho de que existen pacientes con inicio precoz de la enfermedad, con excesiva somnolencia diurna, y cuyo estudio de latencias múltiples muestran frecuentes intrusiones del sueño REM. Este hallazgo también se ha observado en pacientes con la enfermedad clásica (10% de 27 pacientes).
Efecto de la terapia dopaminérgica sobre el sueño y sobre la vigiliaLa hipersomnolencia diurna (también conocida como Excesiva Somnolencia Diurna, o ESD) se observa con más frecuencia en la enfermedad de Parkinson en comparación con otras enfermedades y en relación a sujetos controles sanos. En diversos estudios poblacionales, se observa ESD en el 15.5% de los pacientes, asociándose a un mayor número de complicaciones, con mayor posibilidad de demencia y alucinaciones, y un mayor avance de la enfermedad en general.
A partir de la interesante descripción de Frucht y colaboradores en 1999 de la presencia de ataques de sueño asociado al tratamiento con los nuevos agonistas (Frucht et al. 1999), comenzó a estudiarse el problema con gran interés. Actualmente se sabe que todos los fármacos utilizados, incluyendo levodopa y apomorfina, producen hipersomnolencia, y su frecuencia aumenta también con los agonistas dopaminérgicos.
Actualmente se postula que la hipersomnolencia es una característica primaria de la enfermedad y que el tratamiento contribuye a incrementarla. Se postula que los sujetos con hipersomnolencia primaria, tienen tres veces más riesgo de desarrollar una enfermedad de Parkinson (2).
Evaluación general de los trastornos del sueño en la EPEn la evaluación médica de pacientes con la EP y parkinsonismos atípicos debería estudiarse la calidad del sueño (Tabla 1). Lamentablemente, la valoración en esta esfera mediante la escala de valoración unificada para la enfermedad de Parkinson UPDRS (Unified Parkinson Disease Rating Scale, en inglés) resulta insuficiente. La escala diseñada por Chaudhuri de 15 items resulta fácil de aplicar y está validada en español. Evalúa las manifestaciones más frecuentes que provocan trastornos del sueño en la PD. El control adecuado de los síntomas motores diurnos mejora la calidad de sueño en la mayoría de los pacientes. Sin embargo un 98% de los pacientes en los que se han controlado adecuadamente las manifestaciones motoras siguen presentado alteraciones de la calidad de sueño.
Alteraciones del sueño en la enfermedad de parkinson
| • Insomnio de mantenimiento |
| • Trastorno de conducta en sueño REM |
| • Hipersomnolencia diurna y ataques de sueño |
| • Síndrome de piernas inquietas y movimientos periódicos de las piernas durante el sueño |
| • Síndrome de apneas-hipopneas durante el sueño |
| • Alucinaciones secundarias a intrusiones del sueño REM durante el día |
El tratamiento debe hacerse en forma individualizada. La historia clínica debe basarse en los datos aportados por el cuidador o por la persona que duerme con el paciente. Es muy importante determinar la hora en la que se administra la medicación antiparkinsoniana, cualquier cambio de la misma, periodos off, y la medicación concomitante. En los pacientes que presentan importantes alteraciones motoras nocturnas, trastornos respiratorios o excesiva somnolencia diurna debería plantearse un estudio polisomnográfico. Antes del uso de cualquier fármaco, deben indicarse al paciente y a su familia medidas de higiene del sueño (sobre todo evitar cafeína, tabaco y alcohol).
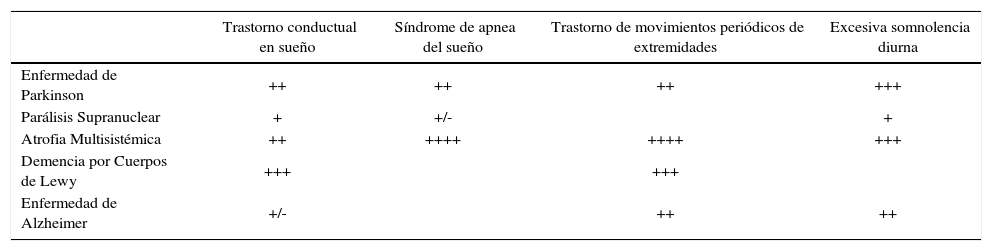
Un resumen con las diferentes alteraciones del sueño en la enfermedad de Parkinson y en otras enfermedades neurodegenerativas se presenta en la Tabla 2.
Alteraciones del sueño en enfermedades neurodegenerativas
| Trastorno conductual en sueño | Síndrome de apnea del sueño | Trastorno de movimientos periódicos de extremidades | Excesiva somnolencia diurna | |
|---|---|---|---|---|
| Enfermedad de Parkinson | ++ | ++ | ++ | +++ |
| Parálisis Supranuclear | + | +/- | + | |
| Atrofia Multisistémica | ++ | ++++ | ++++ | +++ |
| Demencia por Cuerpos de Lewy | +++ | +++ | ||
| Enfermedad de Alzheimer | +/- | ++ | ++ |
PLMD: Trastorno de movimientos periódicos de extremidades; SAS: síndrome de apnea del sueño; RBD: trastorno de conducta en sueño REM; ESD: excesiva somnolencia diurna.
(Modificado deComella 2007 b)
El cuidado de personas con demencia es complejo especialmente en las noches, ya que con la declinación cognitiva, la duración total del sueño disminuye, los patrones del sueño se fragmentan con frecuentes despertares, acompañados de agitación, gritos y agresividad física (3). Los trastornos del sueño afectan a 25-30% de los pacientes con Demencia, contribuyen al riesgo para una mayor institucionalización, mayor sobrecarga y peor calidad de vida para los cuidadores y abuso de psicofármacos (3-6). El mejor manejo de estos trastornos y los factores que influyen podrían repercutir en enlentencer la progresión del deterioro cognitivo de estos enfermos. Los antipsicóticos e hipnóticos son generalmente poco efectivos y con efectos adversos importantes. Metanálisis de las intervenciones no farmacológicas han mostrado que para reducir la agitación son útiles la aromaterapia, los baños termales, la música relajante y los masajes (6).
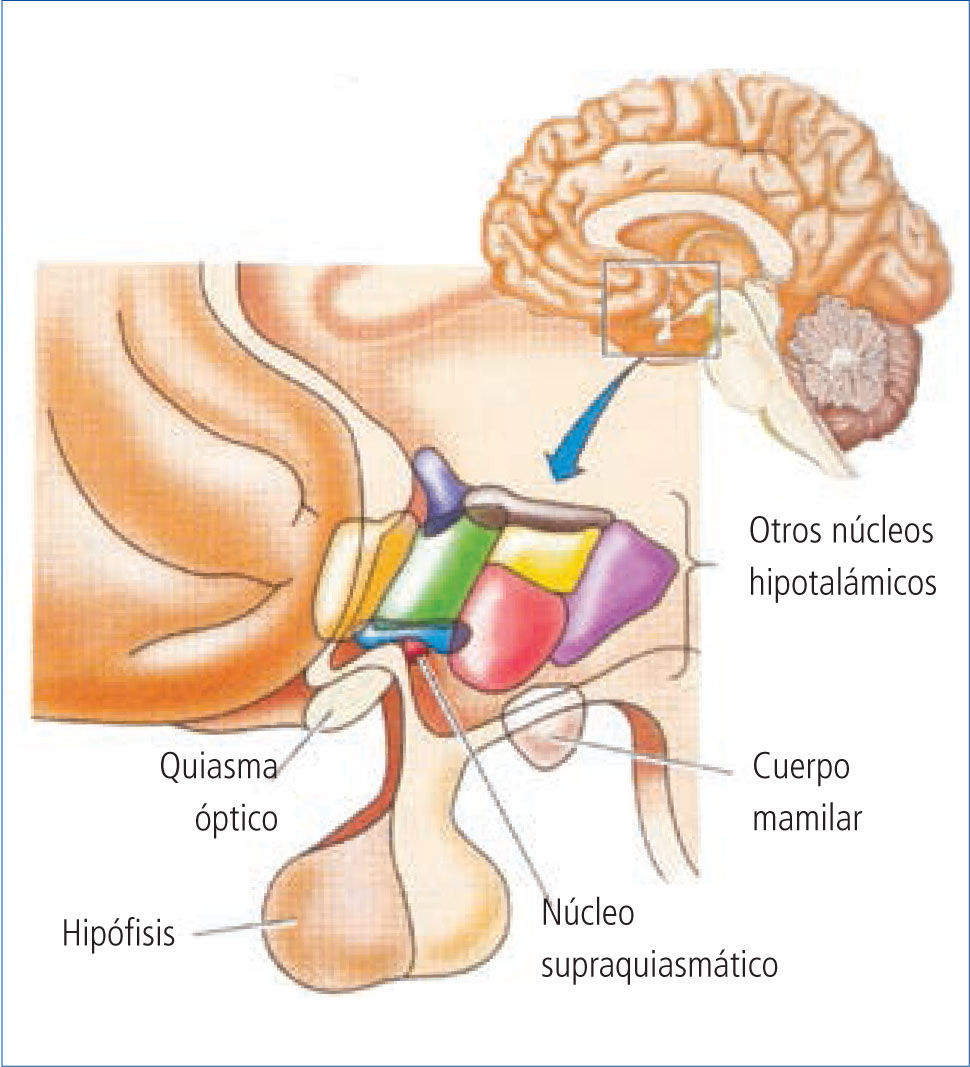
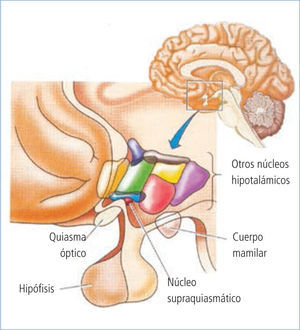
Fisiopatología de los trastornos del sueño en pacientes con demenciaGrupos de neuronas que median el ritmo circadiano - incluyendo el sueño - están localizados en el hipotálamo anterior (núcleo supraquiasmático), sistema reticular activante, glándula pineal y la protuberancia (ver Figura 1). La melatonina, producida en la glándula pineal, es importante en la termorregulación, el sueño y la presión arterial, aumentando su producción en la noche cuando disminuye la cantidad de luz (10).
El sistema colinérgico, que está muy comprometido en la Enfermedad de Alzheimer (EA) desde estadíos muy tempranos, participa en la regulación de las etapas del sueño, siendo su actividad mayor en la vigilia y el sueño REM, y menor en sueño no REM, modificando la función de vías neuronales que inician y mantienen el sueño (11). Cabe enfatizar que el análisis de los trastornos del sueño en la EA se encuentran en su infancia, como parte del proceso considerablemente retrasado de la reformulación de esta propuesta entidad clínico-patológica y la búsqueda hasta ahora infructuosa de su(s) causas, así como de la definición de la fisiopatología a nivel de sistemas neuronales de la misma (12).
Los trastornos del sueño en pacientes con demencia pueden deberse a trastornos del sueño primarios de alta prevalencia, como los trastornos respiratorios del sueño (5, 11), que producen hipoxia y que tienen prevalencias del 70-80%, o segundarios a comorbilidad psiquiátrica, especialmente depresión y ansiedad (13). Por otro lado, existe una creciente evidencia de que los trastornos del sueño se producen con independencia de otros diagnósticos, y que los trastornos del sueño pueden ser indicadores de la degeneración de las vías nerviosas que regulan los patrones de sueño-vigilia y la arquitectura del sueño (14, 15). Las asociaciones entre los trastornos del sueño y la demencia pueden también atribuirse a elementos fisiopatológicos comunes, por ejemplo en la EA por la pérdida de la inervación colinérgica en áreas temporales mediales, y particularmente en hipocampo y corteza entorrinal, conocidos por su importancia en el funcionamiento de la memoria declarativa (11). La hipótesis es que la hipofunción colinérgica es importante tanto en el deterioro de la memoria declarativa como en las alteraciones del sueño en estos pacientes dado que el hipocampo recibe abundante inervación del cerebro anterior basal, que, como ya se ha mencionado, participa en la generación de sueño REM (11).
Por otra parte, la alteración del ritmo circadiano que se observa en la EA podría reflejar una pérdida neuronal progresiva en el núcleo supraquiasmático, influyendo también alteraciones en el péptido vasoactivo intestinal y/o una disminución de la liberación de melatonina (11, 15). Los estudios con polisomnografía en la EA muestran anormalidades del sueño REM, que pueden indicar el daño de las vías colinérgicas, lo cual se relaciona clínicamente con la pérdida de la memoria declarativa. Un estudio de Kunderman y cols. comparó los cambios en PSG en pacientes con Demencia Frontotemporal v/s EA (12). En este último grupo mostró aumento de la latencia del sueño REM, reducción del sueño REM y reducción de la etapa 2 de sueño no REM, concluyendo que las alteraciones del sueño REM parecen ser específicas para la EA, dado que no fueron observadas en los casos de Demencia Frontotemporal. Los cambios en la etapa 2 de sueño NoREM se observaron tanto en pacientes con Alzheimer como en Demencia Frontotemporal, y se correlacionan con los defectos en la memoria declarativa que presentan ambos cuadros. Esta etapa del sueño no REM sería relevante en la consolidación de este tipo de memoria (11).
Trastorno Conductual del sueño REM en el diagnóstico diferencial de las demenciasSegún se resumió más arriba, el RBD es un trastorno de la conducta asociado a la fase REM del sueño que se interpreta como una escenificación de sueños con movimientos asociados, que pueden ser violentos (19-22). Suele aparecer a la hora y media del comienzo del sueño, pudiendo presentarse varios episodios a lo largo de la noche. Afecta preferentemente a pacientes de edad mediana y varones de mayor edad, aunque puede presentarse en ambos sexos y a cualquier edad. En esta patología la atonía muscular (una de las características del sueño REM) está ausente, permitiendo movimientos violentos que pueden llegar a producir lesiones al paciente o a su pareja (Figura 1). En ocasiones pueden ser confundidos con crisis epilépticas, trastornos psiquiátricos o síndrome de apnea obstructiva del sueño (19-22).
Los pacientes relatan actividad vigorosa durante la noche acompañada de sueños muy vívidos: persecuciones, agresiones, situaciones de guerra y todo tipo de situaciones violentas en las que el paciente, al sentirse en peligro ha de protegerse, por lo que comienza a moverse en la cama, grita y puede incluso agredir al compañero de cama, y así convertirse en muchas ocasiones en problemas de pareja. Dicha actividad puede ocasionar además autolesiones, de ahí que la protección del dormitorio sea una de las primeras medidas a tomar. Los pacientes son capaces de describir con claridad lo que han soñado, lo que es una diferencia fundamental con los terrores nocturnos y el sonambulismo. Esto último es muy útil para comenzar a establecer el diagnóstico y plantear un tratamiento apropiado. La queja primordial de estos pacientes es sobre los episodios violentos y no sobre la mala calidad de sueño. Se han observado casos en unidades de cuidados intensivos: en una serie de 20 pacientes, 17 experimentaron RBD (22).
Existe una asociación del RBD con enfermedades del sistema nervioso central tales como la Enfermedad de Parkinson, Atrofia multisistémica, Demencia de los cuerpos de Lewy, Trastorno cerebrovascular o Narcolepsia (20).
Generalmente el RBD es considerado como un marcador de sinucleopatias: 75% de los pacientes seguidos en el tiempo presentará una enfermedad de Parkinson o Demencia por cuerpos de Lewy (19-22). El patrón cognitivo que presentan estos pacientes difiere de lo observado en la EA: hay confusión fluctuante, alucinaciones visuales, gran sensibilidad a neurolépticos, incluso los atípicos que años atrás se planteaba -incorrectamente- tenían menor tendencia a este tipo de efectos adversos, e hiposmia (19). Aún se postula que rara vez se observa RBD en taupatías, como parálisis supranuclear progresiva o la degeneración corticobasal, si bien algunas comunicaciones recientes están mostrando una mayor prevalencia (20). Por lo tanto, es posible que no exista una relación estricta entre la propuesta patología molecular y síndromes clínico-patológicos convencionales.
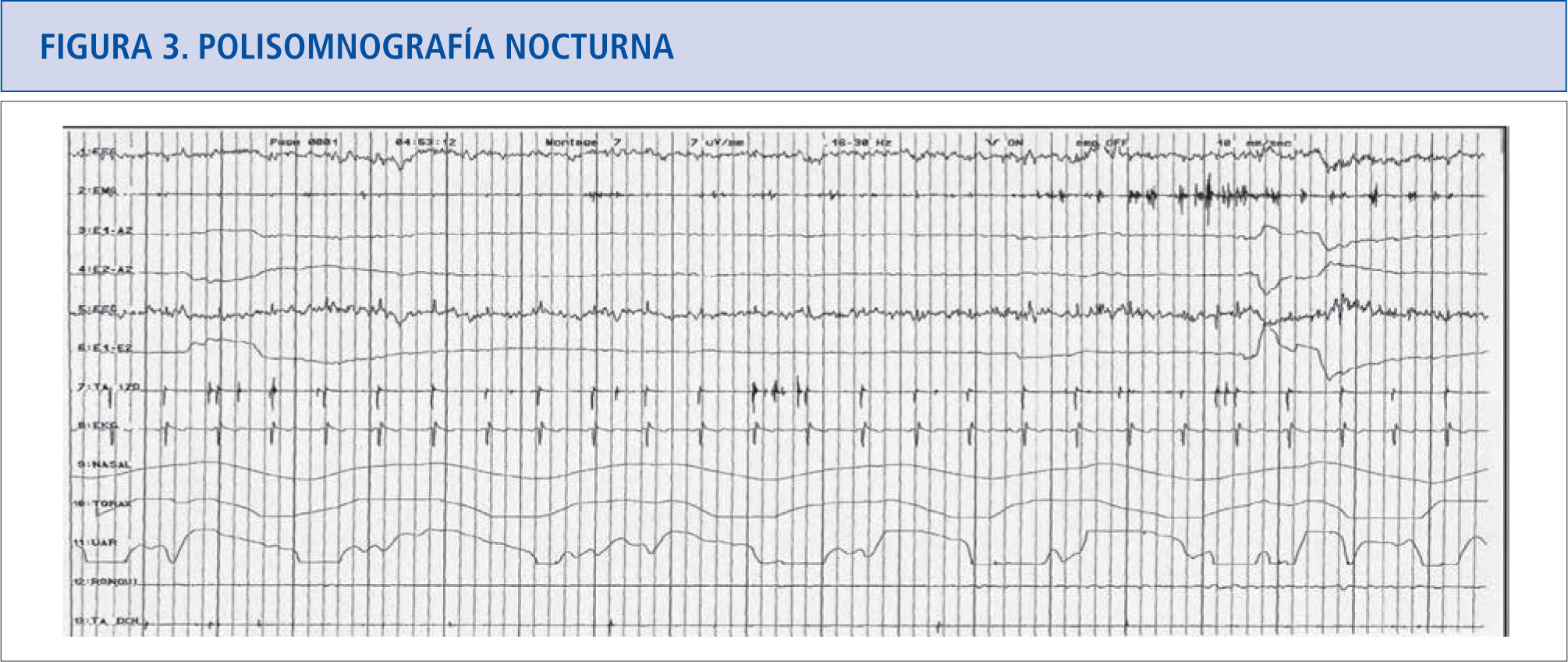
Para llegar al diagnóstico se realiza una historia clínica minuciosa que revela un comportamiento problemático durante el sueño, con sueños violentos o historia de quejas del compañero de cama. En la polisomnografía nocturna (PSGN; Figura 3) se deberá cumplir al menos una de las siguientes características durante el sueño REM para proponer la existencia de un RBD:
- 1)
Aumento excesivo del tono muscular en el registro electromiográfico (EMG) del mentón o aumento del tono muscular en el registro EMG en las extremidades.
- 2)
Observación de movimientos complejos o vigorosos durante el registro.
- 3)
Ausencia de atonía durante el sueño REM (22) que puede presentarse aún sin que el paciente reporte elementos clínicos. Si los resultados y la historia del paciente sugieren alguna enfermedad neurológica, el estudio se completará con potenciales evocados, resonancia magnética nuclear (RMN) cerebral o tomografía axial computarizada (TAC).
El tratamiento de elección es clonazepam, que es efectivo en el 90% de los casos. Además del tratamiento farmacológico es esencial proteger al paciente de posibles elementos que puedan dañarle cuando se presenten los episodios (22). El curso de la enfermedad será crónico en el tipo idiopático, y curiosamente tenderá a remitir si es secundario a una enfermedad neurológica.
Existe un cuestionario de muestreo (screening) para apoyar el diagnóstico de trastorno conductual del sueño REM que responde la pareja del paciente y que presenta una buena correlación diagnóstica con la polisomnografía. Este cuestionario desarrollado por Boeve y cols., se encuentra disponible en español en el sitio web: http://www.mayoclinic.org/sleep-disorders/research.html
Principales trastornos del sueño en paciente con demenciaEn las tablas 2 y 3 presentamos las alteraciones del sueño más frecuentes en pacientes con síndromes demenciales y en enfermedades neurodegenerativas que pueden cursar con algún grado de deterioro cognitivo. En la tabla 4 se observan condiciones médicas crónicas que pueden influir en el sueño y que pueden presentarse en concomitancia con un deterioro cognitivo. Revisamos a continuación los trastornos más frecuentes.
Tipos más frecuentes de alteraciones del sueño en demencia
| • Insomnio |
| • Cambio en patrones de sueño. |
| • Despertares frecuentes. |
| • Somnolencia diurna excesiva. |
| • Disminución del sueño REM y non REM profundo. |
| • Trastorno conductual del REM (más especifico para Demencia por Cuerpos de Lewy). |
| • Sundowning (confusión vespertina) |
| • Síndrome de piernas inquietas. |
| • Movimientos periódicos de las extremidades. |
| • Síndrome apneas obstructivas del sueño (SAOS). |
Condiciones crónicas que pueden alterar el sueño
| • Depresión: insomnio. |
| • Insuficiencia cardíaca congestiva: ortopnea y nicturia. |
| • Enfermedad pulmonar: despertares por tos. |
| • Delirium: fragmentación del sueño. |
| • Dolor agudo o crónico: insomnio, despertares. |
| • Reflujo gastroesofágico: despertares. |
| • Obesidad: ronquido y SAOS (Síndrome de Apnea Obstructiva del sueño). |
Pocos estudios han investigado qué subyace la agitación en pacientes con demencia. El estudio de Rose y cols (3), investigó por ejemplo si trastornos del sueño como el síndrome de piernas inquietas, los movimientos periódicos de extremidades y la presencia de apneas obstructiva puedan contribuir a la agitación de estos enfermos.
El estudio mostró que las personas con demencia y agitación nocturna presentan importantes alteraciones en el sueño nocturno: tiempo total de sueño reducido, pobre eficiencia de sueño y múltiples despertares. La frecuencia de agitación se correlacionó positivamente con mayor compromiso cognitivo, síndrome de piernas inquietas probable, y un índice bajo de apneas. Un índice alto de apneas se correlaciona con más agitación diurna en estos pacientes y mayor compromiso cognitivo debido a la hipoxia (3).
Otro análisis de 157 adultos mayores con demencia mostró una reducción de las horas de sueño a 5 horas, eficiencia de sueño de 69% y despertares después del inicio del sueño a las 2 horas. Las personas con demencias de mayor severidad mostraban mayor latencia en dormirse. En cambio, adultos mayores sin compromiso cognitivo tienen un mayor tiempo total de sueño (> de 6 horas) y una eficiencia de sueño mayor de 80% (7).
Los trastornos del sueño en la EA son similares a los encontrados en los adultos mayores no dementes, pero revisten mayor severidad. El avance en la fase del sueño, facilita su fragmentación y la somnolencia diurna. Además, disminuye el ritmo circadiano normal y el umbral para despertar. A esto se agregan factores ambientales, psicológicos e iatrogénicos (ej. medicamentos) que contribuyen a deteriorar el sueño más allá de la degeneración neuronal que los gatilla (8, 9). Es importante recalcar estos factores contributorios, ya que, como se resume más abajo, éstos tienen tratamientos distintos a aquellos más o menos específicos para la enfermedad que causa los trastornos del sueño. Más aún, dado que la causa de éstas enfermedades es aún desconocida, el tratamiento de los factores contributorios es más efectivo que aquel para la enfermedad primaria u original.
2InsomnioEl insomnio es el trastorno de sueño más común en los adultos mayores por lo demás normales, y por lo tanto no se asocia siempre con trastornos cognitivos. Esto puede deberse, en parte, a la dificultad para hacer este diagnóstico en presencia de un deterioro cognitivo.
3Somnolencia diurna excesivaSe ha asociado en forma independiente al diagnóstico de demencia. No existe consenso en relación a si este fenómeno representa una alteración secundaria a la demencia o bien constituye un factor de riesgo para trastorno cognitivo en adultos mayores.
Algunos autores han planteado que una excesiva somnolencia durante el día constituye u marcador de enfermedad neurodegenerativa que se explicaría porque las células colinérgicas del tronco cumplen un importante rol en el sistema de vigilancia, y estas vías son susceptibles de alteración durante estadíos presintomáticos de la E A (8, 9). En nuestra opinión, esto bien pudiese ser un factor en otras demencias, como la EP y la DCL, que exhiben degeneración importante en el tronco encefálico - que incluye neuronas colinérgicas - pero no en la EA ya que ésta última carece de compromiso notable en el tronco.
4SAOS (Síndrome de apnea obstructiva del sueño)Su relación con deterioro cognitivo es bastante clara en adultos menores de 60 años, afectando la atención, memoria y funciones ejecutivas, que se asocian a disminución de la sustancia gris del hipocampo (4, 6, 12).
A pesar de afectar frecuentemente a la población de mayor edad, su efecto en las funciones cognitivas no ha sido demostrado fehacientemente, salvo en un estudio realizado en mujeres en que la presencia de SAOS aumentaba el riesgo de desarrollar deterioro cognitivo a los 5 años de realizado el diagnóstico (5).
En pacientes con EA, el uso de terapia por presión positiva continua en la vía aérea (CPAP en inglés por Continuous Positive Airway Pressure) para el tratamiento del SAOS, ha demostrado enlentecer o incluso mejorar el deterioro cognitivo (16). Además se ha reportado que sujetos que reciben un tratamiento oportuno y adecuado desarrollan un aumento en el volumen de la sustancia gris del hipocampo y los lóbulos frontales.
Es relevante señalar que el porcentaje del tiempo en apnea/hipopnea probablemente refleje de mejor manera las anormalidades en el intercambio gaseoso, y se sugiere como preferente en relación al índice de apneas/hipopneas utilizado habitualmente. Por último, es probable que la hipoxia intermitente que se produce en este cuadro, constituya un riesgo importante de estrés oxidativo y, por consiguiente, cause mayor daño neuronal.
5Síndrome de Piernas InquietasSe trata de un desorden neurológico en el cual se siente un apremio casi irresistible de mover las piernas en reposo, que ocurre principalmente de noche. Puede relacionarse con agitación nocturna en personas con deterioro cognitivo y es más prevalente en la población mayor (24% v/s 4-11%) (3).
Se ha asociado a depresión, déficit de fierro y a la presencia del alelo å4 de la apolipoproteína E (APOE), que es un propuesto factor de riesgo (si bien no una causa) para la EA.
6Sundowning (agitación vespertina-nocturna)Es la exacerbación nocturna de agitación, confusión y trastornos conductuales por disfunción del ciclo circadiano y disminución de la secreción de melatonina (6).
Medicamentos anticolinesterásicos como el donezepilo, usados para disminuir el deterioro cognitivo, pueden producir estimulación nocturna y trastorno de sueño (6).
La agitación vespertina y nocturna es frecuente en EA, y difícil de controlar con medicamentos antipsicóticos e hipnóticos que además pueden producir frecuentes efectos adversos. Los antipsicóticos atípicos como la olanzapina y la risperidona pueden producir somnolencia diurna, entre otros efectos adversos.
Este problema es una de las principales razones que derivan en la institucionalización de los pacientes con demencia (14).
7Síndromes ParkinsonianosLa presencia de elementos parkinsonianos en la EA leve puede ser un factor de riesgo independiente para la somnolencia diurna en estos pacientes. Los pacientes con EP tienen somnolencia diurna a pesar de un adecuado sueño nocturno, mientras que si estos pacientes con Parkinson presentan una demencia asociada, presentan mayor somnolencia diurna (17, 18).
Las hipocretinas 1 y 2 (orexinas A y B) son neuropétidos hipotalámicos, inicialmente estudiados como reguladores del apetito pero que tienen un importante rol en la estimulación de la vigilancia. Se han encontrado reducciones significativas de estos neuropéptidos en la DCL y en la E P, correlacionándose con el grado de hipersomnia y con la acumulación de α-sinucleína (17, 18).
TratamientoTratamiento FarmacológicoLos medicamentos hipnóticos y sedantes como las benzodiacepinas son muy utilizados en el tratamiento de trastornos del sueño, especialmente en el insomnio porque disminuyen la latencia y aumentan la cantidad total del sueño. Entre sus efectos adversos más comunes destacan la sedación, la somnolencia diurna, la confusión, la amnesia anterógrada y el insomnio de rebote. Además, en algunas personas presentan efectos paradojales, aumentando la agitación psicomotora observada frecuentemente en demencias (6, 15).
Los hipnóticos no benzodiazepínicos como el zolpidem, zopiclona y eszopiclona tienen un perfil más benigno, probablemente por su vida media más corta, pero no están exentos de presentar efectos adversos como los mencionados y no existen estudios en pacientes mayores con demencia (6).
Los antidepresivos se prescriben frecuentemente en casos de demencias, y algunos como la trazodona disminuyen la latencia de conciliación. Sin embargo sus efectos adversos pueden ser importantes, incluyendo somnolencia, la inestabilidad motora, y el aumento de peso/ síndrome metabólico.
La hormona pineal melatonina, tiene una importante función en el control del ciclo circadiano y efecto facilitador del sueño. Sin embargo los ensayos controlados y randomizados no reportan resultados significativos (23, 25). Recientemente se aprobó un agonista de la melatonina (ramelteon), que actúa en los receptores MT1 y MT2, disminuyendo la latencia y mejorando la eficiencia del sueño. Además, no presentaría efectos adversos en la esfera cognitiva ni efecto rebote o de privación, lo que lo hace especialmente atractivo para los adultos mayores con demencias (25).
Tratamiento no farmacológicoEn contraste con el tratamiento farmacológico, que utilizan la mayor parte de los médicos, se suele ignorar la existencia de tratamientos no farmacológicos. Estos son de menor costo y sufren de menos efectos adversos, por lo que es importante plantearlos en el manejo óptimo de nuestros pacientes y verificar su adhesión a ellos durante el seguimiento.
Terapia lumínicaLa luz juega un rol importante en las relaciones de la temperatura corporal central, melatonina y ciclo circadiano de actividad-reposo (26). La Asociación Americana de Medicina del Sueño ha publicado algunos parámetros prácticos para el uso de luz brillante como tratamiento de los trastornos del sueño y del ritmo circadiano (27). Sin embargo, no existe un estándar unánime acerca de cuándo debe exponerse a un determinado paciente a la luz, cuánto debe durar la exposición, qué longitudes de onda son efectivas y seguras, o qué dispositivo lumínico usar.
En la última década, ha aumentado el interés por el uso de la terapia con luz en el tratamiento de los trastornos del sueño en adultos mayores con demencia, ya sea en su uso aislado o asociado a otras terapias (29-36). Lyketsos y cols. (30) realizaron un estudio en residentes de un hogar, en el que observaron mejorías en el tiempo total de sueño nocturno después de 4 semanas de exposición matinal a la luz entregada usando una lámpara de luz de amplio espectro por 1 hora/dosis (dosis >2500 lux) (36). Algunos investigadores han estudiado si una luz fija de pared o en el techo que no restringa la movilidad del paciente pueda ser de utilidad. Así, usaron intervalos de 4 horas en la mañana o tarde comparados con otras sesiones de 11 horas y con luz estándar. La exposición a luz matinal o todo el día produjo mejoría significativa en el tiempo total de sueño (33-38).
Finalmente, se ha estudiado si el uso de terapia combinada de luz más fármacos puede tener un mejor efecto: Dowling y cols (36, 39) comunicaron un estudio en casas de reposo en que los residentes que recibieron más de 2500 lux de luz matinal (por lámpara) más 5mg de melatonina en la noche por 10 semanas tuvieron una mejoría significativa en la actividad diurna y mejoría en la razón de sueño día/noche comparados con los que sólo recibieron luz.
Riemersma van der Lek y cols (40) también encontraron que la combinación de melatonina (2.5mg) y luz (todo el día, montada en el techo) reducía la agitación de los enfermos y mejoraba los parámetros de sueño, incluyendo la latencia al dormir, tiempo total de sueño, y eficiencia de sueño. Aunque algunos efectos adversos fueron comunicados para la melatonina (ánimo disfórico) y para la luz (irritabilidad, mareos, cefalea), los efectos fueron relativamente modestos. Los autores sugieren que la terapia con luz todo el día es segura para su uso a largo plazo en estos pacientes.
Actividad físicaSabemos que el ejercicio regular no sólo crea masa muscular, mejora la fuerza, reduce caídas y mejora el ánimo en adultos mayores, sino que es también el único tratamiento tanto preventivo como paliativo contra el deterioro cognitivo cuya eficacia ha sido conformada (41, 42). El ejercicio se ha asociado a cambios en las fases del ritmo circadiano y la promoción de un sueño más reparador en adultos mayores (41). Aunque estos podrían ser los efectos en personas con demencia, no hay estudios controlados publicados que analicen los efectos aislados del ejercicio sobre el sueño en pacientes con demencia. Algunos estudios analizan más bien la “actividad social” y sus efectos sobre el sueño. Richards y cols, (43) presentó un estudio randomizado en el que observó que los residentes de un hogar que presentaban un sueño severamente alterado (porcentaje de sueño <50%), expuestos a 1 o 2 horas de actividades sociales en sesiones de 15-30 minutos durante 3 semanas, tuvieron una reducción significativa en el tiempo de sueño diurno, en la latencia del sueño, y en el número de despertares nocturnos comparados con controles.
Terapia conductual y multicomponente (mixta)Muchas terapias conductuales para el insomnio, incluyendo el control de estímulos, restringir el sueño, la relajación muscular, el biofeedback, la educación sobre la higiene del sueño, y la terapia multicomponente cognitivo-conductual, son conocidas como útiles en adultos mayores (6). Más aún si se consideran los efectos secundarios de los fármacos, estas terapias debieran ser consideradas como de primera línea para la alteración del sueño en pacientes con demencia. Las recomendaciones incluyen mantener un horario regular de acostarse y levantarse, limitar las siestas y restringir el tiempo en cama. Las recomendaciones en la dieta incluyen tener horarios claros de comidas, evitar el alcohol, la nicotina, la cafeína, y además vaciar adecuadamente la vejiga antes de dormir. El ambiente donde se duerme no debe ser ni muy frío ni caluroso, y se deben reducir la luz y el ruido excesivos (6).
La mayoría de los estudios aleatorizados que han incluido recomendaciones conductuales para mejorar el sueño en pacientes con demencia han sido hechos en casas de cuidado y han sido intervenciones con multicomponentes, enfocadas a reducir el tiempo diurno en cama, aumento de la actividad social y física, y cambiar el medio ambiente para hacerlo más facilitador del sueño nocturno (44).
Naylor y cols. (44) encontraron que una exposición corta de sólo dos semanas a una actividad social de grupo estructurada dos veces al día asociada a una actividad física de poca intensidad (90 minutos en total/día) mejoraba el sueño onda lenta en residentes adultos mayores. Alessi y cols. (45) y Martin y cols. (46) comunicaron que 5 días de exposición a una intervención de multicomponentes que incluía exposición a luz fuera de su hogar (30 min/día con luz >20.000), mantener a los residentes fuera de la cama en el día, participación diaria en un programa de actividad física de leve intensidad (10-15 minutos, 3 veces/día), establecer una rutina consistente de horas de sueño, y la reducción del ruido y de la luz durante la noche en las habitaciones de los residentes condujeron a una mejoría en las fases de actividad y reposo y del tiempo de vigilia nocturna. Sin embargo, otros estudios no han mostrado un beneficio similar (Ouslander et al. (47). Las dificultades para llevar a cabo la adecuada implementación de estas medidas, las comorbilidades de los pacientes, los diferentes tipos de demencia que presentan, podrían explicar los resultados poco consistentes hasta la fecha.
McCurry y cols. (48) comunicaron que pacientes sometidos a una intervención múltiple de ocho semanas que incluía educación de higiene de sueño, caminar diariamente por 30 minutos, y la exposición a la luz (una hora usando una lámpara) resultaron en una reducción en 32% del tiempo de despertares comparado con controles, y los efectos se mantenían tras un seguimiento de 6 meses. Sin embargo, la aplicación de estas intervenciones a cuidadores que están ya sobrecargados y muchas veces pueden parecer escépticos a que esta única terapia pueda ayudar, constituye un verdadero desafío (49). Un estudio a gran escala que se encuentra en marcha, financiado por el NIH de EE.UU., probablemente nos dará mayor claridad acerca de la aplicabilidad y reales beneficios de este tipo de alternativas de tratamiento (4).
ConclusionesLos trastornos del sueño son altamente prevalentes en las enfermedades neurodegenerativas, en las cuales interactúan las alteraciones propias de la enfermedad causante con factores psicológicos, del entorno del paciente e incluso iatrogénicos forman un complejo habitualmente poco analizado - y por lo tanto no mitigado en forma óptima - por el médico tratante. Por lo tanto, el manejo ideal de estas manifestaciones clínicas requiere no sólo la identificación del o los trastornos del sueño en forma aislada, sino que su manejo integrado en el contexto de las etiologías que intervienen en cada paciente individual, y utilizando tanto el armamentario farmacológico como el no farmacológico disponible en la actualidad.
El trastorno conductual del sueño REM se ha configurado como un marcador precoz de enfermedades como Parkinson Idiopático, atrofia multisistemas y Demencia por cuerpos de Lewy. Las investigaciones basadas en la neuroprotección idealmente deberán identificar este compromiso en pacientes para idealmente retrasar u ojalá evitar el desarrollo de la enfermedad neurodegenerativa que en la mayoría de portadores de esta parasomnia se desarrollará. En Demencias y Deterioro Cognitivo la detección de Apneas del sueño y su adecuado manejo, plantea un nuevo enfoque en las alternativas de manejo de estos defectos cognitivos tan prevalentes.
Los autores declaran no tener conflictos de interés, con relación a este artículo.