La Enfermedad Celiaca (EC) tiene una prevalencia cercana al 1% de la población general y se considera que hay un número importante de pacientes asintomáticos no diagnosticados. Su presentación clínica es variable comprendiendo el clásico síndrome de malabsorción, formas menores y la EC silente. El diagnóstico serológico tiene una elevada sensibilidad y especificidad y siempre debe confirmarse con biopsia. El diagnóstico en pacientes en dieta libre de gluten incluye test de tipificación de HLA y prueba de dieta con gluten con estudio serológico e histológico posterior. El pilar del tratamiento es la dieta libre de gluten, que debe ser supervisada por un nutriólogo con experiencia. La monitorización de la terapia debe realizarse con serología. La EC mal controlada puede determinar complicaciones como linfoma y adenocarcinoma de intestino delgado. En el futuro es probable que nuevas terapias farmacológicas sean de utilidad en el manejo de la EC.
Celiac disease has a prevalence near to 1% of general population and there is an important amount of asymptomatic people not yet diagnosed. Clinical presentation includes the classical malabsorption syndrome, minor and silent celiac disease. Serologic diagnosis has an elevated sensitivity and specificity, and must be confirmed by biopsy. Diagnosis in those on gluten free diet includes HLA type and gluten challenge with posterior serologic and histologic evaluation. The core of the treatment is the gluten free diet that must be supervised by an expert nutritionist. Monitoring is with serology. Poor disease control can determine complications such as lymphoma and small bowel adenocarcinoma. In the future, it is likely that new pharmacologic therapies will be available for the management of celiac disease.
La enfermedad celiaca (EC) es una enfermedad inflamatoria de origen autoinmune que afecta la mucosa del intestino delgado en pacientes genéticamente susceptibles y cuyo desencadenante es la ingesta de gluten. La EC se presenta con una gran heterogeneidad clínica en todos los grupos etarios. A continuación se presenta una revisión de los aspectos más relevantes de esta patología.
EPIDEMIOLOGÍALa EC tiene una prevalencia entre 0.75-1% de la población general diagnosticada por serología y/o biopsia 1,2. Se presenta tanto en niños como en adultos, en este último grupo la prevalencia del diagnóstico llega al 0.48% de la población general 3. Es 2 a 3 veces más común en mujeres que en hombres, relación que decrece luego de los 65 años 4. Su prevalencia tiende a ser mayor en países europeos y aumenta hasta 4.5% en población de alto riesgo como familiares de primer grado de pacientes con EC demostrada con biopsias 1. Los gemelos monocigotos y hermanos de pacientes con EC son lo que tienen el mayor riesgo 2. Un estudio realizado en Inglaterra encontró que la seroprevalencia de anticuerpos anti-endomisio en población general asintomática fue de 1.2% 5, demostrando que un grupo importante de pacientes con EC está subdiagnosticado.
El mejor diagnostico serológico de la enfermedad ha significado que su incidencia vaya en franco aumento. Entre los años 1950 y 2001 la prevalecía de EC se ha incrementado desde 0.9 a 9.1/100000 habitantes en Minessota, Estados Unidos 6; otro estudio más reciente realizado en Holanda mostró que la prevalencia casi se triplicó (desde 2.7 a 6.6/100000 habitantes) entre 1995 y 2010 7. En Chile, la Encuesta Nacional de Salud 2009-2010 describe una prevalencia de anticuerpos anti-transglutaminasa >20 UI/ml de 0.76%, siendo ésta mayor en mujeres (1.1% vs 0.4%) 8.
La mortalidad de la EC es dos veces mayor que en la población general. Las causas más frecuentes son las cardiovasculares (con un leve mayor riesgo que la población general) y las neoplasias malignas, principalmente linfoma no Hodgkin (11 veces más riesgo que la población general) 9,10.
PATOGÉNESISLa EC es el resultado de la interacción entre el gluten y factores inmunológicos, genéticos y ambientales. El gluten es un conjunto de proteínas que poseen algunos cereales como el trigo, la cebada y el centeno. En el trigo, el gluten contiene dos tipos de proteínas que son la gliadina y la glutenina, en la cebada las proteínas que causan la enfermedad se denominan hordeínas, y en el centeno, secalinas. Todas estas son proteínas que están relacionadas pues el trigo, la cebada y el centeno tienen un origen evolutivo común. La avena, menos relacionada a estos cereales, raramente desencadena la EC 11.
La gliadina es pobremente digerida en el tracto gastrointestinal humano resistiendo la acidez gástrica, las enzimas pancreáticas y las proteasas del ribete en cepillo intestinal 12. De esta degradación resultan péptidos de los que se han identificado muchos epítopes inmunogénicos, de ellos el más importante es un monómero de 33 aminoácidos. En algunas situaciones patológicas como cuando hay alteraciones de la permeabilidad intestinal, estos péptidos derivados de gliadina pueden atravesar el epitelio, donde son deaminados por la transglutaminasa tisular-2, interactuando así con las células presentadoras de antígeno de la lámina propria.
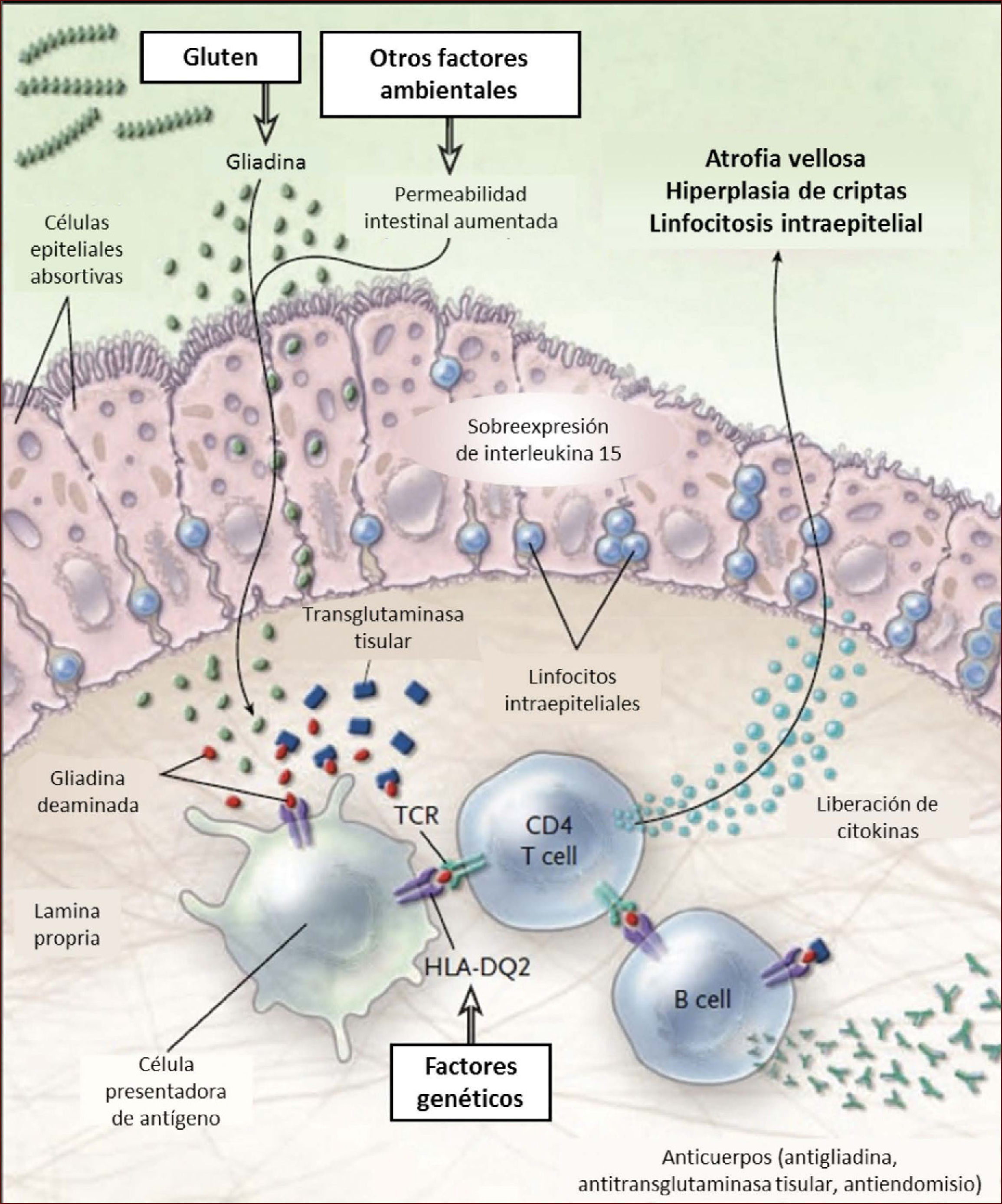
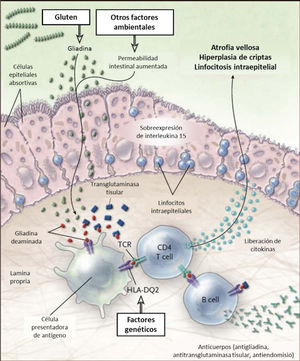
En la EC existen alteraciones de las respuestas inmunes innata y adaptativa. La respuesta innata en la EC se caracteriza por una sobre-expresión de interleukina 15 por los enterocitos que determina la activación de linfocitos intra-epiteliales del tipo natural killer. Estos linfocitos ejercen su acción citotóxica sobre los enterocitos que expresan complejo mayor de histocompatibilidad (MHC) tipo I en situaciones de inflamación. La respuesta adaptativa es liderada por linfocitos T CD4+ anti-gliadina que se activan al interactuar con el péptido en el contexto de las células presentadoras de antígenos con complejo mayor de histocompatibilidad HLA-DQ2 o HLA-DQ8, expresando citoquinas pro-inflamatorias, especialmente interferón-γ. Lo anterior genera una cascada inflamatoria con liberación de metaloproteinasas y otros mediadores que inducen hiperplasia de criptas y daño de las vellosidades. Ambos tipos de respuesta inmune determinan el daño de intestino delgado caracterizado por infiltración de células inflamatorias crónicas en lámina propria y epitelio y atrofia vellositaria 13. Ver Figura 1.
Esquema fisiopatología en la enfermedad celíaca
El gluten es digerido en el lumen y ribete en cepillo intestinal a péptidos, principalmente gliadina. La gliadina induce cambios a través de la inmunidad innata en el epitelio y de la inmunidad adaptativa en la lámina propria. En el epitelio el daño provoca sobreexpresión de interleukina 15, que a la vez activa los linfocitos intraepiteliales. Estos linfocitos se tornan citotóxicos y dañan los enterocitos que expresan proteínas de stress en su superficie. En situaciones de aumento de la permeabilidad intestinal, como en las infecciones, la gliadina entra a al lamina propria donde es deaminada por la enzima transglutaminasa tisular, permitiendo la interacción con el HLA-DQ2 o HLA-DQ8 de la superficie de las células presentadoras de antígenos. La gliadina es presentada entonces a los linfocitos T CD4+ resultando en mayor producción de citokinas que causan daño. Todo esto lleva a la atrofia vellositaria e hiperplasia de criptas, y a la expansión de linfocitos B con la consecuente producción de anticuerpos. Adaptado de 13.
La enfermedad celiaca casi solo se manifiesta en aquellos individuos que expresan HLA-DQ2 o HLA-DQ8, lo que en parte explica la agregación familiar de la enfermedad 14. Sin embargo para el desarrollo de la enfermedad deben involucrarse otros factores puesto que el 30% de la población general expresa HLA tipo DQ2 y evidentemente solo una minoría de estos es susceptible de desarrollar EC. Algunos de estos genes no HLA son COELIAC2 que contiene clusters de genes de citoquinas, COELIAC3 que codifica la molécula CTLA4 (cytotoxic T-lymphocyte antigen 4), COELIAC4 que codifica una variante del gen de la miosina y otras variantes en regiones que albergan los genes para las interleukinas 2 y 21, y otros genes relacionados a la respuesta inmune 15.
Existen factores ambientales en la infancia que pudiesen tener un rol en el desarrollo de EC. Se ha descrito una ventana entre los 4 y 6 meses de edad en la cual la introducción de gluten disminuiría el riesgo de desarrollar EC posteriormente; sin embargo, recientemente se publicó un estudio randomizado que no mostró diferencias en el desarrollo de EC en infantes de alto riesgo expuestos en esta ventana etaria al compararlos con placebo 16. Además, se considera que la lactancia materna protege del desarrollo de EC y que la sobreposición de la lactancia materna con el consumo de gluten es lo que realmente disminuye el riesgo de desarrollar la enfermedad 17. Se ha descrito también en estudios epidemiológicos una relación inversa entre infección por Helicobacter pylori y EC, encontrándose que la frecuencia de infección en celiacos es la mitad que en aquellos no celiacos, postulándose un rol inmunomodulador de la bacteria en la ingesta de gluten 18.
PRESENTACIÓN CLÍNICALas manifestaciones clínicas de la EC tienen un espectro bastante amplio, que va desde el síndrome de malabsorción con esteatorrea, desnutrición calórico-proteica, edema y letargia en los casos más extremos hasta la enfermedad asintomática 15. Sus manifestaciones gastrointestinales pueden ser bastante inespecíficas y se describe que el 20-50% de los pacientes con EC cumple con los criterios de Roma para Síndrome de Intestino Irritable 19, de hecho se recomienda descartar EC en aquellos pacientes en los que se sospecha este diagnóstico 20.
Varios conceptos en relación a las formas de manifestación de la EC han sido descritos en la literatura (EC típica, atípica, potencial, silente y latente, entre otros) 21. Dada la heterogeneidad de estos términos, el 2013 se publicaron los resultados del consenso de expertos de Oslo que homogeneizó las definiciones relacionada a la EC 22.
El consenso acepta los términos de:
EC asintomática (diagnosticada con serología y biopsia en pacientes sin síntomas; equivalente al concepto de EC silente).
EC clásica (con síntomas de malabsorción -diarrea, esteatorrea, descenso ponderal, hipoalbuminemia-).
EC no clásica (sintomáticos, pero sin síntomas de malabsorción).
EC subclínica (con manifestaciones bajo el umbral de detección por síntomas o signos clínicos, que pueden corresponder por ejemplo a alteraciones de laboratorio).
EC sintomática (con síntomas clínicamente evidentes gastrointestinales o extra-intestinales).
EC potencial (pacientes con serología positiva pero con biopsia de intestino delgado normal). El consenso sugiere eliminar el uso de los términos EC típica, EC atípica, EC manifiesta, EC latente y EC silente.
Las manifestaciones clínicas de la EC pueden agruparse en menores o mayores (Tabla 1). El clásico síndrome de malabsorción es cada vez menos frecuente dando paso a las manifestaciones abdominales sin diarrea, extraintestinales y la EC asintomática 23.
Manifestaciones clínicas en enfermedad celíaca
| Síntomas menores |
| Pacientes con molestias transitorias, inespecíficas o aparentemente no relacionadas, como:• Dispepsia• Distensión abdominal• Alteraciones leves del tránsito intestinal similares a las de SII• Anemia de causa no precisada• Fatiga aislada• Hipertransaminasemia de causa no precisada• Infertilidad• Alteraciones neurológicas centrales y periféricas• Osteoporosis• Talla baja• Defectos del esmalte dental• Dermatitis herpetiforme |
| Síntomas mayores |
| Pacientes con evidentes síntomas de malabsorción:• Diarrea• Esteatorrea• Baja de pesoY otras características de malnutrición como:• Calambres• Tetania• Edema periférico debido a alteraciones electrolítica• Hipoalbuminemia). |
Adaptado de referencia 15.
Se ha comparado la presentación clínica de la EC con los hallazgos histológicos, reportándose en un estudio con 499 pacientes adultos que no existe una relación entre el cuadro clínico (clásico, predominio de diarrea o silente) y el grado de atrofia vellositaria, destacando que la mayoría de los pacientes con cuadro clínico silente presentaban atrofia vellositaria total 24. La extensión del compromiso de intestino delgado tampoco se relaciona con la severidad de la presentación clínica según lo demostró un estudio en 38 pacientes con EC confirmada con biopsia no tratados que fueron evaluados por cápsula endoscópica, en quienes el 59% presentaba compromiso extenso (duodenal y yeyunal) y 32% compromiso limitado al duodeno 25.
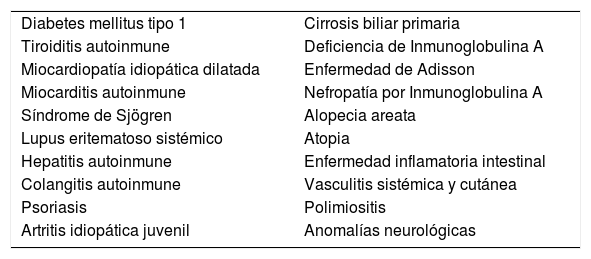
Se han reportado una diversa gama de patologías autoinmunes asociadas a EC (Tabla 2). Especial atención merecen los pacientes con diabetes mellitus tipo 1 pues tienen una mayor prevalencia de EC describiéndose en 3-10% en niños y 2-5% en adultos.
Patologías autoinmunes asociadas a enfermedad celíaca
| Diabetes mellitus tipo 1 | Cirrosis biliar primaria |
| Tiroiditis autoinmune | Deficiencia de Inmunoglobulina A |
| Miocardiopatía idiopática dilatada | Enfermedad de Adisson |
| Miocarditis autoinmune | Nefropatía por Inmunoglobulina A |
| Síndrome de Sjögren | Alopecia areata |
| Lupus eritematoso sistémico | Atopia |
| Hepatitis autoinmune | Enfermedad inflamatoria intestinal |
| Colangitis autoinmune | Vasculitis sistémica y cutánea |
| Psoriasis | Polimiositis |
| Artritis idiopática juvenil | Anomalías neurológicas |
Hay escasa comprensión de la evolución natural de la enfermedad. Un estudio retrospectivo mostró que cerca del 50% de los pacientes con EC se consideran asintomáticos al reiniciar una dieta normal luego de al menos dos años de dieta libre de gluten. Seguidos a largo plazo (2-44 años), el 47% presentó síntomas leves y un 21% se mantuvo con biopsia duodenal normal luego de este período 26.
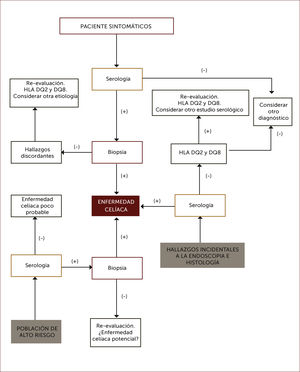
DIAGNÓSTICOEl diagnóstico de EC se basa en la historia clínica, serología y endoscopía con biopsia de duodeno, esta última con un rol confirmatorio de la enfermedad. El estudio de HLA se considera solo para situaciones de dificultad diagnóstica 27–29.
Existen otras entidades que deben diferenciarse de la EC como la sensibilidad al gluten no celiaca y la alergia al trigo. En éstas hay síntomas digestivos y extraintestinales similares a los de la EC pero sin los marcadores serológicos, la biopsia ni la base genética que la caracterizan. La sensibilidad al gluten de origen no celíaco se refiere a aquellos pacientes que desarrollan síntomas en relación a la ingesta de cereales que contiene gluten y que luego mejoran a suspender el gluten de la dieta, sin cumplir criterios de EC. La alergia al trigo es una hipersensibilidad tipo I mediada por Inmunoglobulina E, que se puede medir en sangre 30.
Test serológicos. Los anticuerpos anti-endomisio (EMA) y anti-transglutaminasa tisular (tTGA) son las dos pruebas que se usan actualmente para el diagnóstico de EC, y han reemplazado los antes usados anticuerpos anti-gliadina, de peor rendimiento. El EMA tiene una especificidad de 99%, con una sensibilidad variable 31.
El tTGA basado en IgA (tTGA-IgA) es el test de primera elección para el diagnóstico de EC según las guías actuales del American College of Gastroenterology, con una sensibilidad y especificidad cercanas al 98% 27. Sin embargo, por el déficit de inmunoglobulina A que se describe en el 2-3% de los pacientes con EC 32 se recomienda testear con tTGA-IgG y/o IgG anti-péptido gliadina deaminado (DGP) en los pacientes deficitarios de esta inmunoglobulina. El tTGA-IgG tiene un bajo rendimiento en pacientes con niveles normales de IgA pero una especificidad y sensibilidad de 95% en pacientes con deficiencia de ésta, de manera que su uso se justifica solo en presencia de esta condición 27. Los anticuerpos anti-DGP -que es el marcador serológico más nuevo- no han demostrado tener un rendimiento mayor que el tTGA-IgA, y su uso está justificado en pacientes pediátricos menores de dos años (en combinación con tTGA-IgA) y en pacientes con déficit de IgA 31,33.
Por la agregación familiar descrita se sugiere que los familiares de pacientes con EC sean estudiados dirigidamente con serología, ya sea que presenten o no síntomas compatibles con la enfermedad. Se ha visto que aquellos familiares que se consideraban asintomáticos mejoran algunas molestias para las cuales no tenían explicación luego de instaurar una dieta libre de gluten 27. Los familiares sintomáticos con serología negativa deberían estudiarse con biopsia duodenal 33.
En otro grupo de riesgo como los pacientes diabéticos tipo 1 se recomienda la búsqueda de EC con serología cada uno o dos años en niños y la toma de biopsias de duodeno en adultos que se sometan a endoscopia digestiva alta por cualquier causa. Aun así, el screening en pacientes diabéticos tipo 1 asintomáticos es controversial. No se recomienda el screening de EC en las otras patologías autoinmune asociadas a menos que presenten síntomas que sugieran la enfermedad 27,33.
Existe una tendencia en algunas personas a seguir una dieta libre de gluten sin tener el diagnóstico de EC. Este grupo de pacientes puede presentar serología negativa de manera que en caso de sospecha de EC debe recurrirse a estudio de HLA -que prácticamente descarta la enfermedad en caso de no ser DQ2 o DQ8- y eventualmente biopsia duodenal luego de una prueba de dieta con gluten 27.
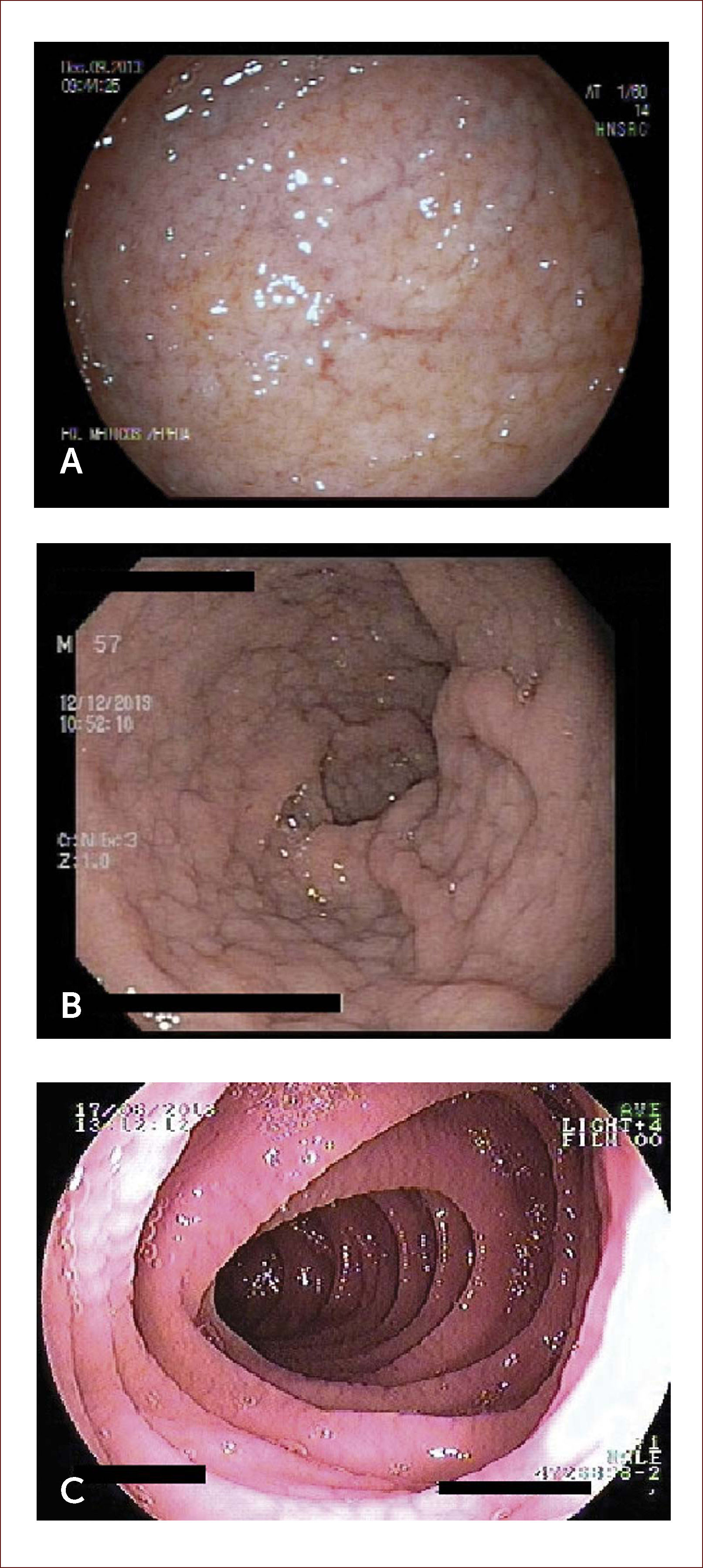
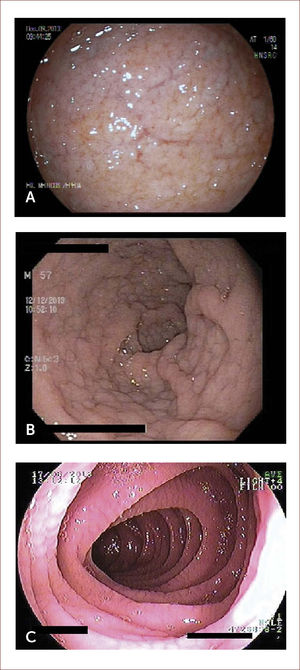
Evaluación endoscópica. Se describen varias característica endoscópicas en EC tales como la pérdida de pliegues mucosos, patrón en mosaico, pliegues festoneados, nodularidad, fisuras y prominencia de la vasculatura submucosa (Figura 2). Su sensibilidad por endoscopía digestiva alta es cercana al 60% y su especificidad 95-100% 34. Algunas técnicas como la visión bajo inmersión en agua, magnificación y cromoendoscopía pueden ayudar a identificar mejor las zonas de atrofia para dirigir las biopsias 35,36. Debido a la naturaleza en parche de las lesiones, se recomienda la toma de múltiples biopsias endoscópicas de duodeno: 1 o 2 en bulbo (posición horaria 9 y/o 12 horas, que es donde se ha demostrado mejor rendimiento diagnóstico) y al menos 4 de duodeno post-bulbar 27,37. Es relevante la toma de biopsias de bulbo pues aumenta en 18% el rendimiento diagnóstico comparado a la toma de biopsias limitadas a la segunda porción duodenal 37.
IMÁGENES ENDOscópicas de duodeno
Imágenes endoscópicas de duodeno donde se aprecian nodularidad, adelgazamiento y visualización de vasculatura submucosa (A), marcada nodularidad con patrón empedrado (B), y aspecto festoneado de la mucosa (C). Las imágenes corresponden a pacientes tratados por los autores.
Debido a la baja sensibilidad de los hallazgos descritos, ante la sospecha clínica de EC con duodeno de aspecto normal a la endoscopía se recomienda de igual manera la toma de biopsias 33.
La cápsula endoscópica es un método de uso reciente y útil para evaluar la mucosa del intestino delgado. Se describen sensibilidades sobre 70% para detectar atrofia en EC. Se ha comparado la sensibilidad diagnóstica para EC de la endoscopía digestiva alta versus la cápsula endoscópica, siendo claramente superior la última (55% vs 92%), con 100% de especificidad de los hallazgos en ambos métodos 25. La cápsula endoscópica es de utilidad también en la EC que no responde a tratamiento, logrando describir estenosis, erosiones, ulceras y lesiones neoplásicas, aparte de los hallazgos propios de la atrofia. Se debe considerar la posibilidad de retención de la cápsula en pacientes con estenosis 38.
La enteroscopia también se ha descrito como un método suplementario en la evaluación de la EC particularmente cuando la sospecha por clínica y serología es elevada pero la biopsia duodenal es negativa -situación que es poco frecuente pero existe-, y también en EC refractaria cuando se sospecha alguna complicación como neoplasias de intestino delgado. Este método permite la toma de biopsias de la tercera y cuarta porción duodenal y de yeyuno para confirmar el diagnóstico 39.
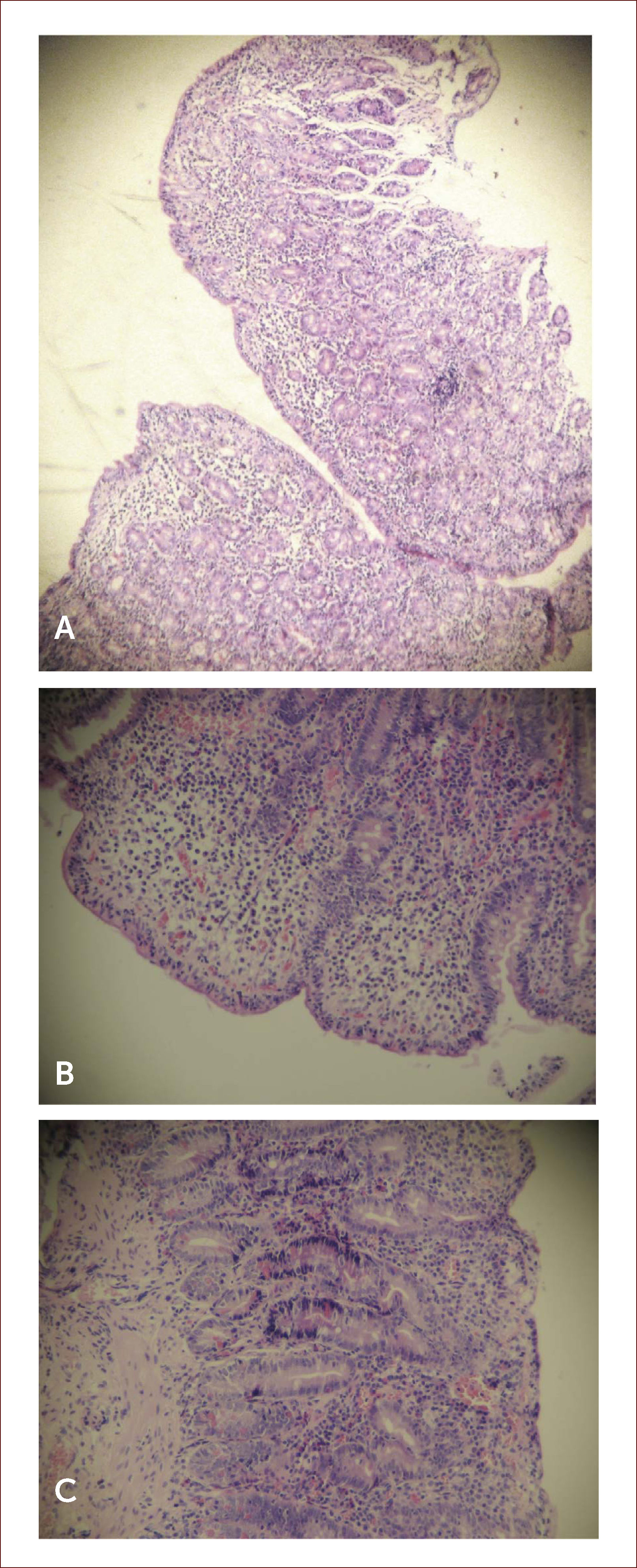
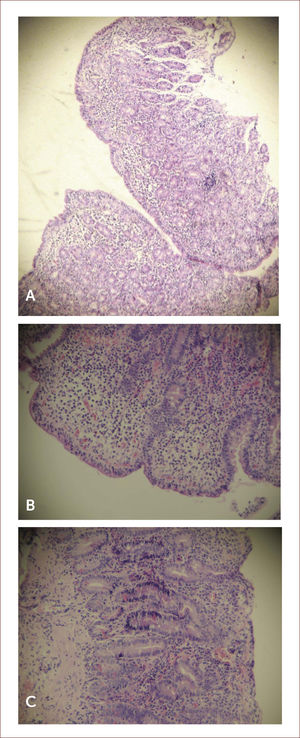
Histología. El diagnóstico de EC siempre debe ser confirmado por biopsia, independiente del estado serológico. Las características histológicas típicas son el incremento de linfocitos intraepiteliales (LIE) (>25 o 40 por cada 100 células epiteliales, dependiendo de la clasificación), la hiperplasia de criptas y los distintos grados de atrofia vellositaria (Figura 3). Las características recién descritas son típicas, pero no específicas de EC; en la tabla 3 se muestra el diagnóstico diferencial de atrofia vellositaria de duodeno.
imágenes histológicas de biopsias duodenales
Imágenes histológicas de biopsias duodenales de pacientes con enfermedad celíaca (tinción con hematoxilina-eosina).
A. Atrofia total de las vellosidades.
B. Linfocitos intraepiteliales >40 por cada 100 enterocitos.
C. Notoria hiperplasia de las criptas.
Otras causas de atrofia vellositaria de duodeno
| Giardiasis |
| Sprue colágeno |
| Inmunodeficiencia común variable |
| Enteropatía autoinmune |
| Enteritis por radiación |
| Enfermedad de Whipple |
| Tuberculosis intestinal |
| Sprue tropical |
| Gastroenteritis eosinofílica |
| Enteropatía por VIH |
| Linfoma intestinal |
| Síndrome de Zollinger-Ellison |
| Enfermedad de Crohn |
| Intolerancia a alimentos aparte del gluten |
| Sobrecrecimiento bacteriano intestinal |
| Enteropatía asociada a drogas: quimioterápicos, anti-inflamatorios no esteroidales, olmesartan, micofenolato mofetil. |
| Enfermedad injerto versus huésped |
| Desnutrición |
Adaptado de referencias 13,27,28.
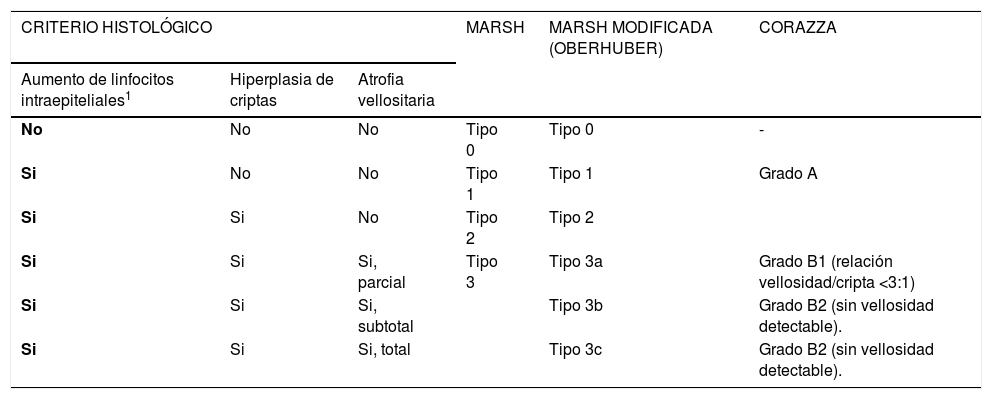
La clásica clasificación de Marsh fue reemplazada el año 1999 por Oberhuber proponiendo una mejor estandarización con 6 tipos 40. El 2007 se publicó una nueva clasificación por Corazza, más simple, con solo tres categorías y con una reproducibilidad inter-observador significativamente superior a la de la clasificación modificada de Marsh 41. En la Tabla 4 se muestran las clasificaciones de Marsh, Marsh modificada (Oberhuber) y de Corazza. Si bien, no existen sugerencias formales sobre cuál de las clasificaciones usar, la de Corazza parece ser más recomendable dada su simpleza y mejor reproducibilidad.
Clasificaciones histopatológicas de Marsh, Marsh modificada (Oberhuber) y Corazza
| CRITERIO HISTOLÓGICO | MARSH | MARSH MODIFICADA (OBERHUBER) | CORAZZA | ||
|---|---|---|---|---|---|
| Aumento de linfocitos intraepiteliales1 | Hiperplasia de criptas | Atrofia vellositaria | |||
| No | No | No | Tipo 0 | Tipo 0 | - |
| Si | No | No | Tipo 1 | Tipo 1 | Grado A |
| Si | Si | No | Tipo 2 | Tipo 2 | |
| Si | Si | Si, parcial | Tipo 3 | Tipo 3a | Grado B1 (relación vellosidad/cripta <3:1) |
| Si | Si | Si, subtotal | Tipo 3b | Grado B2 (sin vellosidad detectable). | |
| Si | Si | Si, total | Tipo 3c | Grado B2 (sin vellosidad detectable). | |
1 > 40 linfocitos intraepiteliales por cada 100 células epiteliales para clasificación de Marsh modificada y >25 linfocitos intraepiteliales por cada 100 células epiteliales para la clasificación de Corazza.
Adaptado de referencia 27.
Repetir las biopsias de duodeno luego de terapia libre de gluten puede ser útil para dar mayor fundamento al diagnóstico y chequear la adherencia a la terapia, pero no es necesario para el diagnóstico siempre y cuando las características de la biopsia inicial sean típicas y el paciente haya presentado una respuesta clínica adecuada a la dieta libre de gluten. También puede ser de utilidad un nuevo set de biopsias post- tratamiento en los casos en que se ha sospechado EC con serología negativa 15,27. En niños está bien estudiado que la repetición de la biopsia post-tratamiento no mejora el rendimiento diagnostico 42 e incluso se ha propuesto recientemente un método de diagnóstico de tres criterios (síntomas, serología y tipificación HLA) sin necesidad de biopsia 43.
El incremento de LIE (>25 LIE por cada 100 enterocitos), conocido como duodenosis linfocítica, puede encontrarse en el 5.4% de la población 44. La mayoría de estos casos no corresponde a EC (16%) y puede obedecer a otras causas como infección por Helicobacter pylori, fármacos (anti-inflamatorios no esteroidales, aspirina), sobrecrecimiento bacteriano intestinal, enfermedades autoinmunes, enfermedad inflamatoria intestinal, colitis microscópica, entre otras; además en un tercio de los pacientes no se identifica la causa 45. Por lo tanto, pacientes que solo presentan incremento de LIE en la biopsia (correspondiente a Marsh 1) no deben considerarse como celíacos hasta estudiar la causa, evitando así el sobrediagnóstico de EC.
Los niveles de anticuerpos son capaces de predecir la presencia de atrofia vellositaria y se ha demostrado que niveles de tTGA-IgA sobre 100 U/ml o sobre 10 veces el límite superior del rango normal tienen una especificidad de 100% en niños y adultos para histología Marsh 2 o 3 46,47. De todas maneras, no hay existe consenso sobre un valor de corte que permita obviar la biopsia de intestino delgado para confirmar el diagnóstico de EC.
Rol de la tipificación de HLA. En población caucásica prácticamente la totalidad de los pacientes con EC poseen los heterodímeros HLA-DQ2 (95%) o HLA-DQ8 (5%), sin embargo cerca del 30% de la población general de raza blanca es portadora de HLA-DQ2 15. Por lo tanto, ser portador de otro heterodímero distinto a los anteriores descarta al enfermedad en un >99% 27. Sin embargo, datos recientes en población chilena reportan frecuencias distintas a las descritas, con portación de al menos un alelo HLA-DQ2 en 82%, HLA-DQ7 en 43% y HLA-DQ8 en 31% de los 51 casos analizados 48. Su uso no tiene utilidad en el diagnóstico habitual de la EC y se reserva para descartar la enfermedad en casos con biopsia intestinal no concluyente o en aquellos que ya están en dieta libre de gluten y por tanto la serología puede ser negativa. También puede ser de utilidad para descartar la enfermedad en los pacientes con síndrome de Down que tienen una prevalencia de EC muy elevada de 10% 49.
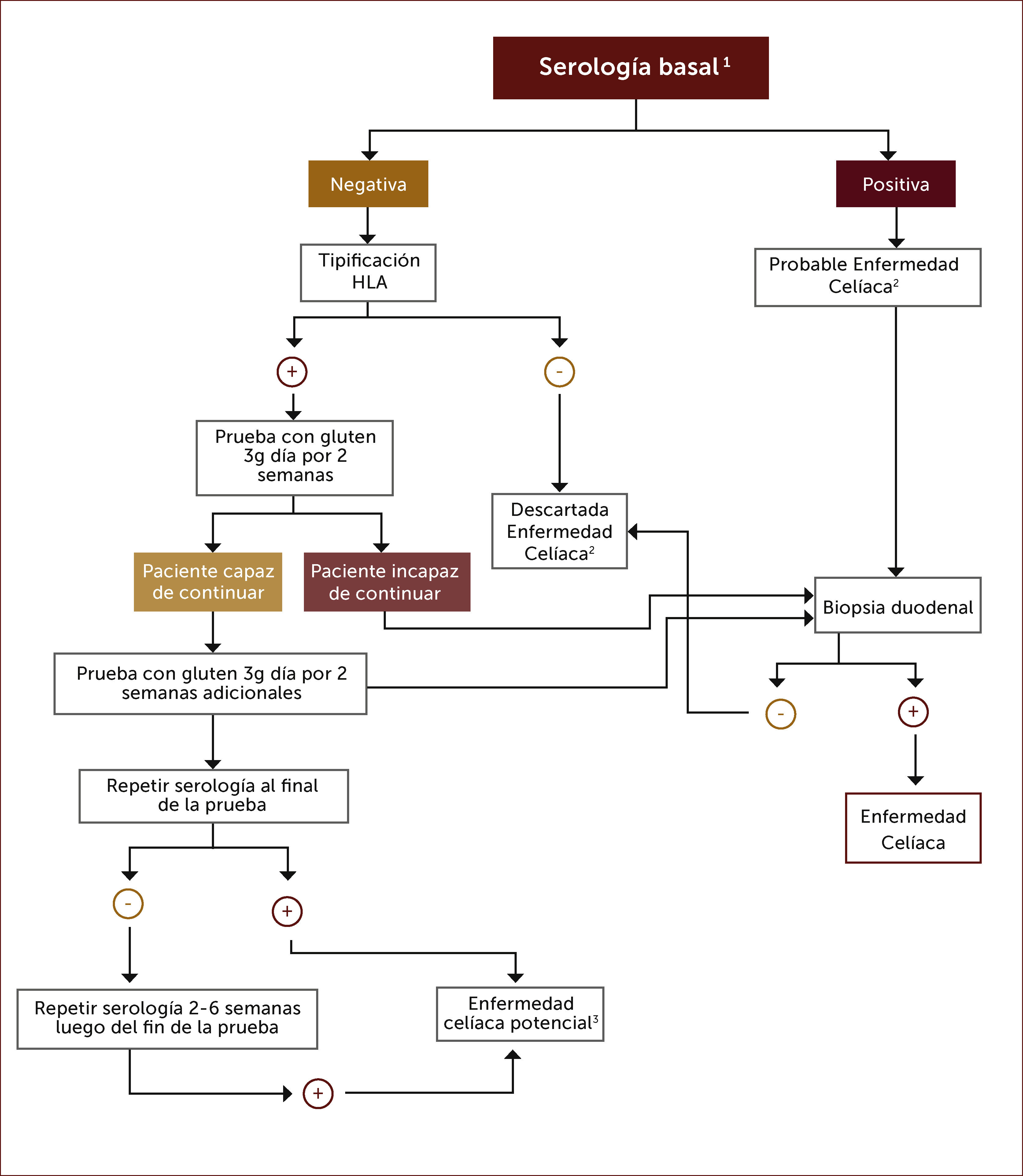
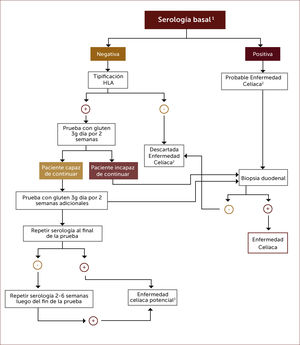
Diagnóstico en pacientes en dieta libre de gluten. Existe una tendencia en algunas personas a iniciar una dieta libre de gluten buscando algún tipo de beneficio para su salud, sin tener el diagnóstico de EC. Como la serología se hace negativa con esta dieta solo es útil solicitarla si la dieta lleva menos de un mes de inicio. Si resultase negativa puede descartarse la enfermedad con estudio de HLA si fuese negativo para los heterodímeros DQ2 o DQ8. En caso de estudio HLA positivo debe ofrecerse una prueba de dieta con gluten de 3g al día por 2-8 semanas para luego re- estudiar con serología y eventualmente biopsias 33. Luego de dos semanas de dieta con gluten el 75% de los potenciales celiacos tiene serología positiva y el 68% presenta histología Marsh III, lo que podría aumentar si se prolonga la dieta a 8 semanas. Incluso, la serología puede recién hacerse positiva luego de algunas semanas de haber finalizado la prueba de dieta con gluten, de manera que si la serología persiste negativa al finalizar la prueba se recomienda repetirla 2-6 semanas después 27.
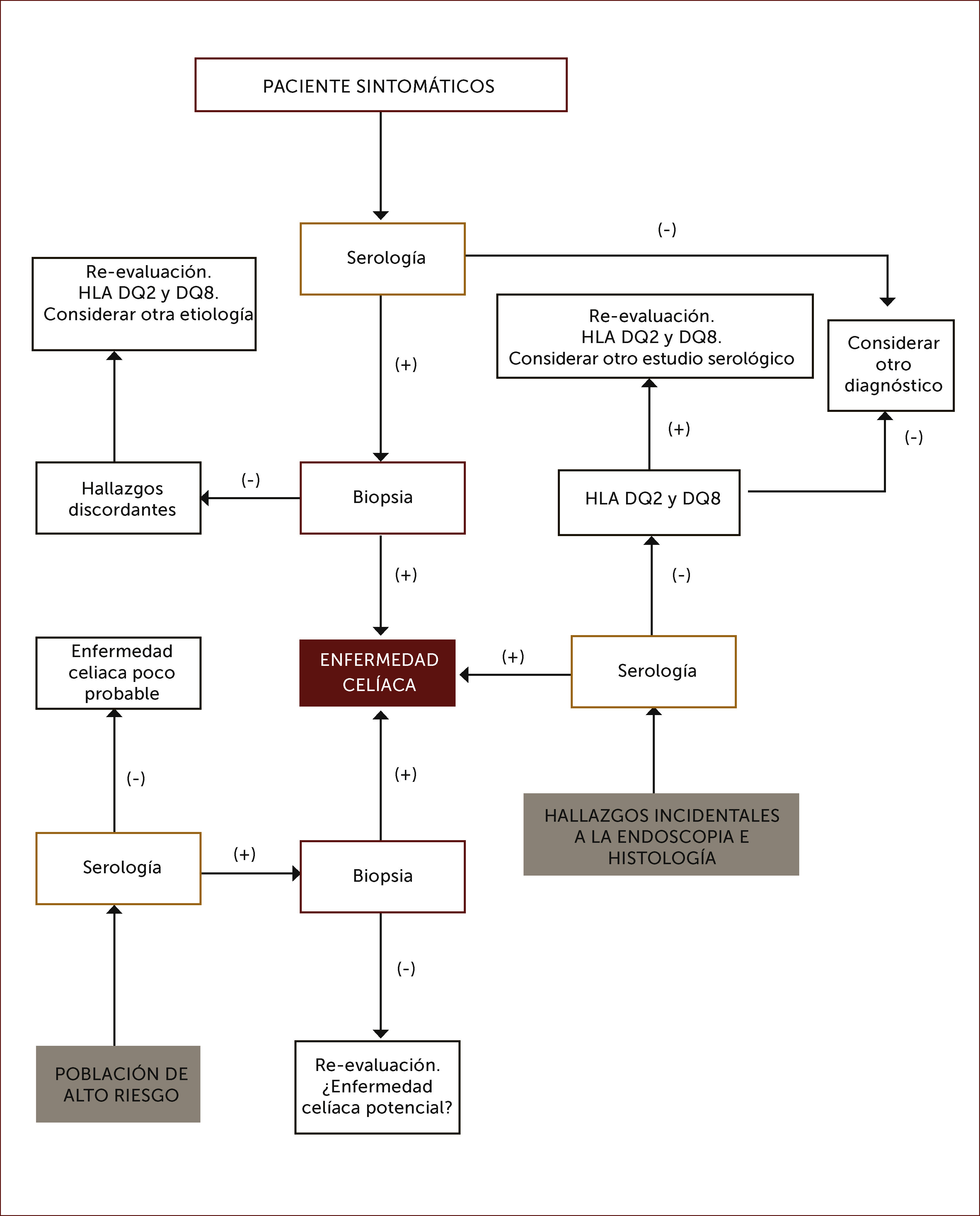
En las Figuras 4 y 5 se muestra un esquema de flujo diagnóstico para EC y otro de diagnóstico en pacientes que están en dieta libre de gluten por otro motivo, respectivamente.
Algoritmo diagnóstico de enfermedad celiaca
Por serología se entiende IgA anti transglutainasa tisular, anti endomisio o anti péptido gliadina deaminado en casos con niveles de IgA sérica normales, o IgG anti transglutaminasa tisular o anti péptido gliadina deaminado en casos con déficit de IgA.
Adaptado de referencia 62.
Algoritmo diagnóstico en pacientes que están en dieta libre de gluten sin tener el diagnÓstico formal de enfermedad celíaca
1 Anticuerpos anti-transglutaminasa tisular, anti-endomisio o anti-péptido gliadina deaminado.
2 Una biopsia duodenal normal o no diagnóstica de EC en un paciente con serología positiva requiere una prueba de dieta con gluten y nuevas biopsias para el diagnóstico o descarte definitivo.
3 Aquellos pacientes con serología positiva pero con biopsia normal tienen enfermedad celiaca potencial.
4 Una prueba de dieta con gluten de dos semanas puede arrojar falso negativo en un 10% de los casos, por lo que parece razonable extender la prueba por más tiempo.
Adaptado de referencia 27.
Se describe que los pacientes con EC no tratada presentan frecuentemente déficit de micronutrientes, entre ellos, fierro (32%), ácido fólico (35-49%), vitamina B12 (10.5%), vitamina B6, vitamina D, cobre (6-33%), zinc (20-31%) y carnitina. La prevalencia de osteoporosis en pacientes con EC puede ser hasta 28% en la columna y 15% en la cadera 33.
Se recomienda chequear al momento del diagnóstico al menos con hemograma, ferritina, ácido fólico, vitamina B12, vitamina D y calcio, además de la evaluación por nutricionista para detectar potenciales deficiencias nutricionales. También se recomienda realizar una densitometría ósea en adultos al momento del diagnóstico o luego de un año de terapia para permitir la estabilización 27,33, especialmente si tienen algún otro factor de riesgo para osteoporosis o en mayores de 55 años 28.
TRATAMIENTOEl pilar del manejo de la EC es la dieta libre de gluten, por lo que deben evitarse el trigo, cebada y centeno para toda la vida. Aunque la avena no está relacionada con los otros cereales mencionados, se han descrito casos de sensibilidad cruzada en pacientes altamente sensibles. En las cadenas de producción puede existir contacto cruzado de la avena con cereales ricos en gluten, de manera que se aconseja la dieta libre de avena inicialmente por el primer año para luego re-introducirla en cantidades moderadas si han desaparecido los síntomas y si se certifica que la avena es pura y no contaminada con cereales que contengan gluten. Uno de los problemas de eliminar la avena es la limitación que provoca en las opciones de alimentación. Los fármacos también pueden contener trazas de gluten de manera que los pacientes deben cerciorarse de que sean libres de éste 33. En el sitio web de la fundación de intolerancia al gluten Convivir se puede encontrar una lista actualizada de medicamentos certificados libres de gluten (www.fundacionconvivir.cl).
Una dieta 100% libre de gluten es impracticable por la contaminación de muchos alimentos con pequeñas cantidades de éste. Sin embargo, una revisión sistemática sugiere que un consumo menor a 10 miligramos de gluten al día es seguro y es poco probable que cause alteraciones histológicas significativas 50. Se define a un alimento como libre de gluten cuando posee menos de 20 partículas por millón.
La dieta libre de gluten resuelve los síntomas y mejora el daño histológico en la mayoría de los casos. Un estudio con cápsula endoscópica demostró que una dieta libre de gluten de al menos seis meses mejoró el patrón endoscópico en 79%, se normalizó en 31% y se mantuvo sin cambios en el 21% de los casos. Lo anterior ocurrió independientemente de la extensión del compromiso intestinal y de la duración de la dieta. Además se observó que el patrón endoscópico de recuperación progresa de distal hacia proximal 25. La recuperación histológica de la mucosa en pacientes adultos es lenta, reportándose en 34% a los dos años, 66% a los 5 años y 90% a los 9 años luego de iniciada la dieta libre de gluten 25
La dieta libre de gluten, además, incrementa el peso corporal, mejora la densidad mineral ósea y reduce los riesgos de infertilidad, abortos espontáneos, parto prematuro, de recién nacidos de bajo peso, neoplasias y mortalidad 27.
Se recomienda que un nutricionista evalúe los casos nuevos de EC para educar y guiar la dieta de estos pacientes y así evitar consumo de alimentos contaminados, la contaminación cruzada en el domicilio y otros problemas asociados a la terapia como el incremento excesivo de peso corporal 27.
La dieta libre de gluten no es fácil de llevar a cabo y se ha publicado que 42-91% de los pacientes con EC no siguen estrictamente la dieta 51, entre otras cosas, por tener que evitar alimentos con trazas de gluten, por el mayor costo y por ser poco apetecibles 52.
Debido a lo anterior se han investigado terapias farmacológicas fundamentadas en la degradación intraluminal del gluten de manera de evitar la formación de péptidos inmunogénicos, disminución de la permeabilidad epitelial al gluten, uso de agentes quelantes de gluten, desensibilización al gluten, inhibición de la transglutaminasa tisular e inhibición de la función presentadora de antígeno de HLA DQ2 o DQ8. Si bien aún no hay fármacos aprobados para su uso habitual en EC, algunos que ya se encuentran en estudios de fases clínicas: ALV003 y AN-PEP, que son proteasas que lisan el gluten en el lumen gástrico evitando la generación de péptidos con capacidad inmunogénica; Larazotide, que es un bloqueador del receptor de zonulina, (proteína que desencadena la apertura de tight junctions del epitelio intestinal y aumenta su permeabilidad a péptidos derivados del gluten); y Nexvax2, que es una vacuna de uso subcutáneo que desensibiliza a los pacientes portadores de HLA-DQ2 53.
SEGUIMIENTO Y CONTROLLa evolución clínica luego de iniciada la dieta libre de gluten es rápida, con mejoría de la diarrea, dolor abdominal y distensión abdominal en un plazo de días y resolución completa a seis meses en el 66%, 96% y 94% de los casos, respectivamente 54. La adherencia a la terapia es mejor monitorizada por un nutricionista entrenado 27.
Los niveles de anticuerpos anti-gliadina, anti-DGP y anti-tTG son dependientes del estado de consumo de gluten en la dieta y por lo tanto son útiles para el monitoreo de la terapia en pacientes que están en dieta libre de gluten 27. Un estudio con 2245 pacientes con seguimiento a cinco años publicó que luego de 12 meses de dieta libre de gluten el 83% de los pacientes puede presentar serología normal, lo que desciende a un 70% si se consideran solo aquellos pacientes que han estado persistentemente negativos, y que alcanza al 99% al cabo de cinco años. Sin embargo, cerca de un tercio de los pacientes al cabo de cinco años han presentado un curso fluctuante de la serología, lo que sugiere adherencia irregular a la dieta 55.
Aunque los plazos para el control serológico con tTGA-IgA o IgA/IgG anti DGP no han sido estudiados, parece recomendable solicitarlos a los 3-6 meses de iniciada la dieta libre de gluten y luego cada un año 27. La persistencia de serología positiva luego un año sugiere no adherencia o dieta contaminada con gluten.
La curación de la mucosa podría considerarse el objetivo de la terapia y es importante documentarla pues se asocia a menos complicaciones pero no a disminución de la mortalidad 56. El control histológico no debería realizarse antes de los dos años de iniciada la terapia por la lentitud en la recuperación de la mucosa 33. Es recomendable repetir las biopsias de intestino en aquellos pacientes con poca respuesta o recaída a pesar de la terapia 27,28.
ENFERMEDAD CELÍACA NO RESPONDEDORA Y ENFERMEDAD CELIACA REFRACTARIALa enfermedad celiaca no respondedora (ECNR) se define como la falta de respuesta clínica o de laboratorio luego de 6-12 meses de iniciada la dieta libre de gluten 27. Se describe que ocurre en un 7-30% de los pacientes con EC y sus causas son exposición al gluten (36%), síndrome de intestino irritable (22%), enfermedad celíaca refractaria (ECR) (10%), intolerancia a la lactosa (8%) y colitis microscópica (6%) 57. Otras causas a descartar son sobrecrecimiento bacteriano intestinal, insuficiencia pancreática e intolerancia a la fructosa.
Ante una ECNR primero debe verificarse que la serología y biopsias iniciales sean compatibles con la enfermedad. Deben descartarse otras causas de atrofia vellositaria duodenal cuando la serología es negativa en un paciente con dieta normal (Tabla 4).
Los pacientes con mala adherencia, ya sea evidente o por consumo inadvertido o involuntario de gluten, deben ser evaluados por un nutricionista con experiencia en EC. El control serológico puede ser de ayuda pues si es positivo señala ingesta de gluten pero un control negativo no descarta un consumo intermitente o en baja cantidades 27.
En caso de ECNR con adherencia adecuada debe considerarse la repetición de las biopsias de duodeno y la realización de biopsias seriadas de colon para descartar otras enfermedades como colitis microscópica, que es 50-72 veces más frecuente en pacientes con EC 33.
La enfermedad celiaca refractaria se define como los síntomas o signos de malabsorción persistentes o recurrentes asociados a atrofia vellositaria de intestino delgado a pesar de una estricta dieta libre de gluten por más de 12 meses, con ausencia de otras enfermedades incluyendo linfoma 27. La ECR afecta a cerca del 2% de los pacientes con EC 57.
Se han descrito dos tipos de ECR, tipo I y II, definidas según el inmunofenotipo de los LIE de la mucosa de intestino delgado. La ECR tipo I se caracteriza por sus linfocitos intraepiteliales de inmunofenotipo normal, y la ECR tipo II por LIE anormales con falta de expresión de superficie del complejo receptor de células T (T-cell receptor, TCR)/CD3 y de CD8, y por la clonalidad de la cadena gama del TCR. Desde el punto de vista clínico la presentación del ECR tipo II es más severa con ulceraciones de la mucosa mayores a 1cm a la endoscopía, yeyunitis ulcerativa y asociada a gastritis linfocítica; además, presenta un mayor riesgo de linfoma de intestino delgado y otros órganos (37% vs 14%) y una evidente menor sobrevida (44% vs 93% a 5 años) 58.
Si bien no hay estudios comparativos sobre tratamiento de ECR, tradicionalmente se ha utilizado esteroides sistémicos y azatioprina, y últimamente se ha reportado el uso de budesonide y mesalazina. Para los casos de ECR tipo II se ha utilizado también 6-mercaptopurina, metotrexato, ciclosporina, anticuerpos anti-factor de necrosis tumoral y cladribina 27.
COMPLICACIONES NEOPLÁSICASLos pacientes con EC tienen más riesgo de desarrollar neoplasias que la población general, tanto intestinales como extra-intestinales. Un estudio de cohorte realizado en Reino Unido con 4732 pacientes celiacos y 23620 controles pareados mostró 1.29 veces mayor riesgo de cualquier neoplasia, especialmente linfoma no Hodgkin (hazard ratio 4.8) y cáncer de intestino delgado (hazard ratio 1.85) 59. El adenocarcinoma de intestino delgado aparece más frecuentemente en yeyuno y se desarrolla a partir de la formación de un adenoma previo 13. También se ha descrito mayor riesgo de adenocarcinoma orofaríngeo, esofágico, pancreático y neoplasias hepatobiliares 13, y menor riesgo de cáncer de mama y pulmón 59. La asociación con cáncer de colon es controversial 60.
El linfoma no Hodgkin que desarrollan los pacientes con EC se denomina linfoma de células T asociado a enteropatía y se diagnostica habitualmente en etapa avanzada al reaparecer síntomas luego de un periodo de buena respuesta a la terapia habitual o también como un cuadro de progresivo deterioro clínico como consecuencia de una EC refractaria tipo 2. Los síntomas pueden incluir anorexia, pérdida de peso, diarrea, dolor abdominal cólico, fiebre, adenopatías y hemorragia digestiva 61. El linfoma es la principal causa de muerte de los pacientes con EC 10. Se desarrolla generalmente en el yeyuno pero también puede hacerlo en íleon o sitios extra-intestinales como hígado, cerebro, tórax y hueso. Es más prevalente en varones sobre los 60 años y su sobrevida es pobre, 15-20% a dos años. Su sospecha obliga a un estudio exhaustivo que puede incluir la tomografía por emisión de positrones (PET-CT), videoendoscopía con cápsula y enteroscopía de doble balón, entre otras 15.
SÍNTESISPodemos suponer que en Chile los casos conocidos de EC probablemente solo representan “la punta del iceberg”, tal como se estima en el resto de mundo. Es importante entonces hacer el esfuerzo de buscar esta patología dirigidamente en aquellos pacientes con síntomas mayores y menores y en aquellos con mayor riesgo de desarrollar la enfermedad, como familiares de primer grado de pacientes con EC y diabéticos tipo 1. El manejo de la EC parece simple, sin embargo la realidad ha demostrado que se requiere de un equipo multidisciplinario que incluya gastroenterólogos pediátrico y adulto, y nutricionista idealmente dedicados al tema, lo que resultará en la mejoría sintomática y la disminución de sus consecuencias nutricionales y complicaciones especialmente neoplásicas. En el futuro es probable que existan alternativas terapéuticas farmacológicas y vacunas que permitan la ingesta de pequeñas cantidades de gluten y que ayuden a controlar la enfermedad, especialmente en los casos refractarios.
Los autores declaran no tener conflictos de interés, en relación a este artículo.
Las imágenes de este artículo han sido autorizadas por el paciente o sus padres para su publicación.