La esteatosis hepática no alcohólica es la acumulación excesiva de grasa en el hígado, en ausencia de causas secundarias y constituye la etiología frecuente de enfermedad hepática crónica sin terapia efectiva demostrada. La enfermedad incluye esteatosis, inflamación, fibrosis/cirrosis y hepatocarcinoma. El fenómeno inicial ocurre en la grasa corporal, con hipertrofia adipocitaria, liberación de adipoquinas y citoquinas pro-inflamatorias, que inducirán resistencia a la insulina. Este fenómeno provocará liberación de ácidos grasos a la circulación, captados por hepatocitos. En su evaluación clínica existen diferentes algoritmos con múltiples variables, limitando la biopsia hepática solo a casos excepcionales. Es esencial modificar el estilo de vida y bajar de peso. En diabéticos, metformina y pioglitazona son de primera elección. Los bloqueadores de la angiotensina son útiles en hipertensos con EHNA. Para prevenir la progresión de la enfermedad y en pacientes no diabéticos, asociar vitamina E. Las estatinas pueden utilizarse dada la asociación con patología cardiovascular.
Nonalcoholic fatty liver disease is characterized by excessive hepatic fat accumulation in the abscence of secundary causes. It is the most common cause of chronic liver disease. The spectrum ranges from benign steatosis, steatohepatitis, cirrhosis and hepatocarcinoma. The initial event is the hyperthofied adipocytes, and the release of adipokines and chemokines, that induce insulin resistance, and then free fatty acids into the circulation that accumulate in the liver. Algorithms have been proposed to target liver biopsy only to select patients. Lifestyle modifications to achieve weight loss are essential for all patients with NAFLD. For diabetics treatment should be with metformin and pioglitazone if glycaemic control is not achieved. Angiotensin receptor blockers are the antihypertensive agent of choice in patients with nonalcoholic steatohepatitis (NASH). If lifestyle changes and metabolic syndrome are unsuccessful in preventing disease progression, vitami E should be considered, also in non-diabetic patients with advance (NASH).
La enfermedad hepática por hígado graso no alcohólico (EHGNA) es consecuencia de múltiples factores de riesgo como sobrepeso, obesidad central, dislipidemia, resistencia a la insulina y Diabetes Mellitus tipo 2; todos ellos asociados conceptualmente con el Síndrome Metabólico, el que podría provocar complicaciones tanto hepáticas como cardiovasculares comorbimortalidad independiente. Identificar esta entidad y tratarla es de crucial importancia dado que la presencia solo de grasa hepática, puede progresar con inflamación, fibrosis, cirrosis y sus complicaciones, así como predisponer al desarrollo de hepatocarcinoma1.
La EHGNA es una entidad de amplio espectro clínico, radiológico y anatomopatológico. Es causa frecuente de elevación de aminotransferasas en sangre y de daño hepático crónico. Constituye la expresión hepática del síndrome metabólico. Independiente al daño hepático, la obesidad es un factor de riesgo para Diabetes Mellitus tipo 2, hipertensión arterial y enfermedad cardiovascular (enfermedad isquémica coronaria y accidente cerebrovascular). La alta prevalencia actual de obesidad y diabetes mellitus así como el progreso en el manejo de las hepatitis virales, ha llevado a la EHGNA a ser un problema clínico muy relevante. Hoy en día es la causa principal de enfermedad hepática crónica en países desarrollados e indicación de trasplante hepático2.
CONCEPTOS BÁSICOSHígado graso no alcohólico (HGNA) o esteatosis hepática: Es la acumulación de grasa en forma de triglicéridos en más del 5% de los hepatocitos demostrado por biopsia hepática, en ausencia de inflamación, fibrosis y un consumo de más de 30gr de alcohol al día.
Esteatohepatitis no alcohólica (EHNA): Entidad caracterizada por esteatosis que además se asocia a injuria hepatocitaria, inflamación, con o sin fibrosis. Se le conoce también como NASH (non alcoholic steatohepatitis).
Enfermedad hepática grasa no alcohólica (EHGNA): Condición que contempla el hígado graso, esteatohepatitis no alcohólica y cirrosis por dicha causa. El 80-90% son HGNA y el 10-20% restante corresponde a EHNA2.
PREVALENCIALa prevalencia de EHGNA y de EHNA es cada vez mayor y su detección depende tanto de la metodología utilizada en el diagnóstico, como de la población estudiada. Los métodos diagnósticos más utilizados en estudios clínicos son: ecografía abdominal, espectroscopía por resonancia magnética, medición de aminotransfereasas y biopsia hepática la que es considerada el “gold standard“1. Existen diferencias étnicas, siendo mayor la frecuencia de EHGNA en hispanos que en caucásicos y afroamericanos, así como en familiares relacionados3. La prevalencia en población hispánica se ha estimado a nivel mundial entre 20-30%2,4–7. En población de alto riesgo ésta alcanzaría el 50% en pacientes con sobrepeso, hasta el 95% en obesos, 70% en diabéticos tipo 2 y 50% en pacientes con dislipidemia3.
En biopsia hepática la prevalencia estimada de EHNA es del 2-5% en población general8,9 y de 10-20% en los portadores de esteatosis10,11. Se estima que entre el 8-26% de los individuos con EHNA progresan a cirrosis11–13 y el 40-60% de los pacientes con cirrosis por esta causa desarrollan complicaciones derivadas de ella, incluido el hepatocarcinoma, a más de 5 años de seguimiento14,15. En estudios retrospectivos se ha estimado que los portadores de cirrosis por EHNA desarrollarían hepatocarcinoma con una frecuencia amplia que oscilaría entre el 4-27% de los pacientes13,14. Siendo su real incidencia desconocida, pero en base a lo anterior se podría estimar que fluctuaría entre el 0,6-210 por 100.000 habitantes15. Por otra parte, es posible que una gran proporción de las cirrosis criptogénicas representen etapas finales de EHNA16.
En Chile, la encuesta nacional de salud 2009-2010 demostró la existencia de exceso de peso en 64,5% de la muestra estudiada, siendo 39% sobrepeso, 25% obesos y 2,3% portadores de obesidad mórbida (IMC>40). La hipertensión arterial afecta al 27%, hipertrigliceridemia 31%, Diabetes Mellitus al 9,4% y síndrome metabólico 35% de la población estudiada. En ellos se realizaron mediciones de enzimas hepáticas ante la sospecha de daño hepático crónico; el 17% de la población tenía gamaglutamiltransferasa (GGT) elevadas (>50U/L) y el 15% ALT (alaninoaminotransferasa) elevadas (ALT> 55 en hombre adultos y >30 en mujeres adultas)17. Por otra parte, en población hispánica chilena se demostró un 23,4% de hígado graso por ecografía abdominal; se trataba de pacientes en los que se había descartado consumo de alcohol superior a 20 gramos/día y tenían serología negativa para virus de hepatitis C18.
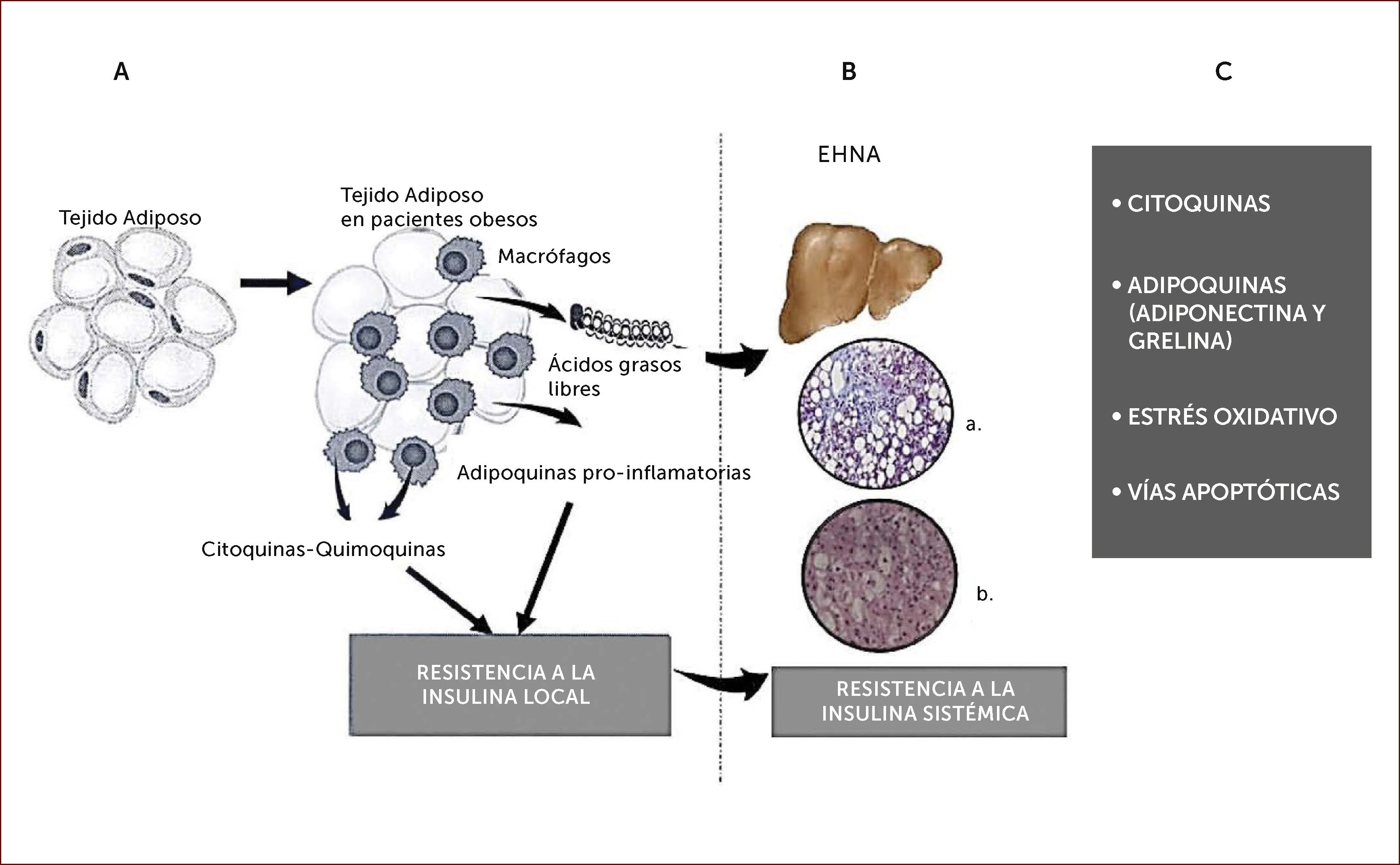
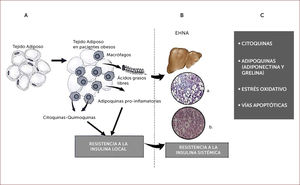
PATOGÉNESISEs conocida la asociación de EHGNA con obesidad, hipertensión, Diabetes Mellitus tipo 2 y dislipidemia, de tal forma que no sorprende la fuerte relación entre esta entidad y la resistencia a la insulina (RI). Esta última deriva de la infiltración por macrófagos del tejido adiposo visceral, en donde se desencadena una respuesta inflamatoria, con secreción de adipoquinas con efectos pro-inflamatorios y pro-fibróticos. Este fenómeno se potencia en el hígado de tal forma que tanto por vía sistémica como intra-hepática, existiría un exceso de citoquinas pro-inflamatorias, tales como factor de necrosis tumoral-alfa e interleuquina 6. Múltiples factores estarían implicados en el proceso inicial de la inflamación en el tejido adiposo que incluyen isquemia relativa y la producción de hipoxia inducida por factor-1, microflora intestinal selectiva, respuesta inflamatoria mediada por microflora y hormonas como leptinas. Una consecuencia importante de la RI es el aumento de la actividad lipolítica y liberación de ácidos grasos libres (AGL) a la circulación, de donde son captados por el hepatocito e inducen lipotoxicidad. La RI también permite potenciar la sensibilidad a la insulina en su efecto lipogénico en el hígado. Otros sistemas en juego incluyen a los canabinoides los que han demostrado ser un importante determinante de la lipogenesis de novo hepático19,20. La diferencia entre esteatosis y esteatohepatitis, radica en el mayor grado de apoptosis e inflamación asociados a balonamiento celular. EHNA está relacionada con mayor propensión al desarrollo de cirrosis. Diversos mecanismos estarían implicados en la injuria celular que incluye lipotoxicidad por AGL, stress oxidativo (SO), stress de retículo endoplásmico (RE) y activación del sistema inmune y de citoquinas, todas ellas mediadas por AGL que se traducen en daño celular. Existen diferentes fuentes de SO: la EHNA se asocia a daño mitocondrial y alteración en el trasporte de electrones; activación del citocromo P450 2 capaz de generar oxígeno reactivo; también la disfunción del peroxisoma. SO activa vías inflamatorias como c-Jun N-terminal (una quinasa) y factor nuclear kappa B. El glutation es el principal antioxidante y su recambio aumenta en condiciones de SO. La apoptosis ocurre tanto por lipotoxicidad como por SO. El stress del RE contribuye a la apoptosis. Finalmente la progresión de la enfermedad es consecuencia del desbalance entre injuria, reparación y fibrosis (Figura 1)19.
A. Adipocitos hipertrofiados liberan citoquinas y quemoquinas lo que induce resistencia a la insulina local y sistémica. Liberación de ácidos grasos libres a la circulación y acumulación en el hígado.
B. EHNA: esteatohepatitis noalcoholica; a y b: histología hepática con esteatosis, balonamiento celular e inflamación.
C. Mecanismos de progresión (esteatosis-esteatohepatitis no alcohólica).
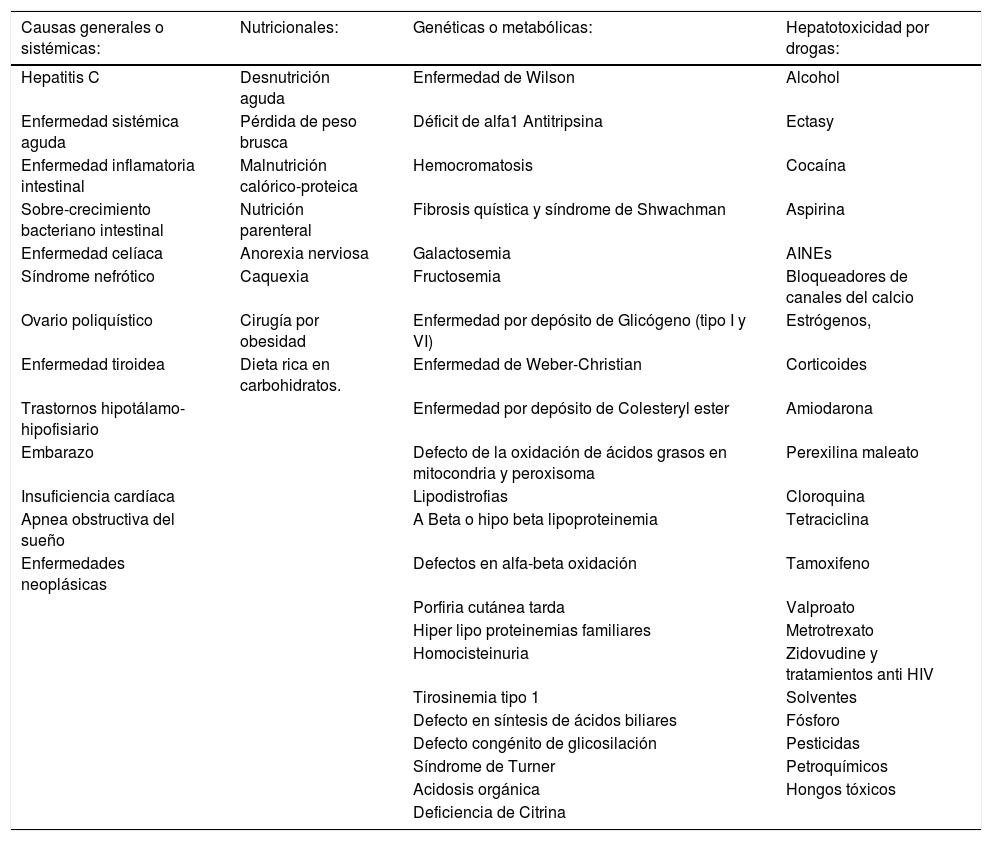
Los criterios diagnósticos son tres: 1) Ausencia de ingesta importante de alcohol (consumo diario de alcohol menor a 30 gr en hombre y 20 gr en mujeres); 2) esteatosis por imágenes o lesiones típicas por histología; 3) exclusión de otras causas de enfermedad hepáticas crónicas concomitantes (Tabla 1)3.
Causas secundarias de hígado graso
| Causas generales o sistémicas: | Nutricionales: | Genéticas o metabólicas: | Hepatotoxicidad por drogas: |
|---|---|---|---|
| Hepatitis C | Desnutrición aguda | Enfermedad de Wilson | Alcohol |
| Enfermedad sistémica aguda | Pérdida de peso brusca | Déficit de alfa1 Antitripsina | Ectasy |
| Enfermedad inflamatoria intestinal | Malnutrición calórico-proteica | Hemocromatosis | Cocaína |
| Sobre-crecimiento bacteriano intestinal | Nutrición parenteral | Fibrosis quística y síndrome de Shwachman | Aspirina |
| Enfermedad celíaca | Anorexia nerviosa | Galactosemia | AINEs |
| Síndrome nefrótico | Caquexia | Fructosemia | Bloqueadores de canales del calcio |
| Ovario poliquístico | Cirugía por obesidad | Enfermedad por depósito de Glicógeno (tipo I y VI) | Estrógenos, |
| Enfermedad tiroidea | Dieta rica en carbohidratos. | Enfermedad de Weber-Christian | Corticoides |
| Trastornos hipotálamo-hipofisiario | Enfermedad por depósito de Colesteryl ester | Amiodarona | |
| Embarazo | Defecto de la oxidación de ácidos grasos en mitocondria y peroxisoma | Perexilina maleato | |
| Insuficiencia cardíaca | Lipodistrofias | Cloroquina | |
| Apnea obstructiva del sueño | A Beta o hipo beta lipoproteinemia | Tetraciclina | |
| Enfermedades neoplásicas | Defectos en alfa-beta oxidación | Tamoxifeno | |
| Porfiria cutánea tarda | Valproato | ||
| Hiper lipo proteinemias familiares | Metrotrexato | ||
| Homocisteinuria | Zidovudine y tratamientos anti HIV | ||
| Tirosinemia tipo 1 | Solventes | ||
| Defecto en síntesis de ácidos biliares | Fósforo | ||
| Defecto congénito de glicosilación | Pesticidas | ||
| Síndrome de Turner | Petroquímicos | ||
| Acidosis orgánica | Hongos tóxicos | ||
| Deficiencia de Citrina |
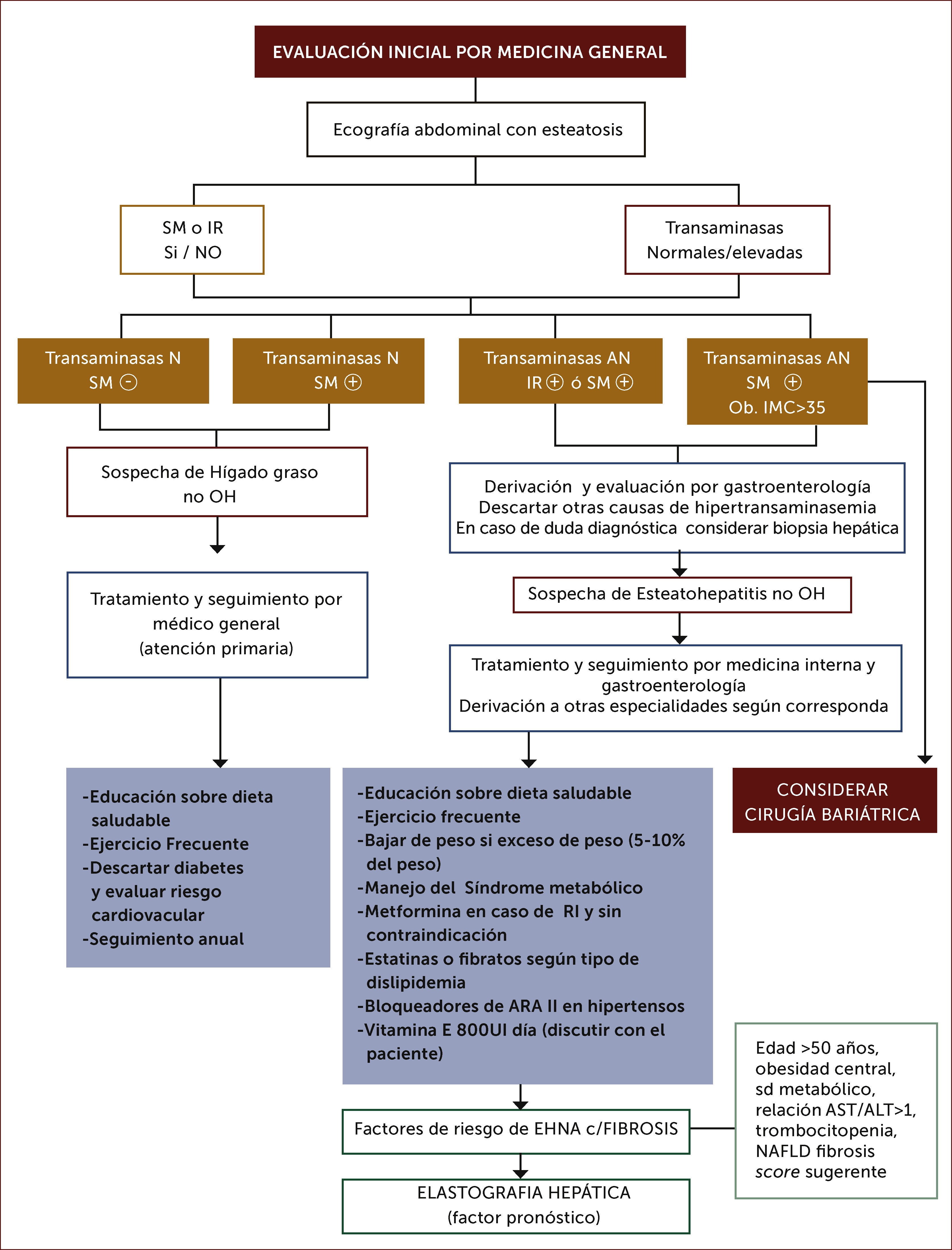
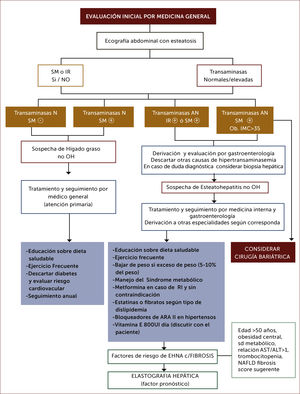
En las dos últimas décadas, se han utilizado diferentes criterios para definir y etapificar las lesiones histológicas en la EHNA21; en todas existirían discrepancias y subjetividad en su interpretación. La biopsia hepática es el “gold standard” para el diagnóstico directo de EHGNA. Es el único método validado para diferenciar hígado graso de EHNA, una vez que se ha descartado el consumo de alcohol. Evalúa el grado de esteatosis, inflamación e injuria hepatocitaria así como el de fibrosis3. Los análisis histológicos más utilizados para el estudio de la EHGNA son: score de Brunt22 y el de NAS (NAFLD Activity Score) desarrollado por el NASH Clinical Research Network23. La biopsia hepática es de uso limitado por ser un procedimiento invasivo, solo representa el 1:50.000 de todo el volumen hepático, y no está exenta de complicaciones tales como dolor (30%), hemorragia (30%) y muerte en casos excepcionales (0.01%)24. Dada la alta prevalencia de EHGNA, la biopsia hepática no es prudente realizarla a todos los pacientes si existe concomitantemente síndrome metabólico, que explique la alteración hepática y excluidas otras causas. Hay acuerdo en realizarla en aquellos que tienen alto riesgo de tener EHGNA con fibrosis avanzada, en casos de sospecha de enfermedad hepática concomitante y en aquellos con sospecha de EHGNA que se someterán a procedimientos quirúrgicos abdominal por otros motivos durante la cirugía; también en estudios clínicos controlados previo consentimiento del paciente3,25.
Evaluación no invasiva de la necro-inflamación:Desde el punto de vista de laboratorio, la EHGNA puede provocar incremento leve, crónica y asintomática de aminotransferasas. La alaninoaminotransferasa (ALT), es una enzima específica de origen hepático y ha sido utilizada como examen de pesquisa por ser de bajo costo, confiable y ampliamente disponible26. Sin embargo, existen estudios que han demostrado que aproximadamente el 80% de los individuos con hígado graso tiene niveles de ALT dentro de rango normal, a raíz de lo cual no sería un indicador sensible de EHGNA4,27. A su vez los niveles de corte para considerar la anormalidad de ALT son controversiales. Por otra parte se han utilizado múltiples biomarcadores y modelos complejos como predictores de daño28. Entre éstos existe información sobre fragmentos de citoqueratina-18 (CK-18) como marcador de apoptosis, con resultados disímiles entre meta-análisis con alta sensibilidad y especificidad, a estudios multicéntricos con limitada utilidad29. En la actualidad se considera como score predictivo de EHGNA al NASH, que incluye como variables: edad, sexo, talla, peso, alfa-macroglobulina, haptoglobina, apolipoproteina A1, bilirrubina total, GGT, ALT, AST, triglicéridos, colesterol y glicemia30.
Las técnicas de imágenes han sido utilizadas como herramienta de primera línea en la sospecha de EHGNA para evaluar esteatosis. La ecotomografía abdominal es el método más empleado por ser no invasivo, ampliamente disponible y de bajo costo9. La sensibilidad en la detección de esteatosis comparado con la histológica varía entre 82-94% y su especificidad sería sobre 82%31. Sin embargo, tiene ciertas limitaciones, como la subjetividad en la interpretación del grado de esteatosis, ser operador dependiente y de baja sensibilidad para determinar esteatosis leve (menos 25-30%)9,32. Existen otras técnicas como la tomografía computarizada, la que no es más precisa que la ecografía para detectar esteatosis y tiene la desventaja de su mayor costo y el uso de radiación. Por otro lado, la resonancia magnética, si bien puede ser más sensible que la ecografía para el diagnóstico de esteatosis leve, consume más tiempo y es de mayor costo, por lo cual pocas veces se utiliza para evaluar esteatosis en la práctica clínica33.
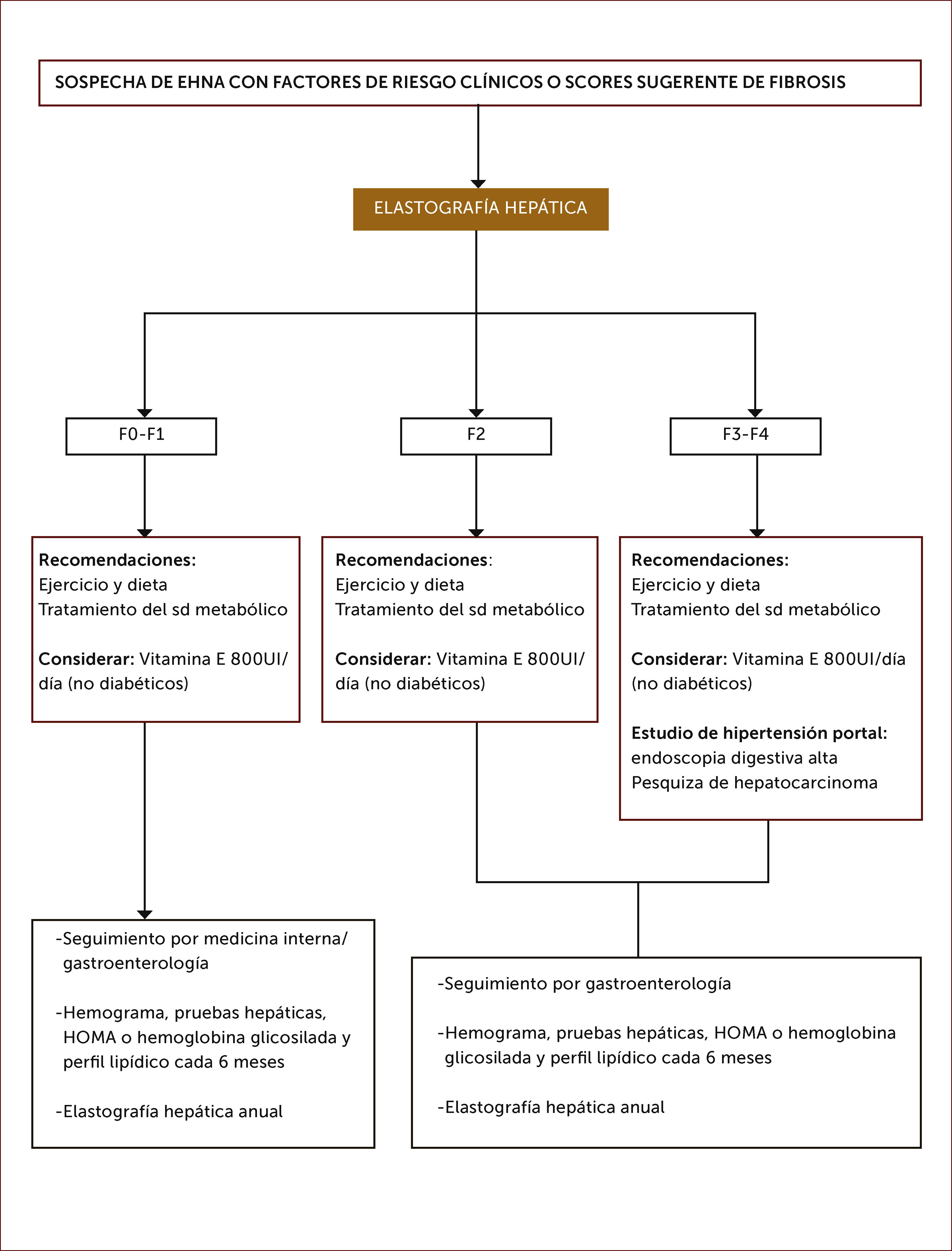
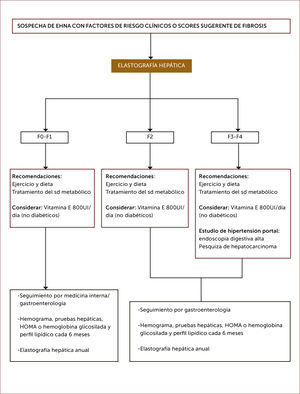
Evaluación no invasiva de la fibrosis:Es importante diferenciar la presencia de esteatosis simple de la EHNA, dado que esta última tiene riesgo de progresar a fibrosis y cirrosis, con un pronóstico distinto34. La presencia de síndrome metabólico es un fuerte predictor de la presencia de EHNA en pacientes con EHGNA37. Así mismo la edad mayor a 50 años, obesidad visceral, hipertensión arterial, Diabetes Mellitus tipo 2, AST/ALT>1 (AST: aspartato aminotransferasa) y trombocitopenia son factores de riesgo de EHNA y fibrosis avanzada3,33. Lo anterior se correlaciona con el grado de EHNA demostrado por biopsia en pacientes con EHGNA, con una sensibilidad del 78% y especificidad del 87%36. Los métodos no invasivos son buenos para detección de fibrosis avanzada, pero no son exactos para determinar fibrosis leve. El NAFLD Fibrosis score ha sido ampliamente validado como predictor de fibrosis avanzada utilizando 6 variables clínicas: edad, índice de masa corporal (IMC), hiperglicemia, recuento de plaquetas, albumina, AST/ALT9.
En los últimos años se han difundido métodos no invasivos de medición de fibrosis basados en la determinación del grado de rigidez del hígado por elastrografía transitoria (Fibroscan), ARFI (Acoustic Radiation Force Impulse), elastografía en tiempo real y elastografía por resonancia37. Estos métodos han demostrado ser útiles en la detección de fibrosis en portadores de hepatitis virales y posteriormente se han utilizado en otras etiologías, como la EHGNA. Algunas de las limitaciones de las técnicas elastográficas serían la presencia de actividad inflamatoria hepática importante, obesidad y esteatosis significativa, las cuales son características frecuentes en portadores de EHGNA38. La técnica ARFI ha sido validada en los últimos años, siendo comparable a otras técnicas como Fibroscan39–41. Es sencilla, rápida, confiable, no invasiva e independiente de la compresión realizada por el operador; además solo requiere de un componente adicional al equipo de ultrasonido, lo que permite la realización de una ecografía hepática tradicional en simultáneo. Para ello se utiliza el equipo ACUSON S2000 de Siemens®. Se realizan 10 mediciones conocidas como velocidad de tensión de onda (shear wave velocity) a 2-3cm bajo la cápsula hepática en el lóbulo hepático derecho, entre la 9°-10° costilla en inspiración profunda. El resultado de la medición se expresa en metros/segundos (m/s) y se ha correlacionado con los niveles de fibrosis demostrada por biopsia30,42,43.
Las guías europeas e italianas sugieren la utilización de la combinación de parámetros clínicos y de laboratorio, marcadores séricos, scores (como el NAFLD fibrosis score) y métodos de imagen (elastografía por Fibroscan) para reducir el número de pacientes con EHGNA que requieran someterse a biopsia hepática25.
Pronóstico:El hígado graso sin otros factores de riesgo asociados no aumenta la morbimortalidad a corto plazo y se asocia a una expectativa de vida normal44; sin embargo la EHNA aumenta la mortalidad global en un 35-85% comparado con población general de la misma edad y sexo44. La mortalidad de causa hepática aumenta 9-10 veces siendo la cirrosis la 3ª causa de muerte independiente en esta población en comparación con la 13ª de la población general. Así mismo la mortalidad de causa cardiovascular está incrementada en dos veces en estos pacientes13.
Prevención:No hay acuerdo internacional con respecto al tipo de pesquisa (screening) en población general dada la falta de claridad en los estudios diagnósticos y opciones de tratamiento; además se requiere un análisis adicional sobre costo-beneficio a largo plazo3. Un ejemplo es el de las guías europeas y de la región Asia-Pacífico que recomiendan estudio en población de riesgo con síndrome metabólico y RI utilizando medición de enzimas hepáticas y ecografía abdominal34.
Tratamiento:Hay acuerdo en la necesidad de utilizar como primera medida terapéutica la dieta y la modificación de estilo de vida, con actividad física regular3,34. Dichas medidas son recomendadas a todos los pacientes con EHGNA, con o sin sobrepeso45.
1. Cambios en estilo de vida:Incluye bajar de peso, modificaciones de la dieta y aumentar la actividad física. Con estas medidas hay reducción del tejido adiposo y así de la insulino-resistencia, principal mecanismo en la patogenia de la EHGNA46,47.
a. Recomendaciones dietéticas incluyen una reducción de 600-800 calorías o restricción calórica a 25-30kcal/kg de peso ideal50–52. La fracción de carbohidratos debe ser reducida a un máximo de 45% del total de calorías y el de las grasas saturadas a <10%51. Se debe favorecer el consumo de frutas y verduras. Dichas medidas han demostrado ser útiles en disminuir la esteatosis hepática y el nivel de amino transferasas52.
b. Baja de peso con la dieta, debe ser de 5-10% del peso basal para observar un beneficio clínico real50. Revisiones sistemáticas han demostrado mejoría en insulino-resistencia, de aminotransferasas, de esteatosis e inflamación pero no de fibrosis hepática53,54). La baja de peso debe ser gradual, 0,5kg/semana, dado que reducciones mayores a 1,6kg/semana pueden generar mayor inflamación y fibrosis55.
Considerando el costo/beneficio, ausencia de contraindicaciones y de efectos colaterales, tanto la dieta como la baja de peso antes señaladas se recomiendan a todos los pacientes con EHGNA56.
c. Ejercicio físico mejora la insulino-resistencia y la esteatosis hepática. Se recomiendan treinta minutos de ejercicio físico aeróbico moderado a intenso tres a cinco veces por semana54. Como recomendación, la actividad física moderada a intensa es beneficiosa dado el bajo costo de la medida y los beneficios tanto en insulino-resistencia como en la mejoría de la esteatosis hepática.
2. Fármacos para bajar de pesoa. Orlistat, un inhibidor de la lipasa entérica y Sibutramina, un inhibidor de la recaptación de serotonina y norepinefrina, por sus efectos en la baja de peso indirectamente podrían mejorar la esteatosis. Sin embargo no se recomiendan por el potencial hepatotóxico del Orlistat57 y el aumento del riesgo cardiovascular de la sibutramina58.
b. Rimonabant, antagonista de receptor de canabinoides. Reduce el apetito y así la ingesta calórica. Por sus efectos adversos psiquiátricos fue retirado del mercado59.
3. Cirugía bariátricaEn obesidad mórbida, la cirugía es una buena alternativa para obtener una reducción de peso mantenida cuando las modificaciones de estilo de vida (dieta y ejercicio) y el tratamiento farmacológico no han sido efectivas60. Se califican como procedimientos restrictivos a la banda gástrica, balón y gastrectomía en manga y los que generan malabsorción: by-pass gástrico. Reduce la inflamación, la esteatosis y podría incluso regresar la fibrosis hepática61. Podría disminuir el riesgo cardiovascular, diabetes Mellitus, hipertensión arterial e hipertrigliceridemia en el largo plazo, en comparación con la baja de peso convencional62. Aún faltan estudios randomizados en cirugía bariátrica que evalúen los efectos en el largo plazo para su recomendación como tratamiento primario en EHNA. En adultos con un IMC mayor a 40 debería considerarse como alternativa63. Previamente debe descartase la presencia de cirrosis hepática dado que dicho estadio de la enfermedad con presencia de hipertensión portal, aumenta el riesgo de morbimortalidad de la cirugía. La recomendación debe ser individualizada, aconsejada por un comité multidisciplinario y en centros médicos especializados.
4. Insulino-sensibilizadoresa. Metformina es una biguanida. Mejora la insulino-resistencia y la hiperinsulinemia. En algunos estudios redujo las aminotransferasas, pero este hallazgo no es constante; tampoco se ha demostrado mejoría histológica64. Se necesitan más estudios en adultos con seguimiento histológico. No se recomienda Metformina para el tratamiento del hígado graso, sin embargo puede ser utilizado para pacientes con Diabetes Mellitus tipo 2 en los que adicionalmente reduce el riesgo de complicaciones relacionadas con esta enfermedad (cardiovasculares y otras causas de mortalidad)65. Existen evidencias que sugieren una reducción en el riesgo de Hepatocarcinoma en pacientes diabéticos con EHNA66.
b. Tiazolidinedionas mejoran la sensibilidad a la insulina en tejido adiposo67. Estudios clínicos han demostrado una disminución de los niveles de aminotransferasas, de inflamación y esteatosis hepática aunque no de fibrosis hepática, en pacientes con EHNA con o sin Diabetes Mellitus tipo 267. El perfil de seguridad es cuestionado por el aumento de riesgo cardiovascular, incluyendo insuficiencia cardíaca congestiva y eventos coronarios. La pioglitazona es la única disponible, aunque existiría un aumento en el riesgo de cáncer vesical e incremento de peso no deseado, lo que puede ser una limitante67.
5. HipolipemiantesPara manejo de la displidemia asociada a síndrome metabólico:
a. Fibratos y estatinas: No hay estudios multicéntricos con base sólida para recomendar su uso en EHGNA. Los fibratos podrían regular la inflamación, sin que exista evidencia clínica al respecto. Se recomienda solo en estudios clínicos controlados y para el tratamiento de la dislipidemia en pacientes con EHGNA68. Las estatinas, a pesar de poder producir un incremento en amino transferasas, su uso es seguro en pacientes con daño hepático, y a largo plazo mejorarían las pruebas hepáticas y el riesgo de eventos cardiovasculares y podría reducir el riesgo de hepatocarcinoma69.
b. Ezetimibe: Es un inhibidor selectivo de la absorción intestinal de colesterol y fitoesterol. Esta droga podría aumentar la sensibilidad a la insulina, reducir la inflamación y esteatosis hepática. Tendría además una función antioxidante hepática70. Un estudio reciente mostró beneficios bioquímico, metabólico e histológico en el seguimiento, pero faltan estudios para recomendar su uso71. Su efecto es prometedor. La recomendación actual no es utilizarlo como tratamiento de EHGNA, pero podría utilizarse para el tratamiento de la dislipidemia en pacientes con EHGNA.
6. Inhibición del eje renina-angiotensina-aldosterona (RAA):Estudios experimentales sugieren un rol del eje RAA como mediador de inflamación y fibrosis hepática en EHGNA. La inhibición del eje RAA reduce la fibrosis hepática en modelos experimentales a través de células estrelladas involucradas en fibrogénesis72. Tanto con Telmisartán e Irbesartán se observaría una mejoría tanto bioquímica como histología73. En estudios con menor número de pacientes se observarían efectos similares con Losartán72.
7. AntioxidantesConsiderando la inflamación y el estrés oxidativo como hallazgos en EHGNA los antioxidantes podrían ser beneficiosos49.
a. Vitamina E: El estudio PIVENS mostró mejoría bioquímica e histológica significativa (43% vs 19% en grupo placebo), mejorando la esteatosis e inflamación sin mejoría de la fibrosis. Sin embargo el efecto benéfico se pierde luego de la discontinuación69. Otro estudio, no logró demostrar dicho beneficio67–74. Es discutible el aumento de la mortalidad de otras causas asociado al uso de vitamina E, observación que no ha sido confirmada en otros estudios. La recomendación actual es el uso de vitamina E en aquellos adultos no diabéticos con EHNA demostrado por biopsia que no responden a cambios en el estilo de vida y que tienen enfermedad avanzada en estado previo a la cirrosis hepática3.
b. Pentoxifilina: Inhibe citoquinas pro-inflamatorias incluido el factor de necrosis tumoral alfa (TNFα) y tendría efecto anti-fibrogénico in vitro75. Se ha observado después de un año de tratamiento, disminución en la necro-inflamación, fibrosis y en cerca del 40% de los pacientes la mejoría del score de actividad EHGNA76,77.
8. Ácido ursodeoxicólicoÁcido biliar cito-protector hidrofílico no ha demostrado beneficio en EHGNA78.
9. Trasplante hepáticoCon el incremento progresivo de EHNA, la cirrosis de esta causa constituye una indicación creciente de trasplante hepático, con cerca del 12% en algunos países como el Reino Unido79. Se ha observado en un estudio limitado de pacientes trasplantados por cirrosis por EHNA, una recurrencia de esteatosis en el 70% y EHNA en el 25%, sin pérdida del injerto o necesidad de retrasplante hepático a 3 años de seguimiento80. Es fundamental en estos pacientes el manejo cardiovascular de tal manera de reducir la mortalidad por esta causa. Se presentan propuestas de Algoritmos de diagnóstico y tratamiento, 1 y 2).
Finalmente se construyó un cuadro con los aspectos relevantes a considerar en el hígado graso no alcohólico.
ASPECTOS IMPORTANTES DEL HIGADO GRASO NO ALCOHÓLICO-
El hígado graso no alcohólico es una enfermedad frecuente en pacientes obesos y/o con síndrome metabólico.
-
Tiene un amplio espectro de manifestaciones desde el hígado graso simple, la esteatohepatitis con o sin fibrosis hasta llegar a las cirrosis.
-
Es muy importante diagnosticar en forma precoz este trastorno para modificar sus factores de riesgo y evitar la progresión de la enfermedad.
-
La esteatohepatitis tiene riesgo de progresar a la fibrosis y posterior cirrosis, siendo hoy en día una causa frecuente de trasplante hepático.
-
La única forma actualmente de poder diferenciar la esteatosis simple de la esteatohepatitis es la biopsia hepática, la cual no se realiza en forma rutinaria.
-
Aquellos pacientes con sospecha de esteatohepatitis con o sin fibrosis deben ser correctamente estudiados por un especialista con el fin descartar diagnósticos diferenciales y dar un tratamiento y seguimiento correcto.
-
Están en investigación exámenes no invasivos para poder reconocer la presencia de esteatohepatitis sin necesidad de llegar a la biopsia hepática.
-
Exámenes no invasivos para detectar fibrosis como la elastografía hepática pueden ser un complemento en el estudio de estos pacientes. Su indicación, resultado y valor pronóstico debe ser adecuadamente interpretados por un especialista, con el fin de realizar un tratamiento y seguimiento con la rigurosidad adecuada.
-
El tratamiento actual para la enfermedad por hígado graso no alcohólico consiste principalmente en medidas no farmacológicas basadas en dieta y baja de peso.
-
No existe un tratamiento farmacológico estandarizado para todos los pacientes con EHGNA.
-
Se recomienda optimizar el manejo de todas las comorbilidades asociadas como diabetes, hipertensión, dislipidemia, obesidad entre otras.
-
Existen estudios que han demostrado beneficio en algunos aspectos con el uso de vitamina E en algunas subpoblaciones. Dada la ausencia de un tratamiento específico, en la actualidad podría ser una alternativa a discutir con el paciente.
Los autores declaran no tener conflictos de interés, en relación a este artículo.