El cáncer gástrico es la causa más frecuente de cáncer en países de Asia Oriental, Europa Oriental y algunas regiones de Latino América. El pronóstico del cáncer gástrico avanzado es pobre, sin embargo, el pronóstico del cáncer gástrico temprano (CGT) es muy favorable con datos de sobrevida libre de enfermedad a cinco años, que alcanzan el 100%. El diagnóstico temprano se logra realizando una endoscopia de tamizaje completa, detallada y de alta calidad. Recientemente, se ha propuesto la endoscopia sistemática alfanumérica codificada (SACE), la cual ha probado su eficacia en Colombia al diagnosticar CGT a una tasa de 0,3% en individuos sanos de riesgo medio. Una vez diagnosticado el CGT, la endoscopia terapéutica desempeña un papel fundamental en el tratamiento curativo de la enfermedad. Entre las diferentes técnicas de resección, la disección endoscópica de la submucosa (ESD) ha demostrado excelentes tasas de curabilidad y resultados de sobrevida a cinco años similares a la gastrectomía, pero con menos morbilidad, constituyéndose actualmente en el tratamiento de elección en estos casos. Fundamentos espaciales y visuales, además de entrenamiento bajo la dirección de expertos calificados en centros de formación acreditados, son necesarios para adquirir competencia en ESD. Estas bases educacionales, tanto para el diagnóstico, como para el tratamiento del CGT, son fundamentales para aumentar la frecuencia y la tasa de curabilidad del cáncer gástrico en Latino América y el mundo.
Gastric cancer ranks as the most common malignant tumor in East Asia, Eastern Europe, and parts of Latin America. Although advanced gastric cancer carries a poor prognosis, survival rates of early gastric cancer, however, are favourable with a 5-year disease-free survival reaching almost 100%. High quality screening esophagogastroduodenoscopy is a key stone for early diagnosis. Recently, systematic alphanumeric coded endoscopy (SACE) has been proposed as a new method to improve detection of early gastric cancer. SACE has proved its efficacy in Colombia, diagnosing early gastric cancer at a rate of 0.3% in healthy average risk individuals. After the diagnosis, therapeutic endoscopy is essential to achieve minimally invasive curative treatment. Among other methods, the endoscopic submucosal dissection technique has demonstrated excellent curability and disease-free survival rates, with less morbidity when compared to gastrectomy, currently constituting the preferred treatment for early gastric cancer. Spatial and visual fundaments, along with special training under the supervision of qualified experts and in recognised institutions, are necessary to obtain proficiency in ESD. This educational basis constitutes the fundaments to increase early diagnosis and curative treatment for gastric cancer in Latin America and the world.
El cáncer gástrico es actualmente el cuarto en frecuencia y la segunda causa de muerte por cáncer a nivel mundial. Se presentan aproximadamente 870.000 casos nuevos cada año, ocasionando en promedio 650.000 muertes en el mundo1,2. La enfermedad tiene una variación geográfica muy importante con altas tasas de prevalencia en países de Asia Oriental, Europa Oriental y algunas regiones de América Latina3,4. Entretanto, países como Estados Unidos la frecuencia y la mortalidad es baja y ha disminuido en los últimos 35 años5.
El diagnóstico tardío es la principal razón de la alta mortalidad, mientras que el diagnóstico temprano y su tratamiento son estrategias efectivas para mejorar la sobrevida libre de enfermedad. En Japón, la realización masiva de esófago-gastro-duodenoscopia (EGD) de tamizaje, junto al desarrollo de mejores competencias en la detección de lesiones tempranas, han mostrado ser efectivas como medidas de prevención secundaria.
DEFINICIÓN DE CÁNCER GÁSTRICO TEMPRANOEl cáncer gástrico temprano (CGT), también llamado cáncer T1 según la clasificación de la WHO, fue definido por primera vez en 1962 por la Japanese Society of Gastroenterological Endoscopy, como una neoplasia limitada a la mucosa y submucosa, independiente del compromiso linfático ganglionar. El pronóstico del CGT es muy favorable con estudios que demuestran tasas de sobrevida total y libre de enfermedad a cinco años de 97.1% y 100% respectivamente. Entre patólogos japoneses y occidentales, ha existido controversia en relación al diagnóstico del CGT. Mientras en países occidentales el CGT es diagnosticado cuando la lesión invade la lámina propia, en japón el CGT es diagnosticado también en lesiones intramucosas, sin que necesariamente exista compromiso de la submucosa. Recientemente, se ha propuesto la clasificación de Vienna de lesiones neoplásicas gastrointestinales, en donde la displasia de alto grado clasificada como categoría 4 de Vienna corresponde al CGT intramucoso de la clasificación japonesa, acercando de esta forma la brecha entre occidente y oriente6.
PROGRAMAS DE TAMIZAJEEn la actualidad, Japón y China son los países líderes en programas de tamizaje. Se ha comprobado, que, a pesar de la alta prevalencia de la enfermedad en estos países, los programas de tamizaje han permitido disminuir su mortalidad7,8. En otros países, no se han desarrollado estos programas masivos de tamizaje, pero se han utilizado otras estrategias como por ejemplo identificar poblaciones de alto riesgo. En general, la incidencia de cáncer gástrico aumenta después de los 40 años y es más frecuente en hombres que en mujeres. Los familiares en primer grado de pacientes con cáncer gástrico tienen un riesgo 1,5 veces mayor de desarrollar la enfermedad. En países Latinoamericanos como Chile, se han implementado importantes estrategias no invasivas para identificar poblaciones con alto riesgo de desarrollar gastritis atrófica mediante las mediciones de Pepsinógeno-1, la relación Pepsinógeno 1/Pepsinógeno-2, y 17-gastrina9.
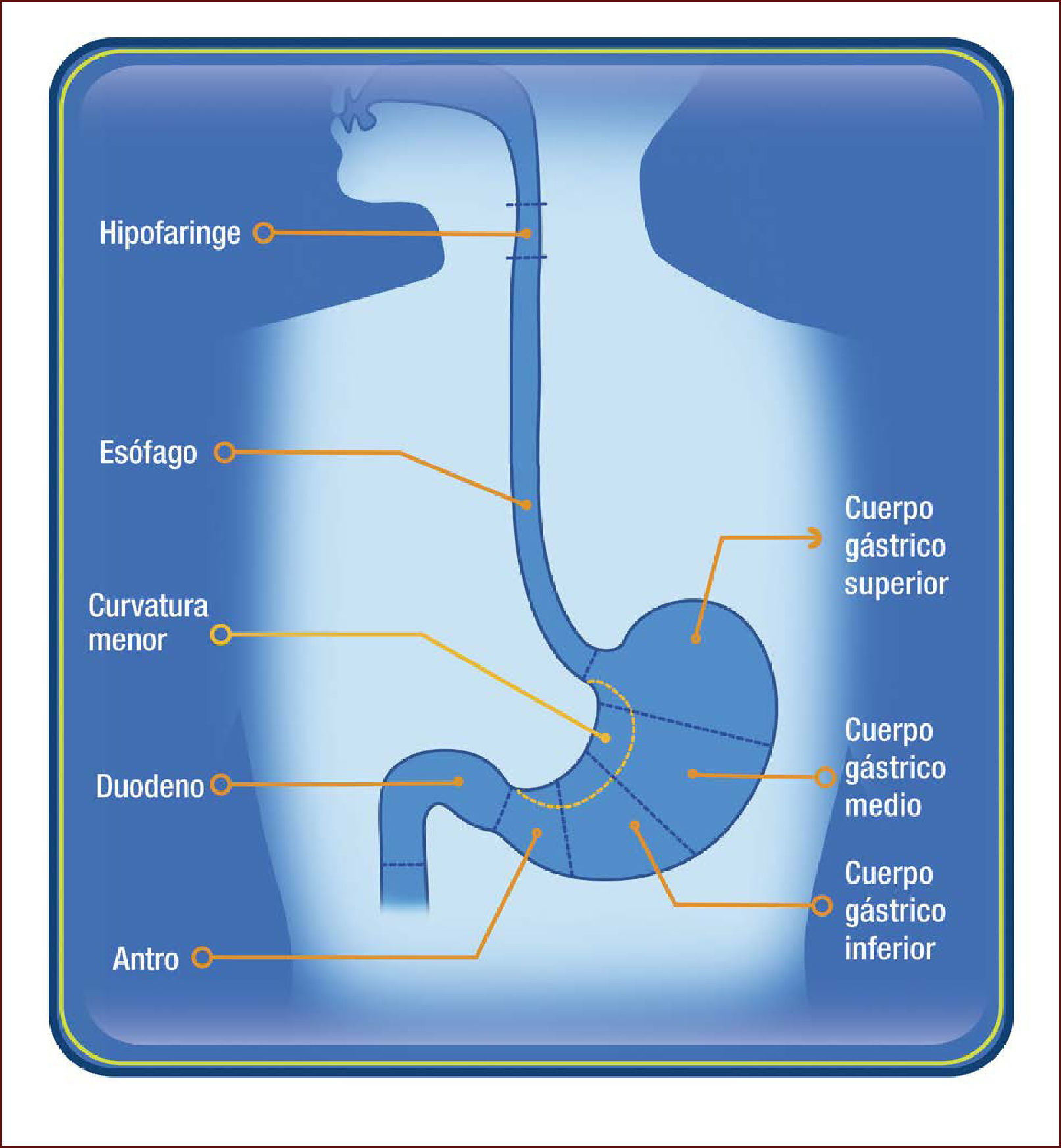
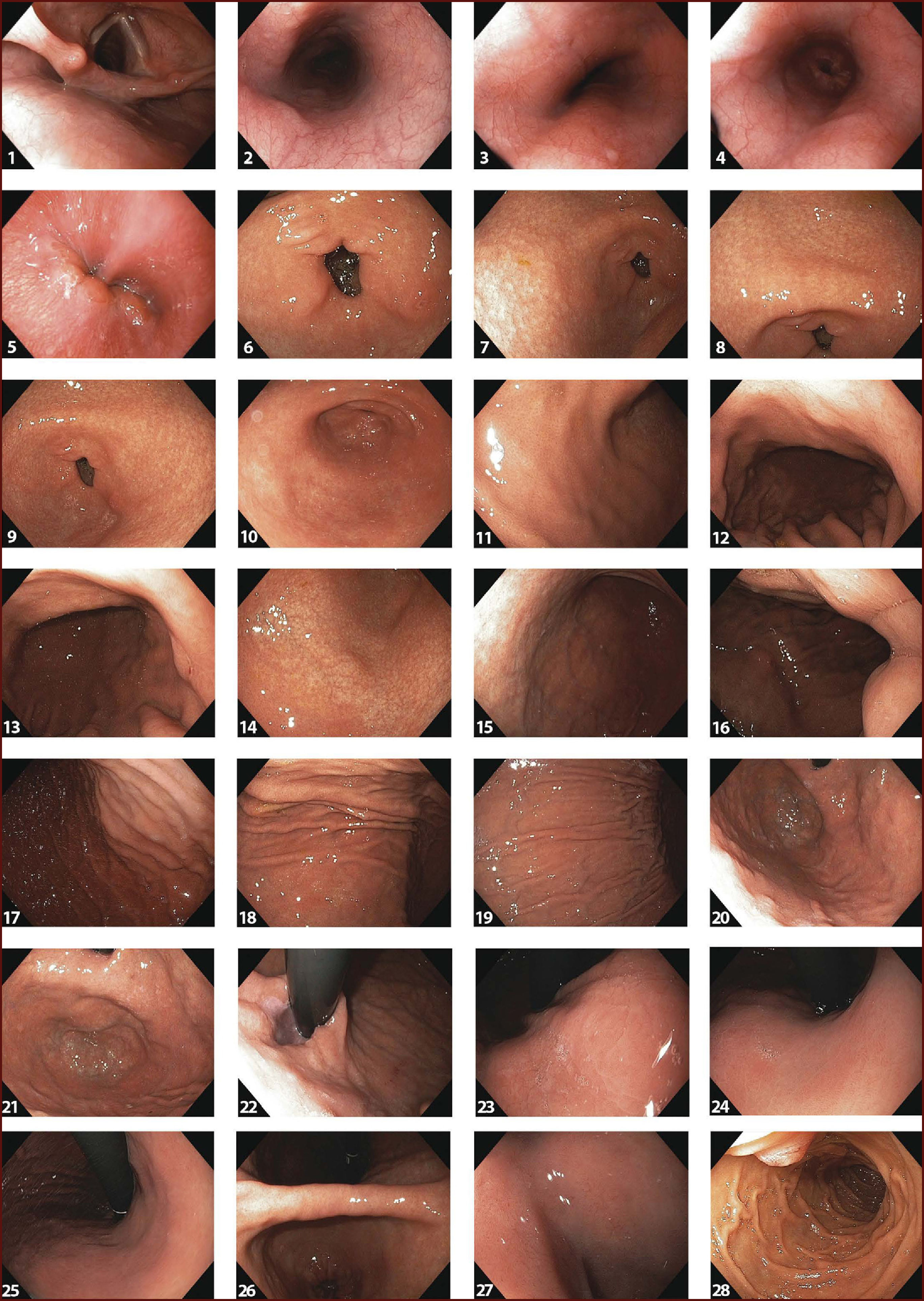
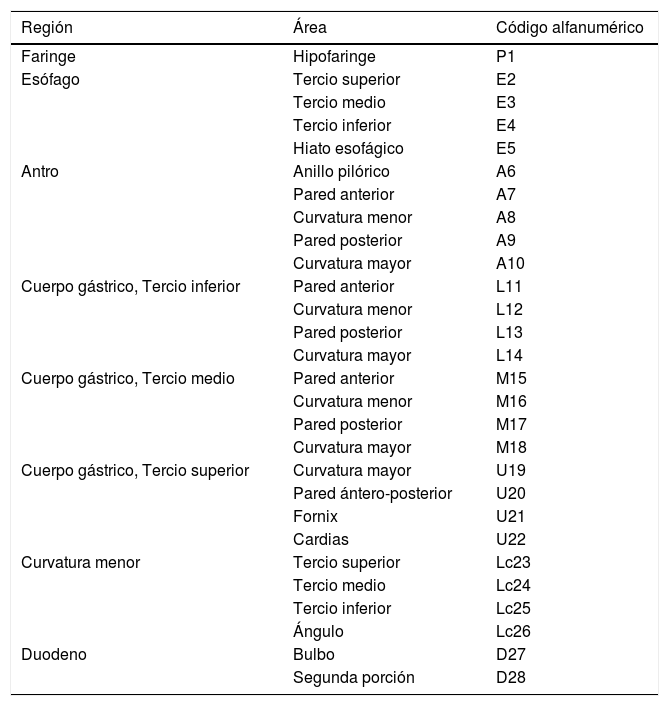
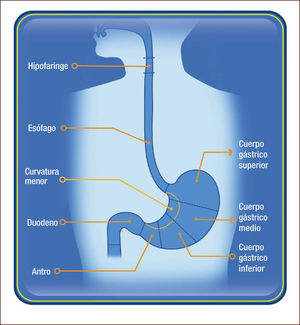
DIAGNÓSTICO ENDOSCÓPICO DEL CGTEl examen endoscópico es sin duda el mejor examen para diagnosticar el CGT en estado curable. En algunos aspectos, sin embargo, el modo en que la EGD se realiza actualmente presenta varias limitaciones y dificulta en vez de facilitar el hallazgo de una lesión temprana. Aunque es el examen más realizado en la práctica clínica gastrointestinal, existen muchos centros donde este examen no sigue un orden particular, no usa nomenclatura endo-luminal precisa para describir regiones o áreas dentro del estómago, y sólo fotográficamente registra áreas anormales de la mucosa. Llama la atención que estándares de calidad en EGD como el tiempo óptimo de observación y la realización de un examen completo, no son globalmente aplicados, en centros de entrenamiento, ni se incluyen en el curriculum de enseñanza universitaria. En contraste, estándares de calidad en colonoscopia son muy usados y dan importancia al examen completo y meticuloso de la mucosa para encontrar lesiones neoplásicas y así reducir la frecuencia de cáncer colo-rectal10–12. Desde un punto de vista global, la situación es aún más compleja, porque ahora la EGD está siendo realizada por médicos de diferentes especialidades. Por lo tanto, debe ser una prioridad la estandarización del examen y la definición de criterios de calidad en EGD. Recientemente, con la intención de proveer un examen de alta calidad y aumentar la frecuencia del diagnóstico del CGT, Emura et al, han propuesto un método completo, detallado y de alta calidad denominado Endoscopia Sistemática Alfanumérica Codificada (SACE por su sigla en Inglés)13. SACE es un método que facilita el examen completo de toda la extensión del tracto digestivo superior, basado en foto-documentación sistemática secuencial, utilizando conceptos fundamentales de anatomía endoscópica endo-luminal. Similar a una tomografía axial computarizada para detección y caracterización de una masa abdominal, SACE provee las bases para realizar un examen endoscópico completo de la entera superficie del tracto digestivo superior, sin dejar espacios ciegos (no observados). Para esto, SACE utiliza una nomenclatura endo-luminal alfanumérica, compuesta de 8 regiones (Figura 1) y 28 áreas numeradas consecutivamente (Figura 2). Para la localización precisa de áreas normales y anormales, SACE incorpora un sistema de coordenadas simples basado en la identificación de marcas naturales, paredes, curvaturas y puntos de referencia anatómicos endo-luminales (Tabla 1). Antes del examen, nosotros recomendamos el uso rutinario de pre-medicación endoluminal, con el objetivo de remover el moco adherido a la mucosa y disolver burbujas de saliva14,15. La cromoendoscopia electrónica tipo NBI o FICE es altamente recomendada para evaluar la mucosa del la faringe y el esófago, con el objetivo de aumentar la probabilidad de detectar un tumor escamocelular temprano16,17. La capacitación en SACE requiere de un curso intensivo teórico práctico dado por expertos, los cuales son ofrecidos en EmuraCenter, Bogotá, Colombia tres veces al año18. Después de obtener un adecuado entendimiento de la nomenclatura alfanumérica endo-luminal, se estima que se requiere de mínimo de 10 exámenes supervisados por un experto en SACE. El tiempo mínimo estimado de duración de SACE para lograr el registro adecuado de las 28 áreas, es de aproximadamente tres minutos19. Se necesita tiempo adicional para toma de biopsias y para el registro fotográfico de anormalidades. Utilizando SACE como método de tamización, Emura et al., reportaron una frecuencia de 2 CGTs (0,3%) por cada 650 voluntarios sanos entre los 50 y 70 años de edad residentes en Bogotá, Colombia19. Esta frecuencia es casi idéntica a la proporción de CGT reportada en China, que identificó 632 (0,31%) CGTs en 198.823 hombres habitantes de una zona de alto riesgo para cáncer gástrico8. No obstante, para establecer diferencias estadísticas entre SACE y la EGD, la realización de estudios de validación son necesarios para obtener conclusiones definitivas. En un futuro y en caso de ser probado y validado internacionalmente, SACE podría cambiar significativamente la forma en que se realiza la endoscopia del tracto digestivo superior.
Endoscopia sistemática alfanumérica codificada (SACE)
1-Hipofaringe. 2- Esófago tercio superior. 3- Esófago tercio medio. 4- Esófago tercio inferior. 5- Hiato esofágico visión directa. 6- Anillo pilórico. 7- Antro, cara anterior. 8- Antro, curva menor. 9- Antro, cara posterior. 10- Antro, curva mayor. 11- Tercio distal cara anterior. 12- Tercio distal, curva menor. 13- Tercio distal, cara posterior. 14- Tercio distal, curva mayor. 15- Tercio medio, cara anterior. 16- Tercio medio, curva menor. 17- Tercio medio, cara posterior. 18- Tercio medio, curva mayor. 19- Tercio superior, curva mayor. 20- Tercio superior, cara antero-posterior. 21- Fornix. 22- Cardias en retroflexión. 23- Curva menor, tercio superior. 24- Curva menor, tercio medio. 25- Curva menor, tercio inferior. 26- Ángulo gástrico. 27- Bulbo duodenal. 28- Segunda porción duodenal.
Anatomía endoluminal del tracto digestivo superior
| Región | Área | Código alfanumérico |
|---|---|---|
| Faringe | Hipofaringe | P1 |
| Esófago | Tercio superior | E2 |
| Tercio medio | E3 | |
| Tercio inferior | E4 | |
| Hiato esofágico | E5 | |
| Antro | Anillo pilórico | A6 |
| Pared anterior | A7 | |
| Curvatura menor | A8 | |
| Pared posterior | A9 | |
| Curvatura mayor | A10 | |
| Cuerpo gástrico, Tercio inferior | Pared anterior | L11 |
| Curvatura menor | L12 | |
| Pared posterior | L13 | |
| Curvatura mayor | L14 | |
| Cuerpo gástrico, Tercio medio | Pared anterior | M15 |
| Curvatura menor | M16 | |
| Pared posterior | M17 | |
| Curvatura mayor | M18 | |
| Cuerpo gástrico, Tercio superior | Curvatura mayor | U19 |
| Pared ántero-posterior | U20 | |
| Fornix | U21 | |
| Cardias | U22 | |
| Curvatura menor | Tercio superior | Lc23 |
| Tercio medio | Lc24 | |
| Tercio inferior | Lc25 | |
| Ángulo | Lc26 | |
| Duodeno | Bulbo | D27 |
| Segunda porción | D28 |
La endoscopia terapéutica desempeña un papel fundamental en el tratamiento del CGT. Históricamente, los métodos para curar el CGT han incluido fulguración, uso de radiación láser, coagulación eléctrica e inyección local de agentes antitumorales. En 1984, la técnica “strip biopsy” fue descrita como una extensión de la polipectomía endoscópica con asa, para remover pólipos del colon20. La disección endoscópica de la submucosa (ESD por su sigla en inglés), ha revolucionado el tratamiento mínimamente invasivo del CGT, permitiendo la extracción en bloque de tumores superficiales de cualquier tamaño y se ha convertido en una alternativa excelente a la cirugía convencional21. Comparado con la mucosectomía endoscópica convencional (EMR por su sigla en inglés), ESD tiene un riesgo más bajo de recurrencia local, y facilita el análisis histológico en un sólo bloque22. De amplia aceptación y uso en Asia, ESD ha ganado popularidad en occidente debido al aumento gradual en el diagnóstico de lesiones tempranas y por la disponibilidad reciente de instrumentos comerciales para endoterapia. Sin embargo, su aplicación ha sido limitada no sólo porque requiere alto nivel de habilidad endoscópica sino que genera más efectos adversos que EMR, aunque la mayor parte de estos pueden ser manejados exitosamente durante el procedimiento21. Resultados recientes han mostrado que tanto la ESD como la gastrectomía, tienen similar tasa de sobreviva y tasa libre de enfermedad a cinco años, sin embargo, ESD mostró menor tasa de eventos adversos post-operatorios23. El diagnóstico temprano y las diferentes técnicas endoscópicas para el tratamiento curativo del CGT con énfasis en ESD, son el foco principal de esta revisión.
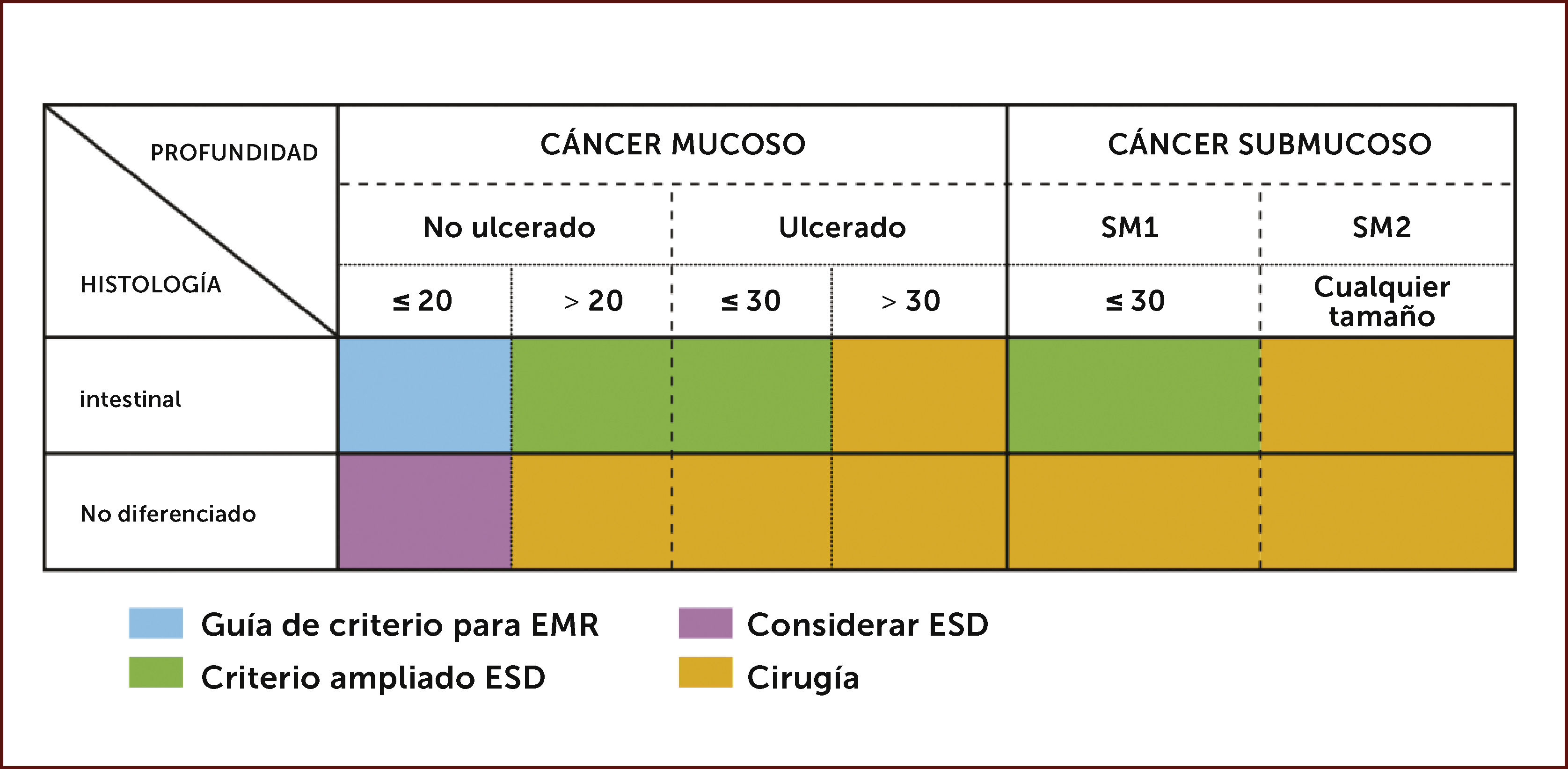
PRINCIPIOS DE RESECCIÓN ENDOSCÓPICACon el objetivo de determinar las variables clínico-patológicas asociadas a metástasis linfática regional, investigadores del Centro Nacional de Cáncer en Tokio, analizaron retrospectivamente 5.265 pacientes con CGT que se sometieron a gastrectomía con disección linfática ganglionar24. Según este estudio, ninguno de los 1.230 tumores diferenciados menores a 30mm con o sin úlcera, presentó invasión linfática regional (IC 95%, 0-0,3%), así como ninguno de los 929 tumores bien diferenciados de cualquier tamaño sin úlcera (IC 95%, 0-0,4%). Además, ninguno de los 145 tumores bien diferenciados menores a 30mm sin compromiso linfático o venoso que invadían la mucosa o la capa submucosa superficial (SM1: hasta 500μm desde la muscularis de la mucosa) presentó metástasis (IC 95%, 0-0.25%). En otro estudio realizado por los mismos autores, se encontró que la invasión linfática regional fue insignificante (IC 95%, 0-3,1%) en adenocarcinomas bien diferenciados con invasión SM1, menores a 30mm y sin invasión linfo-vascular. De lo anterior se concluye que, la linfadenectomía es innecesaria para tumores bien diferenciados que invaden la capa mucosa o la capa SM1 y que satisfacen los criterios previamente mencionados, constituyéndose esto en el principio para realizar tratamiento endoscópico al CGT25. Estudios recientes han reportado que tumores indiferenciados (como el carcinoma de células en anillo de sello) limitados a la capa mucosa, menores a 20mm y sin úlcera, también tienen un riesgo casi nulo de invasión linfática regional26.
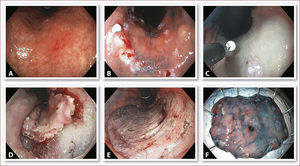
VALORACIÓN DEL MARGEN DE LA LESIÓNEl uso de cromo-endoscopia con índigo carmín 0,25% es determinante para identificar y definir adecuadamente el margen de un CGT. La inadecuada estimación del borde tumoral puede resultar en una resección incompleta y en una recurrencia local tan alta como del 30%27. La cromo-endoscopia se recomienda una vez que la lesión gástrica está identificada, para determinar el margen y estimar la profundidad de la lesión (intra-mucosa, submucosa o más avanzada)28 (Figura 3). NBI con magnificación no sólo es útil para definir los márgenes, sino también, para identificar los patrones vasculares de los tumores bien y mal diferenciados29.
RESECCIÓN MUCOSA ENDOSCÓPICA (EMR POR SU SIGLA EN INGLÉS)La EMR, también conocida como mucosectomía, es un procedimiento endoscópico seguro, pero generalmente, insuficiente para remover en bloque lesiones menores a 15mm. Los resultados indican que cuando se intenta remover estas lesiones, la probabilidad de resección en fragmentos es alta, produciendo un aumento en la recurrencia local. Además, la compleja reconstrucción del espécimen después de una resección en fragmentos imposibilita un adecuado análisis histológico y clasifica la resección endoscópica como no curativa24. Se han descrito varios tipos de EMR, como el EMR con capuchón transparente, EMR con ligadura, la técnica de levantar y cortar, y la mucosectomía simple.
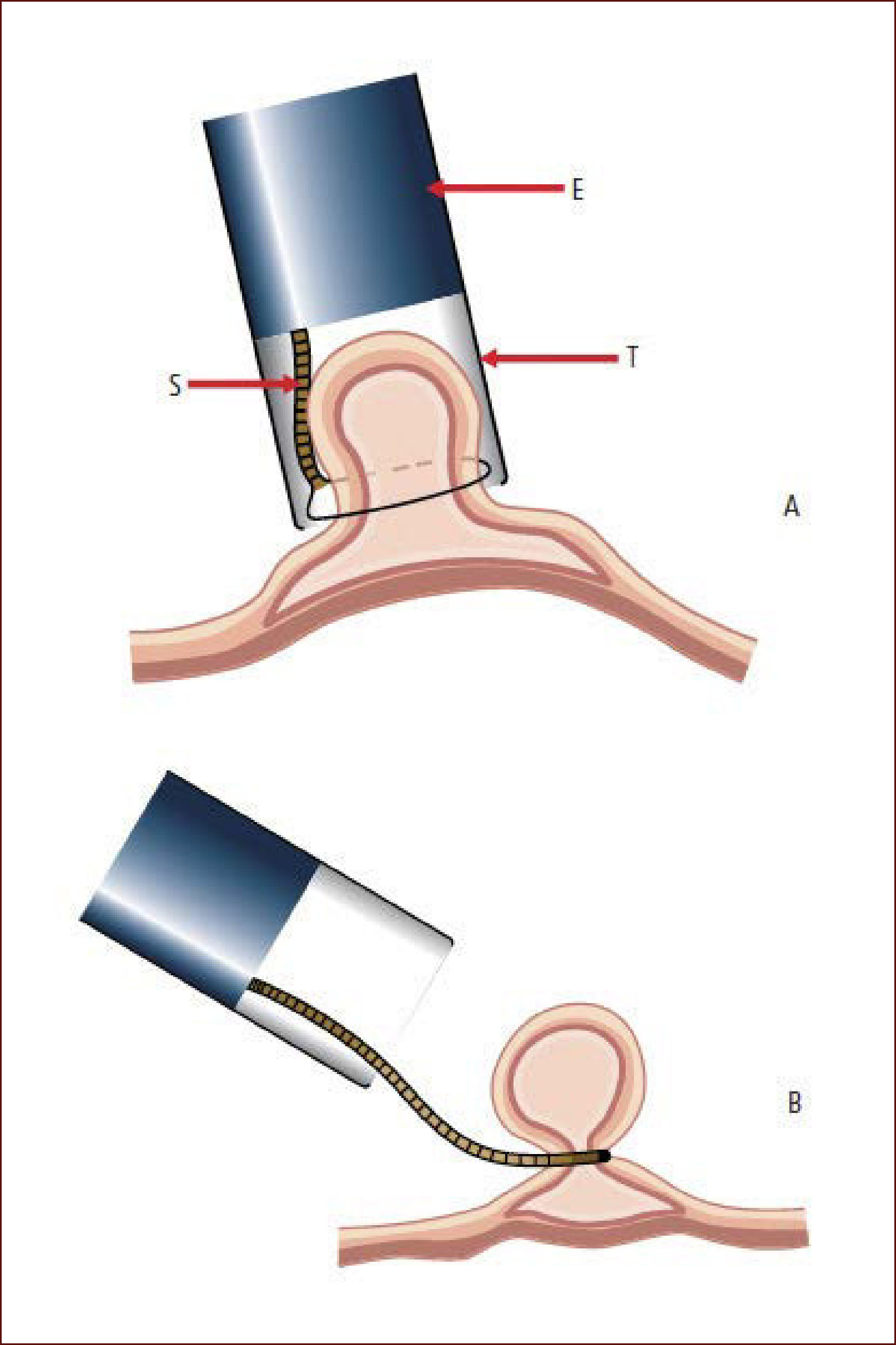
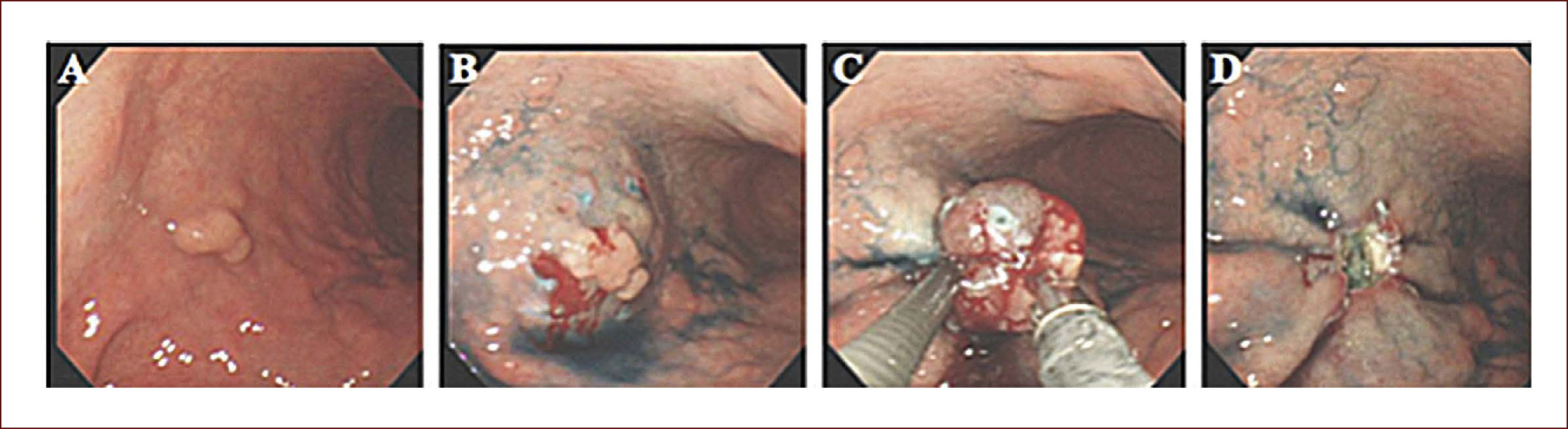
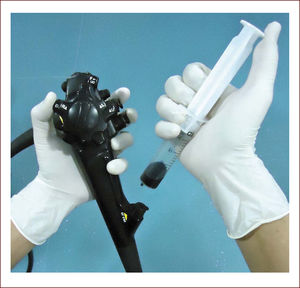
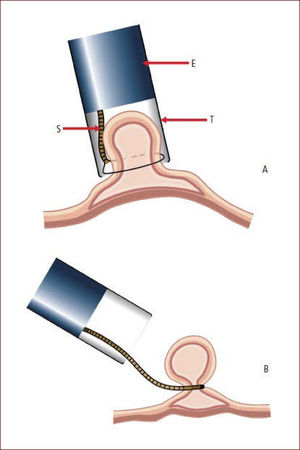
MUCOSECTOMÍA CON CAPUCHÓN (EMR-C)La EMR-C es un procedimiento técnicamente sencillo, utilizado con frecuencia en el tratamiento de lesiones pre-malignas y cáncer temprano del esófago30. Esta técnica requiere un capuchón de plástico transparente en el extremo distal del endoscopio. Después de marcar alrededor de la lesión, se procede a inyectar en la submucosa para levantar la lesión de la capa muscular. Este es un paso crítico ya que sin una adecuada elevación, la lesión no se puede succionar satisfactoriamente dentro del capuchón, aumentando el riesgo de perforación. Después de succionar la lesión, se libera el asa de polipectomía la cual estaba fijada previamente por dentro del capuchón. Por último, se reseca la lesión como en una polipectomía estándar (Figura 4).
Técnica de mucosectomía con cap
A. El endoscopio (E) se aproxima a la lesión y la succiona dentro del cap transparente (T) quedando la lesión por dentro del asa (S). B. La lesión es estrangulada y resecada con corriente electroquirúrgica. Diagrama modifcado de Tada et al20.
Limitaciones: la dificultad para la extracción en bloque de cualquier lesión mayor a 15mm; la dificultad para controlar el tamaño y la profundidad de la resección que dependen de la fuerza de la aspiración.
EMR CON LIGADURA (EMR-L)Esta simple técnica utiliza un equipo estándar de ligadura de varice y como tal, es la técnica más sencilla para endoscopistas con poca experiencia31. El tamaño máximo recomendado para una resección en bloque con la técnica de EMR-L es de 15mm, y se recomiendan otras técnicas para lesiones de mayor tamaño. Después de marcar alrededor de la lesión, la banda de plástico se libera con o sin inyección previa en la submucosa, y por último se realiza una polipectomía estándar (Figura 5). Limitaciones: es generalmente insuficiente para lesiones mayores a 15mm; la correcta colocación de la banda en torno a la lesión no siempre es fácil y requiere habilidad endoscópica.
TÉCNICA DE LEVANTAR Y CORTAREsta técnica descrita por Tada et al., es un procedimiento relativamente sencillo, pero requiere un endoscopio doble canal20. Después de marcar alrededor de la lesión e inyectar en la submucosa, tanto el asa de polipectomía como la pinza de biopsia, son avanzados a través de los canales del endoscopio. Después de levantar la lesión con el fórceps de biopsia, el asa se coloca cuidadosamente alrededor de la lesión, intentando que todas las marcas queden dentro del asa. El asa es liberada y por último, se realiza una polipectomía estándar (Figura 6). Limitaciones: requiere un endoscopio de dos canales y por tanto dos operadores. Se ha reportado una alta frecuencia de resecciones incompletas.
MUCOSECTOMÍA SIMPLEEs una técnica sencilla y de uso frecuente, que no requiere endoscopio de dos canales. Los pasos de esta técnica incluyen marcación peri-lesional, inyección en la submucosa y polipectomía estándar. Al no utilizar ligadura ni capuchón, esta técnica produce una alta frecuencia de resecciones incompletas y como consecuencia, no curativas. Limitaciones: es generalmente insuficiente lesiones menores a 15mm; las lesiones con fibrosis en la submucosa no levantan bien y así la probabilidad de resección incompleta y/o perforación es mayor.
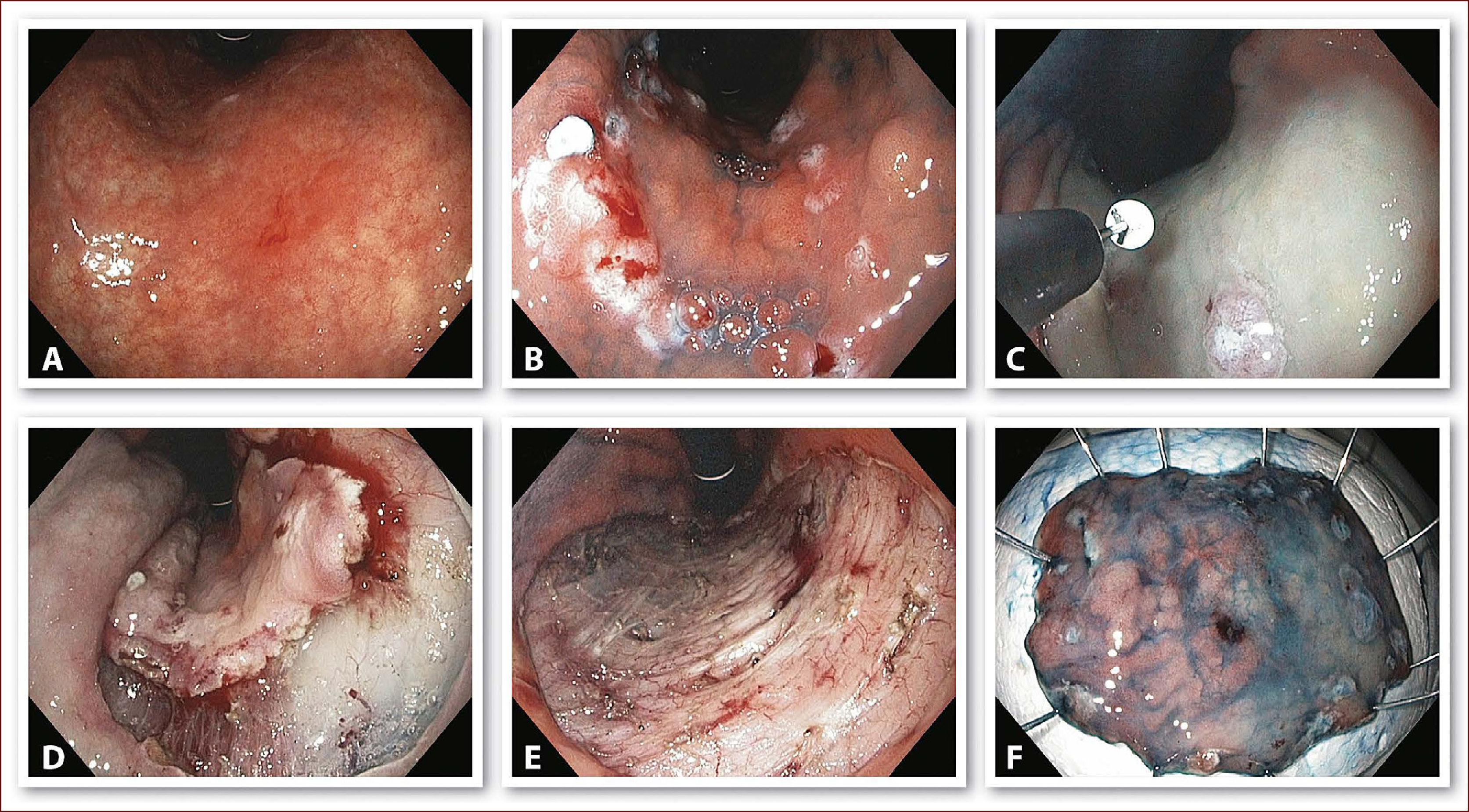
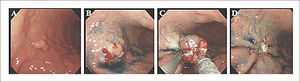
DISECCIÓN ENDOSCÓPICA DE LA SUBMUCOSAEsta técnica mínimamente invasiva, ha revolucionado el manejo del CGT23,26 y sus pasos incluyen marcación perilesional, precorte, incisión circunferencial, disección submucosa, hemostasia y fijación del espécimen18,21 (Figura 7). Brevemente, el margen de la lesión es identificado usando índigo carmín 0,25%, luego se marca el perímetro de la lesión a una distancia de 4 a 5mm del borde utilizando un bisturí de punta convencional. La inyección en la submucosa es un paso clave para separar la mucosa de la capa muscular, permitiendo una directa y clara visualización de la submucosa y de la línea de corte. Aunque el Glicerol (Chugai Pharmaceutical Co., Tokio, Japón)32 y otras soluciones más viscosas como la salina hipertónica y el sodio hyaluronate 0,4%33 se han reportado como útiles, nosotros recomendamos una solución de bajo costo compuesta por: 500mL de solución salina normal, adrenalina 1:500.000 y 4ml de índigo carmín 0,25%. Después de una generosa inyección en la submucosa, se realiza un pre-corte de la mucosa de 3mm de longitud, utilizando un bisturí de punta convencional y a 5mm aproximadamente por fuera de los puntos de marcación. Se pueden realizar uno o varios pre-cortes según la preferencia y habilidad del endoscopista. El pre-corte tiene riesgo de perforación cuando la inyección en la submucosa es inadecuada o se aplica excesiva tensión sobre la pared. La incisión circunferencial separa el tumor del tejido sano, exponiendo la capa submucosa. Con la lesión en plano horizontal, lo más recomendado es iniciar de distal a proximal. La disección de la submucosa separa el tumor de la pared gástrica, dejando la capa muscular expuesta. Se requiere un ajuste adecuado del sistema de electrocoagulación para realizar un adecuado corte, y reducir el riesgo de perforación y hemorragia. Usando el ERBE ICC-200, nosotros recomendamos Endo-corte 80 Watts para la disección submucosa, y Coagulación 40 Watts para la hemostasia. Después de terminar la resección del tumor, se recomienda hemostasia cuidadosa y coagulación de vasos visibles. Para facilitar un adecuado análisis histopatológico, el espécimen antes de su inmersión en formalina debe ser estirado sin dobleces, inspeccionado para la presencia de todos los puntos de marcación perilesional y finalmente, fijado en una lámina de icopor o corcho.
Técnica de disección endoscópica de la submucosa (ESD)
A. Lesión tipo IIc de 18mm y de bordes mal definidos, localizada en curva menor, tercio medio, área 24. B. Marcación perilesional a 5mm de la lesión usando un bisturí de punta convencional. C. Inyección en la submucosa con SSN, adrenalina e indigo carmine. D. Incisión circunferencial por fiera de los puntos de marcación usando el IT-Knife2. E. Disección de la submucosa dejando expuesta la capa muscular propia. F. Lesión de 40mm de diámetro fijada con alfileres antes de la inmersión en formaldehido. La histopatología desmostró displasia de alto grado con borde libres y sin invasion linfovascular.
El uso de insuflación con dióxido de carbono es altamente recomendado, pues mejora la tolerabilidad del paciente en procedimientos largos, y evita el neumo-peritoneo a tensión en casos de perforación41. El capuchón transparente puede asistir como un segundo brazo para mejorar la visualización de la línea de corte, reduciendo el riesgo de perforación. Después de resecar la lesión, la extracción de la pieza debe hacerse cuidadosamente utilizando una malla tipo Roth Net (US Endoscopy) para evitar el daño del espécimen durante la extracción (Figura 8). Antes de iniciar un procedimiento se recomienda tener entrenamiento en el manejo de accesorios para control de hemorragia y perforación tales como fórceps de cauterio y clips metálicos de variados, tamaños, y tenerlos siempre a disposición en la sala de procedimientos.
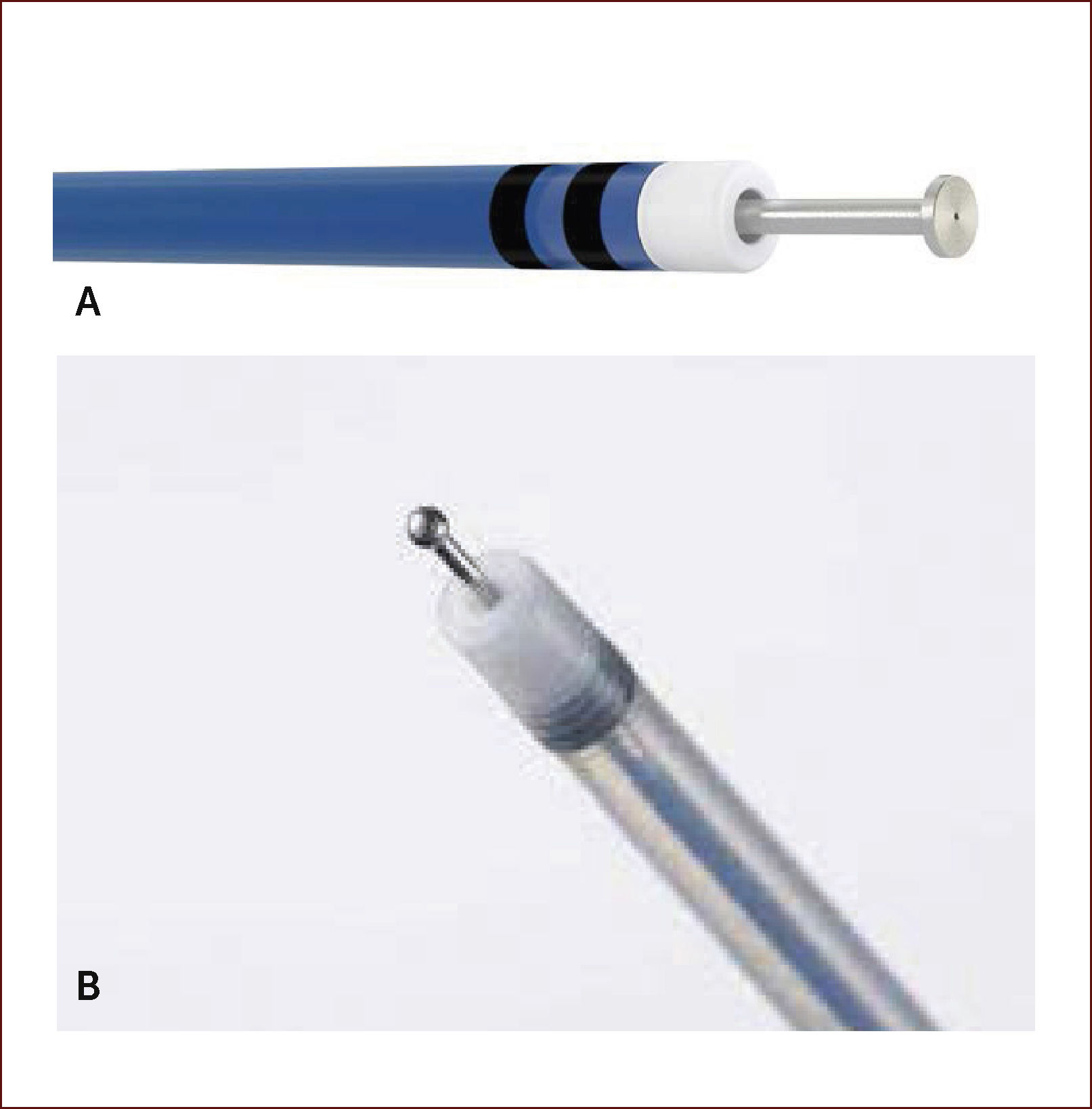
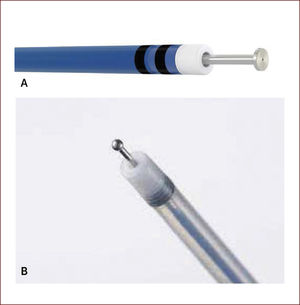
BISTURÍES ENDOSCÓPICOSActualmente se dispone de una variedad de bisturíes especializados para ESD dentro de los cuales se incluyen: IT-Knife2 (Olympus KD-611L)34, Dual Knife (Olympus KD-650L)34, y el Triangle Knife (Olympus KD-640L)34 (Figura 9). Otros bisturíes con capacidad para inyectar en la submucosa como el Flush Knife (Fujinon, Japan)35, y el Hybrid Knife (HK; Erbe Elek-tromedizin GmbH, Tuebingen-Germany)36, tienen la potencial ventaja de disminuir el tiempo operatorio (Figura 10). La elección del bisturí depende de la preferencia y habilidad del cirujano, como de la situación particular de cada procedimiento. En general y cuando es posible, el uso de sólo bisturí es recomendable para disminuir el costo total del procedimiento y mejorar la relación costo/efectividad. Nosotros recientemente reportamos una serie de 54 ESDs para CGT bien diferenciado, en donde tanto la incisión circunferencial y la disección submucosa se realizaron con un sólo bisturí (IT-Knife2) en todos los procedimientos, y se obtuvieron resultados similares a centros de referencia en Japón18.
INDICACIONES PARA ESD Y CRITERIOS AMPLIADOSLos criterios generales para la resección endoscópica en CGT propuestos por la Asociación Japonesa del Cáncer Gástrico incluyen:1 adenocarcinoma diferenciado;2 cáncer intramucoso;3 menor a 20mm y4 sin presencia de úlcera21. Los criterios ampliados para ESD en CGT fueron propuestos en el Centro Nacional de Cáncer en Tokio y se basan en la muy baja probabilidad de metástasis a ganglios linfáticos regionales de un gran número de casos T1 que fueron llevados a gastrectomía. Los criterios ampliados incluyen lesiones mayores a 21mm y lesiones ulceradas, antes resecadas por cirugía. En 2010, Gotoda y cols., reportaron la supervivencia de pacientes tratados con ESD, usando tanto las indicaciones originales como las indicaciones ampliadas. No se encontraron diferencias significativas en la sobrevida entre los grupos, concluyendo que los pacientes que se someten a ESD usando los criterios ampliados tienen la misma tasa de sobrevida que los tratados según los criterios originales37. Por otra parte, un estudio reciente japonés reportó que los tumores no diferenciados, incluyendo el carcinoma con células en anillo de sello y los mal diferenciados limitados a la capa mucosa, menores a 20mm y sin úlcera, tienen riesgo insignificante de invasión linfática ganglionar. Los excelentes resultados a largo plazo de ESD para CGT no diferenciado con los criterios de inclusión ya mencionados, se publicaron recientemente por Abe y Cols.38. Aunque un consenso global aún no se ha alcanzado, los tumores no diferenciados también pueden ser incluidos como indicación de ESD y no requerir la cirugía convencional (Tabla 2).
RESULTADOS DE EMR VS. ESDEMR es un procedimiento mínimamente invasivo y seguro, pero insuficiente para la resección en bloque de cualquier lesión menor a 15mm. Por otra parte, ESD tiene una frecuencia más alta de complicaciones y requiere más destreza y habilidad técnica. Estos resultados sugieren que, la EMR aumenta la posibilidad de realizar una resección en fragmentos debido a las limitaciones técnicas del procedimiento. Como es conocido, cuando se realiza una resección en fragmentos, la curabilidad de la resección no se puede determinar en el examen patológico, dejando el resultado final como resección no curativa39. Un estudio japonés que comparó EMR con ESD reportó una mayor tasa de resecciones completas curativas con ESD que con EMR en lesiones mayores a 20mm y en lesiones localizadas en el tercio superior del estómago40. Este estudio también demostró que la resección en bloque es superior a la resección en fragmentos, porque reduce la recurrencia local y facilita el análisis histopatológico. Adicionalmente, un estudio coreano de 402 resecciones gástricas reportó que la resección en fragmentos presentó una tasa significativamente más alta de recurrencia local (IC 95%, P= 0.001) comparado con la resección en bloque. Este estudio demostró también que las lesiones mayores a 20mm fueron asociadas a resecciones incompletas y recurrencia local41.
FUNDAMENTOS ESPACIALES BÁSICOSA fin de vencer la dificultad técnica en ESD y reducir al riesgo de eventos adversos, la aplicación de los conceptos espaciales endoluminales, es un determinante principal. Descritos originalmente por Emura y Cols., los conceptos espaciales constituyen los fundamentos básicos técnicos para realizar con éxito una ESD y son: horizonte, distancia, tensión, dirección y secuencia42.
HorizonteEl horizonte es la colocación apropiada de la cámara con relación al eje horizontal de la lesión. La posición apropiada en horizonte, localiza la lesión encima de la línea de corte entre las 3 y las 6 del reloj, y la capa muscular propia en la parte inferior. Se recomienda mantener esta posición en todos los momentos del procedimiento.
DistanciaLa distancia es el espacio físico entre el lente y la línea de corte. En bisturíes de movimiento lateral como el IT-Knife2 se recomienda una distancia entre 0.5-20mm. La entrada del bisturí a esta distancia permite un control preciso de la dirección del corte. Una distancia más larga es necesaria para lesiones localizadas en la curvatura menor. En el caso de bisturíes con movimiento de proximal a distal como el Dual Knife, el Flush Knife o el bisturí de punta convencional, la distancia óptima es de unos pocos milímetros. En estos casos, la reducción al mínimo de la longitud del bisturí es un principio general que disminuye el riesgo de perforación.
TensiónLa tensión es la fuerza del bisturí sobre el tejido submucoso, la cual se obtiene con la adecuada manipulación de rueda grande y de la rueda pequeña del endoscopio (mano izquierda) y del eje del tubo endoscópico (mano derecha). La tensión aplicada es la mínima necesaria para conseguir un corte de 1 a 3mm en la submucosa y puede ser aplicada en cualquier dirección.
DirecciónLa dirección es la posición espacial hacia donde el bisturí es dirigido. La dirección es determinada por el examinador después de aplicar tensión sobre el tejido submucoso y antes del corte. Utilizando un reloj imaginario, la dirección del corte va de las tres a las nueve horas, pero puede ir en una dirección diferente, siempre y cuando ésta sea paralela a la muscular propia.
SecuenciaEs la manera como se debe pisar el pedal del electro coagulador. Para ESD en estómago, nosotros sugerimos la secuencia 1, 2, 3 que consiste en 1 corte, durante 2 segundos por 3 veces consecutivas. Esta secuencia optimiza el tiempo del procedimiento y proporciona estrategia en la disección, minimizando el riesgo de perforación.
Fundamentos visuales básicos durante ESDAdemás de los principios espaciales, los fundamentos visuales básicos durante ESD, también contribuyen a minimizar las complicaciones y mejoran la eficacia del procedimiento. Primeramente, para lograr una imagen más clara en el monitor, nosotros recomendamos limpiar el lente del endoscopio antes del procedimiento con una solución comercial desempañante de uso común. Durante el procedimiento, el reconocimiento de vasos sanguíneos nutricios y de grueso calibre en la SM es determinante para evitar el sangrado. Estos vasos pueden ser cauterizados con electrocoagulación usando el bisturí o una pinza tipo grasper. Es necesario reconocer cuándo inyectar en la submucosa y cuánto es suficiente. Como principio básico, se debe inyectar cuanto sea necesario para ver adecuadamente la línea de corte en la submucosa. Finalmente, el uso adecuado de la irrigación de agua del endoscopio es crítico para maximizar la visualización con un lente limpio.
RESULTADOS DE ESD EN JAPÓNEn la serie japonesa más grande, se reportaron 1.033 casos de ESD en 945 pacientes21. La tasa de resección en bloque fue de 98% (1.008/1.033) y la frecuencia total de resecciones con márgenes negativos fue de 93% (957/1.033). Sin embargo, la tasa de resección con márgenes negativos disminuyó al 86% (271/314) en lesiones menores a 21mm y al 89% (216/243) en lesiones ulceradas. En términos de sobrevida del CGT de tipo intestinal, un estudio de la Universidad de Tokio con 276 pacientes reportó una supervivencia total a 5 años de 96.2% y una sobrevida libre de enfermedad del 100%43. Estas cifras muestran que la sobrevida de pacientes tratados con ESD es comparable a la gastrectomía con las ventajas considerables de ESD, tales como: preservación del órgano y de la fisiología gástrica, menos estancia hospitalaria, mínima medicación post-operatoria y ausencia de incisiones en piel. En un reciente estudio japonés de 589 casos de ESD de acuerdo a los criterios ampliados, Isotomo y cols., reportaron una sobrevida total y libre de enfermedad a 5 años de 97.1% y 100% respectivamente23. En relación al CGT no diferenciado, recientemente Abe y cols., reportaron 113 casos de ESD obteniendo una tasa de resección en bloque y en bloque con márgenes libres de 99% y 90.7% respectivamente. A cinco años de seguimiento, ninguno de los pacientes con resección curativa (46/79) tuvo recurrencia local o invasión linfática regional. La tasa de sobrevida total a cinco años después de resección curativa fue de 93.0%39.
RESULTADOS DE ESD EN OCCIDENTEEn Occidente, los reportes de ESD en CGT tienen un menor número de pacientes comparado con las series asiáticas. Las tasas de resección en bloque y curabilidad occidentales varían entre países, y en general son menores que las reportadas en Japón18,44–46. Recientemente reportamos la experiencia con ESD en 54 casos de CGT diferenciado siguiendo los criterios ampliados. La tasa de resección en bloque, en bloque con márgenes libres y resección completa curativa fue 96%, 92% y 84% respectivamente. Este resultado es muy similar a los resultados reportados por centros de referencia en Japón en el mismo tipo de lesiones, demostrando que en occidente sí se pueden obtener los mismos resultados de curabilidad que en Japón18.
TRATAMIENTO DE LAS COMPLICACIONESLas complicaciones más comunes de la ESD son sangrado tardío y perforación. En un estudio japonés con 1.033 casos se evidenció sangrado tardío en el 6% de los casos, todos manejados con éxito endoscópicamente21. Asimismo, en otras series japonesas todos los casos de sangrado durante el procedimiento fueron controlados con electro cauterización o solución de trombina rociada sobre la superficie de la lesión41. En general, todo sangrado durante una ESD debe ser tratado en el momento y con rapidez. Para localizar el origen del sangrado, es muy útil la irrigación de agua la cual se hace manualmente por el canal de trabajo del endoscopio, con el sistema de irrigación para limpieza del lente o con el sistema water-jet de algunos equipos. Los vasos de pequeño calibre son tratados generalmente con electro cauterización usando el bisturí para el procedimiento. Los vasos de gran calibre o los casos de sangrado activo generalmente requieren electro cauterización con fórceps u obliteración con clips metálicos. La frecuencia de perforación se ha reportado entre 3.6% a 4.7% en centros japoneses de referencia18. En casi todos los casos, el cierre endoscópico con clips metálicos se puede realizar con éxito.21 En un estudio japonés multicéntrico se reportó que la incidencia de perforación con ESD (3,6%; 11/303) fue significativamente mayor que con EMR (1,2%; 5/411). Todas las complicaciones fueron manejadas endoscópicamente, y no hubo mortalidad asociada40. A diferencia de EMR, las perforaciónes durante ESD suelen ser pequeñas. En caso de perforación utilizando insuflación con dióxido de carbono, la ausencia de neumo-peritoneo a tensión puede facilitar la continuación del procedimiento hasta completar la disección, y posterioriormente, reparar el defecto en la pared con clips metálicos. En perforaciones pequeñas endoscópicamente identificables, los clips metálicos son el método más aceptado de tratamiento. En perforaciones grandes y con epiplón intra-abdominal visible dentro del lumen, éste último puede ser traído a través del defecto realizando un cierre tipo “parche epiploico”47. La disponibilidad de clips más grandes como el “over the scope clip” y de dispositivos de sutura endoluminal, pueden proporcionar más herramientas para manejar las perforaciones agudas sin cirugía48. Después de realizar el tratamiento endoscópico de una perforación, idealmente se debe obtener una escanografía abdominal utilizando medio de contraste hidrosoluble para confirmar la ausencia de fuga. Las perforaciones gástricas asintomáticas que son reconocidas después de 12 horas por la presencia de aire libre en una escanografía o en radiografías, generalmente se pueden manejar de forma conservadora con restricción de la vía oral, sonda nasogástrica y antibióticos. Estas perforaciones también son conocidas como fugas de aire transmural. En un reciente estudio de 33 pacientes con este hallazgo, ninguno mostró evidencia clínica de peritonitis o requirió intervención quirúrgica. Doce pacientes (36%) presentaron 37,5°C de temperatura corporal, probablemente debido al efecto inflamatorio transmural similar al presentado en el síndrome post-polipectomía, y fueron manejados exitosamente sin cirugía49. En caso aparición de signos de peritonitis, el tratamiento quirúrgico debe ser altamente considerado. El reconocimiento tardío de una perforación gástrica en presencia de síntomas de respuesta inflamatoria sistémica, está generalmente asociado a peritonitis causada por filtración de contenido intestinal a la cavidad peritoneal. La escanografía abdominal permite la identificación de aire y líquido intra-abdominal. Estos pacientes generalmente requieren laparotomía, cierre de la perforación, lavado y drenaje de la peritonitis50.
CURVA DE APRENDIZAJE DE ESDLa ESD requiere un alto nivel de conocimientos técnicos y habilidades que hacen este procedimiento difícil para endoscopistas sin experiencia. Los endoscopistas que intentan aprender la técnica de ESD, deben adquirir conocimientos avanzados en signos endoscópicos de invasión tumoral y en técnicas de imagen avanzada, con el objetivo de reconocer las lesiones tempranas e identificar sus márgenes. Según un estudio reciente, antes de iniciar el entrenamiento en ESD, se recomienda tener habilidad endoscópica en detección y caracterización de lesiones, así como en la capacidad de realizar procedimientos endoscópicos terapéuticos incluyendo, hemostasia, poli-pectomía, y EMR51. Los médicos que planeen aprender la técnica de ESD deben adquirir experiencia en el manejo de hemorragia y en el cierre de perforaciones. Es altamente recomendable que se realicen primero cursos teórico prácticos supervisados por expertos tanto en modelos ex vivo como en modelos en vivo, seguido de observación y ayudantía en casos de ESD en pacientes. Este entrenamiento básico debe ser seguido de autoestudio y de práctica exitosa en modelos ex vivo y en vivo en la instituciones de origen antes de realizar ESD en pacientes. Aunque los modelos vivos son más costosos y requieren protocolos especiales, la experiencia de realizar ESD en un modelo vivo es invaluable, ya que ofrece la oportunidad no sólo de practicar los conceptos básicas de la técnica, sino también de tratar los eventos adversos52. La cantidada mínima de procedimientos para obtener la habilidad necesaria en ESD no se ha establecido concretamente, sin embargo en Japón, reportes indican que al menos 30 casos exitosos son requeridos para lograr resultados óptimos53. Idealmente, el entrenamiento en ESD debe ser obtenido en centros de formación respaldados por instituciones académicas, bajo la dirección de expertos calificados con reconocidas publicaciones científicas. Estas bases educacionales podrían aumentar no sólo la frecuencia, sino también, la tasa de curabilidad del CGT en el mundo.
PERSPECTIVA FUTURAEn el futuro cercano, es muy probable que con la aplicación de criterios de calidad en la EGD, y con el desarrollo de la alta resolución en imágenes, el CGT sea diagnosticado más frecuentemente. La adopción de SACE como un método de examen completo seguramente aumentará las tasas de detección de CGT, especialmente en zonas de alto riesgo de la enfermedad. En un futuro se espera el aumento gradual en la utilización de la ESD por jóvenes endoscopistas, resaltando que más importante que realizar este procedimiento, es realizarlo con una alta tasa de resección en bloque con margen libre, ofreciendo al paciente una mayor probabilidad de curación. Para concluir, el tratamiento endoscópico del CGT iniciado por endoscopistas japoneses, ha revolucionado el manejo global de esta enfermedad y constituye una excelente alternativa a la cirugía convencional.
Para ofrecer atención de alto nivel en gastroenterología y reducir la mortalidad por cáncer gástrico, la aplicación de altos estándares en el diagnóstico, la cuidadosa selección de los casos, y el adecuado entrenamiento en ESD, constituyen importantes desafíos de la endoscopia en Latino América y el mundo.
Los autores agradecen la invaluable contribución de Anna Shiwa en la edición y revisión de este manuscrito. Este trabajo fue apoyado en parte por Plan para el Control del Cáncer en las Américas de Emura Foundation for the Promotion of Cancer Research.
Los autores declaran no tener conflictos de interés, en relación a este artículo.
Las imágenes de este articulo han sido autorizadas por el paciente para su publicación.