El estudio del paciente con derrame pleural requiere un meticuloso análisis de la historia clínica, del líquido pleural y, frecuentemente, de la realización de una biopsia pleural. Actualmente es posible realizar varios procedimientos en un mismo tiempo para agilizar el proceso diagnóstico e idealmente en forma ambulatoria. El presente artículo pretende describir el estado del arte en relación al proceso diagnóstico.
The diagnostic approach in patients with pleural effusion requires considering clinical aspects, fluid analysis, and, often, pleural biopsy. Currently, several procedures con be performed at the same time to speed up the diagnostic process, ideally in an outpatient setting. This article aims to describe the state of the art with regards to the diagnostic process.
El derrame pleural (DP) se define como la acumulación anormal de líquido en la cavidad pleural. La cuantía puede ser variable y se reconocen hasta 60 causas diferentes. Se estima que la incidencia del DP está en aumento debido al incremento de longevidad de la población y al hecho que muchas personas conviven con enfermedades crónicas y cáncer1. Existen pocos estudios epidemiológicos en relación a las etiologías del DP, y la mayoría son retrospectivos. Porcel et al, en el año 2014, en una revisión retrospectiva de 3 000 toracocentesis consecutivas en 19 años, establece que las causas más frecuentes y que dan cuenta del casi 75% de los derrames pleurales son: la insuficiencia cardíaca (IC), el derrame pleural maligno (DPM), el derrame paraneumónico y el derrame por tuberculosis pleural2. Reconocer la etiología es difícil ya que la cavidad pleural no tiene acceso directo, pero es fundamental, ya que de ella depende el tratamiento. Para lograr determinar la etiología, es necesario hacer un análisis detallado de la semiología, de los exámenes imagenológicos, estudiar el líquido pleural y en algunas oportunidades es necesario hacer seguimiento clínico3. Es muy frecuente tener que tomar biopsias a la pleura, siendo mandatorio ante la sospecha de cáncer. Actualmente, gracias al desarrollo de unidades especializadas en patología pleural y al uso del ecógrafo por parte de los neumólogos, es posible realizar tanto procedimientos diagnósticos combinados en un mismo tiempo como terapéuticos, de forma ambulatoria, agilizando el proceso diagnóstico, evitando hospitalizaciones o reduciendo la estadía hospitalaria4. Esto es lo que se considera el abordaje moderno del paciente con DP.
Clínica del derrameUna detallada historia y examen físico permite aproximarnos al diagnóstico diferencial. Es importante evaluar el estado general del paciente, preguntar acerca de enfermedades previas, concomitantes, medicamentos que usa, hábito tabáquico, exposición a asbesto e historial laboral. Algunos pacientes tienen manifestaciones clínicas derivadas de la enfermedad de base y en otros hay síntomas propios del DP, y por último hay pacientes que son asintomáticos en los que el derrame es un hallazgo imagenológico. Los síntomas habituales derivados del DP son la disnea, que se explica por la alteración de la mecánica respiratoria y en especial de la movilidad del diafragma, el dolor con características pleuríticas secundario a la inflamación de la pleura parietal, dolor sordo por compromiso tumoral y la tos seca posiblemente secundaria a la compresión pulmonar5. En el examen físico pueden encontrarse signos propios de la enfermedad de base, pero por la sola presencia del derrame puede haber disminución de las vibraciones vocales, matidez, a veces egofonía y pectoriloquia áfona. La presencia de frotes pleurales puede ser un hallazgo en las etapas iniciales.
En el sitio web sobre enfermedades respiratorias inducidas por fármacos (https://www.pneumotox.com) es posible revisar la asociación entre el uso de medicamentos con DP. Actualmente, los medicamentos más asociados con DP son los inhibidores de tirosinaquinasa6.
ImágenesRadiografía de tóraxLa radiografía de tórax, aunque tiene baja sensibilidad y especificidad, suele ser el examen inicial dada su accesibilidad y bajo costo. En la radiografía de tórax es posible visualizar el derrame con al menos 200ml en la proyección postero anterior y 50ml en la proyección lateral5. Los derrames pueden estar libres o loculados y ser de cuantía variable, desde escaso contenido hasta derrames masivos con desplazamiento del mediastino7.
Ecografía torácicaLa ecografía torácica es un examen de bajo costo, ampliamente disponible, que no emite radiación ionizante y que puede ser realizado por neumólogos al lado de la cama del enfermo. Permite visualizar el derrame desde los 5ml, cuantificarlo, ver tabicaciones, diferenciarlo de masas y guiar diversos procedimientos; como la pleurocentesis, instalación de tubos de drenaje, toma de biopsias pleurales y toracoscopía8. También tiene utilidad al permitir evaluar hallazgos sugerentes de malignidad, como la presencia de nodulaciones en la pleura diafragmática y engrosamiento de la pleura visceral9. Además, permite evaluar la presencia de vasos intercostales y la consolidación pulmonar subyacente. Con esta técnica es posible predecir la presencia de pulmón no expansible. Siempre debería realizarse previo a cualquier procedimiento. Su uso disminuye significativamente el riesgo de pleurocentesis frustras y el de complicaciones posterior a procedimientos pleurales8.
Tomografía computada de tórax (TAC)La TAC es el examen de elección para evaluar patología pleural10. Permite examinar al mismo tiempo el espacio pleural, el parénquima pulmonar y el mediastino. Es debatible si hacerla antes o después de una pleurocentesis ya que al drenar el derrame es posible visualizar mejor el parénquima pulmonar, pero la presencia de derrame permite visualizar mejor la pleura y realizar intervenciones. En la evaluación del paciente con derrame, la TAC se realiza con contraste en fase venosa (60-90 segundos posterior a la administración del contraste). Sin embargo, algunos autores sugieren un bolo dual o prolongado para obtener también cortes en fase arterial y poder así evaluar la presencia de tromboembolismo, el cual es causa de DP en hasta el 5% de los pacientes11.
Cuando hay sospecha clínica de un DPM, se sugiere realizar una TAC de tórax, abdomen y pelvis6. Hay hallazgos sugerentes de patología maligna y otros de patología benigna. Algunos hallazgos que son muy específicos, pero poco sensibles para el diagnóstico de DPM, son el compromiso nodular de la pleura (especificidad 87-100%), el engrosamiento >1cm de la pleura parietal (especificidad 64-94%), el engrosamiento circunferencial de la pleura (especificidad 63-100%) y el engrosamiento de la pleura mediastínica (especificidad 83-97%)12. En un estudio de 370 pacientes, donde se realizó TAC previo a toracoscopía y biopsia pleural que confirmó malignidad, el TAC de tórax mostró una sensibilidad de 68%, especificidad 78%, con un valor predictivo negativo 64,9%, de modo que el uso de TAC no permitiría descartar el origen maligno del derrame13. Porcel et al. diseñó y validó un score basado en la TAC que permite predecir la etiología maligna del derrame con una sensibilidad de 88% y especificidad 94% basado en 3 elementos: 1) la presencia de lesiones pleurales ≥1cm; 2) la presencia de metástasis hepáticas o masas abdominales o masa o nódulo pulmonar y; 3) la ausencia de loculaciones pleurales, derrame pericárdico o cardiomegalia14.
En el empiema se puede observar captación del contraste y engrosamiento en la pleura parietal y visceral, con burbujas de aire en el interior, hipertrofia de la grasa extrapleural >2mm y aumento de su densidad. De igual modo se puede observar loculación del líquido pleural. La TAC también permite diferenciar abscesos pulmonares del empiema, ya que en este último se desplaza y distorsiona el parénquima pulmonar creándose un ángulo obtuso con la pared torácica7.
Tomografía por emisión de positrones/tomografía computada (PET/CT)La combinación de la tomografía por emisión de positrones con la tomografía computada (PET/CT) permite visualizar tejido metabólicamente activo. El PET/CT ha sido propuesto como una técnica de imagen que permite diferenciar entre patología pleural benigna y maligna, con sensibilidad 86-95% y especificidad 61-82%. Tiene, sin embargo, falsos positivos en procesos infecciosos/inflamatorios como, por ejemplo, en las infecciones pleurales y pleurodesis previa. Puede presentar falsos negativos en el caso de un mesotelioma epitelial. Su uso no es de rutina en el paciente con DP7. Puede entregar información en relación al pronóstico y respuesta a terapia en el DPM y puede servir para definir el lugar de biopsia pleural ante la sospecha de malignidad10,15,16.
PleurocentesisEl estudio del líquido pleural debe ser exhaustivo y oportuno, ya que la tardanza en el diagnóstico, dependiendo de la etiología, puede aumentar el riesgo de morbimortalidad17. Es ampliamente sabido que el pronóstico de vida en el DPM es bajo, sin embargo, también lo es en algunos derrames pleurales benignos. La mortalidad a un año se estima en 50% para la IC, 46% en insuficiencia renal y 25% cuando el DP se asocia a enfermedad hepática18.
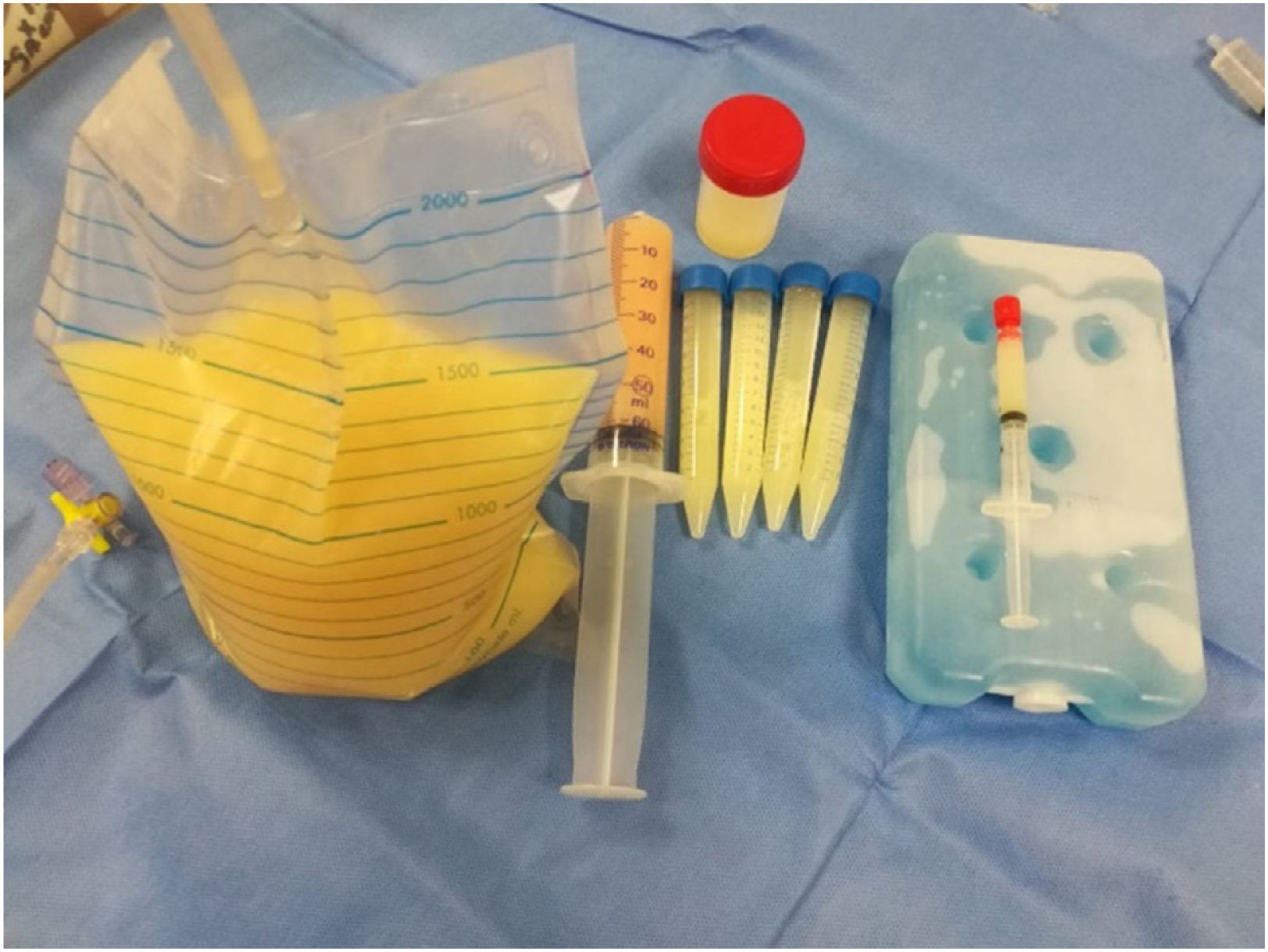
La pleurocentesis se debe realizar en todo paciente con DP salvo en IC evidente. Igual debería hacerse en estos pacientes si el DP no es homogéneo o si hay fiebre o sospecha de otra etiología causal. Otra excepción a la pleurocentesis es cuando el DP es muy pequeño, menor a 1cm desde la pared torácica medido en la ecografía, ya que en esta última situación aumenta el riesgo de neumotórax iatrogénico19. La pleurocentesis siempre debe realizarse inmediatamente posterior a la evaluación ecográfica y puede efectuarse en forma segura mediante aspiración manual o a caída libre por gravedad20. Debe realizarse a más de 10cm lateral de la línea medio espinal y por sobre la costilla para evitar puncionar los vasos intercostales que inicialmente pueden correr por el medio del espacio intercostal para luego posicionarse bajo la costilla21. La pleurocentesis puede ser con fines diagnósticos y/o terapéuticos. Se necesitan al menos 50ml para la pleurocentesis diagnóstica y volúmenes mayores para la pleurocentesis terapéutica. Esta última pretende aliviar la disnea, evaluar tanto el pulmón subyacente como su expansión. Cuánto drenar dependerá de la presentación de algunos síntomas, los que orientan a una caída de la presión intrapleural a valores cercanos a -20 cmH2O, al riesgo de edema de reexpansión y a la presencia de un pulmón no expansible. Estos síntomas son el dolor torácico, malestar retroesternal o hipotensión. Es posible drenar grandes volúmenes, sin un tope máximo y en forma segura, mientras no aparezcan estos síntomas22. El riesgo potencial de una toracocentesis terapéutica es el edema ex vacuo, el cual es una rareza, con incidencia de 0,2 a 0,5% pero con mortalidad estimada en 20%. Como consecuencia, en algunos centros se utiliza la manometría pleural para establecer cuándo detener la pleurocentesis terapéutica, no obstante, no es un procedimiento de rutina23. En el primer acercamiento con el paciente es preferible hacer una pleurocentesis diagnóstica y terapéutica a la vez, de modo de evitar tener que repetir procedimientos en un mismo paciente disminuyendo los riesgos potenciales de complicaciones y las molestias que provoca. Además, se pueden evaluar el alivio de la disnea y la velocidad de reproducción del derrame. En la figura 1 se muestra el líquido pleural obtenido en una pleurocentesis diagnóstica y terapéutica.
Se debe observar el aspecto y olor del líquido. Cuando es hemorrágico puede ser un DPM, traumático o por un tromboembolismo pulmonar. Cuando es de aspecto lechoso puede ser un quilotórax o un empiema. Para diferenciarlos, debe centrifugarse la muestra. Si el sobrenadante persiste turbio, orienta a un quilotórax. La presencia de pus es diagnóstica de un empiema. El olor pútrido orienta a un empiema.
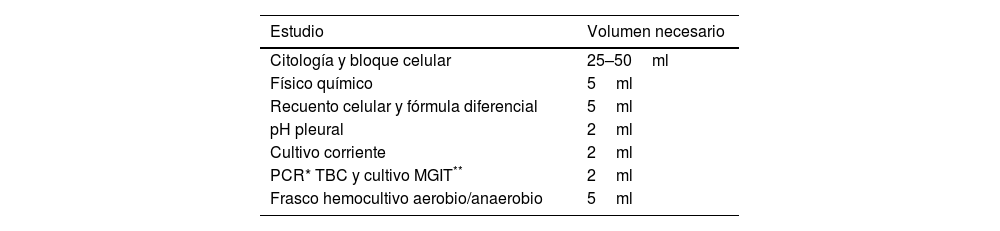
La muestra obtenida mediante la toracocentesis diagnóstica debe enviarse a estudio completo, evitando así eventuales nuevas punciones por falta de alguna determinación en particular. La muestra se depositará en tubos estériles para los distintos laboratorios. Los tubos para examen microscópicos deben contener anticoagulante ácido etilendiaminotetraacético (EDTA). Para los exámenes químicos no es necesario usar anticoagulantes ya que el análisis puede realizarse en el sobrenadante de muestras coaguladas24. Se sabe que hasta un 30% de los derrames tienen más de una etiología25. Se debe evaluar la fórmula diferencial del líquido, físicoquímico (LDH, proteínas, glucosa), pH pleural, citología y bloque celular, estudio de micobacterias (PCR y cultivo en MGIT) asociado a determinación de adenosina desaminasa (ADA) y estudio microbiológico (tinción de Gram y cultivo). En la tabla 1 se muestran los exámenes solicitados en forma rutinaria y el volumen mínimo necesario.
Pleurocentesis: exámenes solicitados y volumen mínimo necesario
Los derrames se clasifican en transudados y exudados en base a los criterios de Light26. En los transudados, la pleura suele estar sana y el derrame se debe a desequilibrios de las presiones hidrostáticas y coloidosmóticas, en cambio, en los exudados, la pleura suele estar enferma. Las principales causas de transudados y exudados se muestran en la tabla 2. Exudado se define por la presencia de cualquiera de los siguientes criterios: proteína pleural/proteína plasmática >0,5, LDH pleural/LDH plasmática >0,6 o LDH pleural >2/3 del límite normal en sangre. Ninguno de ellos debe estar presente para diagnosticar un transudado. Los criterios de Light exigen que se tome concomitantemente una muestra sérica; tienen una sensibilidad de 98% para identificar exudados, pero son menos específicos. Hasta un 25% de los transudados son falsamente clasificados como exudados. Esto ocurre principalmente en condiciones como la insuficiencia cardíaca por el uso de diuréticos. Para corregir esto, se pueden usar las gradientes de albúmina (albúmina plasmática – albúmina pleural >1,2mg/dl) o la gradiente de proteínas (proteína plasmática – proteína pleural >3,1mg/dl) para determinar que es un transudado. La determinación del péptido natriurético cerebral (BNP) y del fragmento aminoterminal del propéptido (NT-proBNP) en sangre (>1 500 pg/ml) permite identificar correctamente al 91% de los transudados por insuficiencia cardíaca que inicialmente se habían clasificado como exudado por los criterios de Light27. El uso del colesterol pleural >55mg/dl o de la lactato deshidrogenasa (LDH) pleural >67% del límite superior de la normalidad identifican exudados con 97% de sensibilidad27. Su uso podría estar indicado cuando no hay análisis sérico disponible.
Causas transudados y exudados
| Transudado | Exudado |
|---|---|
| Insuficiencia cardíaca | Infección espacio pleural: bacteriana/TBC pleural |
| Hidrotórax hepático | Neoplasias:Metastásica a pleura/primaria pleural |
| Síndrome nefrótico | Tromboembolismo pulmonar |
| Diálisis peritoneal | Mesenquimopatías: Artritis reumatoide/Lupus eritematosos sistémico/Síndrome de Sjögren/Amiloidosis/Poliangeitis con granulomatosis |
| Hipoalbuminemia | Patología abdominal y pelviana |
| Atelectasia | Linfangioleiomiomatosis |
| Pericarditis constrictiva | Radiación |
| Pulmón atrapado | Drogas |
| Obstrucción vena cava superior |
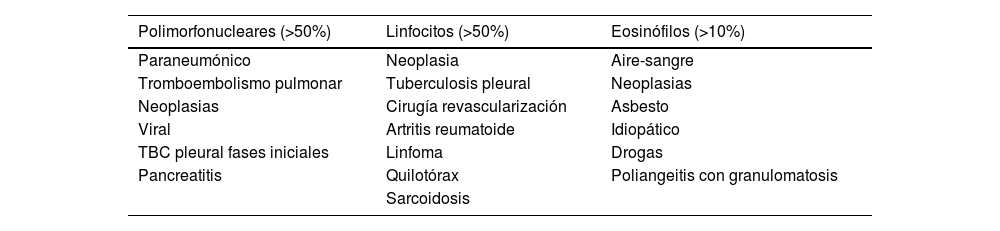
La fórmula diferencial orienta sobre la evolución temporal del proceso subyacente. El predominio celular de polimorfonucleares >50% orienta a procesos agudos, como pueden ser infecciones bacterianas, infección tuberculosa en etapas iniciales (menor a 2 semanas), el tromboembolismo pulmonar y la pancreatitis. El predominio linfocitario >50% refleja cronicidad, y se observa principalmente en el DPM, tuberculoso, linfoma y en la insuficiencia cardíaca. La presencia de eosinófilos >10% puede verse en el DPM, en derrames idiopáticos y en algunos derrames paraneumónicos. A mayor porcentaje de eosinófilos, 30-40%, menor probabilidad de una etiología maligna28. En la tabla 3 se muestran las principales causas de derrames de predominio polimorfonuclear, linfocitario y eosinofílico.
Principales causas de derrames de predominio polimorfonuclear, linfocitario y eosinofílico
| Polimorfonucleares (>50%) | Linfocitos (>50%) | Eosinófilos (>10%) |
|---|---|---|
| Paraneumónico | Neoplasia | Aire-sangre |
| Tromboembolismo pulmonar | Tuberculosis pleural | Neoplasias |
| Neoplasias | Cirugía revascularización | Asbesto |
| Viral | Artritis reumatoide | Idiopático |
| TBC pleural fases iniciales | Linfoma | Drogas |
| Pancreatitis | Quilotórax | Poliangeitis con granulomatosis |
| Sarcoidosis |
El estudio físico químico permite hacer determinaciones de glucosa, la cual debe ser similar a la del plasma, como también de LDH que es un marcador de inflamación. Las condiciones que suelen disminuir el valor de la glucosa bajo 60mg/dl y/o aumentar la de la LDH sobre 1 000 U/l son los procesos infecciosos bacterianos y tuberculosos, la artritis reumatoide y también el DPM. La elevación de proteínas se observa en los exudados, alcanzando valores muy elevados en la tuberculosis pulmonar29.
El pH pleural debe ser tomado en una jeringa con un baño de heparina y sin lidocaína. No deben quedar burbujas de aire en su interior y debe transportarse en frío al laboratorio. El análisis se hace en máquina de gases salvo que haya pus. Su determinación tiene un rol pronóstico en los pacientes con DPM, cuando el valor es inferior a 7,28 suele traducir la presencia de una enfermedad más extensa, probablemente con menor respuesta a la pleurodesis y pobre sobrevida30. En cambio, en los procesos infecciosos bacterianos del espacio pleural, un pH bajo 7,2 determina conducta; la instalación de un tubo de drenaje pleural31.
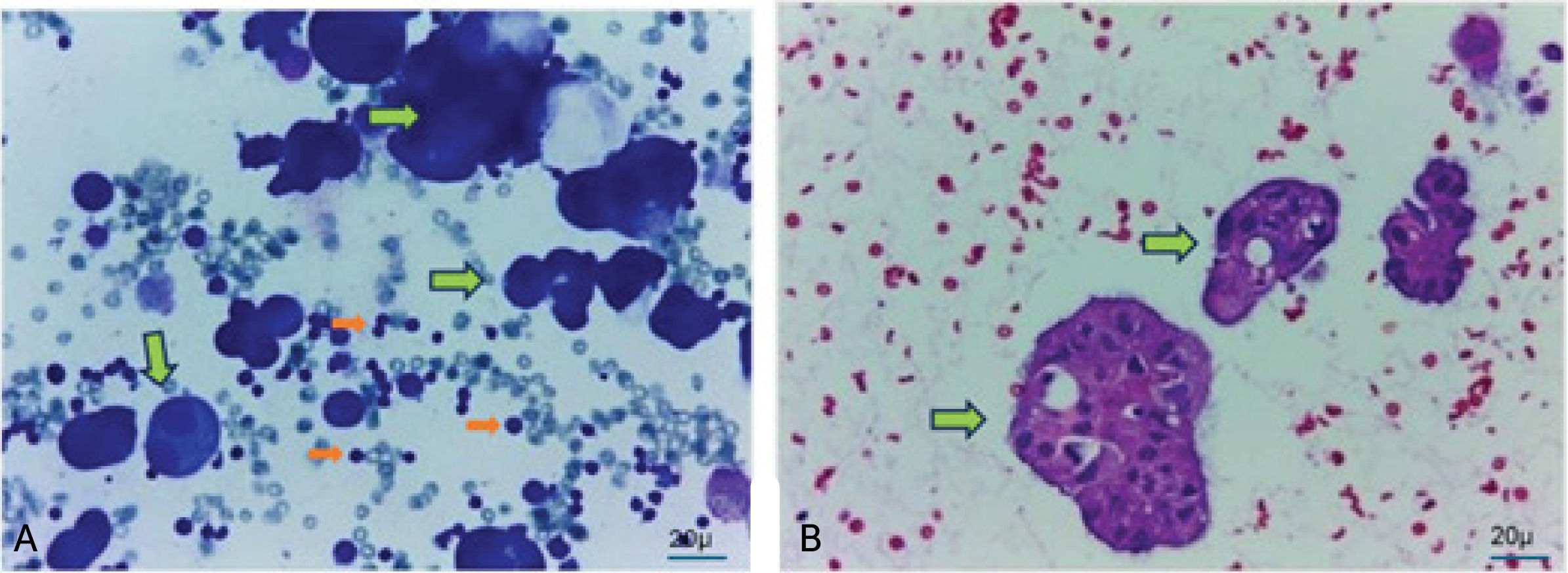
El estudio con citología del líquido es el examen más simple que permite confirmar un DPM. Idealmente deben enviarse entre 25 y 50ml de líquido para su análisis6. El tumor primario tiene incidencia en la positividad de la citología. Así, los cánceres de ovario y mama tienen rendimientos entre 90% y 80% respectivamente, el adenocarcinoma pulmonar un 60%, el carcinoma escamoso pulmonar un 30% y el mesotelioma cercano a un 10%32. Ante la sospecha de un DPM, repetir la citología luego de dos negativas no mejora el rendimiento. En estos casos se sugiere ir directamente a una biopsia pleural. El bloque celular es una técnica complementaria a la citología; permite aumentar el rendimiento diagnóstico ya que aumenta la celularidad de la muestra y facilita la observación de los detalles morfológicos de las células. Permite hacer múltiples secciones del material para tinciones especiales y técnicas de inmunohistoquímica33,34. En la figura 2 se observa una citología positiva de líquido pleural y el bloque celular de la misma. Frente al antecedente de exposición a asbesto, o cuando en las imágenes hay signos sugerentes de un DPM, es posible realizar en el mismo tiempo una pleurocentesis diagnóstica y biopsia pleural percutánea, obteniendo biopsias grandes que permitirán hacer los estudios moleculares y de inmunohistoquímica necesarios para poder determinar la mejor terapia en forma personalizada. Realizar ambos procedimientos en una sola sesión mejora el rendimiento en hasta un 83-90%, acelerando el proceso diagnóstico. Además, puede hacerse en forma ambulatoria favoreciendo la comodidad de los pacientes6. En los pacientes con DPM, el “LENT Prognostic Score for Malignant Pleural Effusion” es el primer índice pronóstico validado que permite predecir sobrevida. LENT utiliza las variables LDH (L) en el líquido pleural, la escala del Eastern Cooperative Oncology Group (ECOG) (E), la relación neutrófilos/linfocitos (N) en el suero, y el tipo de tumor (T)35. Estratifica a los pacientes en grupos de bajo, moderado y alto riesgo, con sobrevida estimada de 319, 130 y 44 días para cada grupo respectivamente y permite así orientar en los tratamientos paliativos a efectuar para aliviar la disnea, minimizando la estadía hospitalaria y evitando procedimientos innecesarios con sus eventuales complicaciones. En el grupo particular de adenocarcinomas pulmonares con mutación en el gen que codifica para el receptor del factor de crecimiento epidérmico (EGFR), el LENT score subestima la sobrevida36.
En el estudio de micobacterias, la determinación de la ADA tiene alta sensibilidad (92%) y especificidad (90%) para tuberculosis (TBC) pleural en regiones con alta y baja endemia. En las regiones con baja prevalencia, valores de corte <30 UI tiene un valor predictivo negativo 98,9% y 93% de sensibilidad37. Existen algunas otras condiciones que pueden elevar el ADA como lo son los derrames paraneumónicos, el linfoma, algunos tumores sólidos y enfermedades reumatológicas como la artritis reumatoide y el lupus eritematosos sistémico. La positividad de la reacción en cadena de la polimerasa (PCR) en la TBC pleural es cercano al 50%, Xpert® MTB/RIF Ultra tiene sensibilidad 68% y especificidad 99%38. Los cultivos en medio líquido BACTEC™ MGIT™ son positivos a contar de la segunda semana con sensibilidad de 63%39. El diagnóstico de certeza de la TBC pleural se establece con la detección de micobacterias en el líquido pleural o en el tejido pleural obtenido mediante biopsia. Sin embargo, en regiones con alta endemia la sospecha se establece con valores de ADA elevados, relación linfocitos/neutrófilos >0,75 o con la presencia de granulomas en la histología18.
Los cultivos bacterianos pueden ser positivos hasta en el 40% de los casos de infección del espacio pleural, y con la siembra adicional de líquido en frascos de hemocultivos es posible incrementar el rendimiento en un 20%. Se sugiere utilizarlo rutinariamente ante la sospecha de infección18. El rendimiento también puede aumentar con técnicas de PCR y con los cultivos de biopsias pleurales, las cuales tienen un rendimiento de 60% independiente de la presencia de engrosamiento pleural. Un estudio demostró que en el 75% de las biopsias con cultivos positivos había habido uso de antibióticos en forma previa40. En el año 2014 se desarrolló el primer modelo pronóstico de mortalidad para los pacientes con infección pleural: “RAPID score”. Los pacientes son estratificados en grupos de bajo, moderado y alto riesgo, con mortalidad a 30 días de 3, 9 y 31% respectivamente. Los criterios utilizados son el nivel de urea plasmática basal, la edad del paciente, la purulencia del líquido pleural, el lugar de adquisición de la infección y el nivel de albúmina plasmática41. La estratificación determina la celeridad en la conducta a seguir.
Con sólo el análisis del líquido pleural, es posible establecer el diagnóstico etiológico en algunas condiciones. Tabla 4.
Diagnósticos posibles según análisis dellíquido pleural
| Hallazgos del líquido pleural | Diagnóstico |
|---|---|
| Pleurocrito >50% | Hemotórax |
| Triglicéridos >110 mg/dl | Quilotórax |
| Colesterol >200 mg/dl | Pseudoquilotórax |
| Amilasa pleura > sangre | Patología pancreática |
| ANA* pleura/sangre >1:160 | Pleuritis lúpica (LES) |
| FR** pleura > sangre | Artritis reumatoide |
| Citometría de flujo | Linfoma pleural |
| B2 transferrina | Fístula duropleural |
| Creatinina pleura/sangre | >1 Urinotórax |
Clásicamente se ha descrito que la biopsia pleural debe realizarse en aquellos pacientes con exudado pleural, en los que no ha sido posible establecer un diagnóstico etiológico con la pleurocentesis y en los que se requiere tejido porque la citología ha sido sospechosa, o positiva, pero no ha entregado suficiente información como para tomar decisiones terapéuticas. En el abordaje moderno, también está indicada en aquellos pacientes en los que a priori se sospecha un DPM, observándose un aumento de la sensibilidad diagnóstica desde un 30% con la sola pleurocentesis hasta un 90% con ambos procedimientos. Otra indicación es en los pacientes con infección del espacio pleural en los que se quiere tomar cultivo de tejido para identificar el agente etiológico42.
En Chile contamos con tres opciones para hacer biopsia pleural: biopsia pleural a ciegas, biopsia guiada por imágenes y por toracoscopía.
Biopsia percutánea a ciegasEn esta técnica, se realiza una biopsia percutánea sin ningún tipo de guía, también llamada “a ciegas” con aguja de Cope o Abrams. Tiene utilidad en enfermedades que comprometen difusamente la pleura como en la tuberculosis. En la TBC pleural, el rendimiento es alto, pero deben tomarse al menos 4-6 biopsias y enviar una o dos a cultivo de TBC. La histología tiene un 80% de rendimiento y el cultivo de TBC 56%, logrando el diagnóstico en el 91% de los pacientes con TBC pleural43. Cuando hay compromiso tumoral de la pleura, éste suele ser en parches, no homogéneo y afectar más las zonas inferiores de la pleural parietal y el diafragma. En esta condición, la biopsia a ciegas tiene rendimiento menor al 50% y por ellos no se recomienda ante la sospecha de DPM44. Las complicaciones reportadas son; dolor en el 15%, neumotórax en el 15% y sangrado en menos del 2%. La biospia percutánea a ciegas no está actualmente recomendada salvo que no haya otra técnica disponible o que exista una alta sospecha de tuberculosis y competencia suficiente para efectuarla42,45.
Biopsia pleural percutánea guiada por imágenesEs posible realizar biopsia pleural percutánea guiada por ecografía o por TAC. La ecografía se usa preferentemente cuando hay engrosamiento o nódulos pleurales, pero también en pleura de aspecto normal. Se puede realizar de forma asistida (ecografía inmediatamente previa al procedimiento) o guiada (bajo visualización directa). Se utilizan agujas tipo Tru-cut™ mediante un dispositivo automático con o sin acoplamiento axial y se deben tomar entre 6 a 10 biopsias. El rendimiento es entre un 70 y 94%, con 100% de especificidad42,45.
Optar entre realizar la biopsia bajo TAC o bajo ecografía depende de la disponibilidad de los recursos y las preferencias del operador ya que los rendimientos son similares8.
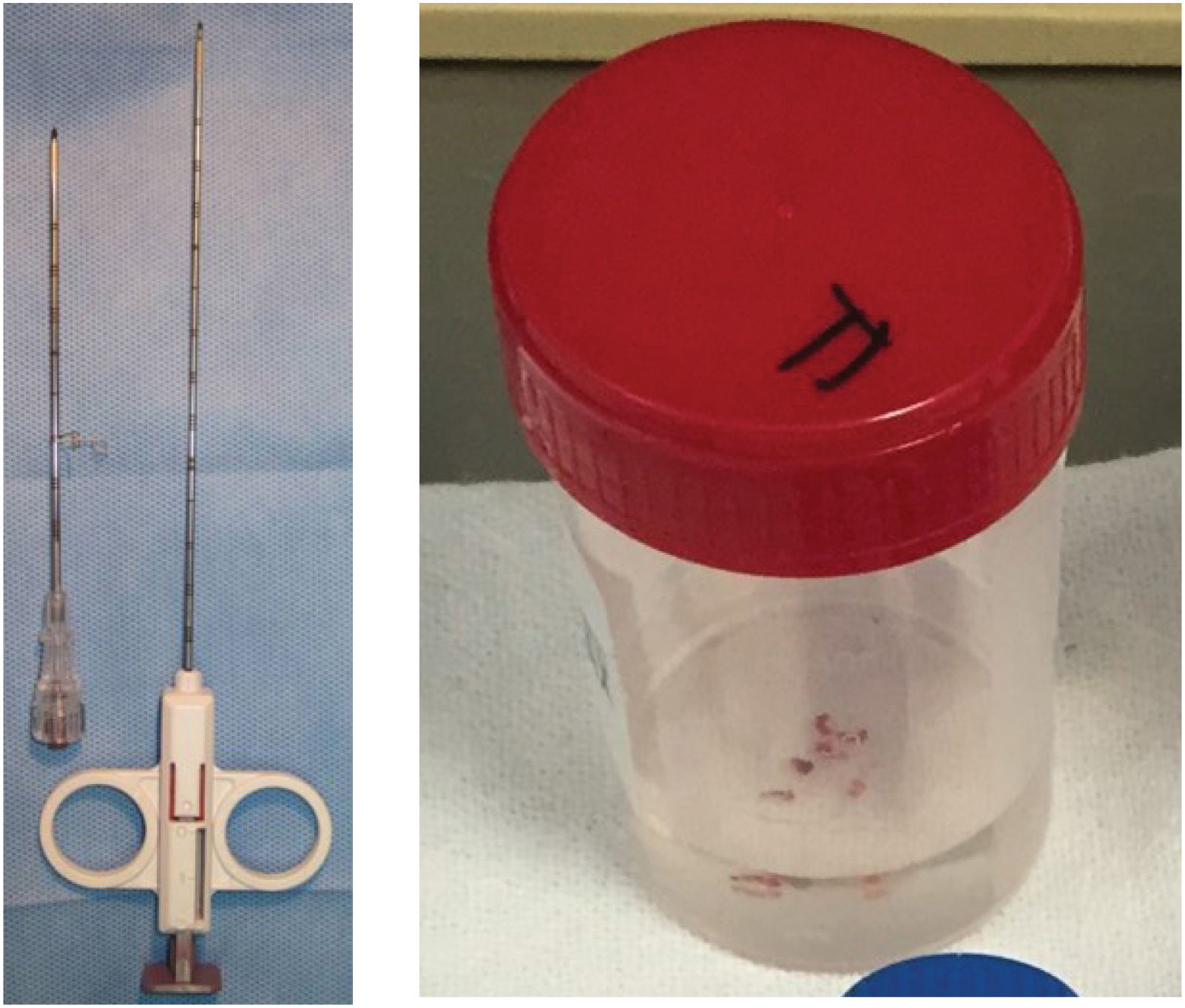
En la figura 3 se muestra una aguja coaxial para biopsia percutánea guiada por imágenes y las biopsias.
La biopsia pleural percutánea es un procedimiento estrictamente diagnóstico, sin posibilidad de hacer tratamiento definitivo en el paciente con DPM42.
ToracoscopíaEs una técnica endoscópica, diagnóstica y terapéutica, que permite visualizar la cavidad pleural, drenar todo el derrame, tomar biopsias de gran tamaño bajo visión directa y realizar pleurodesis en caso de DPM o en el DP benigno recidivante y refractario a tratamiento médico. La toracoscopía puede ser realizada por neumólogo (toracoscopía médica) en sala de endoscopía con analgesia y sedación endovenosa o por cirujanos (videotoracoscopía) en pabellón. La biopsia pleural obtenida por toracoscopía es considerada el “gold standard”, con sensibilidad de un 93-97% para el DPM y 99% en el DP tuberculoso. En los últimos años se han desarrollados toracoscopios semirígidos, con rendimiento y sensibilidad similar al toracoscopio convencional18,46.
Esta técnica está contraindicada cuando hay obliteración del espacio pleural. Son contraindicaciones relativas la hipoxemia no explicada por el derrame, trastornos de coagulación, inestabilidad hemodinámica y la tos incontrolable. Las complicaciones mayores se estiman en 1,8% y son el empiema, el sangrado, la siembra tumoral. Las complicaciones menores se estiman en un 7% y las más frecuentes son la fiebre, enfisema subcutáneo, infección de la piel y arritmias. Se ha reportado siembra tumoral entre un 9-16% en casos de mesotelioma45,47.
En los casos de DPM en que la pleurodesis falla porque no hubo reexpansión pulmonar o cuando existe un derrame maligno sintomático y recidivante por pulmón atrapado, está indicado la colocación de un catéter pleural tunelizado. Son catéteres de entre 10 a 15,5 French (Fr) que provocan mínima incomodidad, insertándose en forma tunelizada bajo la piel y bajo guía ecográfica. Tienen una válvula unidireccional y permiten que el paciente se conecte a un sistema de drenaje al vacío de manera de ir drenando el derrame en forma controlada en el domicilio. Estos catéteres han demostrado ser efectivos en reducir la magnitud del derrame y en aliviar la disnea y se ha reportado que hasta el 50% de los pacientes consiguen una pleurodesis espontánea en un promedio de 52 días44. La presencia del catéter dentro de la cavidad estimula una reacción inflamatoria que favorece la obliteración del espacio pleural. También se ha propuesto instalar durante la toracoscopía un catéter tunelizado, con lo que se ha logrado éxito de la pleurodesis hasta en el 92% y con sólo 1,79 días de estadía hospitalaria promedio. Existen complicaciones tempranas derivadas de la colocación del catéter tunelizado en el 2,8 a 6% de los casos, principalmente el neumotórax, enfisema subcutáneo, sangrado e infección. Hay complicaciones relacionadas al catéter en sí hasta en el 14% de los casos, siendo las más frecuentes el empiema, celulitis, infección e inflamación del trayecto subcutáneo, la siembra tumoral en el trayecto y la obstrucción del catéter, y cada complicación requiere un tratamiento en particular48.
Pleuritis crónica inespecíficaHasta en el 30% de los pacientes la biopsia por toracoscopía es informada como “pleuritis crónica inespecífica”, no logrando establecer un diagnóstico etiológico. En este grupo de pacientes se debe hacer seguimiento periódico durante 2 años. Es necesario realizar una nueva toracoscopía con biopsia en caso de reproducción del derrame o si hay engrosamiento pleural o dolor, ya que en un pequeño porcentaje de casos (4-12%) se logra diagnosticar una enfermedad maligna, principalmente un mesotelioma pleural maligno49.
ConclusiónEn muchos centros se han desarrollado unidades de patología pleural donde es posible evaluar pacientes y hacerles seguimiento clínico. En ellas, se dispone de ecógrafo y pueden realizarse diversos procedimientos como pleurocentesis, biopsias percutáneas, instalación de tubos de drenaje pleural, catéteres tunelizados y toracoscopía médica, privilegiando el abordaje ambulatorio por sobre el clásico abordaje hospitalizado. El enfoque está en el manejo ambulatorio, con la posibilidad de realizar en la misma visita procedimientos múltiples como una pleurocentesis y biopsia percutánea, lo cual agiliza el proceso diagnóstico. De igual modo se pueden instalar catéteres tunelizados para manejo si se considera necesario. Ya no se justifica hospitalizar a un paciente sólo para estudio, salvo en la sospecha de infección del espacio pleural4.
Conflictos de InterésLa autora declara no tener conflictos de interés en relación con este artículo.
AgradecimientoFigura 2 gentileza de la Dra. Cristina Fernández.