En el estudio diagnóstico del paciente con derrame pleural se deben considerar la historia clínica y el análisis de las imágenes para acotar el diagnóstico diferencial. El uso adecuado de las técnicas de imágenes contribuye a realizar procedimientos en forma segura. Se debe realizar una toracocentesis diagnóstica y/o evacuadora y se debe analizar completamente el líquido pleural. A veces es necesario realizar biopsia pleural para lo cual existen diversas técnicas disponibles. En los pacientes con pleuritis crónica inespecífica se debe hacer seguimiento por dos años para evaluar el desarrollo de malignidad.
The diagnostic approach in patients with pleural effusion must begin considering clinical aspects and image interpretation. Different imaging techniques can safely guide invasive procedures. Diagnostic or therapeutic thoracentesis must be performed and pleural fluid must be completely analyzed. Some patient will require pleural biopsy, and different techniques are available.
Patients with chronic unspecific pleuritis histological diagnosis after pleural biopsy, must be followed for two years long to be sure no malignancy is developed.
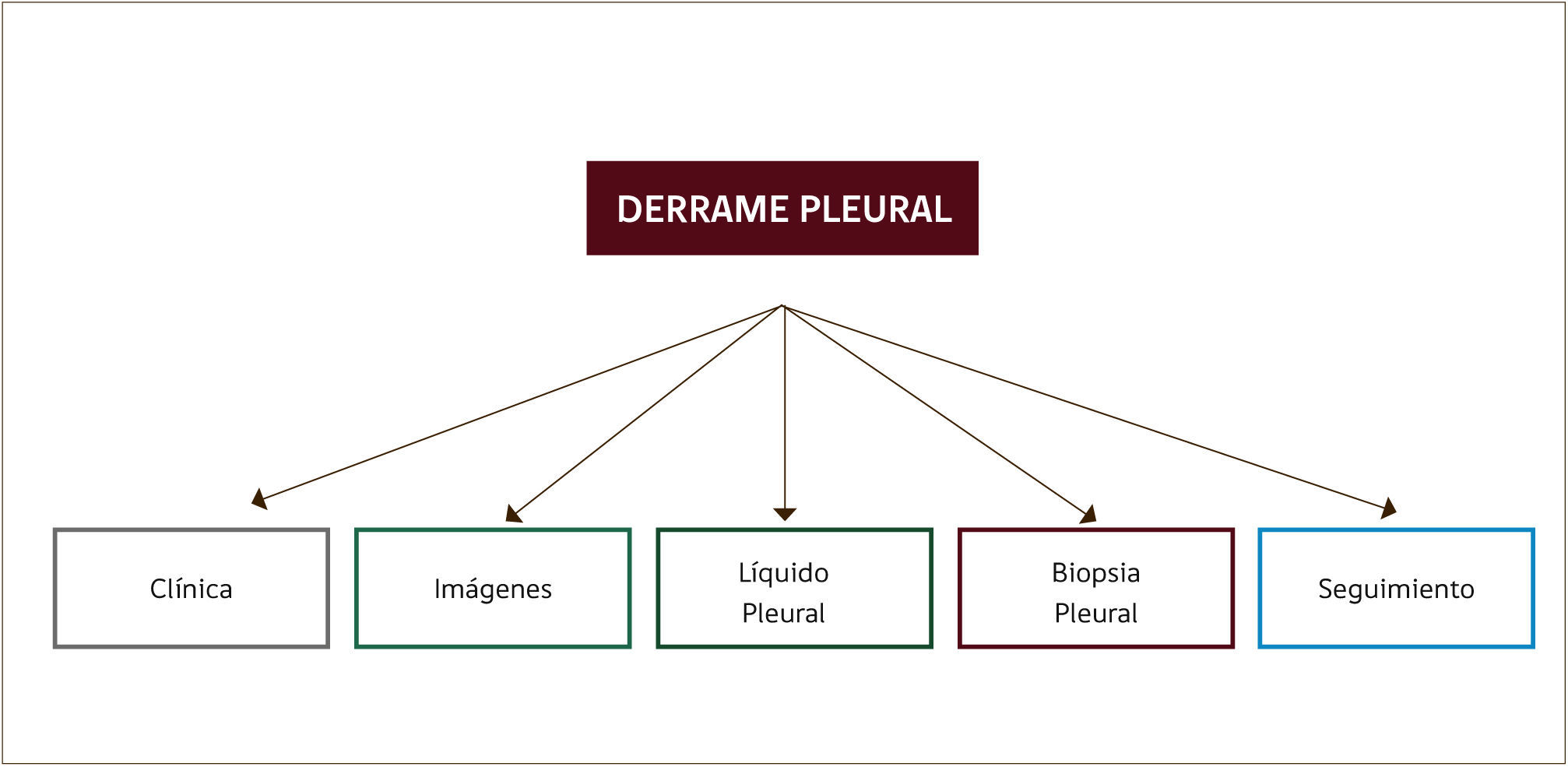
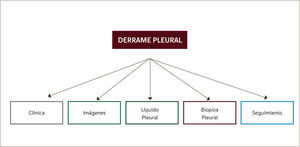
Establecer la causa del derrame es un desafío clínico, el cual se ve dificultado aún más al considerar que la cavidad pleural no tiene acceso directo1,2. El enfrentamiento del paciente con derrame debe considerar un meticuloso examen clínico (historia y examen físico), estudio de las imágenes y del líquido pleural. En ocasiones será necesario realizar biopsia pleural y en un subgrupo de pacientes no se logrará definir la causa del derrame siendo necesario hacer seguimiento durante al menos dos años (Figura 1).
Un amplio espectro de patologías puede causar derrame pleural como: enfermedades de la pleura, enfermedades del pulmón, enfermedades extrapulmonares y el uso de determinados fármacos2. En EE.UU. se estiman 1.500.000 casos nuevos de pacientes con derrame pleural/año. La causa más frecuente es la insuficiencia cardíaca con cerca de 500.000 casos nuevos. La siguen en frecuencia las infecciones bacterianas del espacio pleural en 300.000, derrames pleurales neoplásicos 200.000, tromboembolismo pulmonar 150.000, derrames de etiología viral en 100.000 e hidrotórax 50.0003,4.
CLÍNICAEn el 75% de los casos el clínico se puede aproximar al diagnóstico diferencial con una detallada anamnesis y examen físico. Debe interrogarse dirigidamente sobre enfermedades previas o actuales tales como cardiopatías, cuadros respiratorios infecciosos recientes, neoplasias, mesenquimopatías, traumatismos, enfermedades hepáticas o renales, contacto con pacientes con tuberculosis (TBC), antecedentes laborales y uso de fármacos1. Múltiples medicamentos pueden causar derrame pleural, los más frecuentes en producirlo son el metotrexato, amiodarona, fenitoína, nitrofurantoína y ciclofosfamida. En la página web www.pneumotox.com es posible evaluar el reporte de derrame pleural para un medicamento en particular2.
Los síntomas son variables dependiendo de la etiología del derrame y de la magnitud de éste, sin embargo, algunos pacientes consultan por síntomas causados por el derrame pleural propiamente tal como lo son la disnea, la tos y el dolor torácico; otras veces los síntomas son derivados de la enfermedad de base. Hasta en el 25% de los pacientes el derrame es asintomático y resulta ser un hallazgo anormal en la radiografía de tórax.
IMÁGENESLas técnicas más útiles son la radiografía póstero-anterior (PA) y lateral del tórax, la ecografía pleural y la tomografía computada de tórax (TAC). En ocasiones se pueden complementar con la tomografía por emisión de positrones con tomografía computada integrada (PET/CT) y con resonancia nuclear magnética (RNM). El uso de cada una de ellas tiene objetivos distintos. Es interesante tener presente que tanto el derrame pleural como el engrosamiento pleural pueden ser manifestaciones de patología benigna como maligna, de modo que el análisis de las imágenes constituye un aspecto más en el enfrentamiento global del paciente.
Radiografía de tóraxLa radiografía torácica suele ser el examen inicial. En la radiografía PA son necesarios al menos 200ml para evidenciar el derrame y en la proyección lateral 50cc. En los derrames libres, el ángulo costofrénico suele estar obliterado y el derrame describe una curva ascendente o de Damoiseau. Otras veces el derrame puede localizarse en la zona subdiafragmática, puede ser bilateral o incluso acumularse en las cisuras generando una imagen que simula un tumor pulmonar. Los derrames pueden ser libres o estar loculados, lo cual puede ocurrir en enfermedades que producen inflamación intensa de la pleura como la TBC pleural, el empiema y el hemotórax. La cuantía de los derrames puede ser muy variable, desde muy escaso contenido hasta extenso o masivo y afectar todo el hemitórax, provocando o no desplazamiento del mediastino en forma contralateral. Las principales causas de derrame pleural masivo son las etiologías maligna, la TBC pleural y el empiema4.
EcografíaLa ecografía torácica es un procedimiento no invasivo, de bajo costo, que puede ser realizada al lado de la cama del enfermo. Durante la última década se utiliza cada vez más por neumólogos, sin embargo en nuestro medio es subutilizada aún. Es el examen más sensible para determinar la presencia de derrame con 100% de sensibilidad y 99.7% de especificidad5. Tiene utilidad previo a la toracocentesis, durante y después de ella. La ecografía torácica previo a la toracocentesis permite evaluar el sitio de punción, precisar la presencia de derrame y diferenciarlo de masas, estimar el volumen del derrame, valorar potenciales dificultades como la presencia de tabicaciones, para lo cual tiene mayor precisión que la TAC, y plantear diagnósticos diferenciales. Se ha demostrado que su uso permite efectuar una toracocentesis exitosa en el 88% de los casos en que previamente ha habido una punción frustra guiada solamente por clínica o por radiografía. Distintos estudios han demostrado que es posible sugerir la etiología neoplásica con una sensibilidad 79% y 100% de especificidad al encontrar engrosamiento pleural mayor a 1cm, nodularidad en la pleura, engrosamiento de la pleura visceral, engrosamiento diafragmático mayor a 7mm o nodularidad diafragmática6. La ecografía durante la pleurocentesis disminuye las complicaciones como lo son el neumotórax y la punción de órganos intra abdominales, permite guiar biopsias pleurales, guiar la colocación de catéteres de drenaje y de catéteres crónicos. Posterior al procedimiento, la ecografía permite evaluar la presencia de neumotórax y el volumen remanente7.
Tomografía computada de tórax (TAC)La TAC debe realizarse antes de haber evacuado completamente el derrame para observar mejor las anormalidades pleurales y además debe ser realizada con contraste endovenoso en fase venosa (60-90 segundos tras la administración del contraste)2. Debe incluir abdomen superior hasta las glándulas suprarrenales. Permite evaluar la cavidad pleural, el mediastino y el parénquima al mismo tiempo. La presencia de algunos hallazgos son poco sensibles pero altamente específicos de malignidad como lo son la nodularidad de la pleura parietal (94% sensibilidad y 51% de especificidad), el engrosamiento de la pleura mediastínica (88% sensibilidad y 56% de especificidad), el engrosamiento de la pleura parietal 1cm (94% sensibilidad y 36% de especificidad) y el engrosamiento pleural circunferencial (100% sensibilidad y 41% de especificidad)8. Además, en ocasiones permite identificar el tumor primario. En el empiema se puede observar captación del contraste en la pleura parietal o en ambas pleuras alrededor del derrame, hay engrosamiento pleural en el 80–00% de los casos, el derrame puede estar loculado y presentar burbujas de aire en su interior. A veces se observan adenopatías mediastínicas menores a dos centímetros y engrosamiento y aumento de la atenuación de la grasa extrapleural entre la pleura parietal y las costillas. La TAC permite diferenciar entre absceso pulmonar periférico versus un empiema al considerar el grosor de las paredes y el ángulo que forman en relación a la pared torácica, ángulo agudo en los abscesos y obtuso en los empiemas2,9.
OTRAS TÉCNICAS: PET/CT Y RNMPET/CT. Su uso rutinario no está recomendado. Su mayor utilidad se centra en el estudio del derrame maligno donde tiene 97% sensibilidad y 88.5% de especificidad. Ayuda en la etapificación del tumor y eventualmente puede ayudar a evaluar la respuesta a la terapia. En ocasiones permite identificar la ubicación para la toma de biopsia. Presenta falsos positivos que limitan su uso como lo son la pleuritis urémica, pacientes con pleurodesis previa y la infección del espacio pleural. También presentan falsos negativos el tumor fibroso de crecimiento lento, linfoma y metástasis de cáncer de próstata9,10.
RNM: Esta técnica no es de uso rutinario en el estudio de la patología pleural. Puede ser útil en diferenciar patología benigna v/s maligna y por sobre todo para demostrar infiltración tumoral de la pared torácica y del diafragma adyacente a tumores2.
PLEUROCENTESISEstá indicada en todo paciente que presenta derrame pleural salvo en los casos de insuficiencia cardíaca evidente. Aún así debe hacerse una pleurocentesis si el derrame no es bilateral simétrico o en caso de presentar concomitantemente fiebre o dolor pleurítico. Es conveniente que sea guiada por ecografía7.
Con estudios de imágenes se ha podido observar que la arteria intercostal, una vez que nace de la aorta, hace un trayecto inicial, los primeros 10cm, por el medio del espacio intercostal y a veces este recorrido puede ser tortuoso, en especial en pacientes añosos y extenderse hasta la línea axilar posterior. Por esto es que se sugiere que la pleurocentesis se haga al menos 10cm alejado de la línea vertebral hacia lateral o en la línea axilar posterior. Se debe puncionar a nivel del derrame y sobre el borde superior de la costilla7,11.
La pleurocentesis puede ser con fines diagnósticos “pleurocentesis diagnóstica” de 50 a 100 cc de líquido o “terapéutica” para aliviar síntomas como disnea, el compromiso hemodinámico o para evacuar la infección del espacio pleural extrayendo la mayor cantidad de líquido pleural posible. Preferentemente debe hacerse en forma inicial, una punción diagnóstica y terapéutica a la vez, de modo de evitar tener que repetir procedimientos en un mismo paciente disminuyendo los riesgos potenciales de complicaciones y el disconfort que provocan. Además, al evacuar lo más posible el derrame se busca disminuir sustantivamente la disnea, poder mejorar la visibilidad en la radiografía y TAC de tórax y a la vez evaluar la velocidad de reproducción del derrame12,13. La toracocentesis diagnóstica exclusiva debe reservarse sólo para casos en que la toracocentesis terapéutica no es segura o posible, o bajo circunstancias puntuales de cada enfermo. El riesgo potencial de una toracocentesis terapéutica es el edema ex vacuo, el cual se ha estimado puede tener una mortalidad de hasta 20%. Su frecuencia es extremadamente baja 0.2 – 0.5% y ocurre cuando la presión pleural cae a menos de -20cm de H20. Es posible medir con manometría el descenso de la presión pleural durante la toracocentesis o bien guiarse por síntomas. Se ha visto que el desarrollo de tos o disconfort retroesternal se asocia con presiones pleurales cercanas a -20cm de H207,12,14. En nuestro medio no utilizamos manometría y se le advierte al paciente que ante la aparición de tos o disconfort retroesternal se dará por finalizada la pleurocentesis independiente del volumen drenado.
Las complicaciones más frecuentes de la pleurocentesis son la reacción vagal (10 14%), el neumotórax (3 8%), punción frustra, dolor y sangrado. No es necesario controlar con radiografía de tórax post pleurocentesis salvo que se sospeche alguna complicación por la aspiración de aire, por múltiples intentos de punciones frustras o por que el paciente presente molestias como disnea o tos15.
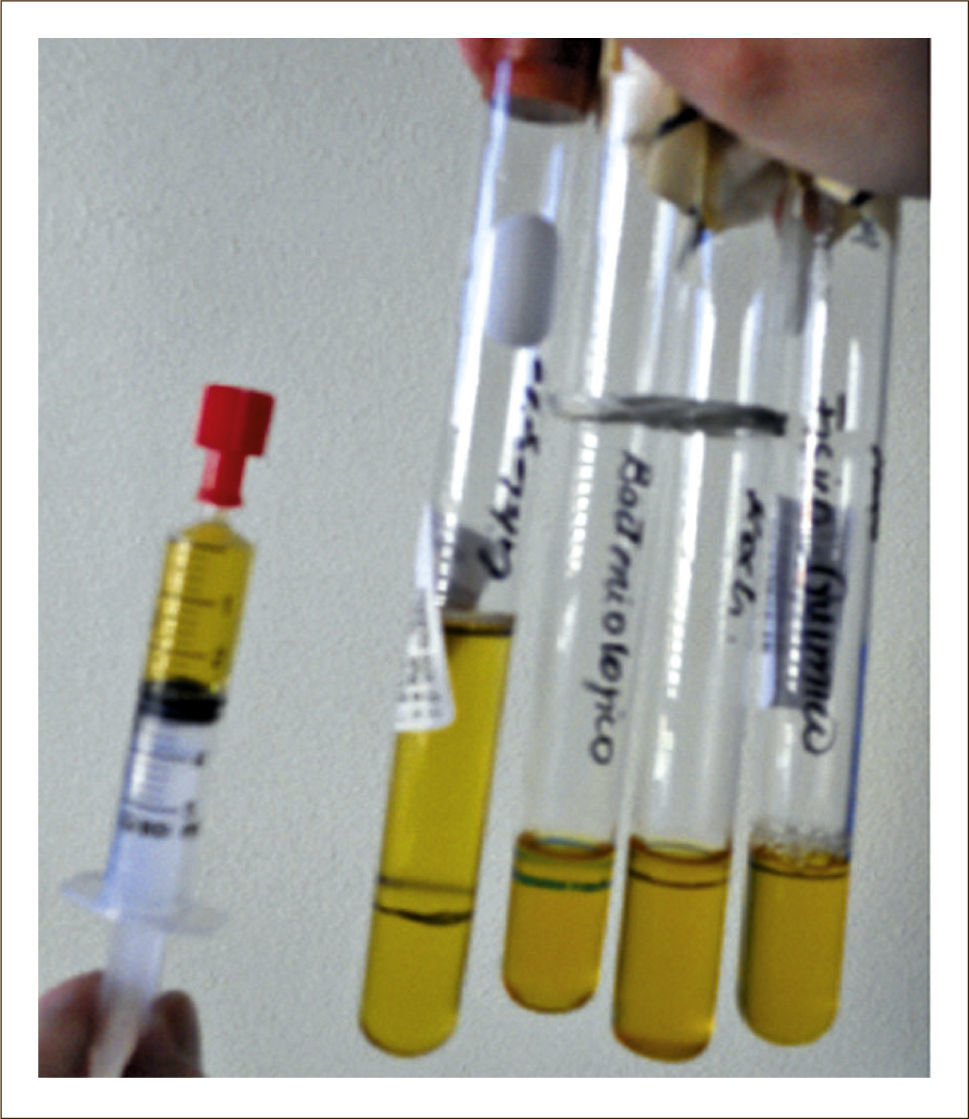
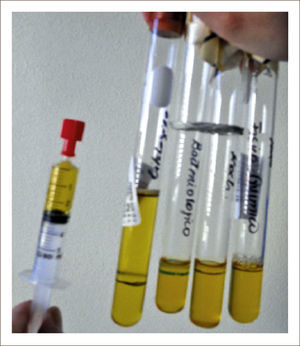
ESTUDIO DEL LÍQUIDOEl estudio inicial del líquido pleural debe considerar su aspecto y olor. El líquido pleural de aspecto hemático debe hacer sospechar la presencia de derrame neoplásico, hemotórax o tromoembolismo pulmonar. La determinación del pleurocrito 50% del hematocrito confirma la presencia de un hemotórax. La coloración blanquecina o un líquido turbio pueden sugerir un empiema o quilotórax. En este caso se debe centrifugar el líquido y si el sobrenadante permanece turbio es necesario hacer determinación de triglicéridos para confirmar un quilotórax. El olor pútrido del líquido plantea un posible empiema, y se debe inocular líquido pleural en frascos de hemocultivos para aumentar el rendimiento etiológico principalmente para bacterias anaerobias2.
Se enviarán muestras en forma rutinaria a distintos laboratorios para análisis físico químico, fórmula diferencial, citología, pH, estudio microbiológico incluyendo cultivos corriente, tinción de Gram, baciloscopía (Bk) cultivo de Koch y Adeno-sin-deaminasa (ADA) (Figura 2), y en ocasiones es posible realizar otras determinaciones las cuales se solicitan frente a hipótesis diagnósticas determinadas.
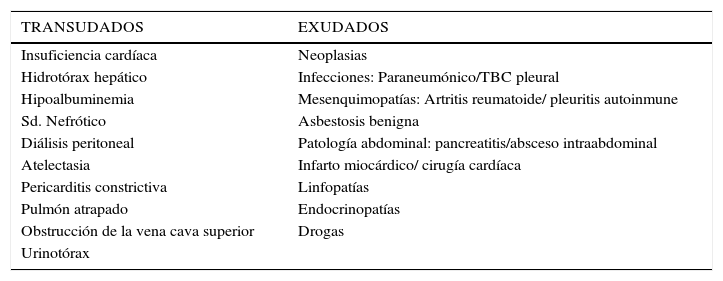
CLASIFICACIÓN DEL DERRAMEEl derrame pleural se clasifica en transudado o exudado. La diferenciación es importante ya que en los transudados la pleura está sana, y la patología que provoca el derrame suele ser sistémica y evidente en base a la historia y examen físico. En los exudados en cambio, la pleura suele estar enferma. El derrame se clasifica en transudado o exudado en base a los criterios de Light16 (Tabla 1). Estos criterios, tienen sensibilidad 98% y especificidad 77% para clasificar correctamente los derrames. Las principales causas de transudados y exudados se muestran en la Tabla 2. La baja especificidad de los criterios de Light ocurre principalmente en pacientes que están en tratamiento con diuréticos, así el 29% de los paciente con insuficiencia cardíaca (IC) y el 18% de los pacientes con hidrotórax hepático (HH) califican erróneamente como exudados siendo transudados, es decir son falsos exudados17,18.
CRITERIOS DE LIGHT PARA CLASIFICAR TRANSUDADOS V/S EXUDADOS
| Proteínas líquido pleural/ proteínas plasma > 0.5 |
| LDH líquido pleural / LDH plasma > 0.6 |
| LDH líquido pleural > 2/3 límite normal |
| • Deben tomarse concomitantemente a la pleurocentesis proteína y LDH en sangre • Basta 1 criterio para clasificar como exudado pleural • No debe haber ningœn criterio para clasificar como transudado |
CAUSAS DE TRANSUDADOS Y EXUDADOS
| TRANSUDADOS | EXUDADOS |
|---|---|
| Insuficiencia cardíaca | Neoplasias |
| Hidrotórax hepático | Infecciones: Paraneumónico/TBC pleural |
| Hipoalbuminemia | Mesenquimopatías: Artritis reumatoide/ pleuritis autoinmune |
| Sd. Nefrótico | Asbestosis benigna |
| Diálisis peritoneal | Patología abdominal: pancreatitis/absceso intraabdominal |
| Atelectasia | Infarto miocárdico/ cirugía cardíaca |
| Pericarditis constrictiva | Linfopatías |
| Pulmón atrapado | Endocrinopatías |
| Obstrucción de la vena cava superior | Drogas |
| Urinotórax |
Se han descrito otros múltiples criterios para diferenciar transudados de exudados, todos con menor sensibilidad y especificidad. Uno de ellos ha sido la determinación de colesterol pleural 60mg/dl. Sobre este valor el líquido se considera un exudado1.
La diferencia entre las proteínas del plasma y la pleura y de la albúmina del plasma y la pleura son otros criterios que pueden ser usados ante la sospecha de estar en presencia de un falso exudado pleural en base a los criterios de Light. (Tablas 3 y 4)18.
La determinación del extremo terminal del péptido natriurético (NTProBNP) tanto en pleura como en sangre con valores 1500pg/ml permiten hacer el diagnóstico de insuficiencia cardíaca con 91% de sensibilidad y 93% de especificidad18,19.
La glucosa pleural es similar al valor plasmático. Valores bajo 60mg/dl se observan en los derrames paraneumónicos, TBC, neoplasia y rotura esofágica. Son causa de valores bajo 29mg/dl la artritis reumatoide y empiema pleural2.
Estudio celular del líquido:El líquido pleural debe ser enviado al laboratorio de hematología donde se realizará la fórmula diferencial. El predominio celular pretende estrechar el diagnóstico diferencial, así el predominio linfocitario (50% del recuento total) generalmente traduce derrames de larga data y es sugerente de neoplasia, TBC pleural, tromboembolismo pulmonar, artritis reumatoide, linfoma y quilotórax. El derrame pleural de la insuficiencia cardíaca también es de predominio linfocítico.
Un predominio celular en base a polimorfonucleares (50% del recuento total) generalmente traduce procesos agudos y es sugerente de derrame paraneumónico, tromoembolismo pulmonar, derrame de origen viral, tuberculosis pleural en fase precoz, pancreatitis, derrame por asbestosis benigna y ocasionalmente neoplasias (20%)20.
El derrame eosinofílico es aquel con 10% o más de eosinófilos. Esto ocurre en el 7.2% de los derrames pleurales. Las causas más frecuentes son neoplasias (34.8%), infecciones del espacio pleural (19.3%) en especial el derrame paraneumónico, idiopático (14.1%), trauma torácico (posiblemente por la presencia de aire o sangre en el espacio pleural) y posterior a procedimientos quirúrgicos. Otras causas descritas son las infecciones por hongos, parásitos, la asbestosis pleural benigna, drogas y el Síndrome de Churg Strauss. En la medida en que el porcentaje de eosinófilos aumenta 30 – 40% la probabilidad de neoplasia disminuye21. El abordaje del derrame en esta condición es igual a cualquier otro y debe incluir todos los procedimientos diagnósticos necesarios, incluidos biopsia percutánea y toracoscopía si es necesario22.
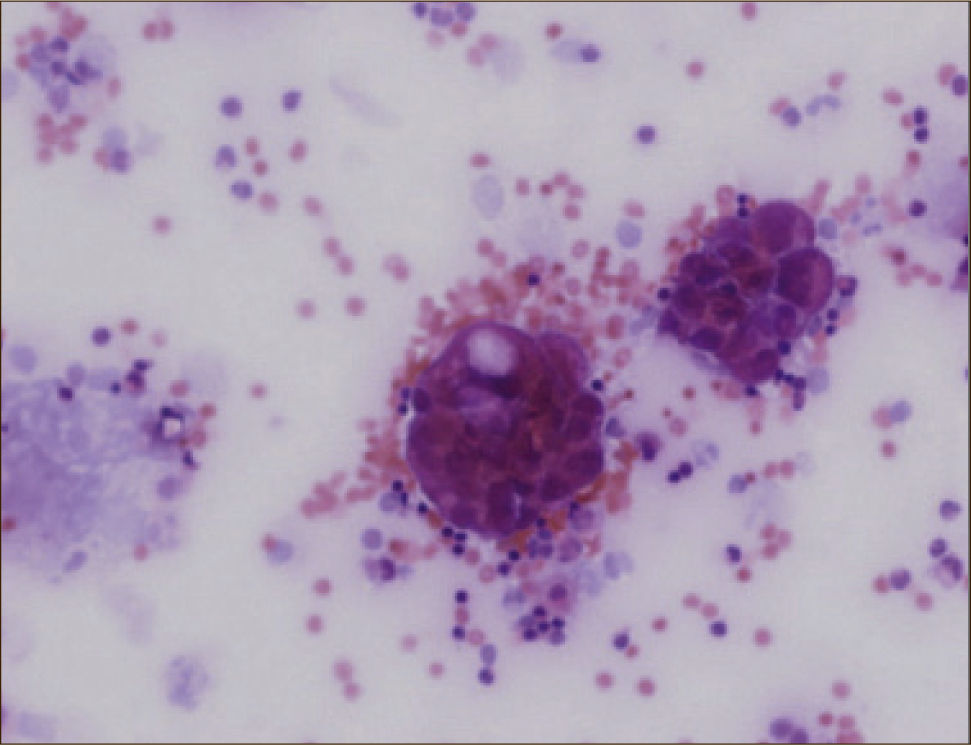
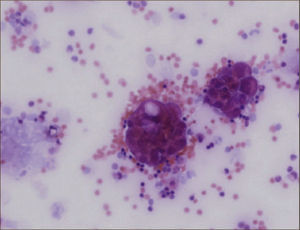
CitologíaLa citología del líquido pleural es el examen más simple que permite confirmar la malignidad del derrame (Figura 3). Su rendimiento es cercano al 60% en casos de adenocarcinoma pero disminuye en otras neoplasias como en el carcinoma escamoso y mesotelioma 28%. El rendimiento depende de la habilidad del patólogo para diferenciar células neoplásicas de las células mesoteliales reactivas y de la extensión de la enfermedad. Se requieren al menos 10ml de líquido pleural y volúmenes mayores a 75ml no agregan mayor rendimiento diagnóstico. En el derrame pleural maligno una segunda citología aumenta el rendimiento en 8 a 10%, por lo que ante la sospecha de una etiología neoplásica, con una primera citología negativa, se recomienda ir directamente a la biopsia pleural1,23,24.
El bloque celular consiste en centrifugar 30 a 50ml de líquido pleural, fijarlo en parafina y luego realizar cortes histológicos.
Es posible reconocer células malignas y hacer técnicas de inmunohistoquímica que permitan ayudar a identificar la estirpe tumoral25,26.
PHLa determinación del pH puede sufrir variaciones por problemas en su toma y procesamiento. Para la toma adecuada no debe usarse la misma jeringa con que se infiltra lidocaína en la piel. La determinación del pH se hace extrayendo unos pocos ml de líquido a una jeringa nueva previamente heparinizada, no deben quedar burbujas de aire (requiere anaerobiosis) y debe ser procesada en la primera hora en el analizador de gases. No debe procesarse si la muestra obtenida es pus ya que puede dañar el equipo de gases. Se ha establecido que la presencia de 0.2ml de lidocaína en la jeringa acidifica 0.15-0.4U la muestra, la presencia de heparina acidifica 0.02U y la presencia de aire alcalinizará la muestra 0.05U25,27. La utilidad de la determinación del pH se centra en dos condiciones: 1) En el contexto de infección del espacio pleural un pH 7.2 implica conducta: la instalación de un tubo de drenaje pleural; 2) En el contexto de neoplasia, un pH 7.3 tiene implicancias pronósticas: menor sobrevida, mayor compromiso tumoral y posiblemente menor tasa de éxito de la pleurodesis17.
Estudio microbiológicoEl estudio microbiológico en la infección del espacio pleural debe contemplar la tinción de Gram y cultivo en medio aerobio y anaerobio. El rendimiento de los cultivos es muy variable entre los distintos estudios, sin embargo oscila cercano al 60%. En el 40% no se aíslan gérmenes. Cuando la infección pleural se ha adquirido en la comunidad, los gérmenes aerobios más frecuentemente involucrados son Gram positivos Streptococco sp y Staphilococco Aureus en el 65% de los casos. Los gérmenes Gram negativos se cultivan menos frecuentemente y se observan cuando existen comorbilidades. Es posible aislar gérmenes anaerobios en el 12 – 34% de los casos y mediante técnicas de amplificación del DNA se ha logrado evidenciar hasta en el 76% de los casos. Cuando la infección se ha adquirido en el “setting” hospitalario, los gérmenes más frecuentemente aislados son el St. Aureus meticilino resistente y se observan más gérmenes Gram negativos. La infección polimicrobiana con anaerobios y Gram negativos es relativamente frecuente. El rendimiento de estos cultivos puede aumentar en un 21% sembrando 2 a 5ml de líquido pleural en frascos de hemocultivos28.
La determinación de Bk y del cultivo de Koch tiene un bajo rendimiento en la TBC pleural. La Bk es positiva en menos del 5% de los casos y el cultivo en medio de Lowenstein Jensen es positivo en menos del 20% de los casos en pacientes VIH negativos a los 30 ó 60 días. El rendimiento aumenta en pacientes VIH positivos. Sembrar el líquido en medio de cultivo líquido (BACTEC) aumenta la positividad del cultivo al doble y en menos tiempo25,29.
Adenosin-deaminasaLa determinación de adenosin-deaminasa (ADA) en el líquido ha demostrado ser útil como complemento en el diagnóstico de la TBC pleural. Más de 100 estudios y 4 meta análisis han demostrado que niveles de corte 40 U/L apoyan el diagnóstico de TBC pleural con sensibilidad 92% y especificidad 90%. Estos estudios usaban métodos de determinación colorimétricos. Existen falsos negativos en las fases iniciales de la enfermedad y falsos positivos en el derrame pleural en la artritis reumatoide, lupus, derrame paraneumónico, empiema y en el linfoma30. Actualmente se utilizan métodos automatizados y se ha postulado que el nivel de corte es cercano a 33 U/L. Hay consenso en que los valores de corte deben ser establecidos en estudios locales. Porcel J en un estudio de 2104 derrames pleurales estimó un nivel de corte para la detección del ADA por método no colorimétrico en 35 UL con 93% de sensibilidad y 90% de especificidad31. La utilidad del ADA se mantiene en pacientes VIH+ independientemente del nivel de CD4 y en pacientes con trasplante renal. En nuestro medio, la mayor utilidad del ADA es su valor predictivo negativo, niveles bajo el nivel de corte hacen improbable una tuberculosis pleural.
OTROS EXÁMENESLa determinación del interferón gamma es útil como biomarcador en el estudio de TBC pleural con sensibilidad 89% y especificidad 97%. Sin embargo, ya que la determinación de ADA está ampliamente disponible y es más económica, el uso de interferon gamma no está recomendado en forma rutinaria29,30.
La técnica de amplificación del ácido nucleico para la detección de TBC (reacción de polimerasa en cadena) en el líquido pleural tiene especificidad 91 – 97% y sensibilidad 62 – 76%. La baja sensibilidad se explica por aspectos técnicos, la naturaleza paucibacilar de la enfermedad y por inhibidores presentes en el líquido. Su utilidad se centra más en confirmar la enfermedad que en descartarla y dado que son exámenes caros y complejos, su uso rutinario no está indicado32.
La nueva técnica Xpert MTB/RIF es una prueba molecular automatizada que detecta al mismo tiempo micobacterium tuberculoso y resistencia a rifampicina en sólo dos horas. Esta técnica no ha demostrado ser útil en el estudio de la TBC pleural, tiene sensibilidad 15 – 44%. No es un examen que se haga rutinariamente33.
La determinación de proteína C reactiva 45 mg/L en el líquido sugiere que la causa del derrame es una infección del espacio pleural y un valor mayor a 100 mg/L tiene sensibilidad 58% y especificidad 88% para diferenciar entre un derrame paraneumónico complicado de uno no complicado.
Es posible determinar la presencia de antígeno de pneumococco en el líquido pleural con los mismos kit que hacen determinación en orina. La sensibilidad de este test en el líquido pleural es 71 – 84% con una especificidad de 93%32.
La determinación de marcadores tumorales CEA, CA-125, CA 15-3 Y CYFRA no está recomendada en el estudio rutinario de los pacientes con derrame pleural. Durante los últimos años la determinación de mesotelina soluble en suero y/o pleura ha demostrado sensibilidad 48 – 87% y especificidad 70-100% para el diagnóstico de mesotelioma epitelioide2. Tiene falsos positivo en cáncer de ovario, páncreas, linfoma y falsos negativos en el mesotelioma sarcomatoso. Últimamente se ha investigado en la determinación de fibulina 3 como otro marcador de mesotelioma pleural. Cuando existe el antecedente de exposición a asbesto, los niveles elevados de estos marcadores permiten seleccionar a aquellos pacientes que ameritan técnicas diagnósticas invasivas para confirmar el diagnóstico. Estos marcadores aún están en investigación y su uso rutinario no está recomendado34–37.
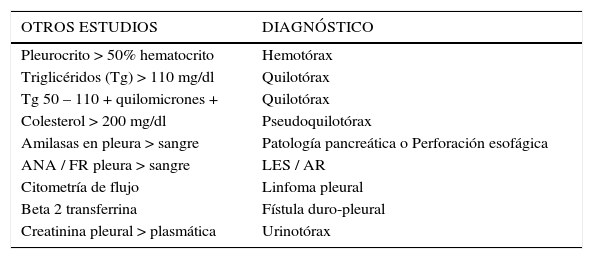
Múltiples otros estudios pueden ser solicitados en el líquido para hacer diagnóstico etiológico específico. Tabla 5.
OTROS ESTUDIOS EN LÍQUIDO PLEURAL
| OTROS ESTUDIOS | DIAGNÓSTICO |
|---|---|
| Pleurocrito > 50% hematocrito | Hemotórax |
| Triglicéridos (Tg) > 110 mg/dl | Quilotórax |
| Tg 50 – 110 + quilomicrones + | Quilotórax |
| Colesterol > 200 mg/dl | Pseudoquilotórax |
| Amilasas en pleura > sangre | Patología pancreática o Perforación esofágica |
| ANA / FR pleura > sangre | LES / AR |
| Citometría de flujo | Linfoma pleural |
| Beta 2 transferrina | Fístula duro-pleural |
| Creatinina pleural > plasmática | Urinotórax |
A pesar del estudio del líquido pleural, en el 25% de los casos no es posible establecer un diagnóstico etiológico de certeza. En los exudados de causa desconocida es necesario realizar una biopsia pleural. Actualmente, en nuestro medio, se dispone de tres técnicas de biopsia: biopsia pleural a ciegas, guiada por imágenes y por toracoscopía. La técnica a usar dependerá de la hipótesis diagnóstica, de las competencias y preferencias del operador, la disponibilidad de ellas y los costos de cada una. Idealmente cada centro debe disponer de todas estas opciones.
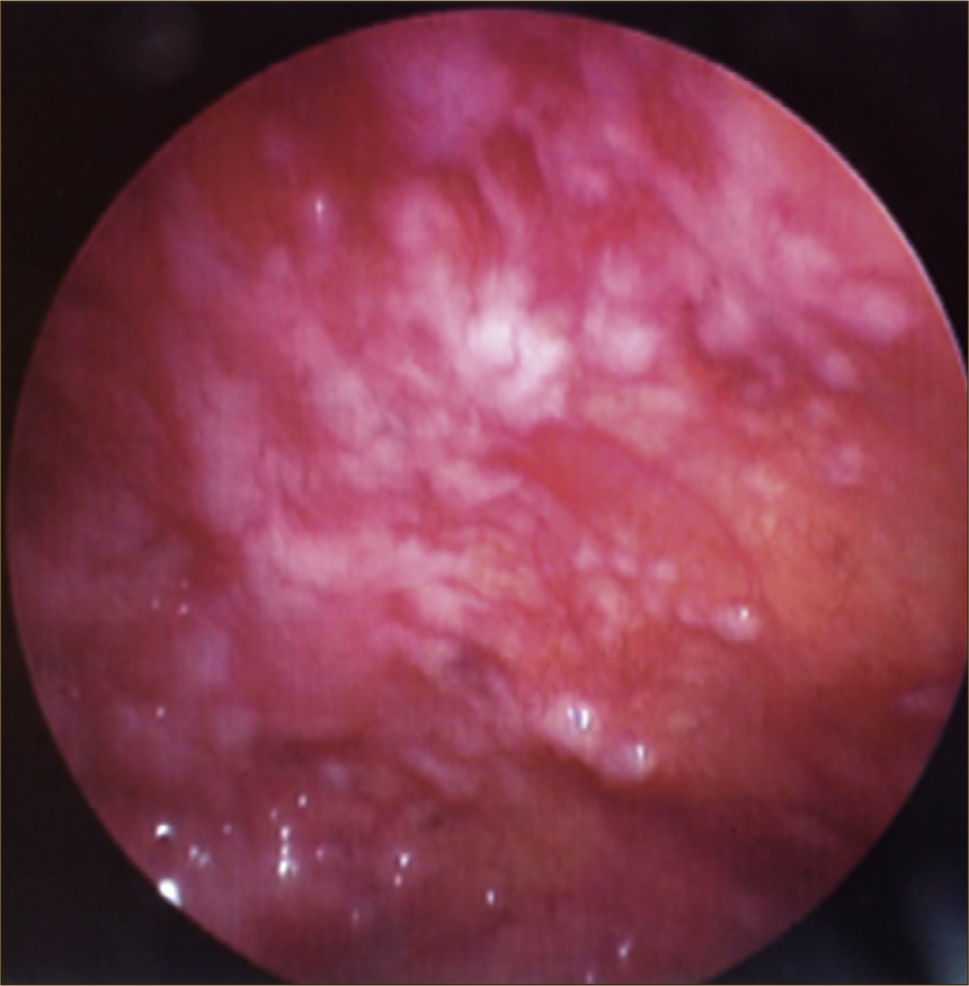
a) Biopsia pleural a ciegas con aguja (Abrams o COPE) (Figura 4): Consiste en biopsiar la pleura sin ninguna guía imagenológica. Está indicada en sospecha de TBC pleural ya que en esta patología el compromiso sobre la superficie pleural es homogéneo. Característicamente se observan granulomas, aunque no siempre se observarán con necrosis caseosa ni con bacilos ácido alcohol resistentes. El diagnóstico diferencial es con la sarcoidosis, la pleuritis reumatoidea y las infecciones fúngicas, sin embargo en más del 95% de los casos los granulomas en la pleura son secundarios a TBC pleural. Deben tomarse entre 4 y 6 biopsias. Una o dos de las biopsias deben ser enviadas en un frasco seco para cultivo. Las otras se envían en un frasco con formalina para biopsia. La combinación de la histología con un 80% de rendimiento y del cultivo de la biopsia con un 56% de rendimiento permite llegar al diagnóstico de TBC pleural en el 91% de los pacientes4,29,38.
La biopsia pleural por aguja de COPE tiene sensibilidad 50% para el diagnóstico de cáncer pleural y esto se debe a que el compromiso tumoral de la pleura parietal no es homogéneo sino salpicado y suele ser más extenso en las zonas más bajas de la pleura y en el diafragma, zonas que tienden a ser evitadas al puncionar mediante esta técnica39. En el derrame pleural maligno, cuando la citología del líquido ha sido negativa, la biopsia pleural percutánea a ciegas aumenta el rendimiento diagnóstico en sólo un 7%-26%. Éste no es el método de elección cuando hay sospecha clínica de carcinomatosis pleural. Las complicaciones más frecuentes son el dolor en el sitio de punción (1-15%), el neumotórax (3-15%), la reacción vagal (1-5%) y el hemotórax (2%)1,2,38,40,41.
b) Biospia pleural guiada por imágenes: ecografía o TAC. Esta técnica permite biopsiar engrosamientos pleurales. Se puede realizar con agujas 14 – 18G tipo tru-cut disparadas mediante un dispositivo automático con o sin acoplamiento a un sistema coaxial, obteniendo cilindros de tejido de 1-2cm de longitud. No requiere necesariamente de la presencia de líquido pleural, pero sí de engrosamiento pleural de al menos 2cm a la ecografía y de 0.5cm al TAC. Tiene alto rendimiento en casos de carcinomatosis pleural con citología negativa, con sensibilidad 70 – 87% y 100% de especificidad. Las complicaciones ocurren en el 5% de los casos y son el neumotórax, el sangrado, el hematoma de pared. Hasta el 7.5% presenta sangrado en el sitio de entrada, lo cual no requiere medidas adicionales. En casos de mesotelioma el riesgo de siembra tumoral es 10%23,42,43.
La preferencia en usar ecografía o TAC depende de múltiples factores como la preferencia del operador, la experiencia, disponibilidad de los equipos y los costos38. Usando la ecografía, la biopsia pleural puede ser guiada en tiempo real. La biopsia pleural guiada por imágenes tiene la desventaja de no permitir hacer intervenciones terapéuticas como pleurodesis en el paciente con derrame pleural maligno41.
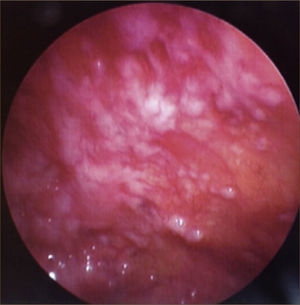
c) Toracoscopía. Es una técnica endoscópica que permite visualizar la cavidad pleural, tomar biospias y realizar tratamiento. Está indicada en el estudio de los exudados de causa desconocida y para hacer pleurodesis en el derrame pleural neoplásico y en ocasiones en derrames pleurales benignos refractarios a tratamiento médico, recidivantes y sintomáticos. En el manejo de la infección del espacio pleural, la toracoscopía en fase precoz permite debridar la cavidad, evacuar el pus y colocar catéteres en una localización óptima44.
La toracoscopía puede ser realizada por neumólogos (toracoscopía médica), o por cirujanos (videotoracoscopía).
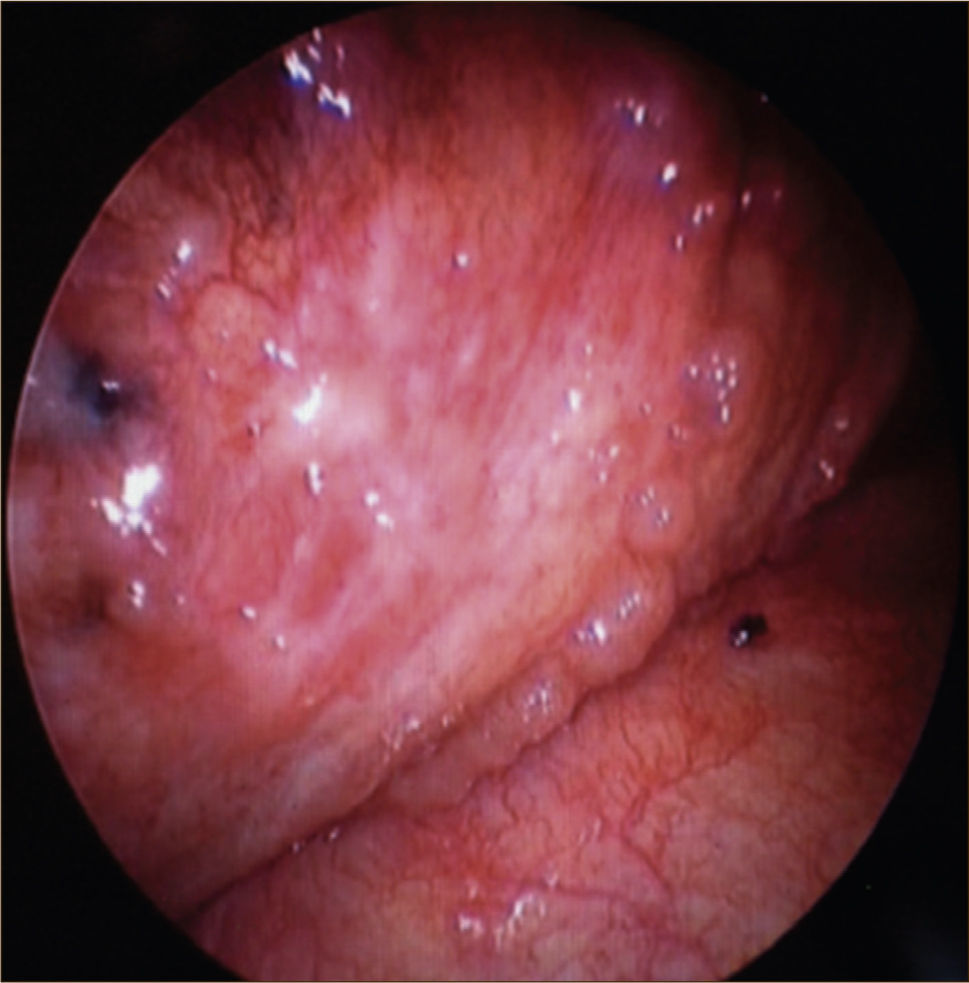
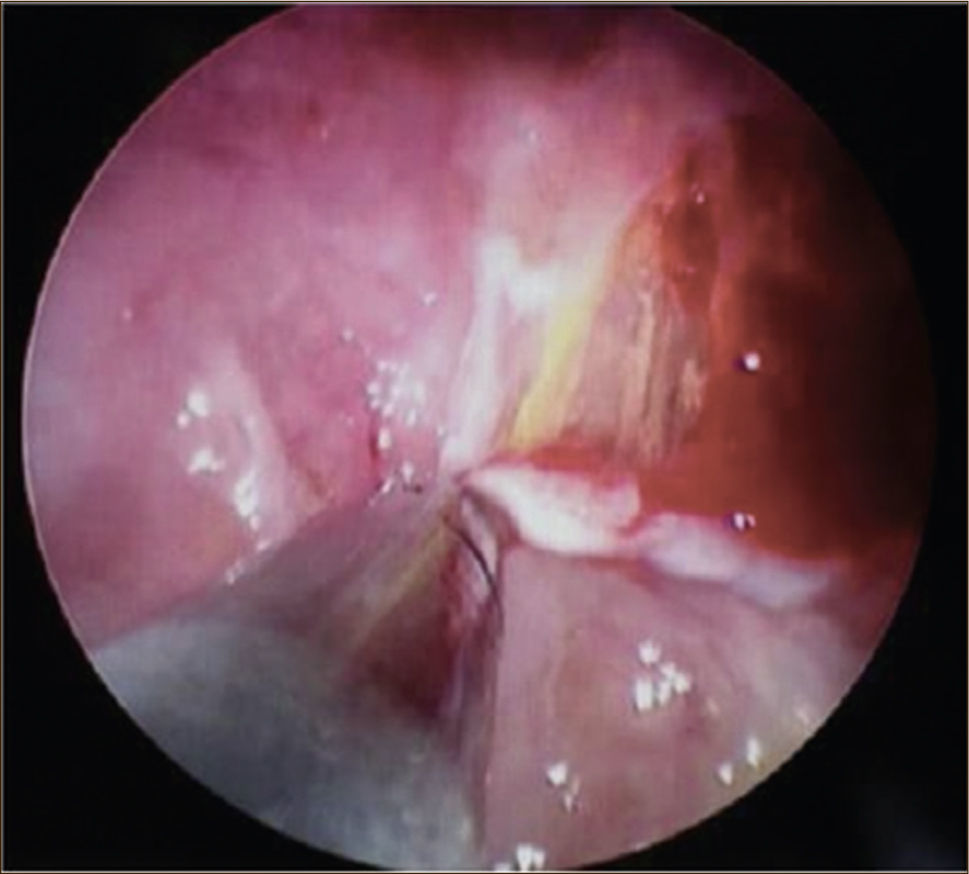
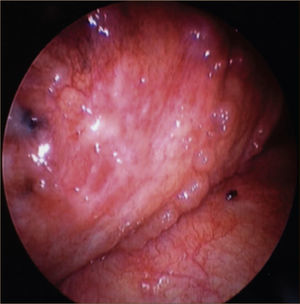
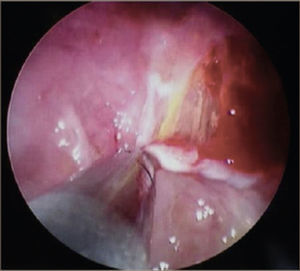
La toracoscopía médica puede ser realizada en sala de endoscopía o en pabellón, con anestesia local y sedación e.v. No requiere intubación. Se accede a la cavidad pleural por un portal de entrada de 10mm, no requiere de estadía en sala de postoperados en forma obligada. Se drena en forma segura todo el derrame contenido en la cavidad pleural y luego se inspecciona la cavidad. Permite tomar biopsias grandes bajo visión directa sobre la pleura parietal, pulmón y diafragma que permitirán hacer estudios moleculares y de inmunohistoquímica al tejido y además permite efectuar pleurodesis en el mismo procedimiento44. (Figuras 5–7).
El rendimiento diagnóstico de la toracoscopía es alto, de modo que evita tener que repetir otros procedimientos en los pacientes. Es el “gold standard” para el diagnóstico del derrame pleural maligno, con sensibilidad 93 – 97%. En el derrame tuberculosos la sensibilidad es 99%1,38,45.
Esta técnica está contraindicada en casos de obliteración del espacio pleural. Son contraindicaciones relativas la hipoxemia no explicada por el derrame, trastornos de coagulación, inestabilidad hemodinámica y la tos incontrolable. Las complicaciones son infrecuentes, se estiman en 1.8 a 7% y las más frecuentes son la fiebre, enfisema subcutáneo, fuga aérea mayor a 7 días, arritmias, empiema, sangrado y siembra tumoral en el trayecto del tubo de drenaje pleural en los mesoteliomas, lo cual ocurre hasta en el 13%.
La pleurodesis se efectúa con insuflación de talco estéril el cual es hasta la fecha el mejor agente sinfisante46. Al contactarse ambas hojas pleurales, y por la estimulación que provoca el talco, se produce inflamación con un desbalance en el sistema coagulación/fibrinólisis a favor de la formación de adherencias de fibrina y reclutamiento y posterior proliferación de fibroblastos con producción de colágeno. Todo esto lleva a la sínfisis de las pleuras parietal y visceral obliterando el espacio pleural. Se requieren 5 gramos de talco en el manejo del derrame pleural maligno y 2 gr en derrames pleurales benignos. Debe usarse talco de partículas grandes con un tamaño medio 25um para minimizar la diseminación extrapleural. Se han observado efectos sistémicos mediados por mecanismos inflamatorios como dolor, fiebre transitoria y activación de la coagulación, y Síndrome de distress respiratorio. Este último evento adverso no se ha descrito al usar talco de partículas grandes calibrado. Es interesante mencionar que el talco tendría propiedades proapoptóticas de las células tumorales y angiostáticas lo cual contribuye a controlar el derrame maligno47.
En los casos de derrame pleural maligno en que la pleurodesis falla porque no hubo re expansión pulmonar o cuando existe un derrame maligno sintomático y recidivante por pulmón atrapado, está indicado la colocación de un catéter pleural tunelizado. Son catéteres de 10 – 15.5 F que provocan mínimo disconfort, se insertan en forma tunelizada bajo la piel y bajo guía ecográfica. Tienen una válvula unidireccional y permiten que el paciente se conecte a un sistema de drenaje al vacío cada ciertos días de manera de ir evacuando el derrame en forma controlada. Estos catéteres han demostrado ser efectivos en reducir la magnitud del derrame y en aliviar la disnea y se ha reportado que hasta el 50% (11.8 – 76.4) de los pacientes consiguen una pleurodesis espontánea en promedio a los 52 días48. La presencia del catéter dentro de la cavidad estimula una reacción inflamatoria que favorece la obliteración del espacio pleural49.
También se ha postulado instalar durante la toracoscopía un catéter tunelizado, con lo que se ha logrado éxito de la pleurodesis hasta en el 92% y con sólo 1.79 días de estadía hospitalaria promedio. Se han reportado complicaciones por los catéteres tunelizados como lo son la celulitis o la siembre tumoral por el trayecto del tubo entre otros45,50.
La toracoscopía médica es un método diagnóstico y terapéutico seguro y efectivo, da rapidez y autonomía al neumólogo tratante en el estudio y manejo del paciente con derrame pleural. Existen amplias opciones de aprendizaje mediante cursos hands on en el mundo y debiera ser una técnica disponible en todo hospital o institución con unidad de neumología intervencional51,52.
SEGUIMIENTOPese a todo el estudio efectuado en distintas series, entre el 4 y hasta un 25% de los pacientes tienen diagnóstico histológico “pleuritis crónica inespecífica”. Estos son los verdaderos exudados de causa desconocida. En este grupo de pacientes, debe hacerse un seguimiento clínico y radiológico seriado durante dos años. Si en este lapso de tiempo el derrame persiste o aumenta debe repetirse la toracocentesis y la toracoscopía. En estudios de seguimiento a esta población, se ha establecido que entre el 4 y 8%, y en la población expuesta al asbesto hasta el 25% de los casos desarrolla a largo plazo una neoplasia, y la más frecuente es el mesotelioma pleural maligno2,4,41,51,53–55. La autora declara no tener conflictos de interés, en relación a este artículo.