El cáncer de mama es una enfermedad heterogénea que incluye una amplia gama de manifestaciones clínicas, radiológicas y patológicas. El proceso de diagnóstico y de tratamiento de mujeres portadoras de cáncer de mama es en esencia, multidisciplinario.
En este capítulo revisaremos las estrategias de diagnóstico por imágenes frente a la sospecha de malignidad. En patología se explican los conceptos más recientes de la clasificación molecular del cáncer de mama y su rol pronóstico y predictivo. En tratamiento locorregional se presentan las alternativas quirúrgicas, de radioterapia y de reconstrucción mamaria según la presentación de la enfermedad. En tratamiento sistémico se señalan las indicaciones de adyuvancia pre y postoperatoria, incluyendo las terapias endocrina, biológica y quimioterapia. En la etapa metastásica se revisan los distintos tratamientos que compatibilizan la prolongación de la supervivencia con la mejor calidad de vida posible. Finalmente presentamos una serie de intervenciones que constituyen el soporte emocional de las pacientes con cáncer de mama.
Breast cancer is an heterogeneous disease that includes a wide spectrum of clinical, radiological and pathological manifestations. Breast cancer patients diagnostic and therapeutic processes are essentially multidisciplinary.
In this chapter we will review diagnostic imaging strategies in front of a breast cancer suspicion. In pathology the most recent concepts in breast cancer molecular classification and its prognostic and predictive roles are explained. In locoregional treatment, surgical, irradiation and reconstructive alternatives are presented. In systemic therapy, adjuvant and neoadjuvant indications are pointed out including endocrine and biological therapies and chemotherapy. In metastatic stage, different therapies that fit together life prolongation and quality of life are reviewed. Finally we show a series of interventions which constitute the emotional support of breast cancer patients.
La recomendación para iniciar el estudio en una mujer sintomática mayor de 35 años o con hallazgos sospechosos en una mamografía de tamizaje es la mamografía diagnóstica.
La mamografía diagnóstica incluye además de las proyecciones basales craneocaudales y oblicuas, proyecciones adicionales, siendo las más comunes las compresiones focalizadas y las magnificaciones.
Actualmente se recomienda la mamografía digital, que tendría mayor sensibilidad para el diagnóstico de cáncer respecto a la mamografía análoga en las mujeres con mamas densas y en las perimenopáusicas.
Luego de completar exhaustivamente el estudio el hallazgo se caracteriza según el léxico sugerido por Breast Imaging Reporting and Data System (BIRADS®).
BIRADS 3, hallazgo probablemente benigno, sugerir una mamografía unilateral y/o proyecciones específicas en 6 y 12 meses y luego anual por 2 a 3 años para recategorizar como BI-RADS 2. Si hay cambios debe sugerirse estudio histológico.
BIRADS 4 y 5 incluyen nódulos espiculados, microcalcificaciones y asimetrías focales sospechosas. Son hallazgos probablemente malignos y de alta sospecha de malignidad respectivamente y deben ser estudiados con histología.
Toda vez que la lesión sospechosa en mamografía sea visible en ultrasonido debe ser éste el método de elección por sobre la biopsia estereotáxica para realizar la toma de muestra para el estudio histológico ya que éste es un procedimiento más cómodo, más rápido y más barato para la paciente. La biopsia estereotáxica se efectúa especialmente en los casos de microcalcificaciones o nódulos o asimetrías sin representación ecográfica.
Los hallazgos mamográficos sospechosos se estudian complementariamente con ecografía, la que puede caracterizar mejor algunos nódulos, demostrar una masa en relación a microcalcificaciones o distorsiones de la arquitectura. También puede demosrtar un segundo foco sospechoso no visible en la mamografía.
En las mujeres menores de 30 años con una lesión palpable se sugiere iniciar el estudio con ecografía, sin embargo se debe considerar complementar con mamografía en los casos de hallazgo ecográfico BI-RADS 4 o 5, malignidad confirmada en biopsia core y ecografía negativa con clínica sospechosa. Si la lesión encontrada en la ecografía es un nódulo sólido y se considera probablemente benigno BI-RADS 3 lo que equivale a un 2% de sospecha de malignidad, la indicación es controlar con ecografía en seis meses para constatar la estabilidad de la lesión y luego controlar de forma anual.
Otros hallazgos son las lesiones quísticas complejas que tienen un componente sólido como la pared focalmente engrosada, septum engrosado o masa intraquística, los que presentan un riesgo de malignidad de 10 a 20% por lo que deben estudiarse con citología o biopsia.
En las pacientes con lesiones BI-RADS 4 y 5, y con adenopatías axilares palpables, es recomendable efectuar punción citológica con aguja fina de dichas adenopatías.
A todos los diagnósticos histológicos obtenidos por punción percutánea tanto en la bopsia core bajo ecografía como en la biopsia estereotáxica se les debe analizar la correlación patológica-imaginológica en el contexto de un comité multidisciplinario. En caso de no haber correlación y de mantenerse la sospecha de cáncer, se debe resecar la lesión al igual que las lesiones de alto riesgo.
Las lesiones de alto riesgo son hiperplasia atípica, neoplasia lobulillar in situ, lesiones que producen mucina, lesiones fibroepiteliales con sospecha de tumor filodes, lesiones papilares, cicatriz radiada y otras histologías que pudieran ser sugeridas por el patólogo.
Algunos de los hallazgos mencionados, como la hiperplasia atípica, pueden constituir además un subdiagnóstico de la punción, es decir que coexista en su cercanía una lesión maligna que no aparezca en la biopsia. Una vez confirmado el diagnóstico el cáncer se puede efectuar resonancia magnética para estudio de etapificación. Este método está especialmente recomendado en pacientes jóvenes o en pacientes con mamas densas.
En nuestro medio, el Consenso de la Sociedad Chilena de Mastología recomienda considerar que la Resonancia Magnética Mamaria (RMM) tiene mayor utilidad y cuando existe en el carcinoma lobulillar infiltrante y podría tenerla en otros subgrupos como en las pacientes jóvenes, en los tumores mayores de 2 cm, en las mamas densas, tumores con márgenes irregulares en mamografía, discrepancia de tamaño entre los exámenes convencionales y sospecha de carcinoma intraductal extenso (2).
Clasificación molecular del cáncer de mamaTradicionalmente los cánceres mamarios han sido clasificados en tipos ductal y lobulillar. Un pequeño porcentaje son “carcinomas de subtipo especial”. Importante en la clasificación morfológica es el grado tumoral que incorpora: formación de túbulos, pleomorfismo nuclear y proliferación celular. Este sistema ha proporcionado información pronóstica útil (3). Seguimiento a largo plazo ha mostrado un excelente pronóstico para tumores grado I de Nottingham y pobre supervivencia para tumores grado III (4, 5). La clasificación morfológica a pesar de sus ventajas, tiene inconvenientes: no diferencia supervivencia libre de enfermedad y supervivencia global entre tumores ductales y lobulillares. Hay pobre reproducibilidad interobservador, especialmente cuando la graduación es hecha por patólogos no especialistas en mama.
La necesidad de distinguir diferentes grupos pronósticos entre pacientes con tumores de características similares o idénticas, el poder predecir la respuesta a distintos agentes terapéuticos en pacientes individuales y por lo tanto poder escoger el tratamiento correcto, en el momento preciso para una enferma individual, han promovido la clasificación molecular del cáncer de mama (6).
El año 2000 Perou y su grupo describieron subtipos moleculares del cáncer mamario, usando microarreglos de cADN. Seleccionaron 1753 genes en 65 especímenes quirúrgicos. La muestra tumoral experimental fue marcada con un nucleótido fluorescente y las referencias con otro nucleótido fluorescente. La abundancia relativa de las dos copias fue visualizada usando una imagen seudocoloreada con la relación de intensidad de fluorescencia roja a verde en cada sitio. Los perfiles moleculares creados mostraron similitudes y diferencias entre tumores relacionados con variables biológicas tales como velocidad de crecimiento y composición celular. Clave para el estudio fueron 22 tumores con doble muestreo (20 con muestras previas y posteriores a terapia con doxorrubicina y 2 tumores pareados con sus metástasis ganglionares). La gran mayoría de los tumores tenía más similitudes entre sus dos muestras que con cualquier otro tipo de especimen (cada tumor es único y tiene una firma genética distintiva). Luego seleccionaron en 115 cánceres, 534 genes (“set génico intrínseco”) (7-9).
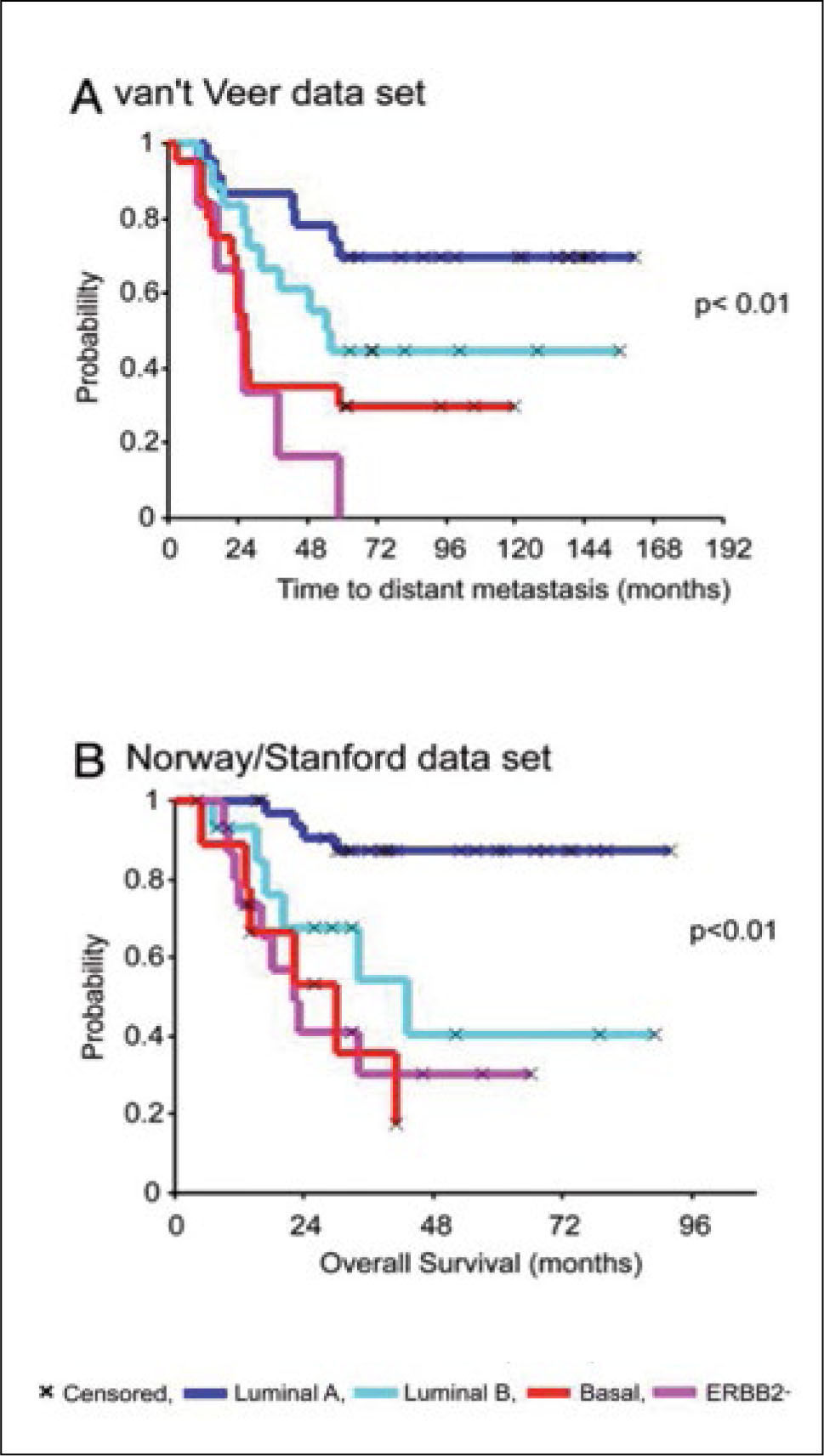
La clasificación molecular reveló cinco clases distintivas de carcinoma: luminal A, luminal B (incluye los inicialmente considerados luminales C), erbB 2 (HER 2), basal–símil y mamario normal símil (Figura 1 y Tabla 1). Este último grupo correspondería a una categoría artificial, producto de falla de muestreo (10).
La validez de esta clasificación ha sido testeada por otros investigadores respecto a la supervivencia global y a la supervivencia libre de enfermedad. Los grupos basal símil y erbB2 (previo al uso de herceptina) mostraron la peor evolución, los luminales A, la mejor, y el luminal B una evolución intermedia (8, 9) (Figura 2).
Parker (11) hizo aplicable la técnica a tejido incluido en parafina. Estudió 1906 genes de 189 tumores de publicaciones previas (8, 9). 50 genes fueron seleccionados por tener el menor error de validación cruzada. Este método de predicción para cada subtipo fue llamado PAM 50. De él derivaron dos escores, uno mejoró la predicción de riesgo en pacientes no tratados de cualquier subtipo; el otro predijo la eficacia de la terapia neoadyuvante (taxanos y antraciclinas) con un valor para respuesta patológica completa de un 97%.
Desde el punto de vista patológico, la inmunotipificación puede aproximarnos a los subtipos moleculares, usando tres marcadores: receptores de estrógeno, receptores de progesterona y HER 2 (12-15) (Tabla 2). Cheang (16) refinó la categorización de cánceres luminales B. Destacó que alrededor de un 30% de estos, muestran sobreexpresión HER2. Los demás pueden ser separados de los luminales A, pues tienen un índice proliferativo (Ki-67) de 14% o más. Los cánceres basales símiles, en su mayor parte son negativos para receptores hormonales y HER 2 (triple negativos), y de éstos entre el 70 y el 80% tienen expresión basal símil. Nielsen (17) con un panel de 4 anticuerpos (receptores de estrógeno, HER 2, EGFR y citoqueratinas 5/6) identifica cánceres basal símiles con una especificidad de 100% y sensibilidad de 76%. Blows (18) usando 5 anticuerpos (receptores de estrógeno y progesterona, HER2, citoqueratinas 5/6 y EGFR) define 6 subtipos de carcinomas mamarios con diferencias en su evolución a corto y largo plazo. En todo caso la clasificación molecular está aun en desarrollo. Recientemente Prat (19) propone una definición más estricta para tumores luminales A: deben tener receptores de estrógeno positivos, receptores de progesterona sobre un 20% y Ki-67 menor de 14%. Un punto de cautela en tumores con caracteres histológicos basal símil: no todos ellos implican un mal pronóstico; subtipos especiales de carcinomas mamarios como el adenoideo quístico, secretor y medular son “triple negativos”.
Oncotype, Mammaprint y otros sistemas de estudios moleculares pronósticos, tienen como parte importante genes de proliferación celular como el Ki-67 (MIB-1). La heterogeneidad de los tumores, las pequeñas muestras utilizadas y la falta de una adecuada estandarización hacen necesaria cautela en la interpretación de estos análisis y sus resultados. Luporsi (20) en una revisión sobre Ki-67 encontró grandes diferencias en la metodología de estudio, con infrecuente uso de automatización en la inmunotinción y puntos de corte entre 5 y 34%. Éstos debieran ser reproducibles en forma relativamente segura. El consenso de St. Gallen (21) estableció tres niveles para Ki-67: bajo, igual o menor a 15%; alto, sobre 30%, e intermedio, entre 16 y 30%. En el trabajo diario, un punto de corte de 25% podría ser práctico (22).
Las Tablas 3A y 3B modificadas de Rosai (23) proporcionan una adecuada sinopsis de este complejo tema.
Características del ca de mama según patrón de expresión génica
| Luminal A | Luminal B | HER2 | Basal símil | |
|---|---|---|---|---|
| Patrón de expresión génica | Expresión de CK luminales (de bajo PM). Alta expresión de receptores hormonales y genes asociados | Expresión de CK luminales (de bajo PM). Moderada a débil expresión de receptores hormonales y genes asociados | Alta expresión de HER2 y genes relacionados. Baja expresión de receptores de estrógeno y genes asociados | Alta expresión de CK basales (alto PM) y sus genes. Baja expresión de receptores de estrógeno, HER2 y genes asociados |
| Caracteres clínicos y biológicos | 50% de tumores invasivos. RE/RP (+). HER2 (-). | 20% de tumores invasivos. RE/RP (+). HER2 variable Mayor proliferación que luminal A. Tienden a tener mayor grado histológico | 15% de tumores invasivos. RE/RP (-). HER2 (+) Alta proliferación. Mutación TP53 común. Tienden a tener alto grado histológico y ganglios positivos. | 15% de tumores invasivos. Mayoría RE/RP/ HER2 (-). Alta proliferación. Mutación TP53 común. Disfunción de BRCA1 esporádica. |
Tipos de respuesta según patrón de expresión génica
| Luminal A | Luminal B | HER2 | Basal símil | |
|---|---|---|---|---|
| Correlación histológica | Ca. tubular Ca cribiforme Ca ductal NOS Ca lobulillar clásico | Ca ductal NOS Ca micropapilar | Ca ductal NOS de alto grado | Ca ductal NOS de alto grado Ca metaplásico Ca medular |
| Respuesta a tratamiento y evolución | Responde a terapia endocrina. Respuesta variable a QT. Buen pronóstico | Respuesta a terapia endocrina, puede no ser tan buena como en luminal A. Respuesta variable a QT, mayor que en luminal A. Pronóstico no tan bueno como luminal A. | Responden a Herceptina. Respuesta a QT con antraciclinas. Pronóstico asimilable a luminales B con Herceptina. | No responden a terapia endocrina ni a Herceptina. QT actualmente en discusión. Generalmente pobre pronóstico (pero no uniformemente pobre). |
En resumen, en la actualidad la clasificación molecular no se usa directamente en los informes patológicos de cánceres mamarios. Sin embargo, la inclusión de los resultados inmunohistoquímicos para receptores de estrógeno, progesterona, HER 2, en conjunción con el grado histológico e índice mitótico pueden hacer inferir los subtipos luminal A, luminal B, HER 2 y basal símil, permitiendo su mejor clasificación en cuanto a pronóstico y manejo terapéutico.
Tratamiento quirúrgico del cáncer de mamaAnalizaremos en forma separada la cirugía del cáncer in situ y del cáncer invasor.
Carcinoma ductal in situ (CDIS)Es una condición premaligna de la mama que incluye una serie de lesiones relacionadas, cuya característica común es una proliferación de células cancerosas confinada al interior de los conductos, sin evidencia de invasión del estroma a través de la membrana basal de dichos conductos (24).
El diagnóstico del CDIS se realiza mayoritariamente por la detección de microcalcificaciones en mamografías efectuadas como tamizaje. Las opciones de cirugía para el CDIS son la cirugía conservadora seguida de radioterapia (RT) o la mastectomía total.
El propósito de la cirugía conservadora en el CDIS es obtener márgenes negativos, ya que se ha mostrado que el principal factor de riesgo para la recurrencia en esta enfermedad es el compromiso de los márgenes (25).
La probabilidad de recurrencia local (RL) es aproximadamente 8% a 5 años después de cirugía conservadora seguida de radioterapia post operatoria (26).
La mastectomía prácticamente no presenta recurrencia (27).
Carcinoma invasor:
Cirugía en la mamaLas principales opciones del tratamiento quirúrgico del cáncer invasor son el tratamiento conservador de la mama o la mastectomía, con re-construcción mamaria inmediata o sin ella, dependiendo del deseo y de las condiciones de la paciente.
Históricamente, el tratamiento conservador de la mama fue descrito por primera vez en 1924 por el cirujano inglés Sir Geoffrey Keynes quien utilizó semillas de radio como tratamiento adjunto a la cirugía e informó una tasa de supervivencia a 5 años del 77% para las pacientes con ganglios clínicamente negativos y del 36% para las pacientes con ganglios clínicamente positivos.
En 1939 Vera Peters, oncólogo radioterapeuta de Toronto, comenzó a tratar con radioterapia (RT) a pacientes que habían recibido una cirugía con conservación de la mama.
Los resultados de los ensayos individuales que comparan la mastectomía con la cirugía conservadora y los resultados de un metaanálisis de todos estos ensayos, han demostrado una supervivencia equivalente a largo plazo con ambas técnicas (28).
En todos estos estudios el tratamiento conservador es seguido de irradiación de la mama completa.
Recientemente se están realizando estudios en los que se utiliza irradiación parcial acelerada de la mama, tema que se analizará más adelante. Se entiende por cirugía conservadora en cáncer de mama, la extirpación del tumor rodeado completamente por grasa subcutánea o tejido mamario normal.
El objetivo de la cirugía con conservación de la mama es extirpar el tumor completo alcanzando una tasa de RL baja, pero manteniendo los mejores resultados estéticos y funcionales, hecho que se asocia a una mejor calidad de vida debido a una imagen corporal sin mutilación. El tratamiento conservador está indicado en un alto porcentaje de pacientes con cáncer de mama en etapa clínica I o II. Estas pacientes deben ser seleccionadas cuidadosamente mediante una anamnesis rigurosa, un examen clínico que evalúe la relación entre el tamaño del tumor y el tamaño de la mama junto con el análisis de las imágenes. Asimismo, la preferencia de la paciente es esencial para elegir la técnica a efectuar. La RL se define como la recurrencia del tumor en el sitio del primario, en el mismo cuadrante o cerca de él.
Diversos estudios, aleatorios prospectivos y retrospectivos que comparan la cirugía conservadora más RT con la mastectomía radical han publicado tasas de RL del 5% al 19% en cirugía conservadora y del 4 al 14% para la mastectomía (29).
Otras publicaciones han reportado una tasa significativamente más alta de RL cuando se omite la RT después de la cirugía conservadora (30).
Por otra parte, la RT no compensa una cirugía insuficiente siendo el estado patológico de los márgenes de la resección, el factor más importante asociado con el riesgo de recidiva tumoral mamaria.
La información más reciente indica que la RL se ha logrado reducir a un 5% a 10 años de seguimiento. Esta cifra se puede explicar por los siguientes factores:
- 1.
La evaluación mamográfica preoperatoria detallada especialmente respecto de la detección de microcalcificaciones con el objeto de planificar su extirpación completa.
- 2.
El análisis patológico de los márgenes quirúrgicos de la pieza operatoria para verificar que estén libres de tumor y además consignar la distancia del margen al tumor.
- 3.
El uso cada vez más frecuente de tratamiento sistémico adyuvante cuyo objetivo es disminuir el riesgo de enfermedad a distancia, ha resultado ser efectivo al interactuar en forma favorable con la RT reduciendo en gran medida la tasa RL.
En la evaluación preoperatoria con imágenes, es controvertido el uso sistemático de la resonancia mamaria (RM) en una paciente con un cáncer de mama recién diagnosticado en quien se está considerando la posibilidad de tratamiento conservador de la mama.
Estudios han mostrado que la RM muestra focos adicionales de cáncer en la mama homolateral en un porcentaje considerable; este porcentaje de focos adicionales es mucho mayor que la tasa de RL a 10 años ocurrida en las pacientes sometidas a tratamiento conservador convencional sin evaluación pre operatoria con RM.
Los autores que cuestionan el uso de la RM mamaria de rutina argumentan que la alta tasa de falsos positivos encontrados en la RM conlleva a biopsias, demoras y costos innecesarios. Asimismo sostienen que no hay estudios clínicos que muestren mejores resultados, como una disminución de la RL o una mayor supervivencia, un cambio de indicación a mastectomía o una disminución en el número de reoperaciones asociados a la utilización rutinaria de la RM (31).
Las indicaciones de RM mamaria están descritos previamente en este artículo en relación al margen quirúrgico, ha habido discusión permanente acerca de cuánto margen libre de tumor es el adecuado en el tratamiento conservador.
El objetivo del cirujano es extirpar la cantidad adecuada de tejido alrededor del tumor para alcanzar márgenes negativos.
Según la experiencia de Kearney y Morrow con una resección entre 0,5 a 1 cm. de tejido mamario macroscópicamente normal se obtuvieron márgenes negativos del punto de vista microscópico en el 95% de 239 pacientes (32).
La evaluación macroscópica de los márgenes de la pieza operatoria es importante para garantizar una adecuada extirpación quirúrgica de la neoplasia. Cuando los márgenes están comprometidos se debe ampliar la resección.
Si se cuenta con el apoyo de anatomía patológica en el pabellón, es conveniente que el patólogo analice en ese momento los bordes de la pieza operatoria, los cuales se deben enviar claramente identificados por el cirujano, mediante tinta o puntos, señalando los bordes superior, lateral y superficial de esta pieza.
Lo habitual es procurar que el margen sea mayor a 2mm, pero un margen menor no es necesariamente indicación de mastectomía o de ampliación siempre y cuando no haya presencia de células tumorales en el margen de resección como se señaló anteriormente. Mención especial merecen los márgenes correspondientes a la fascia pectoral o a la piel, los que no son relevantes, ya que no hay tejido mamario más allá de estos límites.
Por otra parte, en las mujeres jóvenes menores de 40 años o ante la existencia de un importante componente de carcinoma intraductal peritumoral, es recomendable tener bordes negativos mayores a 2mm. Estos dos grupos de pacientes tienen una tasa de RL más alta que aquél que presentan las mujeres mayores incluso con márgenes negativos mayores de 2mm (33).
Tal como se señaló precedentemente, el agregado de quimio y hormonoterapia adyuvante han logrado disminuir la tasa de RL.
Un estudio retrospectivo mostró una reducción del 66% de las RL cuando las pacientes recibían hormonoterapia.
En el ensayo NSABP-B-13, a las pacientes con ganglios negativos y receptores de estrógeno negativos se les indicó aleatoriamente quimioterapia a un grupo, y al otro se les dejó sin ningún tratamiento sistémico. La tasa de RL a 8 años en la mama homolateral fue del 13.4 % en la rama sin tratamiento y de sólo 2,6 % en la rama con quimioterapia (34).
Las contraindicaciones para la conservación de la mama son el embarazo por ser una contraindicación absoluta para recibir RT, las pacientes portadoras de microcalcificaciones difusas de aspecto maligno, las pacientes con márgenes positivos después de la extirpación al límite de lo estéticamente aceptable y en aquéllas que han recibido RT en manto o en el mediastino previamente.
Cirugía en la axilaEl estudio estándar histopatológico de los ganglios axilares está indicado en los carcinomas infiltrantes de la mama y en los carcinomas ductales in situ extensos por la probabilidad de microinvasión.
En la axila clínicamente negativa o bien con citología negativa del ganglio axilar visualizado en la ecografía, está indicado el estudio histológico del ganglio centinela, procedimiento que se explicará a continuación. En la axila clínicamente positiva o con citología positiva es necesaria la disección axilar (DA).
El propósito de la DA es etapificar la enfermedad con respecto al compromiso axilar y consiste en la extirpación de los grupos ganglionares de los niveles I y II de Berg (31).
En resumen, el tratamiento conservador en el cáncer de mama contempla la mastectomía parcial asociada a la biopsia del ganglio centinela axilar y/o disección axilar seguida de radioterapia.
Biopsia de ganglio centinelaTal como ya se ha indicado, en la etapificación del cáncer de mama, es primordial conocer el estado ganglionar regional, lo cual influye en la elección del tratamiento sistémico más eficiente de esta enfermedad.
El examen clínico habitual puede hacer sospechar el compromiso metastásico de los ganglios axilares cuando éste es significativo, pero existe una importante probabilidad de error ante un compromiso mínimo, en que aún en manos expertas, es del orden de 25% tanto de sospecha como de ausencia de compromiso ganglionar axilar.
El gran problema de la DA es su morbilidad asociada: dolor crónico, parestesias o hipoestesias y el riesgo de linfedema de la extremidad superior.
En la actualidad, el diagnóstico del cáncer de mama se produce con mayor frecuencia en etapas más precoces y por lo tanto con menor riesgo de compromiso ganglionar en la axila. En etapas precoces el compromiso axilar es del orden del 15 a 25%, por lo que la DA sería innecesaria en el 75 a 85% de los casos.
Como concepto, el ganglio centinela (GC) corresponde al primer ganglio de una cadena que recibe el flujo linfático desde el tumor primario y como consecuencia recibiría las primeras células tumorales diseminadas por esta vía (Figura 3).
La técnica de biopsia del ganglio centinela (BGC), es un procedimiento mínimamente invasivo que se utiliza para reemplazar la DA en esta evaluación y disminuir la morbilidad asociada (35). Corresponde a la identificación y remoción de el o los primeros ganglios linfáticos donde drena el tumor primario de la mama afectada. De ser el o los GC negativos, el riesgo de positividad en otros, es mínima (36).
Hay 2 métodos que permiten identificar el GC. Uno de ellos consiste en observar la difusión de un radiofármaco asociado a un vehículo desde el tumor hasta los ganglios linfáticos a través de las vías linfáticas, llamado linfocintigrafía seguida de la detección in situ de radiación con un detector manual; el otro consiste en la utilización de un colorante, el azul patente, que permite visualizar el GC y sus vías aferentes al teñirse con este elemento (Figuras 4, 5), unos minutos después de la inyección subdérmica de este colorante en la región periareolar.
La utilización combinada de ambos métodos o técnica mixta, mejora los porcentajes de identificación y es, en general, la más recomendada (37-40). Su éxito se mide de acuerdo a la tasa de identificación (ID) y en función de una baja tasa de falsos negativos (FN). Requiere de un período de validación logrando sobre un 90% de ID y FN < al 5% (37, 38). Como complemento, se debe considerar la palpación intraoperatoria del lecho axilar y resección de cualquier ganglio sospechoso (41).
Hay indicaciones absolutas y recomendables de la BGC como tumores menores de 2 cm y axila clínicamente negativa, carcinoma intraductal extenso o carcinoma intraductal con microinvasión. Además recomendable la evaluación de la axila con ecografía. En caso de sospecha de compromiso metastásico, realizar punción citológica del ganglio bajo ecografía.
En la medida que se ha logrado más experiencia con el método, se han agregado nuevas indicaciones la BGC como pacientes obesas, enfermedad multifocal o multicéntrica, antecedente de cirugías mamarias previas y pacientes con indicación de quimioterapia neoadyuvante, condiciones que pueden provocar alteraciones en el drenaje linfático.
El hecho de contar con biopsia intraoperatoria realizada por anátomo patólogos especializados en el método constituye un gran aporte, pues la verificación de compromiso tumoral del GC permite efectuar la DA necesaria en forma inmediata, evitando un segundo tiempo quirúrgico (42).
Estudios clínicos recientes han determinado que ante la presencia de enfermedad microscópica ganglionar axilar, no necesariamente se requiere efectuar DA, pues los resultados con el manejo adecuado, no cambian el pronóstico del paciente (43).
Tendencias actuales en radioterapia del cáncer de mamaManejo conservadorLa mastectomía radical, descrita por Halsted hacia fines del siglo XIX permaneció por más de 60 años como el tratamiento estándar del cáncer de mama. Desde los años 70, el tratamiento conservador, que incluye cirugía parcial con disección axilar o con biopsia de ganglio centinela (44-46) seguida de RT post operatoria con o sin sobreimpresión en el lecho tumoral, indicada según edad, bordes e invasión (47, 48), se constituyó en el procedimiento de elección para el manejo del cáncer de mama temprano (49), obteniendo resultados similares a la mastectomía con relación al riesgo de diseminación y a la supervivencia (40, 50-55), limitando la indicación de mastectomía con o sin reconstrucción, a pacientes en quienes el manejo conservador está contraindicado. En los últimos años, este enfoque ha sido cuestionado, proponiéndose el uso de otras alternativas.
Omisión de RT en pacientes mayores con cáncer de mama de bajo riesgo tratadas con cirugía conservadora:
La RT reduce el riesgo de recurrencia local en un 70% y previene una muerte por cáncer de mama por cada cuatro recurrencias locales evitadas (56, 57). Aún no se ha identificado ningún subgrupo de pacientes que no se beneficie de la RT (58). En algunas publicaciones con seguimiento corto se propone cirugía conservadora sola seguida de tamoxifeno en pacientes mayores con tumores bien diferenciados, receptores hormonales positivos y bordes amplios (59, 60), presentando una tasa de RL a 10 años de un 10% en contra de un 2% en el grupo tratado con cirugía más radiación (61). Aunque la idea de evitar la irradiación puede resultar atractiva, el cáncer de mama en octogenarias no siempre es indolente (62) y el aumento en la expectativa de vida de una población que envejece (63) puede hacer posible una recurrencia tardía. Un estudio prospectivo de Harvard realizado en pacientes de bajo riesgo tratadas con cirugía conservadora sola mostró un 23% de recurrencias, hecho que motivó su cierre prematuro (64). Otro estudio aleatorizado finlandés efectuado en pacientes de bajo riesgo mostró una tasa de RL actuarial a 8 años de 27% (65). Por lo tanto, la omisión de la RT en el manejo conservador se podría plantear sólo en pacientes de bajo riesgo con expectativa de vida muy limitada por la existencia de comorbilidades o por edad extrema. El tamoxifeno si bien puede reducir la tasa de RL, no reemplaza a la RT (66) y no está exento de riesgos.
Radioterapia hipofraccionadaBasados en la experiencia de centros de Canadá y del Reino Unido con el uso de esquemas de RT postoperatoria acortados (67, 68), algunos ensayos aleatorios recientes han evaluado el control local y los efectos adversos usando RT sobre la mama completa en esquemas de fraccionamiento acelerado (69-73). El uso de esquemas hipofraccionados en cáncer de mama parece bastante lógico, considerando que la relación alfa/beta del cáncer mamario es cercana a 4 similar a los tejidos normales (68), por lo que, en teoría, se podría lograr tasas similares de control tumoral y de complicaciones además de menor proporción efectos cutáneos agudos (70, 74). Aunque los resultados iniciales parecen apoyar esta teoría, y en algunos casos favorecer el hipofraccionamiento (73, 75) se debe considerar que los ensayos mencionados no incluyen irradiación de pared torácica, de cadenas ganglionares ni de sobreimpresión en lecho tumoral, que muchas pacientes necesitan (76). Tampoco incluyen pacientes con tumores de mayor volumen, ni incluyen un número razonable de pacientes con terapia sistémica (77), por lo que mientras no se disponga de resultados con mayor seguimiento, el esquema hipofraccionado se debería limitar a pacientes mayores con bajo riesgo de RL después de cirugía conservadora cuando las condiciones individuales de la paciente dificulten efectuar una RT convencional.
Radioterapia parcial de mamaUno de los temas de mayor desarrollo y controversia es la irradiación parcial acelerada de la mama. Dado que la mayoría de las RL se presentan en la vecindad del lecho tumoral, la propuesta es irradiar solo ese sector de la mama con métodos que permitan reducir la duración del tratamiento a menos de una semana. Se han diseñado varias técnicas, que incluyen la irradiación intraoperatoria del lecho en fracción única, con electrones (78) o fotones de baja energía (79), braquiterapia intra (80) o post operatoria del lecho quirúrgico (81, 82), braquiterapia intersticial (83, 84) y RT externa conformal en múltiples campos con fraccionamiento acelerado (85). Su aplicación a pacientes de bajo riesgo hace improbable un impacto negativo en la supervivencia, pero persisten dudas sobre la probabilidad de RL tardía y secuelas debido al volumen y fraccionamiento empleados, existiendo varios reportes de complicaciones, en especial con terapia conformada 3D (86-90). En el caso de la RT intra operatoria, persisten dudas sobre la radiobiología de la fracción única y de la adecuada cobertura del lecho tumoral debido a la ausencia del informe patológico definitivo antes de la realización de la terapia. Hasta ahora sólo se ha publicado un estudio aleatorizado con una mediana de seguimiento de sólo 25 meses (91), por lo que, hasta tener más datos, esta técnica se debe continuar considerando experimental.
Radioterapia post mastectomíaLa RT post mastectomía radical es otro tema de debate. Tradicionalmente se ha indicado en pacientes con cáncer localmente avanzado, con tumor primario mayor a 5 cm o con más de tres ganglios comprometidos (92). Sin embargo, existe evidencia creciente en series canadienses y europeas, con seguimiento largo, que la RT beneficia también a pacientes con menos de 4 ganglios axilares comprometidos. Un análisis de los datos de la serie danesa DBCG 82 sugiere que el mayor impacto de la RT sobre la supervivencia global y específica por cáncer de mama se produce justamente en este grupo de pacientes de riesgo intermedio y bajo (93) mientras que el beneficio en pacientes con enfermedad más agresiva es fundamentalmente en el control local. Las pacientes con axila negativa y con compromiso vascular linfático asociado a otros factores pronósticos como tamaño tumoral, localización, grado histológico, subtipo biológico y edad también se podrían beneficiar con este tratamiento (94-97).
La creciente tendencia a usar reconstrucción mamaria inmediata luego de la mastectomía está planteando nuevos debates sobre la secuencia de tratamientos cuando existe indicación de RT. La aplicación de RT puede complicar los resultados de la reconstrucción mamaria (98), y ésta a la inversa, puede dificultar la posibilidad de efectuar una RT segura en términos de buena cobertura del objetivo, pared y eventualmente cadena mamaria interna y de brindar adecuada protección de los tejidos normales, en particular pulmón y miocardio (99) aún con las técnicas actuales de intensidad modulada. Por ahora no existen criterios definitivos que generen consenso en el enfoque terapéutico de estas pacientes y es necesaria la conformación de equipos multidisciplinarios que incluyan a cirujano oncológico de mama, cirujano plástico, radiooncólogo, oncólogo médico, enfermera y otros profesionales, para el desarrollo de un algoritmo local, con evaluación prospectiva de los resultados y participación en estudios prospectivos.
Reconstrucción mamaria (RM)Constituye la reposición de tejido con el objeto de recuperar un volumen que reemplace la ausencia de una mama.
La mastectomía continúa siendo una indicación de tratamiento en algunas pacientes con cáncer de mama y la RM ha mostrado que puede disminuir el impacto emocional que significa la pérdida de una mama.
Está indicada en todas las pacientes que deban someterse a una mastectomía, que se encuentran en buenas condiciones de salud y que no tengan enfermedad diseminada.
La RM forma parte de la cirugía oncoplástica de la mama en la que se combinan aspectos reconstructivos y estéticos para obtener los mejores resultados.
Existen numerosas opciones de reconstrucción que incluyen el uso de tejido autólogo colgajos pediculados y libres; expansores e implantes y por último técnicas de reducción y pexia mamaria para simetrización.
Para decidir el momento y el tipo de RM debe realizarse una cuidadosa evaluación de las condiciones generales de la paciente como edad, obesidad, hábito de cigarrillo y enfermedades que pueden afectar el resultado o la capacidad de la paciente para tolerar el procedimiento. Por otra parte deberán evaluarse los tejidos del tórax y de la pared abdominal.
En cuanto a las opciones de temporalidad de la reconstrucción mamaria, y entendiéndose ésta como parte del tratamiento integral del cáncer mamario, ésta debe insertarse adecuadamente en la secuencia de terapias propias de la patología, de manera que no afecte el tratamiento efectivo de la enfermedad tumoral.
Todos estos factores determinan las distintas modalidades de reconstrucción:
1. Reconstrucción mamaria inmediata, que se realiza en el mismo tiempo quirúrgico de la mastectomía o resección tumoral. Es ideal en casos que no requerirán radioterapia posterior y en mastectomías con conservación de piel, pero útil en cualquier tipo de mastectomía. Se reporta que provee mejores resultados estéticos (100).
Sus indicaciones son en pacientes con cáncer de mama in situ extenso y en enfermas con etapas tempranas I y II, que no pueden realizarse una cirugía conservadora
2. Reconstrucción mamaria diferida, la cual se realiza en forma tardía, de manera de no ser afectada, ni afectar a su vez el normal desarrollo de la radioterapia adyuvante cuando ésta es requerida. Esta opción es también útil en pacientes que no tienen clara la indicación de reconstrucción o en aquellas que por razones emocionales no se encuentran dispuestas a la cirugía de reconstrucción inmediata.
Otros factores que también influirán en la toma de decisiones son el hábito corporal de la paciente que determina la disponibilidad de tejido para las reconstrucciones autólogas, las comorbilidades que limitan el uso de algunas técnicas, las características de la resección que determinan el área y el volumen del defecto a reconstruir y dentro de este ítem, la eventual conservación de piel e incluso del complejo aréola pezón.
Opciones para la reconstrucción mamariaA. Reconstrucciones con aloplásticos (expansores, implantes, matrices dérmicas acelulares), recomendadas para reconstruir mamas idealmente de pequeño a moderado tamaño. Se planifican de manera de no exponer el implante a radioterapia por complicaciones de éste y por las limitaciones que su presencia determina en la administración de radioterapia. Puede realizarse la llamada reconstrucción secuencial en que se instala un expansor en forma inmediata, este se irradia con volúmenes menores a su capacidad total, se completa su expansión post radioterapia para su posterior cambio por implante definitivo (101). Este cambio a prótesis definitiva en tejido irradiado presenta altas complicaciones por lo que, en la actualidad, se sugiere mejorar la zona de la neomama con lipotransferencia. Otra alternativa es cambiar el expansor por un colgajo miocutáneo del abdomen.
B. Reconstrucciones con tejido autólogo. Consideradas hasta hoy las reconstrucciones ideales por su mejor resultado estético, menor tasa de complicaciones y mayor estabilidad de los resultados en el largo plazo. Dentro de éstas se encuentran variadas alternativas de colgajos pediculados: colgajo músculo cutáneo del recto anterior del abdomen (TRAM), colgajo latissimus dorsi (músculo cutáneo del dorsal ancho). También existen los colgajos libres como el TRAM libre, TRAM libre con conservación de músculo, el colgajo cutáneo adiposo de perforantes de epigástrica inferior profunda (DIEP), el colgajo de la arteria epigástrica inferior superficial (SIEA), cada cual con sus características de volumen, dificultad operatoria, morbilidad y resultados. Sus desventajas radican en que son cirugías más agresivas, más demandantes técnicamente y que requieren estadías hospitalarias más prolongadas, y que incluyen zonas donantes con potenciales complicaciones.
C. Reconstrucciones mixtas, que combinan el uso de tejido autólogo e implante, siendo el mejor ejemplo el uso de colgajo muscular de latissimus dorsi e implante mamario. Este último provee el volumen que el músculo por sí solo no es capaz de aportar, y el músculo brinda una cobertura suficiente y estable al implante.
D. Cirugía oncoplástica. En el campo llamado “cirugía oncoplástica” se hace uso, en mamas con volumen suficiente y tumores relativamente pequeños o de moderado tamaño, de técnicas de reducción y pexia mamaria. Estas permitirán resección adecuada del tumor, remodelando la mama remanente con las mencionadas técnicas y simetrizando en forma inmediata la mama contralateral, obteniendo resultados de volumen y simetría adecuados (102).
E. Lipotransferencia. Finalmente no puede dejar de mencionarse el creciente uso de la lipotransferencia como método complementario a la reconstrucción mamaria, que permite mejorar el resultado estético sobre todo en casos de contorno irregular o asimétrico de la mama reconstruida. Se recomienda su uso con cautela especialmente en pacientes tratadas por cáncer in situ, a falta de estudios bien diseñados de largo plazo que reafirmen la seguridad oncológica de este método (103). En la actualidad hay evidencias que la lipotransferencia se puede utilizar ampliamente después de una mastectomía y reconstrucción mamaria por cáncer de mama.
En resumen puede decirse que hoy existe un amplio arsenal de técnicas en reconstrucción mamaria, con las cuales el cirujano reconstructor puede ofrecer la alternativa de tratamiento más adecuada. Para esto deben considerarse múltiples factores, características del defecto a reconstruir, características corporales, emocionales y comorbilidad de la paciente, necesidad de terapias adyuvantes, capacidades técnicas del cirujano y limitaciones de la institución. Una adecuada elección permitirá un resultado exitoso y mejorar significativamente la calidad de vida de una paciente con cáncer de mama en la que deba realizarse una mastectomía.
Terapia adyuvante sistémica (TAS)Se realiza para disminuir el riesgo de aparición de metástasis a distancia a consecuencia de la persistencia de células cancerosas luego de la erradicación del tumor primario. Durante el tiempo de desarrollo del cáncer se producen siembras celulares que son indetectables con cualquier examen de imágenes. La TAS también reduce el riesgo de RL, pero no remplaza el rol principal de reducción de estas recaídas aportado por la RT.
Las ventajas de esta estrategia han sido demostradas desde hace varios años con los metaanálisis de Oxford (104). La selección de la necesidad de TAS y el tipo de terapia se han basado en los factores pronósticos clásicos: edad (mal pronóstico en menores de 35 años), tamaño tumoral, grado histológico, invasión linfática, índices proliferativos, presencia o ausencia de receptores hormonales (de estrógeno y progesterona) presencia de c-erbB2 y en el estado de los ganglios axilares.
En las decisiones de TAS se han definido como primer punto de atención, la presencia de marcadores con características predictivas del éxito de las terapias. Estos son los receptores de estrógeno (ER), de progesterona (PR) y de c-erb B2.
La aplicación de los factores pronósticos permite evaluar si la terapia produce una ganancia en supervivencia que justifique los efectos secundarios de la terapia, especialmente al indicar quimioterapia. Los factores predictivos, marcadores tumorales y c-erbB2 indican o predicen una buena respuesta al tratamiento indicado.
Se debe analizar cada caso en un comité multidisciplinario. Hay elementos adicionales que se pueden emplear como la página www.adjuvant on line.com con estimaciones de las ganancias con determinada terapias, pero desafortunadamente no considera la influencia de cerbB2.
Además hay dos estudios multigénicos que pueden ayudar la decisión de usar o no quimioterapia: Oncotype Dx y Mammaprint. Ambos se basan en análisis retrospectivos y están en curso estudios fase III para evaluar su efectividad. Tienen la dificultad de su alto costo. El Oncotype tiene mayor soporte de estudios retrospectivos y podría ser usado en casos de difícil resolución como por ejemplo tumores de 0,6 cm a 1 cm con factores desfavorables o tumores de más de 1 cm con axila negativa, ER positivo y cerbB2 negativo.
Los tumores de menos de 0,5 cm, con axila negativa y ER positivo tienen un excelente pronóstico y no requieren de terapia sistémica, salvo el uso de tamoxifeno para proteger la mama contra lateral de un segundo primario.
En los tumores de 0,5 a 1 cm, siempre con axila negativa, hay que considerar la presencia de factores desfavorables como grado histológico II o III, invasión linfática, edad menor de 35 años, RE y RP negativos y cerbB2 positivo. Si no hay factores desfavorables y con ER y/o RP positivos sólo requieren uso de terapia endocrina (TE). En presencia de factores desfavorables, será necesario administrar quimioterapia.
En tumores mayores de 1 cm, con axila negativa, si los receptores hormonales (RH) son negativos, deberán recibir quimioterapia. En caso de tener RH positivos se hará primero quimioterapia y luego TE. El uso simultaneo de quimioterapia y TE es perjudicial (105). Esta indicación es discutida por grupos europeos que administran sólo TE (106).
En el caso de axila positiva se utilizará siempre quimioterapia agregando luego TE si los RH son positivos. El grupo austríaco de cáncer de mama ha empleado sólo TE en pacientes con menos de 10 ganglios afectados (106).
Terapia endocrinaEstá indicada sólo cuando los RH son positivos.
El tamoxifeno es el medicamento de efectos positivos más sólidamente demostrados. Es efectivo en las pacientes postmenopáusicas y también en las premenopáusicas. La duración del tratamiento debe ser de por lo menos 5 años. Estudios recientes han señalado mejores resultados al prolongar la administración a 10 años (107).
En las pacientes premenopáusicas la supresión ovárica, química, quirúrgica o radiante, es también una terapia efectiva (104). Si la paciente ha tenido quimioterapia, la supresión ovárica no agrega nada a lo obtenido ya con la quimioterapia.
En las pacientes postmenopáusicas se cuenta además con otro tipo de medicamentos, los inhibidores de aromatasa. Hay tres: letrozole, anastrozole y exemestano. No hay diferencias de actividad entre ellos. Se han usado en remplazo del tamoxifeno por 5 años o por 2 a 3 años luego de 2 a 3 años de tamoxifeno. Finalmente sólo letrozole se ha usado al término de los 5 años de tamoxifeno con una extensión de 5 años adicionales. En general se ha demostrado diferencias significativas a favor de su uso sobre el tamoxifeno exclusivo, pero las diferencias son clínicamente pequeñas (108). En general se recomienda agregar en algún momento un inhibidor de aromatasa luego de 3 años o 5 años de tamoxifeno. Reservamos el uso inicial y exclusivo de un inhibidor de aromatasa en las pacientes con mayor riesgo, por ejemplo con axila positiva.
Durante la administración de tamoxifeno se debe evitar el uso de anti depresores rescatadores de la serotonina, como fluoxetina y paroxetina que inhiben la enzima CYP2D6 impidiendo la transformación del tamoxifeno en su principio activo, el endoxifeno.
QuimioterapiaHay diversos esquemas de quimioterapia de eficacia demostrada. Tres son los esquemas preferidos en las guías estadounidenses del National Comprehensive Cancer Network (NCCN): 4 ciclos adriamicina con ciclofosfamida (AC) seguido de taxol® semanal por 12 semanas, 4 AC seguido de 4 ciclos con taxol®, administrados semana por medio con apoyo de factores de estimulación de granulocitos (dosis densa) y 6 ciclos de taxotere® y ciclofosfamida (TC) (1). En el caso de pacientes con sobre expresión de c-erbB2 se debe agregar trastuzumab por 1 año (109). Estudios retrospectivos señalan que en estas enfermas sería preferible incluir esquemas con antraciclinas.
Terapia sistémica preoperatoria del cáncer de mama“Cáncer de mama no es una sola enfermedad aún cuando pueda tener una misma histología. La única cosa que comparten los cánceres de mama es que se originan en un mismo órgano”(110).
Si compartimos este paradigma es indudable que es necesario tratar a cada paciente portadora de un cáncer de mama de una manera lo más personalizada posible. Sin embargo, no hay duda que hoy no se dispone de la tecnología necesaria para hacerlo.
La mayoría de las veces las pacientes portadoras de cáncer de mama no diseminado, son sometidas a cirugía y luego a terapia adyuvante con esquemas de quimioterapia, terapia molecular y/o terapia endocrina.
Por otra parte, estudios en pacientes con cáncer de mama temprano, con axila positiva o negativa, con cirugía exclusiva y con seguimientos prolongados, muestran cerca de un 70% supervivencia global por enfermedad específica (40, 55). Desafortunadamente no disponemos de herramientas diagnósticas para determinar cuáles de ellas están curadas luego de cirugía, de tal manera que le indicamos terapia adyuvante a un 100% de las pacientes para beneficiar a un 30%.
Una vez que el tumor ha sido extirpado, no se cuenta con ninguna herramienta que permita discernir si la terapia que se está entregando a la paciente es útil. Sólo nos guiamos por estadísticas derivadas de distintos estudios.
La terapia sistémica preoperatoria (TSP) tiene las mismas indicaciones que la terapia adyuvante. Está absolutamente indicada en pacientes con cáncer locorregionalmente avanzado, en pacientes con cáncer de mama inflamatorio y en pacientes con indicación límite de cirugía conservadora. La TSP tiene además la ventaja de que podemos determinar in situ si la terapia entregada a la paciente es adecuada o no, ya que podemos evaluar clínica, radiológica y molecularmente sus resultados. Además es un excelente laboratorio que nos permite evaluar medicamentos en forma mucho más eficaz y rápida que las terapias adyuvantes. Es por ello que muchos centros grandes están incorporando esta modalidad de tratamiento.
Sin embargo, no se ha demostrado que el uso de TSP produzca una mayor supervivencia global excepto en subgrupos (111), pero tampoco menor, en comparación a la supervivencia obtenida con el uso de terapias adyuvantes, al menos en estudios fase III en que las pacientes fueron tratadas en forma estándar de acuerdo al conocimiento de la época (112, 113) aún cuando una actualización más reciente marca una fuerte tendencia a mejorar en la supervivencia, algunas veces al borde de la significación estadística para algunos subgrupos tratados con TSP (111).
Tradicionalmente la TSP ha sido reservada para las pacientes con enfermedad loco regional avanzada que no permite una cirugía inicial, para pacientes resecables sólo con cirugía radical y para pacientes portadoras de cáncer inflamatorio.
Desde que „Perou y Soerlie” (9) describieran los distintos subtipos moleculares del cáncer de mama, hemos ido aprendiendo de las evoluciones clínicas que cada uno de ellos conlleva. Ahora sabemos que las pacientes que son ricas en RE y con HER-2 negativo son las que menos responden a quimioterapia pero tal vez las que sobreviven más prolongadamente.
Otro aspecto positivo de las TSP es el necesario trabajo conjunto de todo el equipo de profesionales que tratan a la paciente con cáncer de mama como revisaremos a continuación.
Evaluación radiológica de la paciente antes de la TSP: la mamografía y ecografía mamaria así como también el uso de resonancia mamaria en muchos casos, se deben incluir en la evaluación local de la paciente (114). Esta última adquiere relevancia por la necesidad de poder, en el período post TSP, determinar la forma de disminución del tamaño tumoral, que puede ser concéntrica o bien dejando islotes tumorales, lo cual cobra especial importancia en la planificación de la cirugía (115). Se debe tomar muestra para biopsia de la lesión en número y cantidad suficiente como para hacer un diagnóstico histológico y molecular, lo que guiará posteriormente el tipo de TSP a utilizar.
Evaluación de la axila preTSP: la evaluación de la axila se puede hacer a través de ecografía axilar y con punción citológica de los ganglios que aparezcan como sospechosos. En el caso de que la punción sea positiva, la paciente deberá recibir disección axilar en el momento de la cirugía. En caso que la evaluación citológica sea negativa para células neoplásicas, se puede evaluar el uso de biopsia del ganglio centinela en esa paciente (116).
Estudio histopatológico: debe incluir el tipo histológico, el grado de diferenciación, la presencia de receptores hormonales, la mutación o sobre-expresión de HER-2 y el nivel de proliferación celular medido por Ki-67. Este último parámetro tal vez sea más importante en pacientes ricas en receptores de estrógenos, ya que sabemos que más que la respuesta clínica, es la disminución del Ki- 67 lo que puede predecir en mejor forma el pronóstico en estas pacientes (117).
Terapia sistémica pre-operatoria: el principal objetivo de la TSP es aumentar la supervivencia de las pacientes con cáncer de mama. Dado que no tenemos ninguna forma de predecir esto, muchas veces se ha utilizado como marcador indirecto de respuesta patológica completa (pRC) (118), aún cuando no siempre se ha asociado una mayor pRC a una mayor supervivencia global (112, 113). Tampoco acuerdo de cómo definir pRC luego de TSP (119). La TSP no se debe iniciar sin un diagnóstico histopatológico completo que nos indique la terapia que la paciente debe recibir. En efecto, la quimioterapia, que es lo que generalmente se tiende a utilizar de forma inmediata en estas pacientes, es más efectiva en pacientes con receptores hormonales negativos y en pacientes con HER-2 mutado o sobre-expresado (120, 121). En este último grupo la combinación de quimioterapia más trastuzumab y lapatinib (122, 123) o de trastuzumab más pertuzumab es superior a un solo inhibidor HER-2, pero nuevamente las pacientes con receptores hormonales negativos, presentan mucho mejor respuesta que las pacientes con receptores positivos. Por otra parte, la quimioterapia induce sólo un bajo porcentaje de respuestas completas en pacientes ricas en receptores hormonales y HER-2 negativo, aún cuando sea el grupo de pacientes que presente mayor supervivencia. Esta situación, aparentemente contradictoria, se explica por la biología de esta enfermedad que es generalmente más lenta y con recurrencias mucho más tardías, cuando ocurren. De hecho el porcentaje de pRC que se obtiene con quimioterapia en pacientes ricas en receptores hormonales varía entre un 2% y 10%, cifras que nos deben hacer meditar sobre el valor de la quimioterapia adyuvante en este tipo de pacientes (124).
Evaluación imaginológica post TSP: la evaluación con resonancia mamaria de la forma de reducción del tamaño tumoral es especialmente relevante en la planificación de la cirugía. En las pacientes con reducción concéntrica, que parece ser más frecuente en pacientes con cáncer de mama triple negativo y con cáncer de mama con sobre-expresión de HER-2, puede permitir una cirugía conservadora. La reducción fragmentaria parece ser más frecuente en las pacientes con tumores ricos en receptores hormonales y ello es una contraindicación para la cirugía conservadora (115).
Cirugía luego de TSP: el volumen y la extensión del tumor original, las características biológicas y la respuesta a la terapia son los tres factores más importantes que influyen en la elección del tipo de cirugía después de la TSP. Por ejemplo, una paciente con un cáncer triple negativo, que presenta una adecuada respuesta a la TSP y reducción concéntrica del tumor demostrada en la resonancia mamaria puede ser operada con cirugía conservadora. En cambio, en las pacientes con tumores de tipo luminal, especialmente los B, en general es poco probable que se pueda conservar la mama por la pobre respuesta patológica que se suele obtener, razón por la que en estos casos se debe efectuar una mastectomía total.
En lo que respecta al manejo quirúrgico de la axila, la conducta variará de acuerdo al estado de los ganglios antes y después de la TSP.
La biopsia del ganglio centinela está recomendada sin duda, en las pacientes sin compromiso axilar pre TSP y puede ser considerado en las pacientes cuyos ganglios se normalizan como consecuencia de la TSP, demostrado por métodos de imágenes y por citología.
En las pacientes con axila positiva está recomendada la disección axilar clásica (116).
En las pacientes que, aún cuando hayan logrado una respuesta clínica y radiológica completa, es decir que se haya producido una desaparición del tumor en la palpación y en las imágenes, no se debe omitir la cirugía sobre la mama ni sobre la axila.
Radioterapia en las pacientes con TSP: estudios retrospectivos señalan que pudiera omitirse la radioterapia en pacientes que recibieron mastectomía más disección axilar con ganglios histológicamente negativos, sin embargo, los mismos autores sugieren que se debe esperar por información de estudios prospectivos (125).
Finalmente no es recomendable usar radioterapia exclusiva como tratamiento local en pacientes con cáncer de mama tratadas con TSP y que obtengan respuesta clínica y/o radiológica completa.
Tratamiento del cáncer de mama metastásicoLa presencia de metástasis es la condición que implica incurabilidad.
Entre el 5% a 10% de los casos debutan en fase metastásica.
Evaluación y aproximación inicial:
Enfrentados a la sospecha de metástasis, debemos corroborarlo con imágenes como tomografías computadas, resonancias magnéticas, cintigramas y en casos calificados, pudiese ser necesario un PET CT. La determinación de células tumorales circulantes, resulta muy interesante, pero es un método no validado aún (126, 127).
Una vez corroborada la presencia de diseminación secundaria, debemos obtener una comprobación histológica siempre que sea posible especialmente cuando se trata de metástasis únicas, imágenes equívocas o de aparición muy alejada del tratamiento inicial del primario. El objetivo de la confirmación histológica es la comprobación de recurrencia del cáncer de mama y la reevaluación de las características biológicas de las metástasis, por cuanto es posible encontrar discordancia entre el primario y sus metástasis. Idealmente es preferible una biopsia de tejidos blandos, pues las biopsias óseas presentan mayor dificultad para el análisis con técnicas de inmunohistoquímica (128).
Las determinaciones con ensayos multigenes (firmas genéticas) aún no han sido validadas.
Conceptualmente el tratamiento del cáncer de mama metastásico también incluye el uso de cirugía, radioterapia, hormonoterapia y quimioterapia sumada a las nuevas terapias biológicas, ya sea aisladas o en combinación.
La aplicación de éstas dependerá de distintos factores, entre ellos la presencia de comorbilidades, el Performance Status, las características patológicas y biológicas del tumor como la presencia de receptores hormonales (RH) y de HER-2. También dependerá de las características clínicas como la localización de la enfermedad, siendo distinta la existencia de metastasis óseas o pleurales que las viscerales y la magnitud, oligometastasis versus localizaciones masivas con riesgo vital inminente (129).
El tratamiento debe tener objetivos realistas, los que se deben informar a la paciente para ayudarla en la toma activa de decisiones. En cada caso se deben calibrar los posibles beneficios con los potenciales riesgos.
Recidiva locorregionalUna primera forma de recidiva es la enfermedad recurrente exclusivamente loco-regional. Los sitios más frecuentes son la pared torácica y los ganglios supraclaviculares. A menudo este tipo de recidiva se acompaña de diseminación a distancia. La recomendación en estos casos, es proceder con “intento curativo”, indicando la cirugía cuando sea posible; lo recomendado es la mastectomía con disección axilar, cuando el tratamiento previo ha sido cirugía conservadora y radioterapia cuando la paciente no ha recibido radioterapia previa. En algunos casos calificados se puede intentar reirradiación.
El tratamiento sistémico, hormonoterapia, quimioterapia o anti Her-2, puede tener un rol que aún no ha sido del todo dilucidado (“adyuvancia secundaria”).
Recurrencia a distanciaLa recurrencia a distancia requiere de tratamiento sistémico. Estos tratamientos son capaces de prolongar la supervivencia y mejorar la calidad de vida, pero no lograrán la curación. No es raro ver prolongaciones muy significativas de la supervivencia, particularmente en casos de tumores respondedores a hormonas. El enfoque terapéutico debe ser multidisciplinario. Desde hace algunos años, la actitud terapéutica ha sido estratificar cada caso, según las características clínicas y biológicas. Para la mayoría de los pacientes el objetivo de “supervivencia global”, se obtiene con el uso secuencial de la terapia antitumoral, tanto como con el uso de combinaciones, siendo menos tóxico el uso de monodrogas en forma secuencial, especialmente en el caso de la quimioterapia.
En caso de enfermedad visceral agresiva o extensa o de necesidad de control rápido de síntomas, se prefiere el inicio con quimioterapia incluyendo combinaciones, aún tratándose de tumores respondedores a hormonas.
Terapias hormonalesEstán indicadas en tumores hormono-respondedores con independencia de la situación del receptor Her-2. La terapia endocrina está asociada con una toxicidad baja, por lo cual es un excelente método de control tumoral con una menor merma en calidad de vida. La terapia endocrina incluye los inhibidores de aromatasa (IA) no esteroidales anastrozole y letrozole o inhibidores esteroidales (exemestano), los moduladores séricos del receptor de estrógeno, sERM en su abreviatura inglesa, (tamoxifeno y toremifeno), los down-regulators del receptor de estrógeno (fulvestrant) y en las mujeres premenopáusicas los análogos LH-RH. En mujeres premenopáusicas la terapia inicial es con tamoxifeno, pero una vez que la enfermedad progresa, es posible combinar una “terapia ablativa” del ovario en combinación con un IA como segunda línea hormonal. La supresión ovárica también se puede realizar mediante ablación quirúrgica o actínica. Existe escasa evidencia para seleccionar la secuencia óptima de terapia endocrina. Para mujeres postmenopáusicas que no han recibido antiestrógenos o que han completado más de un año sin recibirlos, la opción puede incluir IA, un SERM o un ER down-regulator. De acuerdo algunos estudios los IA parecen presentar consistentemente resultados superiores comparados con tamoxifeno en primera línea hormonal, aunque las diferencias son modestas. Debemos considerar siempre los efectos secundarios, como la pérdida acelerada de masa ósea con los IA. Con el tamoxifeno hay riesgo trombótico y en menor medida riesgo proliferativo sobre endometrio. Existe evidencia de superioridad del fulvestrant sobre anastrozole, en primera línea, de modo que éste también se ha constituido en una alternativa. Como segunda línea hormonal podemos usar alguna otra de las familias de drogas ya mencionadas, que no se haya utilizado previamente. Sigue sin estar clara una definición de la mejor secuencia de tratamiento hormonal. Un reciente e interesante avance ha consistido en el uso concomitante del fármaco everolimus (inhibidor de mTOR) con tamoxifeno o con un IA, restableciendo la sensibilidad del tumor a la manipulación hormonal, con resultados clínicamente positivos.
QuimioterapiaEn el caso de indicar quimioterapia por tumores con RH negativos, por progresión tras hormonoterapia o por riesgo vital, existen varias alternativas posibles y la prescripción debe hacerse sobre una base individualizada.
El único estándar es el uso de taxanos, en caso de adyuvancia previa sólo con antraciclinas. Las terapias de combinación ofrecen una respuesta tumoral más rápida, con escasa ventaja en supervivencia y con el costo de mayor toxicidad, por lo que existe acuerdo en que el uso de monoterapia secuencial, ofrece mejores resultados en cuanto a calidad de vida y menor toxicidad, sin detrimento en la supervivencia global.
Drogas disponibles para uso en cáncer de mama metastásico:
- 1.
Antraciclinas: doxorubicina, epidoxorubicina, doxorubicina liposomal.
- 2.
Taxanos: paclitaxel, docetaxel, nab-Paclitaxel (Abraxano®).
- 3.
Capecitabine, vinorelbine, ciclofosfamida, eribulin, ixabepilona, gemcitabine.
Existen distintas combinaciones, en base a estas drogas, siendo importante mencionar el uso de platino, en caso de tumores que presentan daño en los sistemas de reparación del ADN como algunos casos de cáncer de mama triple negativos.
Después del fracaso de una primera línea de quimioterapia, no hay un enfoque estándar para la decisión de las segundas o terceras líneas. La decisión de terapia más allá de la tercera línea, debe ser ajustada individualmente, basados en el performance status y en las respuestas a los esquemas previos.
Terapias biológicasEn el caso de los tumores Her-2 positivos, el uso de terapia anti Her-2 trastuzumab, pertuzumab, lapatinib, sola o en combinación, debe ser planteada precozmente, salvo contraindicación para su uso (130, 131). El uso de estas drogas biológicas, junto con quimioterapia, parece ser costo efectivo, en la mayor parte de los países donde se ha estudiado.
En estudios recientes, la adición de pertuzumab a la combinación de trastuzumab y quimioterapia está asociada a una mejor tasa de respuesta y al aumento de la supervivencia libre de progresión (PFS).
Nuevos estudios muestran que la molécula conjugada TDM-1 (taxano + trastuzumab), es superior a la combinación de trastuzumab + docetaxel.
La actitud general ha sido continuar la terapia con anti Her-2 tanto como sea posible. En el caso de trastuzumab, ante la progresión tumoral se puede ir cambiando el agente quimioterápico de la combinación. No está claro cuando es recomendable el cambio de trastuzumab por lapatinib. La combinación de lapatinib con capecitabine es superior al uso de capecitabine sola, constituyendo otra alternativa.
La combinación de anti Her-2 con terapia hormonal, permite prolongar la PFS en muchos casos.
Enfermedad óseaEl manejo de las metástasis óseas cobra importancia como tratamiento de soporte (135). Las metástasis óseas están presentes en hasta un 80% de los cánceres mamarios diseminados y son fuente de gran morbilidad. El uso de bifosfonatos disminuye la hipercalcemia, el dolor y la aparición de “eventos esqueléticos”, como fracturas, necesidad de radioterapia y/o cirugía y descompresión medular. El estándar es el uso de zoledronato o pamidronato. Se requiere vigilancia de la función renal previa a cada aplicación, pues ambos pueden comprometerla. El uso de ibandronato tiene la ventaja de producir una disminución más rápida del dolor con menos riesgo de afectar la función renal. Últimamente se ha sumado el denosumab, un nuevo anticuerpo, dirigido contra el ligando de RANK, que es un mediador de la función de los osteoclastos y ha sido validado en un reciente ensayo de No-inferioridad. La terapia con denosumab y con bifosfonatos tiene el riesgo de producir osteonecrosis de mandíbula por lo cual se requiere evaluación odontológica previa. El uso de estas terapias requiere la vigilancia de los niveles de calcio, fósforo y magnesio, junto con la creatinina. También es necesario el aporte de calcio y vitamina D, salvo en presencia de hipercalcemia.
Evaluación de respuestaPara evaluar la respuesta a nuestros tratamientos, se sugieren plazos de 2 a 4 meses en las terapias endocrinas y cada 2 a 4 ciclos en caso de quimioterapia, sin embargo estos períodos son inciertos. La evaluación dependerá de la agresividad de la enfermedad, pudiendo prolongarse en casos de tumores más indolentes. Este seguimiento se basa en la comparación con exámenes previos, usando alguno de los sistemas acreditados internacionalmente como el RECIST, Response Evaluation Criteria In Solid Tumors (Criterios de Evaluación de Respuesta en Tumores Sólidos).
En caso de sospecha de progresión se procederá a la reevaluación clínica y con imágenes. Los marcadores séricos (CEA, Ca 15.3), pueden ser de utilidad cuando están inicialmente elevados, especialmente en los casos de enfermedad de difícil evaluación con imágenes como compromiso óseo, pleural o peritoneal.
Finalmente no se debe olvidar que un objetivo primordial del tratamiento es la mantención de la calidad de vida, por lo que tan importante como mantener un buen control de los síntomas propios de la enfermedad, es seguir de cerca a cada paciente, para evitar la mantención de un tratamiento cuando éste ha dejado de ser útil.
Apoyo e intervención psicológica en pacientes con cáncer de mamaEl cáncer de mama es una enfermedad que por mucho que sea conocida, es desconocida para la persona que recibe el diagnóstico, porque no la ha experimentado antes. Si bien existe gran cantidad de información disponible, cuando el cáncer de mama se presenta en la vida de una mujer, éste atemoriza y la paciente suele hacer una asociación inmediata con el sufrimiento y dolor, tanto físico como emocional y normalmente lo asocia también a la muerte (132-136).
La primera reacción frente al diagnóstico generalmente es de shock e incertidumbre. La mujer, en un plazo corto imagina y piensa en su familia, esposo, hijos, amigos y personas dependientes de ella en lo emocional y en lo práctico. Luego una vez entendido y aceptado el proceso que se debe vivir, la mujer entra en las distintas fases del duelo oncológico a raíz de la pérdida no sólo de la salud sino de una pérdida total incluida una pérdida de control. Este duelo se caracteriza por gran pena y tristeza, rabia, ira e irritabilidad, la persona está más vulnerable y sensible por lo que una depresión es frecuente en este proceso emocional que se vive a raíz del diagnóstico de cáncer, depresión que en la mayoría de los casos es totalmente reactiva al momento tan estresante y que se vive y se percibe como algo muy amenazante.
Las preguntas, preocupaciones e interrogantes que las pacientes frecuentemente formulan son: ¿Qué es el cáncer? ¿Por qué a mí? ¿Qué hice mal para que me diera cáncer? ¿Me voy a morir ? ¿Qué pasa con mi familia? ¿Qué pasa con mis hijos? ¿Cómo hablo con ellos? ¿Qué pasa con mi marido? ¿Qué hago con mi trabajo? ¿Me apoyarán? ¿Podré trabajar durante el tratamiento? ¿Se me va a caer el pelo?
Se parte de la base que cada mujer que se diagnostica de un cáncer de mama es una mujer única en su cáncer, en su forma de enfrentar las distintas situaciones que vive en la vida, es única en su historia, en la etapa del ciclo vital en que se encuentra, y “cómo” lo vive y es única en su organización y en su estructura. No existen dos pacientes iguales y no hay un patrón que seguir. Por estas razones, no es recomendable tener un protocolo de intervención psicosocial único. Creemos que lo mejor es tener una pauta de evaluación psicosocial y con ella, elaborar una pauta de intervención caso a caso.
A continuación se presenta un esquema de derivación psicooncológica de pacientes recién diagnosticadas de un cáncer de mama y alternativas de tratamiento dependiendo de cada persona.
Finalmente es importante decir que hemos trabajado por largo tiempo con este esquema de evaluación e intervención, lo que nos ha permitido observar y percibir, que las pacientes enfrentan en mejores ccondiciones sus diagnósticos y tratamientos, refieren sentirse acompañadas y acogidas en un proceso oncológico difícil.
El grupo de autores ha estructurado el trabajo en forma multidisciplinaria y hemos tratamos de cumplirlo día a día, hecho que se ve reflejado en el bienestar físico y emocional que expresan nuestras pacientes.
Los autores declaran no tener conflictos de interés, con relación a este artículo.